Вступ
COVID-19 (Coronavirus disease 2019) — офіційна назва захворювання, дана Всесвітньою організацією охорони здоров’я (ВООЗ) 11 лютого 2020 року, викликається одноланцюжковим РНК-вірусом, що відноситься до родини коронавірусів. Спалах COVID-19 визнаний 30 січня 2020 р. ВООЗ надзвичайною ситуацією в галузі охорони здоров’я, що має міжнародне значення. Цей респіраторний вірус має високу контагіозність і може легко передаватися на відстані менше 2 метрів. Інкубаційний період захворювання становить близько 14 днів, загалом 6–7 днів. Найбільш поширеним ускладненням нової коронавірусної інфекції COVID-19 є двостороння пневмонія. Для визначення найоптимальнішої стратегії лікування сьогодні проводяться численні клінічні дослідження.
Онкологічні пацієнти належать до групи ризику тяжкого перебігу коронавірусної інфекції COVID-19 через пригнічений імунітет на фоні протипухлинного лікування, незалежно від термінів його проведення. Аналіз даних, проведений у Китаї, показав, що в онкологічних хворих порівняно з пацієнтами без онкологічних захворювань у 5 разів вищий ризик зараження COVID-19 і вища ймовірність тяжкого перебігу інфекції з необхідністю застосування інтенсивної терапії [1].
За рекомендацією Європейського товариства медичної онкології (European Society for Medical Oncology, ESMO), до групи ризику особливо тяжкого перебігу COVID-19 серед онкологічних пацієнтів відносять осіб, які [2]:
— одержують хіміотерапію або отримали хіміотерапію протягом останніх 3 місяців;
— одержують променеву терапію;
— після трансплантації кісткового мозку або отримували лікування з використанням стовбурових клітин протягом останніх 6 місяців;
— з деякими типами пухлин кровотворної тканини, навіть якщо вони не проходять лікування зараз (хронічний лейкоз, лімфома, мієлома);
— одержують тривалу імуносупресивну терапію (глюкокортикоїди, моноклональні антитіла);
— з лейкопенією та/або низьким рівнем імуноглобулінів.
Лікування та спостереження за пацієнтами з онкологічними захворюваннями в умовах пандемії є досить складним завданням з огляду на вразливий статус їх імунної системи та агресивний характер основного захворювання. За даними ВООЗ, смертність у групі онкологічних пацієнтів із підтвердженою коронавірусною інфекцією становить 7,6 %. Для порівняння, смертність серед інших груп із підтвердженою коронавірусною інфекцією становить: серед пацієнтів із серцево-судинними захворюваннями — 13,2 %, із цукровим діабетом — 9,2 %, з артеріальною гіпертензією — 8,4 %, із хронічними респіраторними захворюваннями — 8,0 %; загалом серед інфікованих — 3,4 %, серед пацієнтів без супутніх захворювань — 1,4 % [3].
Згідно з інформацією про захворюваність на COVID-19 у пацієнтів з онкологічними захворюваннями з м. Ухань (Китай), із 1524 пацієнтів, які надійшли в онкологічне відділення з грудня 2019 по лютий 2020 р., 12 (0,79 %) були інфіковані COVID-19. Варто зазначити, що серед цієї групи пацієнтів показник інфікування був вищим, ніж сукупна частота всіх діагностованих випадків COVID-19, зареєстрованих у м. Ухань за той же період (0,37 %) [4].
Китайський центр із контролю та профілактики захворювань подав опис клінічних симптомів, лабораторних та радіологічних результатів 44 672 пацієнтів із лабораторно підтвердженим COVID-19. З них 965 (2,2 %) були молодшими за 20 років; у цій віковій групі було зареєстровано лише одну смерть (0,1 %). Більшість пацієнтів (77,8 %) були віком 30–69 років. Серед пацієнтів віком від 80 років летальність становила 14,8 %. За даними інших досліджень із м. Ухань зазначено, що з усіх заражених COVID-19 приблизно 1–2 % мали онкологічні захворювання [5, 6].
На жаль, дані про клінічні характеристики інфікованих COVID-19 онкопацієнтів у даний час обмежені. Однак є ретроспективне дослідження 5688 пацієнтів із лабораторно підтвердженим COVID-19 з Нью-Йорка. З онкозахворюваннями були зареєстровані 334 (6 %) пацієнти. Розподіл по локалізаціях був таким: рак молочної залози (n = 57), рак передміхурової залози (n = 56), рак легень (n = 23), урогенітальний рак (n = 18) та колоректальний рак (n = 16). Зазначено, що онкологічним пацієнтам віком від 66 до 80 років інтубація легень була потрібна значно частіше, ніж пацієнтам без онкології, в інших вікових групах не було виявлено суттєвих відмінностей. При цьому в онкологічних пацієнтів віком до 50 років смертність від COVID-19 була вп’ятеро вища, ніж у пацієнтів із непухлинною патологією цієї же вікової групи (відносний ризик 5,01, 95% довірчий інтервал 1,55–16,2). Також відзначено значно більший ризик розвитку тяжких ускладнень COVID-19 серед пацієнтів, які отримували протипухлинне лікування протягом останніх 14 днів [7].
Міжнародні рекомендації з лікування пацієнтів з онкологічними захворюваннями у період пандемії
Основна проблема терапії в умовах пандемії полягає в тому, що в онкологічних пацієнтів не можна переривати лікування та суттєво змінювати обсяг лікувальних та діагностичних маніпуляцій. Однак, враховуючи дуже високу небезпеку, яку становить COVID-19 для пацієнтів з онкологічною патологією, Управління з санітарного нагляду за якістю харчових продуктів та медикаментів США (Food and Drug Administration, FDA) визнає можливість вимушених відступів через епідемічну обстановку [8].
Крім того, Американським товариством клінічної онкології (American Society of Clinical Oncology, ASCO) було запропоновано такі зміни ведення онкологічних пацієнтів під час пандемії COVID-19 [9]:
— планове обстеження онкологічних пацієнтів, які завершили лікування та/або перебувають на тривалому динамічному спостереженні, доцільно відкласти до завершення обмежувально-карантинних заходів;
— обсяг обстежень, необхідних для встановлення онкологічного діагнозу або уточнення його виду та стадії, може бути переглянутий із метою мінімізації відвідувань медичних закладів. Обстеження, які не були проведені у період спалаху коронавірусної інфекції (червона зона карантину), необхідно пройти після закінчення дії жорстких протиепідемічних заходів;
— тимчасово відкласти онкоскринінг (планове обстеження з метою раннього виявлення онкологічних захворювань) для зменшення контактів та навантаження на заклади охорони здоров’я;
— планові перевірки, консультації, спостереження за станом пацієнта, які впливають безпосередньо на лікувальний процес, можуть проводитися дистанційно;
— для профілактики фебрильної нейтропенії рекомендується використання колонієстимулюючих факторів.
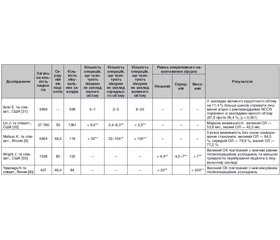
Онкологічні установи мають бути максимально ізольовані від вогнища інфекції. ESMO, ASCO, Національний альянс онкологічних центрів у Сполучених Штатах (National Comprehensive Cancer Network, NCCN) та багато інших онкологічних міжнародних спільнот розробили керівні принципи для мінімізації наслідків негативного впливу пандемії COVID-19 на діагностику та лікування онкологічних пацієнтів. Основний принцип цих рекомендацій полягає в тому, щоб класифікувати онкопацієнтів із високим, середнім чи низьким пріоритетом у лікуванні та спостереженні для стратегічного планування подальшого їх ведення (табл. 1) [10].
На думку більшості міжнародних онкологічних спільнот, тактику лікування онкологічних хворих у період епідемії/пандемії COVID-19 можна розглядати за двома сценаріями:
— при позитивному лабораторному тесті COVID-19: госпіталізація в інфекційний стаціонар. Згідно з міжнародними рекомендаціями, на час розвитку в пацієнта COVID-19 все специфічне протипухлинне лікування в онкологічних та гематологічних пацієнтів припиняється, включаючи таргетну та хіміотерапію. Лікування відновлюється лише тоді, коли тест на COVID-19 буде негативним;
— при негативному лабораторному тесті на COVID-19: лікування в онкологічних установах (із максимальним терміном скорочення госпіталізації та використанням телемедичних технологій), лікування вдома або перерва у лікуванні, якщо можливо.
Вакцинація
Якщо пацієнт перебуває в активній фазі онкологічного захворювання або з моменту закінчення лікування та настання ремісії не минуло 5 років, пацієнт перебуває в зоні підвищеного ризику та ускладнень після COVID-19. Європейська спільнота медичних онкологів (ESMO) розробила такі рекомендації з приводу вакцинації [11]:
— вакцинація показана незалежно від конкретного виду лікування та форми раку (радіотерапія, імунотерапія, хіміотерапія або інше специфічне біологічне лікування);
— вакцинацію рекомендується проводити до початку хіміотерапії, якщо це можливо, або після хіміотерапії, при відновленні нормального рівня лейкоцитів;
— під час хіміотерапії або імунотерапії рекомендована вакцинація через 15 днів після лікування та за 7 днів до наступної терапії. Як альтернатива рекомендується робити вакцинацію між циклами хіміотерапії, але не в період низьких показників крові;
— у разі запланованої операції рекомендується зробити щеплення щонайменше за 1 тиждень до операції. Вакцинацію можна зробити в будь-який час після операції, за умови, що показники лейкоцитів знаходяться в межах норми;
— хворим після трансплантації гемопоетичних стовбурових клітин, алогенної та автогенної трансплантації, клітинної терапії рекомендована вакцинація щонайменше через 3 місяця після закінчення терапії;
— пацієнтам з онкогематологічною патологією та хворим, які перебувають на курсі інтенсивної цитотоксичної хіміотерапії (ХТ) (наприклад, цитарабін/антрациклінвмісні курси ХТ при гострій мієлоїдній лейкемії) слід відтермінувати проведення вакцинації до відновлення абсолютної кількості нейтрофілів;
— вакцинація не заборонена пацієнтам, які перехворіли на інфекцію COVID-19 або інфікувалися після першої дози вакцини, Італійська асоціація медичної онкології (CIPOMO) рекомендує зробити щеплення через 15 днів після повного одужання від інфекції COVID-19 або через 1 місяць після початку інфекції;
— АSCO та Центр профілактики та контролю захворювань пропонують зробити щеплення у період до 6 тижнів (42 дні) після першої дози вакцини у разі зараження після першої вакцинації;
— вакцинація не показана, якщо в пацієнта є протипоказання до вакцини або будь-якого конкретного компонента вакцини проти SARS-CoV-2, наприклад тяжка алергічна реакція.
Висновок
Отримані дані свідчать про те, що ймовірність тяжкого перебігу COVID-19 вища серед пацієнтів з онкозахворюваннями, особливо з гемобластозами та раком легень. Пацієнти з онкологічними захворюваннями загалом більш сприйнятливі до інфекції, ніж здорові, через імуносупресивний стан, обумовлений як пухлиною, так і протираковою терапією. Онкопацієнти є групою високого ризику, тому слід застосовувати рекомендовані заходи з імунізації щодо COVID-19. При веденні онкологічних пацієнтів під час пандемії повинні враховуватися модифікуючи параметри, такі як: етапи розвитку спалаху коронавірусної інфекції в регіоні, можливості медичних сил і засобів на місцях, індивідуальний ризик інфікування, тяжкість і поширеність онкологічного процесу, супутні захворювання, вік та персоналізований підхід у схемах лікування. Також необхідно ретельно зважувати коефіцієнт ризику/користі під час проведення хірургічного, (нео)ад’ювантного і паліативного лікування в онкологічних пацієнтів.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 29.10.2021
Рецензовано/Revised 10.11.2021
Прийнято до друку/Accepted 16.11.2021
Список литературы
1. Liang W. Cancer patients in SARS-CoV-2 infection: a nationwide analysis in China. Lancet Oncol. 2020. 21(3). 335-7. doi: 10.1016/S1470-2045(20)30096-6. PMID: 32066541.
2. ESMO. ESMO COVID-19 and cancer. Available from: https://www. esmo.org/covid-19-and-cancer/q-a-on-covid-19.
3. Gosain R., Abdou Y., Singh A. et al. COVID-19 and cancer: a comprehensive review. Current oncology reports. 2020 May 8. 22(5). 53. doi: 10.1007/s11912-020-00934-7. PMID: 32385672.
4. Yu J., Ouyang W., Chua M.L.K., Xie C. SARS-CoV-2 transmission in patients with cancer at a tertiary care hospital in Wuhan, China. JAMA Oncol. 2020 Mar 25. 6(7). 1108-10. doi: 10.1001/jamaoncol.2020.0980. PMID: 32211820.
5. The Novel Coronavirus Pneumonia Emergency Response Epide miology Team. The epidemiological characteristics of an outbreak of 2019 novel coronavirus diseases (COVID-19) — China, 2020. China CDC Weekly. 2020 Feb 10. 41(2). 145-51. doi: 10.3760/cma.j.issn.0254-6450.2020.02.003. PMID: 32064853.
6. Desai A., Sachdeva S., Parekh T., Desai R. COVID-19 and cancer: lessons from a pooled meta-analysis. JCO Glob Oncol. 2020 Apr. 6. 557-9. doi: 10.1200/GO.20.00097. PMID: 32250659.
7. Miyashita H., Mikami T., Chopra N. et al. Do Patients with cancer have a poorer prognosis of COVID-19? An experience in New York city. Ann. Oncol. 2020 Aug. 31(8). 1088-9. doi: 10.1016/j.annonc.2020.04.006. PMID: 32330541.
8. U.S. Food & Drug Administration. FDA drug shortages. Available from: https://www.accessdata.fda.gov/scripts/drugshortages/default. cfm.
9. Verity R., Okell L.C., Dorigatti I. et al. Estimates of the severity of coronavirus disease 2019: a model-based analysis. Lancet Infect. Dis. 2020 Jun. 20(6). 669-77. doi: 10.1016/S1473-3099(20)30243-7. PMID: 32240634.
10. Ontario Health Cancer Care Ontario. Pandemic planning clinical guideline for patients with cancer. Available from: https://www.accc-cancer.org/docs/documents/cancer-program-fundamentals/oh-cco-pandemic-planning-clinical-guideline_final_2020-03-10.pdf.
11. ECPC. Summary guidance for Covid-19 vaccination for cancer patients. Available from: https://ecpc.org/covid-19-information.

/77.jpg)