Международный эндокринологический журнал Том 17, №8, 2021
Вернуться к номеру
Лептин и адипонектин у пациентов с хронической болезнью почек и вторичным гиперпаратиреозом
Авторы: Карлович Н.В. (1), Мохорт Т.В. (1), Сазонова Е.Г. (1, 2)
(1) — Учреждение образования «Белорусский государственный медицинский университет», г. Минск, Республика Беларусь
(2) — Государственное учреждение «Республиканский центр медицинской реабилитации и бальнеолечения»,
г. Минск, Республика Беларусь
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
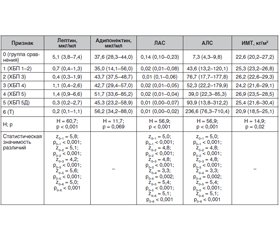
Актуальність. Результати досліджень щодо оцінки рівнів адипонектину, лептину та їх співвідношення при хронічній хворобі нирок (ХХН) суперечливі. Передбачається, що гіперлептинемія та зміна кліренсу адипонектину є наслідком зниження швидкості клубочкової фільтрації, посилюють ниркові порушення та можуть впливати на прогноз виживання через кардіоваскулярні події. Відомо, що вторинний гіперпаратиреоз є найчастішим ускладненням ХХН, що не тільки впливає на фосфорно-кальцієвий обмін і кісткову тканину, але й здійснює внесок у розвиток патологічних процесів із залученням інших гормонально-метаболічних маркерів. Найбільший інтерес становить оцінка рівня адипоцитокінів при розвитку вторинного гіперпаратиреозу (ВГПТ) на тлі ХХН як незалежного фактора збільшення серцево-судинних ризиків. Мета дослідження: оцінка рівнів адипоцитокінів (адипонектин, лептин) та їх співвідношень у пацієнтів із різними стадіями ХХН та їх взаємозв’язку з проявами ВГПТ. Матеріали та методи. До одномоментного поперечного дослідження було включено 160 осіб із хронічною нирковою недостатністю та 40 здорових осіб як групу порівняння. Результати. Встановлено зниження рівнів лептину та збільшення частки пацієнтів із гіполептинемією при зменшенні швидкості клубочкової фільтрації, що може бути важливим фактором, який визначає нутритивний статус. Відзначено наявність кореляційних зв’язків рівнів лептину з індексом маси тіла (ІМТ) (ρ = 0,411) та віком пацієнтів (ρ = 0,189), а також співвідношень лептин/адипонектин та адипонектин/лептин (ρ = 0,395 та ρ = –0,395) у пацієнтів зі ХХН, що зберігається у підгрупах за стадіями ниркової недостатності. Виявлено взаємозв’язок із статтю для лептину та зниження його рівнів нижче нормальних значень в осіб обох статей. Висновки. Частка пацієнтів із гіперадипонектинемією була значно вищою в осіб із термінальною стадією ХХН порівняно з пацієнтами на стадіях 1–2. У досліджуваних пацієнтів не встановлено статистично значущого взаємозв’язку адипоцитокінів та рівнів паратгормону з наявністю ВГПТ.
Актуальность. Результаты исследований по оценке уровней адипонектина, лептина и их соотношения при хронической болезни почек (ХБП) противоречивы. Предполагается, что гиперлептинемия и изменение клиренса адипонектина являются следствием снижения скорости клубочковой фильтрации, усугубляют почечные нарушения и могут влиять на прогноз выживаемости по причине кардиоваскулярных событий. Известно, что вторичный гиперпаратиреоз является наиболее частым осложнением ХБП, не только оказывающим влияние на фосфорно-кальциевый обмен и костную ткань, но и вносящим вклад в развитие патологических процессов с вовлечением иных гормонально-метаболических маркеров. Наи-больший интерес представляет оценка уровня адипоцитокинов при развитии вторичного гиперпаратиреоза (ВГПТ) на фоне ХБП как независимого фактора увеличения сердечно-сосудистых рисков. Цель исследования: оценка уровней адипоцитокинов (адипонектин, лептин) и их соотношения у пациентов с различными стадиями ХБП и их взаимосвязи с проявлениями ВГПТ. Материалы и методы. В одномоментное поперечное исследование были включены 160 человек с хронической почечной недостаточностью и 40 здоровых лиц в качестве группы сравнения. Результаты. Установлено снижение уровней лептина и увеличение доли пациентов с гиполептинемией при уменьшении скорости клубочковой фильтрации, что может быть важным фактором, определяющим нутритивный статус. Отмечено наличие корреляционных связей уровней лептина с индексом массы тела (ИМТ) (ρ = 0,411) и возрастом пациентов (ρ = 0,189), а также соотношений лептин/адипонектин и адипонектин/лептин (ρ = 0,395 и ρ = –0,395) с ИМТ у пациентов с ХБП, сохраняющееся в подгруппах по стадиям почечной недостаточности. Выявлена взаимосвязь с полом для лептина и снижение его уровней ниже нормальных значений у лиц обоих полов. Выводы. Доля пациентов с гиперадипонектинемией была значимо выше у лиц с терминальной стадией ХБП по сравнению с пациентами на стадиях 1–2. У исследуемых пациентов не установлено статистически значимой взаимосвязи адипоцитокинов и уровней паратгормона с наличием ВГПТ.
Background. The results of studies evaluating the levels of adiponectin, leptin and their ratios in chronic kidney disease (CKD) are conflicting. It is assumed that hyperleptinemia and changes in adiponectin clearance are consequences of a decrease in the glomerular filtration rate, they exacerbate renal impairment and may affect the prognosis of survival due to cardiovascular events. It is known that secondary hyperaparathyroidism is the most frequent complication of CKD, which not only affects calcium-phosphorus metabolism and bone tissue, but also contributes to the development of pathological processes involving other hormonal and metabolic markers. Of greatest interest is the assessment of adipocytokine levels in the development of secondary hyperparathyroidism against the background of CKD as an independent factor of increasing cardiovascular risks. The purpose of the study was to assess adipocytokine levels (adiponectin, leptin) and their ratios in patients with different stages of chronic kidney disease and their relationship with manifestations of secondary hyperparathyroidism. Materials and methods. This cross-sectional study enrolled 160 people with CKD and 40 healthy individuals as a comparison group. Results. Leptin level reduction and an increase in the proportion of patients with hypoleptinemia with a decrease in the glomerular filtration rate were found, which may be an important factor determining nutritional status. Correlations were revealed between leptin level, body mass index (ρ = 0.411) and patients’ age (ρ = 0.189), as well as between leptin/adiponectin and adiponectin/leptin ratios (ρ = 0.395 and ρ = –0.395) and body mass index in patients with CKD persisting in subgroups by stage of renal failure. A relationship was found with sex for leptin and a decrease in its levels below normal values in both men and women. Conclusions. The proportion of patients with hyperadiponectinemia was significantly higher among those with end-stage CKD compared to patients with stages 1–2. There was no statistically significant relationship between adipocytokine and parathyroid hormone levels and the presence of secondary hyperparathyroidism in patients examined.
адипонектин; лептин; хронічна хвороба нирок; вторинний гіперпаратиреоз
адипонектин; лептин; хроническая болезнь почек; вторичный гиперпаратиреоз
adiponectin; leptin; chronic kidney disease; secondary hyperparathyroidism
Введение
Материалы и методы
Результаты
Обсуждение
Выводы
- Frühbeck G., Catalán V., Rodríguez A., Gómez-Ambrosi J. Adiponectin-leptin ratio: A promising index to estimate adipose tissue dysfunction. Relation with obesity-associated cardiometabolic risk. Adipocyte. 2018, Jan. 2. 7(1). 57-62. doi: 10.1080/21623945.2017.1402151.
- Afshin A., Forouzanfar M.H., Reitsma M.B., Sur P., Estep K., Lee A., Marczak L. et al.; GBD 2015 Obesity Collaborators. Health Effects of Overweight and Obesity in 195 Countries over 25 Years. N. Engl. J. Med. 2017, Jul. 6. 377(1). 13-27. doi: 10.1056/NEJMoa1614362.
- Lim C.C., Teo B.W., Tai E.S., Lim S.C., Chan C.M., Sethi S., Wong T.Y., Sabanayagam C. Elevated serum leptin, adiponectin and leptin to adiponectin ratio is associated with chronic kidney disease in Asian adults. PLoS One. 2015, Mar. 20. 10(3). e0122009. doi: 10.1371/journal.pone.0122009.
- Wannamethee S.G., Tchernova J., Whincup P., Lowe G.D.O., Kelly A., Rumley A., Wallace M., Sattar N. Plasma leptin: associations with metabolic, inflammatory and haemostatic risk factors for cardiovascular disease. Atherosclerosis. 2007. 191. 418-426. https://doi.org/10.1016/j.atherosclerosis.2006.04.012
- Spranger J., Kroke A., Möhlig M., Bergmann M.M., Ristow M., Boeing H., Pfeiffer A.F. Adiponectin and protection against type 2 diabetes mellitus. Lancet. 2003, Jan. 18. 361(9353). 226-8. doi: 10.1016/S0140-6736(03)12255-6.
- Lee K.W., Shin D. Prospective Associations of Serum Adi-ponectin, Leptin, and Leptin-Adiponectin Ratio with Incidence of Metabolic Syndrome: The Korean Genome and Epidemiology Study. Int. J. Environ. Res. Public. Health. 2020, May 8. 17(9). 3287. doi: 10.3390/ijerph17093287.
- Lee J.M., Kim S.R., Yoo S.J., Hong O.K., Son H.S., Chang S.A. The relationship between adipokines, metabolic parameters and insulin resistance in patients with metabolic syndrome and type 2 diabetes. J. Int. Med. Res. 2009, Nov-Dec. 37(6). 1803-12. doi: 10.1177/147323000903700616.
- Alnaggar A.R.L.R., Sayed M., El-Deena K.E., Gomaa M., Hamed Y. Evaluation of serum adiponectin levels in diabetic nephropathy. Diabetes Metab. Syndr. 2019, Jan-Feb. 13(1). 128-131. doi: 10.1016/j.dsx.2018.04.035.
- Hyun Y.Y., Lee K.B., Oh K.H., Ahn C., Park S.K., Chae D.W., Yoo T.H. et al.; Representing KNOW-CKD Study Group. Serum adiponectin and protein-energy wasting in predialysis chronic kidney disease. Nutrition. 2017, Jan. 33. 254-260. doi: 10.1016/j.nut.2016.06.014.
- Karlovich N.V. Secondary hyperparathyroidism in chronic kidney disease. Minsk, 2021. 177 p. (in Russian)
- Levey A.S., Coresh J., Greene T., Stevens L.A., Zhang Y.L., Hendriksen S., Kusek J.W., Van Lente F.; Chronic Kidney Disease Epidemiology Collaboration. Using standardized serum creatinine values in the modification of diet in renal disease study equation for estimating glomerular filtration rate. Ann. Intern. Med. 2006, Aug. 15. 145(4). 247-54. doi: 10.7326/0003-4819-145-4-200608150-00004.
- Stevens P.E., Levin A.; Kidney Disease: Improving Global Outcomes Chronic Kidney Disease Guideline Development Work Group Members. Evaluation and management of chronic kidney di-sease: synopsis of the kidney disease: improving global outcomes 2012 clinical practice guideline. Ann. Intern. Med. 2013, Jun. 4. 158(11). 825-30. doi: 10.7326/0003-4819-158-11-201306040-00007.
- Sprent P. Statistics in medical research. Swiss Med. Wkly. 2003, Oct. 11. 133(39-40). 522-9. PMID: 14655052.
- Shankar A., Syamala S., Xiao J., Muntner P. Relationship between Plasma Leptin Level and Chronic Kidney Disease. Int. J. Nephrol. 2012. 269532. doi: 10.1155/2012/269532.
- Karlovich N.V., Spiridonova O.S., Sazonova E.G., Mokhort T.V. Determination of the parathyroid hormone reference interval in patients with different stages of the chronic kidney disease. Proceedings of the National Academy of Sciences of Belarus, Medical series. 2021. 18(2). 186-195. (In Russian) https://doi.org/10.29235/1814-6023-2021-18-2-186-195.
- Mach F., Baigent C., Catapano A.L., Koskinas K.C., Casula M., Badimon L., Chapman M.J. et al.; ESC Scientific Document Group. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk: The Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and European Atherosclerosis Society (EAS). European Heart Journal. 2020. 41(1). 111-188. https://doi.org/10.1093/eurheartj/ehz455.
- Fang H., Judd R.L. Adiponectin Regulation and Function. Compr. Physiol. 2018, Jun. 18. 8(3). 1031-1063. doi: 10.1002/cphy.c170046. PMID: 29978896.
- Vasilkova O., Mokhort T., Naumenko E., Korotayeva L., Filiptsova N. Insulin-Like Growth Factor-1 and Chronic Kidney Di-sease in Patients With Type 2 Diabetes Mellitus. International Journal of Endocrinology (Ukraine). 2019. 15(1). 3-9. doi. 10.22141/2224-0721.15.1.2019.158685.
- Zhang J., Wang N. Leptin in chronic kidney disease: a link between hematopoiesis, bone metabolism, and nutrition. Int. Urol. Nephrol. 2014. 46(6). 1169-74. DOI: 10.1007/s11255-013-0623-8.
- Jiang Y., Shen Z., Zhang J., Xing C., Zha X., Shen C., Zeng M. et al. Parathyroidectomy Increases Heart Rate Variability and Leptin Levels in Patients with Stage 5 Chronic Kidney Disease. Am. J. Nephrol. 2016. 44(3). 245-54. doi: 10.1159/000449018.

/13.jpg)
/14.jpg)