Вступ
Епілептичний напад, як прояв високої нейронної активності, є одним з найпоширеніших проявів патології нервової системи й може відзначатися при великій кількості різноманітних неврологічних і соматичних захворювань, становлячи 6–8 % у структурі неврологічної захворюваності [1].
При епілепсії якість життя безпосередньо пов’язана з ефективністю, безпекою і переносимістю протиепілептичної терапії. З огляду на постійну появу нових антиконвульсантів все частіше постає проблема вибору препарату як оптимального для даного пацієнта не лише в плані досягнення медикаментозної ремісії, але й з погляду покращення якості життя хворого на епілепсію. У зв’язку із зазвичай багаторічною тривалістю прийому протиепілептичних препаратів пацієнтами необхідно враховувати їх вплив на когнітивні функції для підтримки якості життя на максимально можливому рівні.
Мета дослідження: пошук антиконвульсантів з найменшим негативним впливом на когнітивні функції.
Матеріали та методи
Було проведено літературний пошук у базах даних PubMed, Medline, Google Scholar, Cochrane Database і в Інтернеті вільного доступу з використанням ключових слів: epilepsy, antiepileptic drugs, levetiracetam, cognitive functions, quality of life, side effects. Отриманий матеріал було відібрано й відсортовано відповідно до поставлених в огляді завдань.
Результати
При лікуванні епілепсії, особливо протиепілептичними препаратами першого покоління, доводиться балансувати між прямою дією антиконвульсантів і їх побічними ефектами, у тому числі зниженням когнітивних функцій, особливо з урахуванням раніше існуючих когнітивних порушень у пацієнта [2, 3].
У даний час відсутній консенсус щодо доцільності застосування ноотропної терапії в пацієнтів з епілепсією, зокрема із симптоматичною епілепсією [4]. Традиційно вважається, що застосування ноотропів при епілепсії може викликати погіршення перебігу захворювання [5]. Застосування ноотропних засобів при епілепсії, як правило, не рекомендується через посилення епілептичної активності, також можливе збільшення кількості епілептичних нападів.
Родоначальником родини ноотропів є пірацетам, який був синтезований у 1964 C.E. Giurgea [6]. У 1972 році було виявлено, що пірацетам покращує когнітивні функції і пам’ять, у тому ж році C.E. Giurgea запропонував термін «ноотропи» для позначення класу препаратів, що покращують вищі функції головного мозку і не мають побічних ефектів, властивих психо-стимуляторам [7].
Класифікація речовин з ноотропною дією (1998) [8, 9]:
1. Ноотропні препарати з домінуючим мнестичним ефектом:
1.1. Піролідонові ноотропні препарати (рацетами), переважно метаболічної дії (пірацетам, оксирацетам, анірацетам, етирацетам, ізоцетам та ін.).
1.2. Холінестеразні препарати:
1.2.1. Посилення синтезу ацетилхоліну і його викиду (холін хлорид, фосфатидилсерин, лецитин, ацетил-L-карнітин та ін.).
1.2.2. Агоністи холінергічних рецепторів (оксотреморин, бетанехол, спіропіперидини та ін.).
1.2.3. Інгібітори ацетилхолінестерази (фізостигмін, такрин, аміридин, галантамін, ертастигмін та ін.).
1.2.4. Речовини зі змішаним механізмом дії (деманол, ацеглутамат, фактор росту нерва, біфемалан та ін.).
1.3. Нейропептиди та їх аналоги (адренокортикотропний гормон, ебірад, соматостатин, вазопресин, тироліберин, субстанція Р, ангіотензин II, холецистокінін-8, пептидні аналоги пірацетаму та ін.).
1.4. Речовини, що впливають на систему збуджуючих амінокислот (глутамінова кислота, мілацемід, гліцин, D-циклосерин, нооглютил).
2. Ноотропні препарати змішаної дії з широким спектром ефектів (нейропротектори):
2.1. Активатори метаболізму мозку (актовегін, інстенон, ацетил-L-карнітин, фосфатидилсерин, ефіри гомопантотенової кислоти, ксантинові похідні та ін.).
2.2. Церебральні вазодилататори (вінпоцетин, оксибрал, ніцерголін, вінконат та ін.).
2.3. Антагоністи кальцію (німодипін, цинаризин, флунаризин та ін.).
2.4. Антиоксиданти (мексидол, ексифон, піритинол, атеровіт, меклофеноксат, токоферол).
2.5. Речовини, що впливають на систему гамма-аміномасляної кислоти (ГАМК) (гаммалон, пантогам, пікамілон, лігам, нікотинамід, фенібут, фенотропіл, натрію оксибутират, нейробутал та ін.).
2.6. Речовини з різних груп (етимізол, оротова кислота, метилглюкооротат, оксиметацил, беглімін, цереброкраст, женьшень, інстенон, екстракт гінгко білоба, лимонник та ін.).
У зв’язку з наведеними вище фактами, у тому числі відомим упередженням щодо негативного впливу ноотропів при епілепсії, незважаючи на те, що протиепілептичний ефект пірацетаму давно й широко використовувався при кортикальній міоклонії, актуальним є питання підбору протиепілептичного препарату, який не викликає погіршення когнітивних функцій, а в ідеалі — покращує їх [10].
Протиепілептичні препарати часто поділяються на «старі» (розроблені до 1990-х років) і «нові» (введені у 1990-ті роки чи пізніше). Для старих протиепілептичних препаратів доступні численні огляди й клінічні дані, що оцінюють їх вплив на когнітивні функції. Наприклад, одне з таких досліджень, що порівнює вплив карбамазепіну й фенітоїну на когнітивні функції пацієнтів з епілепсією, виявило помірний негативний вплив обох препаратів на когнітивні функції [11]. Рандомізовані подвійні сліпі перехресні дослідження показали, що карбамазепін, фенітоїн і вальпроєва кислота мають схожі когнітивні побічні ефекти. Навпаки, фенобарбітал продемонстрував значно гірші результати, ніж фенітоїн або вальпроати, з 32 % змінних. Усі ці препарати впливали на когнітивні функції, при цьому приблизно половина змінних мала значно гірші показники в групах, які отримували карбамазепін, фенітоїн і вальпроати [12, 13]. Повідомлялося, що загальний коефіцієнт інтелекту (особливо показники продуктивності) покращувався в дітей після припинення прийому фенобарбіталу порівняно з тими, хто продовжував його приймати [14]. Отже, було встановлено, що серед «старих» протиепілептичних препаратів карбамазепін, фенітоїн і вальпроати мали подібний вплив на когнітивні функції, при цьому фенобарбітал викликав найсерйозніші когнітивні розлади.
З початку 1990-х років було введено в клінічну практику багато нових протиепілептичних препаратів, таких як фелбамат, габапентин, ламотриджин, окскарбазепін, топірамат, тіагабін, вігабатрин, зонісамід, прегабалін, леветирацетам тощо. Не всі з них знайшли широке застосування на практиці, так, наприклад, фелбамат через серйозні проблеми безпеки, включно з апластичною анемією і гепатотоксичністю, рекомендується тільки пацієнтам з епілепсією, яка не піддається лікуванню іншими протиепілептичними препаратами [15].
Загалом для зменшення когнітивних побічних ефектів протиепілептичних препаратів використовуються такі методи:
— лікування основних патологічних процесів;
— повільне титрування дози на початку прийому;
— використання мінімально можливих доз протиепілептичних препаратів;
— використання монотерапії;
— якщо це можливо, рекомендовано уникати призначення протиепілептичних препаратів з більш серйозними побічними ефектами (наприклад, фенобарбіталу);
— запобігання несприятливим фармакокінетичним взаємодіям;
— баланс усіх факторів для контролю над нападами й підтвердження діагнозу епілепсії за умови резистентності до протиепілептичних засобів [15].
Деякі пацієнти піддаються кращому контролю над нападами (з найменшими побічними ефектами) шляхом адиктивної політерапії за допомогою низьких доз препаратів [15].
Одним з «нових» протиепілептичних препаратів не тільки з найменшим негативним впливом на когнітивні функції, але й з позитивним впливом на них є леветирацетам, хімічно подібний за своєю структурою до родоначальника родини ноотропів — пірацетаму.
Хімічна структура леветирацетаму
Леветирацетам — це піролідинон і карбоксамід, що є N-метил-піролідин-2-оном, у якому один з метильних атомів водню замінений амінокарбонільною групою, а інший — етильною групою, і являє собою S-енантіомер етилового аналога пірацетаму (рис. 1).
Механізм дії
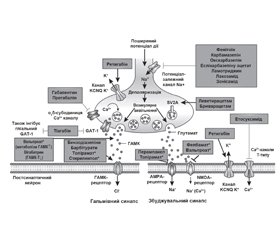
Точний механізм, за допомогою якого леветирацетам виявляє свою протиепілептичну дію, неясний, але він вважається унікальним серед усіх інших протиепілептичних препаратів. Сучасні знання дозволяють припустити, що зв’язування леветирацетаму з білком синаптичних везикул 2A (SV2A) є ключовим фактором його дії. SV2A — це мембранозв’язаний білок, який виявляється в синаптичних везикулах і повсюдно зустрічається в центральній нервовій системі, він, мабуть, відіграє роль в екзоцитозі везикул і модуляції синаптичної передачі за рахунок збільшення кількості секреторних везикул, доступних для нейротрансмісії (рис. 2).
Білок синаптичних везикул SV2A є місцем зв’язування леветирацетаму з мозком [16]. Стимуляція пресинаптичного SV2A леветирацетамом може пригнічувати вивільнення нейромедіаторів, але ця дія, мабуть, не впливає на нормальну нейротрансмісію. Цей факт спричинив припущення, що леветирацетам модулює функцію SV2A виключно в патофізіологічних умовах.
/46.jpg)
Леветирацетам і споріднені аналоги показали кореляцію між спорідненістю до SV2A і протиепілептичною активністю, що також свідчить про те, що дія на цій ділянці сприяє протиепілептичній активності препарату. Також було показано, що леветирацетам опосередковано впливає на ГАМКергічну нейротрансмісію (незважаючи на те, що не має прямого впливу на ГАМКергічні або глутаматергічні рецептори) і модулює іонні струми. Аналогічним чином in vitro було показано, що леветирацетам пригнічує кальцієві канали N-типу. Стереоселективне зв’язування леветирацетаму обме-жується синаптичними плазматичними мембранами в центральній нервовій системі, при цьому зв’язування в периферичних тканинах не відбувається. Леветирацетам пригнічує імпульсний спалах, не впливаючи на нормальну збудливість нейронів, що дозволяє припустити, що він може вибірково запобігати гіперсинхронізації епілептиформного спалаху й поширенню судомної активності [17].
Фармакодинаміка
Леветирацетам швидко й майже повністю всмоктується після перорального прийому, при цьому абсолютна біодоступність при пероральному прийомі становить 100 %. Tmax становить приблизно 1,3 год після прийому, а Cmax становить 31 мкг/мл після одноразового прийому 1000 мг і 43 мкг/мл — після повторного прийому. Одночасний прийом леветирацетаму з їжею подовжує Tmax приблизно на 1,5 год і знижує Cmax на 20 %.
Приблизно 66 % введеної дози леветирацетаму виводиться із сечею в незміненому вигляді, тоді як тільки 0,3 % від загальної дози виводиться з калом. Первинний неактивний метаболіт леветирацетаму, L057, також виявляється в сечі в кількості приблизно 24 % від введеної дози.
Об’ємний розподіл леветирацетаму становить приблизно від 0,5 до 0,7 л/кг. Загальний плазмовий кліренс леветирацетаму становить 0,96 мл/хв/кг, нирковий кліренс становить 0,6 мл/хв/кг. Первинний неактивний метаболіт леветирацетаму, L057, має нирковий кліренс 4 мл/хв/кг. З огляду на високу частку препарату, що зазнає ниркового кліренсу, загальний кліренс леветирацетаму знижується в пацієнтів з нирковою недостатністю. Фармакокінетика леветирацетаму лінійна в діапазоні доз 500–5000 мг. Стабільний стан досягається через 2 дні багаторазового прийому двічі на день [18]. Леветирацетам не зв’язується значною мірою з білками (< 10 %), і його обсяг розподілу близький до обсягу внутрішньоклітинної і позаклітинної води. Леветирацетам не метаболізується в організмі людини. Основним метаболічним шляхом є ферментативний гідроліз ацетамідної групи, який дає метаболіт карбонової кислоти L057 (24 % дози) і не залежить від ізоферментів цитохрому P450 печінки. Основний метаболіт неактивний у моделях судом у тварин. Два другорядних метаболіти були ідентифіковані як продукт гідроксилювання 2-оксопіролідинового кільця (2 % від дози) і розкриття 2-оксопіролідинового кільця в положенні 5 (1 % від дози). Енантіомерного взаємоперетворення леветирацетаму чи його основного метаболіту немає. Період напіввиведення леветирацетаму з плазми становить 6–8 год і не залежить від дози або повторного введення. Період напіввиведення збільшується в осіб похилого віку (приблизно на 40 %) і хворих з нирковою недостатністю.
Гепатотоксичність
Прийом леветирацетаму пов’язаний з рідкісними випадками підвищення рівня сироваткової амінотрансферази й лужної фосфатази під час лікування, а також з рідкісними випадками клінічно очевидних захворювань печінки, спричинених лікарськими засобами [17].
Доказова основа впливу леветирацетаму на когнітивні функції пацієнтів з епілепсією
Невелике відкрите дослідження 27 пацієнтів з резистентною епілепсією показало, що прийом леветирацетаму у вигляді додаткової терапії (спочатку 500 мг/день, потім збільшення до 1000–3000 мг/день) протягом 1 року значно покращував показники проспективної пам’яті, робочої пам’яті, а також швидкість мовлення, увагу і якість життя [19].
У кокранівському метааналізі 11 рандомізованих контрольованих досліджень 2012 р. (усього 1861 пацієнт) у пацієнтів з резистентною фокальною епілепсією додаткове застосування леветирацетаму (1000–4000 мг/день для дорослих, 60 мг/кг/день) протягом 24 тижнів значно знижувало частоту фокальних нападів і позитивно впливало на пізнавальні здібності й деякі аспекти якості життя дорослих, проте в дітей не було виявлено впливу прийому леветирацетаму на когнітивні функції [20].
У відкритому дослідженні за участю 55 пацієнтів з епілепсією, які раніше не отримували лікарських препаратів, монотерапія леветирацетамом протягом 1 року значно покращувала вербальну й зорову увагу, швидкість психомоторних функцій, ментальну гнучкість, виконавчі функції, швидкість мовлення й словотворення [21]. Усього було оцінено 25 показників когнітивних функцій плюс 2 показники настрою, з яких 14 когнітивних показників мали p-значення менше за 0,05 (різниця між показниками до лікування і після лікування). Жодна нейропсихологічна сфера не продемонструвала значного зниження. Також не було виявлено змін настрою.
Метою дослідження S. Zhou із співавт. було вивчення клінічних ефектів леветирацетаму при лікуванні дітей з епілепсією. Для цього із січня до грудня 2017 року було відібрано 136 дітей з епілепсією. Згідно з методом випадкових чисел вони були поділені на експериментальну групу й контрольну групу по 68 пацієнтів у кожній групі. Пацієнти контрольної групи отримували вальпроати, тоді як пацієнти експериментальної групи — леветирацетам. Порівнювалися рівні ефективності, когнітивні функції і частота клонічних нападів у двох групах. У результаті не було знайдено суттєвої різниці в загальному рівні ефективності між двома групами (р > 0,05). До лікування не було зафіксовано значних відмінностей у показниках уваги, виконавчих здібностей, абстрактному мисленні й орієнтуванні між двома групами (р > 0,05). Після лікування показники уваги (106,54 ± 6,56), виконавчих здібностей (105,76 ± 6,77), оцінки абстрактності й спрямованості (106,65 ± 6,57) були значно вищими в групі леветирацетаму. Різниця у двох групах була статистично значущою (р < 0,05). Після 3 місяців лікування частота міоклонічних нападів (9,22 ± 0,95) і частота тоніко-клонічних нападів (11,68 ± ± 1,36) виявилися значно нижчими, ніж у контрольній групі, а різниця між двома групами була статистично значущою (р < 0,05). Авторами зроблено висновок про те, що леветирацетам ефективний при лікуванні дітей, які страждають від епілепсії. Він може ефективно покращувати когнітивні функції пацієнтів, знижувати частоту міоклонічних і тоніко-клонічних нападів [22]. Було виявлено, що леветирацетам не ефективніший, ніж фенітоїн, щодо всіх видів нападів (співвідношення шансів (СШ) = 0,73; 95% довірчий інтервал (ДІ) = = 0,51–1,05; р = 0,09) і пізніх нападів (СШ = 0,64; 95% ДІ = 0,34–1,19; р = 0,16). Однак існує значна різниця в показниках частоти розвитку ранніх нападів (СШ = = 0,63; 95% ДІ = 0,40–0,99; р = 0,04). Авторами не було знайдено значних відмінностей у показниках смертності (СШ = 0,67; 95% ДІ = 0,43–1,05; р = 0,08) або побічних ефектів (СШ = 1,31; 95% ДІ = 0,80–2,15; р = 0,29) між групами. Отже, проведений метааналіз показав, що профілактика нападів за допомогою леветирацетаму була пов’язана з кращими показниками профілактики ранніх нападів. Статистично значущої різниці в профілях ефективності й безпеки не було виявлено [23].
Дослідження N. Akter із співавт. було спрямоване на порівняння ефективності леветирацетаму й фенобарбіталу в контролі над нападами при епілепсії. Це рандомізоване контрольоване дослідження було проведено для оцінки ефективності й переносимості леветирацетаму порівняно з фенобарбіталом при дитячій епілепсії серед дітей віком від 1 місяця до 15 років, яким був встановлений діагноз епілепсії (ідіопатична фокальна, генералізована, фокальна з вторинною генералізацією відповідно до ILAE), для оцінки ефекту леветирацетаму (n = 50) і фенобарбіталу (n = 68) з травня 2015 року до липня 2016 року. Діти спостерігалися протягом 12 місяців з інтервалом у 3 місяці для порівняння ремісії нападів і побічних ефектів леветирацетаму й фенобарбіталу. Діти в групі леветирацетаму були приблизно на 10 місяців старші, а також мали більш старший вік початку нападів (p = 0,02), ніж діти в групі фенобарбіталу (p = 0,03 і 0,02 відповідно). Генералізовані тоніко-клонічні напади були найпоширенішими типами нападів в обох групах. За 3 місяці лікування 55,8 % пацієнтів із групи леветирацетаму досягли 50–75 % ремісії нападів порівняно з 44,2 % у групі фенобарбіталу, через 6 місяців 75–100 % ремісії нападів спостерігалися в 57,4 % пацієнтів у групі леветирацетаму порівняно з 42,6 % пацієнтів у групі фенобарбіталу (p = 0,06), частка продовжувала збільшуватися через 9 місяців у групі леветирацетаму (n = 33; 55,9 %) проти групи фенобарбіталу (n = 26; 44,1 %), і це значення було статистично значимим (p = 0,05). Через 12 місяців подальшого покращення не спостерігалося. Повідомлялося про поведінкові проблеми в 4 пацієнтів із групи фенобарбіталу без будь-яких ознак погіршення когнітивних функцій, лише 3 пацієнти з групи леветирацетаму відчували дратівливість, проте жодна дитина з обох груп не припинила лікування через побічні ефекти. Авторами зроблено висновок про те, що монотерапія леветирацетамом більш ефективна в плані контролю нападів при фокальній, генералізованій і фокальній епілепсії з вторинною генералізацією порівняно з фенобарбіталом і має мінімальні побічні ефекти [24].
У дослідженні, проведеному у 2020 році в Єгипті, порівняли вплив леветирацетаму у вигляді монотерапії і натрію вальпроату у вигляді монотерапії на когнітивні функції в пацієнтів з епілепсією. Це було порівняльне проспективне дослідження 50 пацієнтів з нещодавно діагностованою епілепсією. Вони були поділені на дві групи: групу, яка приймала леветирацетам, і групу, яка приймала вальпроати. Усі пацієнти були піддані оцінці когнітивних функцій з використанням тестів на час реакції, тесту прокладання шляху й Вісконсинського тесту на сортування карт перед лікуванням і через 3 місяці після лікування. В обох групах відзначали зниження частоти епілептичних нападів. Пацієнти, які приймали леветирацетам, показали значне покращання когнітивних функцій через 3 місяці після початку лікування, тоді як пацієнти групи вальпроату показали значне зниження когнітивних функцій через 3 місяці після початку лікування [25].
У дослідженні J. Liu зі співавт. було включено одне рандомізоване контрольоване дослідження, у якому брало участь 95 осіб. Не було виявлено значних відмінностей при порівнянні леветирацетаму й ламотриджину (відносний ризик (ВР) = 1,20; докази з дуже низькою вірогідністю), леветирацетаму порівняно з фенобарбіталом (ВР = 1,01, докази з дуже низькою вірогідністю) або фенобарбіталом (ВР = 0,84, докази з дуже низькою вірогідністю) у їх впливі на когнітивні функції. Було встановлено, що леветирацетам може покращувати когнітивні функції, а ламотриджин може полегшувати депресію, тоді як фенобарбітал і ламотриджин можуть погіршувати когнітивні функції, а леветирацетам і фенобарбітал можуть погіршувати настрій. Автори оцінили вірогідність доказів усіх результатів як дуже низьку [26].
Застосування леветирацетаму при хворобі Альцгеймера
У наш час існують досить надійні дані, що демонструють глибокий зв’язок між епілепсією і хворобою Альцгеймера: пацієнти з помірними когнітивними порушеннями і хворобою Альцгеймера більш схильні до нападів, а судоми, мабуть, сприяють відкладенню тау- і бета-білка [27]. Згідно з цією точкою зору було доведено, що епілепсія із залученням лобової частки й хвороба Альцгеймера мають кілька спільних патологічних і нейровізуалізаційних особливостей. Навіть якщо припустити, що результати досліджень, присвячених поширеності інтеріктальної і субклінічної епілептиформної активності в цих пацієнтів, ще не є остаточними, можна говорити про те, що епілептиформна активність може негативно впливати на пам’ять і прискорювати когнітивне зниження або безпосередньо, або у зв’язку з нерозпізнаними німими нападами. Крім того, дані про патологічний вплив гіперзбудливості в скроневих відділах головного мозку на преморбідних і ранніх стадіях хвороби Альцгеймера відкривають нові терапевтичні можливості для терапії. Тому існує нагальна потреба у великих лонгітудинальних епідеміологічних дослідженнях, присвячених точному й довгостроковому нейрофізіологічному моніторингу впливу епілептиформної активності на когнітивні функції і прогресування захворювання. Відсутні чіткі рекомендації, що вказують на те, чи слід лікувати субклінічні епілептиформні аномалії при хворобі Альцгеймера без явних нападів і як їх лікувати. Протиепілептичні препарати можуть мати більше негативних, ніж позитивних когнітивних ефектів: препарати першого покоління можуть погіршити увагу, зосередження й швидкість психомоторних реакцій, водночас препарати нових поколінь переносяться краще і, як було доведено, покращують когнітивні функції і настрій. Авторами зроблено висновок, що леветирацетам і ламотриджин є найбільш прийнятними варіантами, але необхідно також отримати додаткову інформацію про препарати останнього покоління [27].
Леветирацетам в ін’єкційній формі показав свою ефективність при лікуванні епілептичного статусу в людей похилого віку. Лікування людей похилого віку може ускладнюватися серйозними побічними ефектами, пов’язаними з традиційними препаратами. Метою пілотного дослідження J. Fattouch із співавт. (2010) була оцінка короткострокової ефективності/безпеки внутрішньовенного введення леветирацетаму як препарату вибору для лікування епілептичного статусу в людей похилого віку [28]. До дослідження було включено дев’ять пацієнтів похилого віку (п’ять жінок і четверо чоловіків, середній вік 78 років). Двом пацієнтам раніше було встановлено діагноз епілепсії, у решти семи епілептичний статус був симптоматичним. Усі пацієнти мали супутні захворювання (аритмії, респіраторний дистрес, захворювання печінки). Оскільки традиційна терапія вважалася небезпечною, леветирацетам використовувався як терапія першої лінії (ударна доза 1500 мг/100 мл/15 хв, середня підтримуюча добова доза 2500 мг/24 год), що вводився під час відео-ЕЕГ-моніторингу. У всіх пацієнтів, крім одного, леветирацетам виявився ефективним і приводив або до зникнення (7/8), або значного зниження (1/8) епілептичної активності, у жодного пацієнта не було відзначено рецидиву в наступні 24 год. Жодних побічних ефектів чи змін ЕКГ і лабораторних показників не спостерігалося. Автори вважають, що ін’єкційна форма леветирацетаму може бути ефективним і безпечним засобом лікування епілептичного статусу в людей похилого віку.
Перспективи застосування леветирацетаму при травматичних ушкодженнях нервової системи
Вивчалася можливість застосування леветирацетаму при такій тяжкій і соціально значущій патології, як травма спинного мозку. Пошкодження спинного мозку призводить до серйозних порушень моторних, сенсорних і вегетативних функцій у пацієнтів. Після первинного пошкодження виникає підвищене вивільнення глутамату, що призводить до ексайтотоксичності й подальшої загибелі нейронів. Отже, пригнічення ексайтотоксичності глутамату є перспективною метою для посилення нейропротекції під час гострої фази пошкодження. В експериментальному дослідженні на тваринах R. Lima зі співавт. оцінювався терапевтичний ефект леветирацетаму, відомого своєю здатністю зв’язуватися з білком синаптичних везикул SV2A у головному й спинному мозку. Терапія леветирацетамом була протестована на двох моделях: одна — при ушкодженні шийного, а інша — грудного відділу спинного мозку. Лікування було ефективним в обох випадках. У пролікованих тварин спостерігалося значне покращання великої і дрібної моторики. Гістологічна оцінка показала значне зменшення розмірів порожнин, а також більше виживання нейронів та олігодендроцитів у постраждалих тварин. Молекулярний аналіз показав, що леветирацетам діє шляхом стабілізації астроцитів, забезпечуючи ефективне поглинання надлишкового глутамату з позаклітинного простору. Загалом результати дослідження продемонстрували, що леветирацетам може бути багатообіцяючим препаратом для лікування травм спинного мозку [29].
Черепно-мозкова травма (ЧМТ) є провідною причиною тривалої інвалідності [30]. Після ЧМТ підвищений ризик розвитку судом відіграє важливу роль як причина подальшого погіршення стану пацієнта і багато в чому пов’язаний з довгостроковими несприятливими наслідками, а також є предиктором майбутнього розвитку епілепсії [31]. Ризик ранніх нападів після ЧМТ у перші сім днів становить від 4 до 25 % [32]. Цей ризик найбільш виражений у пацієнтів з тяжкою ЧМТ, визначеною як ≤ 8 балів за шкалою коми Глазго (GCS). У цих пацієнтів зазвичай спостерігається субдуральна гематома, епідуральна гематома, внутрішньочерепна гематома, лінійний/вдавлений перелом або забій кори [33]. Протиепілептичні препарати рекомендуються для запобігання раннім посттравматичним нападам протягом семи днів після травми в пацієнтів з тяжкою черепно-мозковою травмою [34]. Ці препарати зазвичай не рекомендуються пацієнтам з ЧМТ легкого і середнього ступеня тяжкості, що визначається при оцінці за GCS > 8. Метою дослідження J. DJohn із співавт. була оцінка доцільності використання леветирацетаму в пацієнтів з легкою, середньою і тяжкою ЧМТ. У цьому ретроспективному когортному дослідженні оцінювалася ефективність використання леветирацетаму в дорослих пацієнтів, які надходили до клініки з ЧМТ протягом п’яти років. Пацієнти, молодші за 18 років, які в анамнезі мали судоми, були переведені до спеціалізованого центру або померли від отриманих травм, були виключені з дослідження. Первинним результатом дослідження було вивчення доцільності застосування леветирацетаму, вторинні результати включали тривалість лікування й частоту нападів. З 448 обстежених пацієнтів 36 було виключено. З 412 включених пацієнтів 403 (97,8 %) мали легку ЧМТ. У пацієнтів з легкою ЧМТ 153 (38 %) отримували леветирацетам, а 94 (23,3 %) отримували його понад 7 днів. Крім того, 105 (26,1 %) пацієнтів з нетяжкою ЧМТ було виписано з рекомендаціями щодо прийому леветирацетаму, незважаючи на відсутність нападів під час госпіталізації.
Усі шість пацієнтів з легкою ЧМТ, у яких відзначалися напади, отримували леветирацетам. Авторами зроблено висновок про те, що некоректне використання леветирацетаму часто зустрічається в пацієнтів, які надійшли з легкою ЧМТ, при цьому багато пацієнтів продовжують використовувати леветирацетам після виписки. Автори вважають, що при ретельному відборі пацієнтів особи з легкою і помірною ЧМТ, імовірно, не потребують профілактики судом за допомогою леветирацетаму. Автори також повідомляють про необхідність ширшого висвітлення питання показань і тривалості лікування в пацієнтів із ЧМТ.
У проведеному А. Hazama із співавт. ретроспективному когортному дослідженні, заснованому на даних історій хвороби пацієнтів із січня 2013 року по січень 2017 року в травматологічному центрі першого рівня в США, було проведено аналіз підгруп за шкалою коми Глазго (група A: помірні GCS = 13–15, леветирацетам — n = 135, без леветирацетаму — n = 122; група B: помірні GCS = 9–12, леветирацетам — n = 23, без леветирацетаму — n = 19; група C: тяжкі GCS = < 8, леветирацетам — n = 6) [36]. З 403 пацієнтів, включених у дослідження, 227 одержували леветирацетам. Демографічні показники між групами лікування були схожими. Повний когортний аналіз виявив шість пацієнтів з посттравматичними судомами й відсутністю значних відмінностей між групами (леветирацетам — n = 3, без леветирацетаму — n = 3, СШ = 0,77; р = 0,75; 95% ДІ = 0,154–3,87). Аналіз підгруп виявив зниження частоти нападів у групах леветирацетаму (СШ = 0,18, р = 0,27; 95% ДІ = 0,008–3,80) і B (СШ = 0,82; р = 0,92; 95% ДІ = 0,015–43,7), але це зниження не було статистично значущим. На частку пацієнтів з тяжкою ЧМТ у групі C припадала більшість нападів (n = 4, СШ = = 1,52; р = 0,71; 95% ДІ = 0,15–15,4). Авторами зроблено висновок про те, що пацієнти з тяжчою ЧМТ частіше мають ранні посттравматичні напади. Загалом було виявлено тенденцію до зниження частоти нападів у пацієнтів, які отримували профілактику препаратом леветирацетам. Незважаючи на цю тенденцію, зниження частоти нападів не досягло статистичної значущості.
Оскільки фенітоїн є стандартом лікування для запобігання судомам, то метою дослідження L. Zhao із співавт. (2018) була оцінка безпеки й ефективності застосування леветирацетаму в профілактиці посттравматичної епілепсії порівняно з фенітоїном [23]. Було виявлено, що леветирацетам не ефективніший, ніж фенітоїн, з точки зору загальної частоти нападів (СШ = 0,73; 95% ДІ = 0,51–1,05; р = 0,09) і пізніх нападів (СШ = 0,64; 95% ДІ = 0,34–1,19; р = 0,16). Однак була виявлена значна різниця в показниках ранніх нападів (СШ = 0,63; 95% ДІ = 0,40–0,99; р = 0,04). Не було виявлено значних відмінностей у показниках смертності (СШ = 0,67; 95% ДІ = 0,43–1,05; р = 0,08) або побічних ефектів (СШ = 1,31; 95% ДІ = 0,80–2,15; р = 0,29) між групами. Отже, проведений авторами метааналіз показав, що профілактика нападів за допомогою леветирацетаму була пов’язана переважно зі зменшенням частоти ранніх нападів. Статистично значущої різниці в профілях ефективності й безпеки (смертність і побічні ефекти) між фенітоїном і леветирацетамом не було виявлено. Отже, з огляду на позитивний ефект леветирацетаму на когнітивні функції, а також його високий профіль безпеки, він, можливо, може виявитися кращим для застосування в пацієнтів з преморбідними когнітивними порушеннями.
Американськими дослідниками в даний час (початок дослідження — у 2021 році, закінчення — у 2022 році) проводиться проспективне одноцентрове фармакокінетичне й фармакодинамічне дослідження, що включає пацієнтів після тяжкої ЧМТ у критичному стані, які отримують внутрішньовенно леветирацетам для профілактики судом [37]. Пацієнти з тяжкою ЧМТ, які підходять для мультимодального моніторингу, отримують 1000 мг леветирацетаму кожні 8 год відповідно до встановленої практики. Усі інші пацієнти з тяжкою ЧМТ одержують 1000 мг леветирацетаму кожні 12 год. Пацієнти з порушенням функції нирок (кліренс креатиніну < 50 мл/хв) виключаються з дослідження. У всіх пацієнтів беруться п’ять зразків сироватки після шостої або послідовної дози. У пацієнтів, які отримують леветирацетам кожні 8 год, зразки збираються через 0,5; 1, 4, 6 і 8 год. У пацієнтів, які отримують леветирацетам кожні 12 год, зразки збираються через 0,5; 1, 4, 8 і 12 год. Концентрації препарату в сироватці будуть проаналізовані за допомогою фармакокінетичного моделювання й моделювання Монте-Карло. Фармакодинаміка леветирацетаму оцінюється в пацієнтів, які отримують мультимодальний моніторинг або, при можливості, поверхневу ЕЕГ.
Висновки
1. Найбільш оптимальним вибором при необхідності лікування пацієнтів з епілепсією з коморбідними когнітивними порушеннями є монотерапія протиепілептичними препаратами з доведеним ноотропним ефектом.
2. Монотерапія є кращою внаслідок кращого комплаєнсу терапії, у тому числі відсутності сумації побічних ефектів.
3. Одним із препаратів вибору, позитивний вплив якого на когнітивні функції у пацієнтів з епілепсією доведено, є леветирацетам.
4. Завдяки високому профілю безпеки леветирацетам може бути рекомендований до застосування в літніх пацієнтів з епілепсією, у тому числі для купірування в них епілептичного статусу.
5. Леветирацетам може успішно використовуватися при поєднанні хвороби Альцгеймера з епілепсією.
6. Актуальним і перспективним напрямом подальших досліджень є вивчення можливостей застосування леветирацетаму при травматичних ушкодженнях нервової системи.
Конфлікт інтересів. Не заявлений.
Отримано/Received 20.10.2021
Рецензовано/Revised 05.11.2021
Прийнято до друку/Accepted 13.11.2021
Список литературы
1. Дзяк Л.А., Зенков Л.Р., Кириченко А.Г. Эпилепсия. Киев: Книга-плюс, 2001. 168 с.
2. Бадалян О.Л., Бурд С.Г., Савенков А.А., Тертышник О.Ю., Юцкова Е.В., Тарарина Л.А. Применение Фенотропила в лечении неврологических заболеваний. Русский медицинский журнал. М. 2006. 14(16). 1222-1228.
3. Бадалян О.Л., Савенков А.А., Авакян Г.Н., Юцкова Е.В. Возможности применения ноотропных препаратов в комплексном лечении эпилепсии. Эпилепсия и пароксизмальные состояния. 2013. № 2. URL: https://cyberleninka.ru/article/n/vozmozhnosti-primeneniya-nootropnyh-preparatov-v-kompleksnom-lechenii-epilepsii.
4. Карлов В.А. и др. Эпилепсия у детей и взрослых, женщин и мужчин. Руководство для врачей. Москва, 2010. 720 с.
5. Mattes A., Schneble H. Epilepsien. Diagnostik und Terapie fur Klinik und Praxis. New York: Tieme Verlag, 1992.
6. Li J.J., Corey E.J. Drug Discovery: Practices, Processes, and Perspectives. John Wiley & Sons, 2013. Р. 276. ISBN 9781118354469.
7. Giurgea C. Vers une pharmacologie de l’activit? integrative du cerveau. Tentative du concept nootrope en psychopharmacologie [Pharmacology of integrative activity of the brain. Attempt at nootropic concept in psychopharmacology]. Actual Pharmacol. (Paris). 1972. 25. 115-56. French. PMID: 4541214.
8. https://www.rmj.ru/articles/nevrologiya/Sovremennyy_vzglyad_na_nootropnuyu_terapiyu/#ixzz7BdAPJ15i.
9. Воронина Т.А., Середенин С.Б. Ноотропные препараты, достижения и новые проблемы. Экспериментальная и клиническая фармакология. 1998. Т. 61. № 4. С. 3-9.
10. Koskiniemi M., Van Vleymen B., Hakamies L. et al Piracetam relieves symptoms in progressive myoclonus epilepsy: a multicentre, randomised, double blind, crossover study comparing the efficacy and safety of three dosages of oral piracetam with placebo Journal of Neurology, Neurosurgery & Psychiatry 1998. 64. 344-348.
11. Pulliainen V., Jokelainen M. Effects of phenytoin and carbamazepine on cognitive functions in newly diagnosed epileptic patients. Acta Neurol. Scand. 1994. 89. 81-86.
12. Meador K.J., Loring D.W., Allen M.E., Zamrini E.Y., Moore E.E., Abney O.L., et al. Comparative cognitive effects of carbamazepine and phenytoin in healthy adults. Neurology. 1991. 41. 1537-1540.
13. Meador K.J., Loring D.W., Moore E.E., Thompson W.O., Nichols M.E., Oberzan R.E. et al. Comparative cognitive effects of phenobarbital, phenytoin, and valproate in adults subjects. Neurology. 1995. 45. 1494-1499.
14. Tonekaboni S.H., Beyraghi N., Tahbaz H.S., Bahrey-nian S.A., Aghamohammadpoor M. Neurocognitive effects of phenobarbital discontinuation in epileptic children. Epilepsy Behav. 2006. 8. 145-148.
15. Park S.P., Kwon S.H. Cognitive effects of antiepileptic drugs. J. Clin. Neurol. 2008. 4(3). 99-106. doi: 10.3988/jcn.2008.4.3.99.
16. Lynch B.A., Lambeng N., Nocka K., Kensel-Hammes P., Bajjalieh S.M., Matagne A., Fuks B. The synaptic vesicle protein SV2A is the binding site for the antiepileptic drug levetiracetam. Proc. Natl. Acad. Sci USA. 2004 Jun 29. 101(26). 9861-6. doi: 10.1073/pnas.0308208101. Epub2004 Jun 21. PMID: 15210974; PMCID: PMC470764.
17. National Center for Biotechnology Information. PubChem Compound Summary for CID 5284583, Levetiracetam. Retrieved August 28, 2021. https://pubchem.ncbi.nlm.nih.gov/compound/Levetiracetam.
18. Physicians Desk Reference. 61st ed. Montvale, NJ: Thomson PDR, 2007. Р. 3315.
19. Lopez-Gongora M., Martinez-Domeno A., Garcia C. et al. Effect of levetiracetam on cognitive functions and quality of life: a one-year follow-up study. Epileptic Disord. 2008. 10. 297-305. https://www.ncbi.nlm.nih.gov/pubmed/19017572.
20. Mbizvo G.K., Dixon P., Hutton J.L. et al. Levetiracetam add-on for drug-resistant focal epilepsy: an updated Cochrane Review. Cochrane Database Syst Rev. 2012. CD001901. https://www.ncbi.nlm.nih.gov/pubmed/22972056.
21. Koo D.L., Hwang K.J., Kim D. et al. Effects of levetiracetam monotherapy on the cognitive function of epilepsy patients. Eur. Neurol. 2013. 70. 88-94. https://www.ncbi.nlm.nih.gov/pubmed/23839084.
22. Zhou S., Zhan Q., Wu X. Effect of Levetiracetam on Cognitive Function and Clonic Seizure Frequency in Children with Epilepsy. Curr. Mol. Med. 2019. 19(9). 699-703. doi: 10.2174/1566524019666190729113321. PMID: 31362674.
23. Zhao L., Wu Y.P., Qi J.L., Liu Y.Q., Zhang K., Li W.L. Efficacy of levetiracetam compared with phenytoin in prevention of seizures in brain injured patients: A meta-analysis. Medicine (Baltimore). 2018. 97(48). e13247. doi:10.1097/MD.0000000000013247.
24. Akter N., Rahman M.M., Akhter S., Fatema K. A Randomized Controlled Trial of Phenobarbital and Levetiracetam in Childhood Epilepsy. Mymensingh Med. J. 2018 Oct. 27(4). 776-784. PMID: 30487494.
25. El Sabaa R.M., Hamdi E., Hamdy N.A., Sarhan H.A. Effects of Levetiracetam Compared to Valproate on Cognitive Functions of Patients with Epilepsy. Neuropsychiatr. Dis. Treat. 2020. 16. 1945-1953. Published 2020 Aug 11. doi:10.2147/NDT.S256117.
26. Liu J., Wang L.-N. Treatment of epilepsy for people with Alzheimer’s disease. Cochrane Database of Systematic Reviews. 2021, Issue 5. Art. No.: CD011922. DOI: 10.1002/14651858.CD011922.pub4. Accessed 26 July 2021.
27. Tombini M., Assenza G., Ricci L., et al. Temporal Lobe Epilepsy and Alzheimer’s Disease: From Preclinical to Clinical Evidence of a Strong Association. J Alzheimer’s Dis Rep. 2021. 5(1). 243-261. Published 2021 Apr 6. doi:10.3233/ADR-200286.
28. Fattouch J., Di Bonaventura C., Casciato S., Bonini F., Petrucci S., Lapenta L., Manfredi M., Prencipe M., Giallonardo A.T. Intravenous Levetiracetam as first-line treatment of status epilepticus in the elderly. Acta Neurol/ Scand. 2010 Jun. 121(6). 418-21. doi: 10.1111/j.1600-0404.2010.01351.x. PMID: 20578996.
29. Lima R., Gomes E.D., Cibrão J.R. et al. Levetiracetam treatment leads to functional recovery after thoracic or cervical injuries of the spinal cord. NPJ Regen. Med. 6. 11 (2021). https://doi.org/10.1038/s41536-021-00121-7.
30. Carney N., Totten A.M., O’Reilly C. et al. Guidelines for the management of severe traumatic brain injury. Fourth edition. Neurosurgery. 2016. 80. 6-15.
31. Caballero G.C., Hughes D.W., Maxwell P.R., Green K., Gamboa C.D., Barthol C.A. Retrospective analysis of levetiracetam compared to phenytoin for seizure prophylaxis in adults with traumatic brain injury. Hosp. Pharm. 2013. 48. 757-761.
32. Temkin N.R., Dikmen S.S., Winn HR. Management of Head Injury. Philadelphia, PA: W.B. Saunders, 1991. Posttraumatic seizures. Р. 425-435.
33. Inaba K., Menaker J., Branco B.C. et al. A prospective multicenter comparison of levetiracetam versus phenytoin for early posttraumatic seizure prophylaxis. J. Trauma Acute Care Surg. 2013. 74. 766-773.
34. Guidelines for the management of severe traumatic brain injury. XIII. Antiseizure prophylaxis. Brain Trauma Foundation; American Association of Neurological Surgeons; Congress of Neurological Surgeons. J. Neurotrauma. 2007. 24. 83-86.
35. DJohn J., Ibrahim R., Patel P., DeHoff K., Kolbe N. Admi-nistration of Levetiracetam in Traumatic Brain Injury: Is it Warran-ted? Cureus. 2020. 12(7). e9117. Published 2020 Jul 10. doi:10.7759/cureus.9117.
36. Hazama A., Ziechmann R., Arul M., Krishnamurthy S., Galgano M., Chin L.S. The Effect of Keppra Prophylaxis on the Incidence of Early Onset, Post-traumatic Brain Injury Seizures. Cureus. 2018. 10(5). e2674. Published 2018 May 23. doi:10.7759/cureus.2674.
37. https://clinicaltrials.gov/ct2/show/NCT04836481.
UA-LEVI-PUB-112021-073

/45.jpg)
/46.jpg)