Международный эндокринологический журнал Том 17, №7, 2021
Вернуться к номеру
Інсулінорезистентність у хворих на псоріаз
Авторы: Паньків І.В.
Буковинський державний медичний університет, м. Чернівці, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
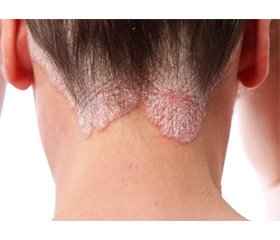
Псоріаз розглядається як хронічне системне запальне захворювання з активацією дендритних клітин шкіри з накопиченням у вогнищах запалення інтерлейкіну-23 та активованих Th-1-лімфоцитів (Th-17, Th-22). Останнім часом відзначається велика кількість даних, що виявляють зв’язок псоріазу з іншими запальними захворюваннями, до яких, зокрема, належать ожиріння, цукровий діабет, атеросклероз, артеріальна гіпертензія, неалкогольна жирова хвороба печінки, синдром полікістозних яєчників, доброякісна гіперплазія передміхурової залози та ін. Усі зазначені стани пов’язані із системним запаленням та індукованою ним інсулінорезистентністю. Псоріаз належить до найпоширеніших хронічних дерматозів і діагностується в 1–2 % населення розвинутих країн. Псоріаз як хронічне імунозапальне захворювання шкіри часто асоціюється з компонентами метаболічного синдрому: ожирінням, артеріальною гіпертензією, інсулінорезистентністю, дисліпідемією. Ризик розвитку метаболічного синдрому в пацієнтів із псоріазом на 40 % вищий, ніж у загальній популяції. Спільними ланками патогенезу псоріазу та метаболічного синдрому є хронічне системне запалення та підвищення рівня прозапальних цитокінів. Системне запалення сприяє розвитку ожиріння, захворювань серцево-судинної системи, цукрового діабету 2-го типу. Ці стани призводять до коморбідності серед пацієнтів із псоріазом. Існує позитивний зв’язок між тяжкістю перебігу псоріазу та наявністю метаболічного синдрому, що проявляється більшою поширеністю висипів, скороченням термінів ремісії та підвищеним ризиком розвитку псоріатичного артриту. У носіїв алелей ризику ожиріння гена FTO спостерігаються тяжчий перебіг псоріазу, наявність псоріатичного артриту, підвищення індексу маси тіла. Огляд літератури присвячений питанням взаємозв’язків між інсулінорезистентністю та патогенезом псоріазу.
Psoriasis is a chronic systemic inflammatory disease accompanied by an activation of skin dendritic cells with accumulation in the inflammatory foci of interleukin-23 and activated Th-1 lymphocytes (Th-17, Th-22). In recent years, there has been a large number of evidence linking psoriasis with other inflammatory diseases, including obesity, diabetes mellitus, atherosclerosis, hypertension, nonalcoholic fatty liver disease, polycystic ovary syndrome, benign prostatic hyperplasia, etc. All of these conditions are associated with systemic inflammation and insulin resistance induced by it. Psoriasis is the most common chronic dermatosis and affects 1–2 % of the population in developed countries. Psoriasis as a chronic immune-mediated inflammatory skin disease is often associated with metabolic syndrome and its components such as obesity, hypertension, insulin resistance and dyslipidemia. The risk of developing metabolic syndrome in patients with psoriasis is 40 % higher than in the general population. Psoriasis and metabolic syndrome share some pathogenic mechanisms such as chronic low-grade systemic inflammation and an increased level of pro-inflammatory cytokines. Systemic inflammation causes obesity, cardiovascular diseases, diabetes mellitus type 2. These conditions increase the risk of mortality among patients with psoriasis. There is a positive correlation between the severity of psoriasis and metabolic syndrome, which is manifested by a severe rash, reduction of the remission and higher risk of psoriatic arthritis development. The carriers of the risk allele of FTO gene are characterized by a more severe psoriasis, the presence of psoriatic arthritis and increased body mass index. A review of the literature focuses on the relationship between insulin resistance and the pathogenesis of psoriasis.
псоріаз; інсулінорезистентність; ожиріння; коморбідність; поліморфізм генів
psoriasis; insulin resistance; obesity; comorbidity; genetic polymorphism
- Łebkowska A., Krentowska A., Adamska A., Lipińska D., Piasecka B., Kowal-Bielecka O., Górska M. et al. Type B insulin resistance syndrome associated with connective tissue disease and psoriasis. Endocrinol. Diabetes Metab. Case Rep. 2020, Aug 4. 2020. 20-0027. doi: 10.1530/EDM-20-0027.
- Wen S., Liu C., Li Y., Pan J., Nguyen T., Zhou L. Psoriasis Exacerbates the State of Insulin Resistance in Patients with Type 2 Diabetes. Diabetes Metab. Syndr. Obes. 2021, May 26. 14. 2389-2397. doi: 10.2147/DMSO.S312420.
- Bajaj S., Mandal S., Singh K.G., Prajapati R. Metabolic Diseases and Associated Complications in Patients with Psoriasis. J. Assoc. Physicians India. 2020 Oct. 68(10). 44-46. PMID: 32978925.
- Polic M.V., Miskulin M., Smolic M., Kralik K., Miskulin I., Berkovic M.C., Curcic I.B. Psoriasis Severity — A Risk Factor of Insulin Resistance Independent of Metabolic Syndrome. Int. J. Environ. Res. Public Health. 2018. 15(7). 1486. doi: 10.3390/ijerph15071486.
- Abramczyk R., Queller J.N., Rachfal A.W., Schwartz S.S. Diabetes and Psoriasis: Different Sides of the Same Prism. Diabetes Metab. Syndr. Obes. 2020, Oct 7. 13. 3571-3577. doi: 10.2147/DMSO.S273147.
- Hao Y., Zhu Y.J., Zou S., Zhou P., Hu Y.W., Zhao Q.X., Gu L.N. et al. Metabolic Syndrome and Psoriasis: Mechanisms and Future Directions. Front. Immunol. 2021. 12. 711060. doi: 10.3389/fimmu.2021.711060.
- Chan W.M.M., Yew Y.W., Theng T.S.C., Liew C.F., Oon H.H. Prevalence of metabolic syndrome in patients with psoriasis: a cross-sectional study in Singapore. Singapore Med. J. 2020 Apr. 61(4). 194-199. doi: 10.11622/smedj.2019152.
- Caroppo F., Galderisi A., Ventura L., Belloni Fortina A. Metabolic syndrome and insulin resistance in pre-pubertal children with psoriasis. Eur. J. Pediatr. 2021. 180(6). 1739-1745. doi: 10.1007/s00431-020-03924-w.
- Bulur I., Erdogan H.K., Kocatürk E., Saracoglu Z.N., Alataş Ö., Yildiz P., Bilgin M. The role of irisin in the relationship between psoriasis and insulin resistance. G. Ital. Dermatol. Venereol. 2018. 153(4). 477-482. doi: 10.23736/S0392-0488.16.05413-4.
- Gisondi P., Fostini A.C., Fossà I., Girolomoni G., Targher G. Psoriasis and the metabolic syndrome. Clin. Dermatol. 2018 Jan-Feb. 36(1). 21-28. doi: 10.1016/j.clindermatol.2017.09.005.
- Choudhary S., Pradhan D., Pandey A., Khan M.K., Lall R., Ramesh V., Puri P., Jain A.K., Thomas G. The Association of Metabolic Syndrome and Psoriasis: A Systematic Review and Meta-Analysis of Observational Study. Endocr. Metab. Immune Disord. Drug. Targets. 2020. 20(5). 703-717. doi: 10.2174/1871530319666191008170409.
- Jensen P., Skov L. Psoriasis and Obesity. Dermatology. 2016. 232(6). 633-639. doi: 10.1159/000455840. Epub. 2017, Feb 23. PMID: 28226326.
- Kunz M., Simon J.C., Saalbach A. Psoriasis: Obesity and Fatty Acids. Front. Immunol. 2019, Jul 31. 10. 1807. doi: 10.3389/fimmu.2019.01807.
- Correia B., Torres T. Obesity: a key component of psoriasis. Acta Biomed. 2015, Sep 14. 86(2). 121-9. PMID: 26422425.
- Paroutoglou K., Papadavid E., Christodoulatos G.S., Dalamaga M. Deciphering the Association Between Psoriasis and Obesity: Current Evidence and Treatment Considerations. Curr. Obes. Rep. 2020 Sep. 9(3). 165-178. doi: 10.1007/s13679-020-00380-3.
- Petersen M.C., Shulman G.I. Mechanisms of Insulin Action and Insulin Resistance. Physiol. Rev. 2018, Oct 1. 98(4). 2133-2223. doi: 10.1152/physrev.00063.2017.
- Wu H., Ballantyne C.M. Metabolic Inflammation and Insulin Resistance in Obesity. Circ. Res. 2020, May 22. 126(11). 1549-1564. doi: 10.1161/CIRCRESAHA.119.315896.
- Shimobayashi M., Albert V., Woelnerhanssen B. et al. Insulin resistance causes inflammation in adipose tissue. J. Clin. Invest. 2018, Apr 2. 128(4). 1538-1550. doi: 10.1172/JCI96139.
- Li B., Xi P., Wang Z., Han X., Xu Y., Zhang Y., Miao J. PI3K/Akt/mTOR signaling pathway participates in Streptococcus uberis-induced inflammation in mammary epithelial cells in concert with the classical TLRs/NF-ĸB pathway. Vet. Microbiol. 2018 Dec. 227. 103-111. doi: 10.1016/j.vetmic.2018.10.031.
- Reich K. The concept of psoriasis as a systemic inflammation: implications for disease management. J. Eur. Acad. Dermatol. Venereol. 2012 Mar. 26, Suppl. 2. 3-11. doi: 10.1111/j.1468-3083.2011.04410.x.
- Rendon A., Schäkel K. Psoriasis Pathogenesis and Treatment. Int. J. Mol. Sci. 2019, Mar 23. 20(6). 1475. doi: 10.3390/ijms20061475.
- Deng Y., Chang C., Lu Q. The Inflammatory Response in Psoriasis: a Comprehensive Review. Clin. Rev. Allergy Immunol. 2016 Jun. 50(3). 377-89. doi: 10.1007/s12016-016-8535-x.
- Stanescu A.M.A., Simionescu A.A., Florea M., Diaconu C.C. Is Metformin a Possible Beneficial Treatment for Psoriasis? A Scoping Review. J. Pers. Med. 2021, Mar 30. 11(4). 251. doi: 10.3390/jpm11040251.
- Singh S., Bhansali A. Randomized Placebo Control Study of Metformin in Psoriasis Patients with Metabolic Syndrome (Systemic Treatment Cohort). Indian J. Endocrinol. Metab. 2017, Jul-Aug. 21(4). 581-587. doi: 10.4103/ijem.IJEM_46_17.
- Chang G., Wang J., Song J., Zhang Z., Zhang L. Efficacy and safety of pioglitazone for treatment of plaque psoriasis: a systematic review and meta-analysis of randomized controlled trials. J. Dermatolog Treat. 2020 Nov. 31(7). 680-686. doi: 10.1080/09546634.2019.1610552.
- Hafez V.G., Bosseila M., Abdel Halim M.R., Shaker O.G., Kamal M., Kareem H.S. Clinical effects of «pioglitazone», an insulin sensitizing drug, on psoriasis vulgaris and its co-morbidities, a double blinded randomized controlled trialx1. J. Dermatolog Treat. 2015 Jun. 26(3). 208-14. doi: 10.3109/09546634.2014.932324.
- Griffiths C.E.M., van der Walt J.M., Ashcroft D.M., Flohr C., Naldi L., Nijsten T., Augustin M. The global state of psoriasis disease epidemiology: a workshop report. Br. J. Dermatol. 2017 Jul. 177(1). e4-e7. doi: 10.1111/bjd.15610.
- Armstrong A.W., Harskamp C.T., Armstrong E.J. Psoriasis and metabolic syndrome: a systematic review and meta-analysis of observational studies. J. Am. Acad. Dermatol. 2013 Apr. 68(4). 654-662. doi: 10.1016/j.jaad.2012.08.015.
- Snekvik I., Nilsen T.I.L., Romundstad P.R., Saunes M. Metabolic syndrome and risk of incident psoriasis: prospective data from the HUNT Study, Norway. Br. J. Dermatol. 2019 Jan. 180(1). 94-99. doi: 10.1111/bjd.16885.
- Polic M.V., Miskulin M., Smolic M., Kralik K., Miskulin I., Berkovic M.C., Curcic I.B. Psoriasis Severity-A Risk Factor of Insulin Resistance Independent of Metabolic Syndrome. Int. J. Environ. Res. Public Health. 2018, Jul 13. 15(7). 1486. doi: 10.3390/ijerph15071486.
- Souza C.S., de Castro C.C.S., Carneiro F.R.O., Pinto J.M.N., Fabricio L.H.Z., Azulay-Abulafia L., Romiti R. et al. Metabolic syndrome and psoriatic arthritis among patients with psoriasis vulgaris: Quality of life and prevalence. J. Dermatol. 2019 Jan. 46(1). 3-10. doi: 10.1111/1346-8138.14706.
- Novelli L., Lubrano E., Venerito V., Perrotta F.M., Marando F., Curradi G., Iannone F. Extra-Articular Manifestations and Comorbidities in Psoriatic Disease: A Journey Into the Immunologic Crosstalk. Front. Med. 2021. 8. 737079. doi: 10.3389/fmed.2021.737079.
- Owczarczyk-Saczonek A., Purzycka-Bohdan D., Nedoszytko B., Reich A., Szczerkowska-Dobosz A., Bartosiñska J., Batycka-Baran A. et al. Pathogenesis of psoriasis in the «omic» era. Part III. Metabolic disorders, metabolomics, nutrigenomics in psoriasis. Postepy Dermatol. Alergol. 2020 Aug. 37(4). 452-467. doi: 10.5114/ada.2020.98284.
- Johnson J.A., Ma C., Kanada K.N., Armstrong A.W. Diet and nutrition in psoriasis: analysis of the National Health and Nutrition Examination Survey (NHANES) in the United States. J. Eur. Acad. Dermatol. Venereol. 2014 Mar. 28(3). 327-32. doi: 10.1111/jdv.12105.
- Wu A.G., Weinberg J.M. The impact of diet on psoriasis. Cutis. 2019 Aug. 104(2S). 7-10. Erratum in: Cutis. 2019 Oct. 104(4). 241. PMID: 31634384.
- Chang J.Y., Park J.H., Park S.E., Shon J., Park Y.J. The Fat Mass- and Obesity-Associated (FTO) Gene to Obesity: Lessons from Mouse Models. Obesity (Silver Spring). 2018 Nov. 26(11). 1674-1686. doi: 10.1002/oby.22301.
- Mizuno T.M. Fat Mass and Obesity Associated (FTO) Gene and Hepatic Glucose and Lipid Metabolism. Nutrients. 2018, Nov 1. 10(11). 1600. doi: 10.3390/nu10111600.
- Castellini G., Franzago M., Bagnoli S., Lelli L., Balsamo M., Mancini M., Nacmias B. et al. Fat mass and obesity-associated gene (FTO) is associated to eating disorders susceptibility and moderates the expression of psychopathological traits. PLoS One. 2017, Mar 10. 12(3). e0173560. doi: 10.1371/journal.pone.0173560.
- Ford A.R., Siegel M., Bagel J., Cordoro K.M., Garg A., Gottlieb A., Green L.J. et al. Dietary Recommendations for Adults With Psoriasis or Psoriatic Arthritis From the Medical Board of the National Psoriasis Foundation: A Systematic Review. JAMA Dermatol. 2018, Aug 1. 154(8). 934-950. doi: 10.1001/jamadermatol.2018.1412.