Останні досягнення в дослідженнях патофізіології та старіння судин головного мозку підкреслюють важливість судинного внеску в різні типи судинних когнітивних порушень та деменції, найбільш поширеним із яких є церебральна хвороба дрібних судин. Судинні когнітивні порушення та деменція в даний час визнаються другою за поширеністю причиною зниження когнітивних функцій у літніх людей, вони часто збігаються з хворобою Альцгеймера. Усе частіше визнається, що судинні механізми, які сприяють когнітивним порушенням, потенційно оборотні й лікування та втручання, які зберігають цереброваскулярне здоров’я, можуть допомогти запобігти когнітивному спаду та навіть певним типам хвороби Альцгеймера.
Поширеність судинних когнітивних порушень та деменції сильно залежить від віку [63]. Відповідно, усе більше доказів того, що вікові структурні та функціональні зміни великих артерій, артеріол та капілярів призводять до порушення регуляції мозкового кровотоку та ішемії, порушення гематоенцефалічного бар’єра, кліренсу метаболічних побічних продуктів, посилення нейрозапалення та порушення паракринної регуляції функції сусідніх клітин (наприклад, нейрональних стовбурових клітин), усі вони діють синергетично, погіршуючи роботу мозку. Існують також вагомі докази, що свідчать про внесок вікових змін артеріолярних мікросудин та капілярів у хворобу Альцгеймера [64].
Венозна циркуляція мозку з низьким тиском, низькою швидкістю й великим об’ємом відіграє вирішальну роль у підтримці гомеостазу в центральній нервовій системі. Незважаючи на своє велике фізіологічне значення, роль вікових змін венозного кровообігу мозку в патогенезі судинних когнітивних порушень і деменції та хвороби Альцгеймера вивчена набагато менше. У цій статті розглянутий вплив старіння на функціональну та структурну цілісність венозного кровообігу мозку з точки зору потенційних механізмів, що беруть участь у патогенезі нейродегенерації та когнітивного спаду.
Відомо, що старіння змінює структуру мозкових капілярів, сприяючи структурним аномаліям базальної мембрани, збільшуючи периваскулярні відкладення колагену і призводячи до потовщення базальної мембрани [69]. Підвищений колагеноз, пов’язаний із віком, також зустрічається у венах та венулах мозку [34, 103], що пояснюється збільшенням експресії генів, які кодують колаген, та відкладенням колагену І та ІІІ підтипів у судинній стінці. Вважається, що ця вікова реконструкція венозної стінки підтримує міцність вени, її опір розриву у відповідь на патологічне проникнення збільшеної артеріальної пульсової хвилі (виникає через підвищену жорсткість великих провідних артерій) через капілярну мережу у венозну систему при старінні. Повідомлялося про збільшення венозного колагенозу в мозку з явним лейкоареозом [34], що свідчить про те, що патологічна перебудова венозної стінки може спричиняти ураження білої речовини як при нормальному старінні, так і при хворобі Альцгеймера [104].
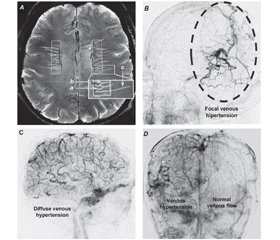
Артеріолярна звивистість — це часта вікова судинна патологія білої речовини, що нерідко асоціюється з лейкоареозом [34]. Звивисті судини часто оточені збільшеними периваскулярними просторами, що відповідають стану état criblé (також відомий як status cribrosum) [34]. Гістопатологічне дослідження післясмертного мозку літніх людей та вдосконалені методи візуалізації in vivo (наприклад, ультрависока польова TOF МР-ангіографія та візуалізація з урахуванням сприйнятливості) показують, що у венулах також часто виявляють підвищену звивистість, викликану віком [100] (рис. 1А).
/51.jpg)
Останні дослідження надають попередні докази того, що звивистість вен може бути раннім нейровізуалізаційним маркером захворювання дрібних судин і може корелювати з гіперінтенсивністю білої речовини та/або мікрогеморагіями мозку [105]. Недавнє дослідження, у якому порівнювали глибокі медулярні вени, візуалізовані на 7 Tл МРТ, показало, що в пацієнтів із ранньою хворобою Альцгеймера також виявляють підвищену звивистість вен [32]. Слід зауважити, що існуючі дослідження з використанням методів візуалізації, у яких повідомляють про звивистість вен у літніх пацієнтів та/або в пацієнтів із хворобою Альцгеймера, є поперечними (cross-sectional) за своїм типом. Отже, залишається з’ясувати тільки, чи є насправді венулярна звивистість прогресивною умовою виникнення патологічних вікових змін у головному мозку.
Механізми, що лежать в основі підвищеної звивистості вен головного мозку, дуже багатогранні, і на основі аналогічних механізмів, що проявляються в периферичному кровообігу, можна припустити, що вони включають підвищення мозкового тиску у венулах (подібно до гемодинамічного середовища, що сприяє утворенню варикозного розширення вен на нижніх кінцівках), зміну еластичності судинної стінки, дегенеративні зміни гладких м’язів та ендотеліальних клітин та патологічне ремоделювання позаклітинного матриксу та базальної мембрани [100]. Вікові механізми, що сприяють ремоделюванню стінки вени, це порушення експресії ангіогенних факторів та факторів росту (наприклад, VEGF), старіння клітин, окиснювальний стрес та порушення регуляції матричних металопротеїназ [100]. Цікаво, що фармакологічне виснаження клітин стінок венул унаслідок постійного стимулювання антагоніста рецептора тромбоцитарного фактора росту збільшує звивистість вен, що досліджувалося на моделях тварин з імітацією фенотипу старіння. Імовірно,звивистість мозкових вен корелює з наявністю звивистих вен сітківки, що пояснюється спільною етіологією [83]. У зв’язку з цим цікаво, що підвищена звивистість вен сітківки передбачає підвищений ризик виникнення хвороби Альцгеймера [39]. Важливу роль підвищення венозного тиску в розвитку венозної звивистості підтверджує й те, що в пацієнтів із венозними застоями, пов’язаними з внутрішньочерепною дуральною артеріовенозною фістулою, також виявляються звивисті, роздуті піальні вени, добре помітні на ангіограмах. Приклади вогнищевої та дифузної звивистості у мозкових венах, що відносяться до внутрішньочерепних артеріовенозних фістул, наведені на рис. 1B–D.
Вікові зміни мостоподібних вен, які з’єднують поверхневу венозну мережу з твердими пазухами, відіграють центральну роль у субдуральних кровотечах, пов’язаних із травмами мозку, у літніх людей [84]. Через атрофію мозку та подальше розширення субдурального простору з’являється підвищений механічний тиск на мостоподібні вени в літніх людей [84]. Це збільшене механічне навантаження в поєднанні з віковим зниженням еластичності венозної стінки спричиняє розриви вен у відповідь навіть на незначну черепно-мозкову травму, що призводить до збільшення частоти кровотеч у субдуральний простір у літніх людей [84].
Венозна стінка значно більше може розтягуватися порівняно зі стінкою артерії, що має важливе фізіологічне значення. Розтяжність внутрішньої яремної вени є головним фактором специфічного венозного дренажу мозку й підтримує тиск у венах головного мозку в межах норми. Існують вагомі докази того, що старіння зменшує розтяжність венозної системи верхніх кінцівок на 38 % при визначенні за допомогою плетизмографії [75]. Старіння також зменшує розтяжність яремних вен на 68 % (виміряно ультрасонографією) у положенні лежачи (хоча цей ефект може мати постуральну залежність) [27].
Імовірно, що через вікове зниження розтяжності внутрішня яремна вена втрачає компенсаторну здатність збільшувати трансмуральний тиск і тим самим спричиняє у венозній системі мозку венозну гіпертензію. Імовірно, що вплив старіння на біомеханіку венозної стінки багатогранний і включає вікову патологічну перебудову венозної стінки, включаючи зміни в позаклітинному матриксі та медіальному шарі. Вікові зміни біомеханічних властивостей стінок яремної вени також визначаються змінами венозного тонусу та внутрішньо- та позалюмінального тиску. Вікові зміни в багаторівневому контролі венозної біомеханіки, імовірно, включають зміни як у внутрішніх локальних міогенних та гуморальних механізмах, так і в зовнішніх системних гормональних та нервових впливах.
Гемодинамічні фактори (зміна тиску та потоку) разом із запальними процесами спричинюють вікові зміни біомеханічних властивостей яремної вени, що ще більше сприяє віковому прогресуванню венозної дисфункції. Кілька вікових патологічних станів, включаючи хронічну серцеву недостатність, легеневу гіпертензію та хронічну обструктивну хворобу легенів, можуть підвищити центральний венозний тиск у літніх людей і тим самим змінити біомеханічні властивості вен. Крім того, секс, ожиріння та малорухливий спосіб життя можуть сильно модулювати вплив старіння на біомеханічні властивості венозної системи мозку [8, 9] подібно до їх впливу на систему периферичних вен [71]. Дослідження на 70 дорослих кавказьких близнюках з італійського реєстру близнюків показують, що спадкові чинники відповідають за 30–70 % біомеханічних властивостей внутрішніх яремних вен.
Численні вади розвитку також можуть впливати на венозний кровообіг шийної ділянки в літніх людей, що призводить до порушення венозного дренажу в мозку [36]. Причини звуження або оклюзії можуть бути внутрішньопросвітними, такими як перегородки, стулки або аномальні клапани, або позапросвітними, такими як будь-яка анатомічна або патологічна маса, що здавлює судину.
Аномальна ремодуляція та підвищена жорсткість венозної стінки та/або збільшення венозного тиску можуть погіршити ефект віндкеселя венозного кровообігу [19]. Оскільки венозний кровообіг відіграє велику роль в ефекті віндкеселя та послабленні артеріальної пульсації при старінні, будь-які вікові зміни, які впливають на венозну систему, справлятимуть значний вплив на проникнення хвилі артеріального тиску в мозок [19]. Підвищений пульсовий тиск може досягати венозної сторони через артеріальне дерево внаслідок відсутності належного міогенного авторегуляторного захисту в проксимальних артеріях мозку [74]. Крім того, посилена артеріальна пульсація може передаватися до вен і додаватися до венозної пульсації опосередковано через ліквор. За наявності вікових змін циркуляції ліквору, коли зменшується густина ліквору, менш гальмовані пульсові хвилі можуть досягати венул і вен. Вікове збільшення пульсового тиску, зумовлене жорсткістю артерій, та відсутність міогенного захисту артерій разом зі зниженням ефекту віндкеселя спричинюють механічний стрес на венозну стінку в літніх людей.
Попередні доклінічні дослідження виявили вікові дегенеративні зміни та патологічні вікові перебудови у венозних клапанах [87], які, імовірно, спричинюють недостатність венозних клапанів. Відповідно до нашого розуміння патогенезу хронічної венозної недостатності в периферичному кровообігу, вікові зміни у венозних клапанах мозку сприяють виникненню їх недостатності, що призводить до венозного рефлюксу та гіпертензії церебральних вен.
Таким чином, чітко зрозуміло, що є низка причин, які призводять до порушення венозного кровотоку в ділянці головного мозку та/або до венозної внутрішньочерепної гіпертензії, проте зв’язки між змінами у венозному кровообігу мозку та нейродегенеративними захворюваннями чи когнітивними порушеннями недостатньо вивчені. У статті ми подаємо огляд наявних даних, що підтверджують потенційно важливу роль венозної дисфункції при різних патологіях мозку. Також висловлені деякі припущення щодо механізмів, за допомогою яких зміни венозного кровообігу мозку можуть спричинювати вікові церебральні захворювання та когнітивне зниження, з огляду на це використання препаратів, які покращують венозну циркуляцію, особливо у старшому віці, є важливим методом профілактики виникнення когнітивної дисфункції. Одним із таких препаратів, що з’явився в Україні, є Флего. Це дієтична добавка до раціону харчування, що містить діосмін, гесперидин, антоціанідин та азіатикозид, які підтримують нормальне функціонування венозно-лімфатичної системи та сприяють поліпшенню мікроциркуляції в тканинах організму, венозному відтоку та лімфатичному дренажу, у тому числі при варикозному розширенні вен та геморої. Діосмін і гесперидин є біофлавоноїдами рослинного походження. Діосмін підвищує тонус венозних і лімфатичних судин, зменшує венозний і лімфатичний застій, зміцнює стінки капілярів і знижує їх проникність, виявляє протизапальний, протинабряковий і анальгезивний ефект, покращує мікроциркуляцію і трофіку тканин, перешкоджає тромбоутворенню. Гесперидин сприяє зміцненню стінок дрібних судин, завдяки чому знижується їх проникність, що зумовлює зменшення набряків. Гесперидин — це флаван-глікозид, виявлений у цитрусових. Він є природним глюкозидом, що міститься в більшості цитрусових, найбільше його в альбедо — внутрішньому білому пухкому шарі шкірки цитрусових. Його аглікон-форма — це гесперетин. Назва походить від слова Hesperidium (гесперидій) — плід рослин підродини помаранчеві. Гесперидин був уперше виділений у 1828 році французьким хіміком Лебретоном із білого внутрішнього шару цитрусової шкірки (мезокарпа, альбедо). Уважається, що гесперидин відіграє певну роль у захисті рослин. У медицині гесперидин використовується як венопротекторний, антиоксидантний засіб. У лікувальних цілях часто застосовується в поєднанні з діосміном. Входить до складу препаратів для лікування венозної недостатності, геморою, при лімфедемі. Існують дослідження, які доводять позитивний вплив гесперидину при лікуванні ревматоїдного артриту й на зниження діастолічного кров’яного тиску, а також його здатність пригнічувати поширення і зростання ракових клітин при онкозахворюваннях [106]. Екстракт чорниці містить антоціанідини, які укріплюють стінки кровоносних судин, знижують ризик утворення тромбів, нормалізують проникність капілярів, знижують ламкість капілярів, проявляють протизапальну та протинабрякову дію. Центела азіатська містить азіатикозиди, які поліпшують периферичний кровообіг, зміцнюють стінки вен, стимулюють біосинтез колагену, підвищують пластичність судинної стінки, знижують проникність судин, перешкоджають утворенню тромбів, виявляють легкий седативний ефект, прискорюють процеси загоєння, зміцнюють гладкі й скелетні м’язи, виявляють легкий сечогінний ефект.
Конфлікт інтересів. Не заявлений.
Отримано/Received 15.09.2021
Рецензовано/Revised 02.10.2021
Прийнято до друку/Аccepted 06.10.2021
Список литературы
1. Aiello A.Е., Chiu Y.L., Frasca D. How does cytomegalovirus factor into diseases of aging and vaccine responses, and by what mechanisms? Geroscience. 2017. 39. 261-271. doi: 10.1007/s11357-017-9983-9.
2. Akkawi N.М., Agosti C., Borroni B., Rozzini L., Magoni M., Vignolo L.А., Padovani A. Jugular valve incompetence: a study using air contrast ultrasonography on a general population. J. Ultrasound. Med. 2002. 21. 747-751. doi: 10.7863/jum.2002.21.7.747.
3. Al-Mujaini A.S., Montana C.C. Valsalva retinopathy in pregnancy: a case report. J. Med. Case Reports. 2008. 2. 101. doi: 10.1186/1752-1947-2-101.
4. Albano B., Gandolfo C., Del Sette M. Post-coital intra-cerebral venous hemorrhage in a 78-year-old man with jugular valve incompetence: a case report. J. Med. Case Reports. 2010. 4. 225. doi: 10.1186/1752-1947-4-225.
5. Alosco M.L., Brickman A.М., Spitznagel M.В. et al. Independent and interactive effects of blood pressure and cardiac function on brain volume and white matter hyperintensities in heart failure. J. Am. Soc. Hypertens. 2013. 7. 336-343. doi: 10.1016/j.jash.2013.04.011.
6. Altamura C., Scrascia F., Quattrocchi C.С. et al. Regional MRI diffusion, white-matter hyperintensities, and cognitive function in Alz-heimer’s disease and vascular dementia. J. Clin. Neurol. 2016. 12. 201-208. doi: 10.3988/jcn.2016.12.2.201.
7. An J.Y., Quarles E.K., Mekvanich S. et al. Rapamycin treatment attenuates age-associated periodontitis in mice. Geroscience. 2017. 39. 457-463. doi: 10.1007/s11357-017-9994-6.
8. Arbeille P., Fomina G., Roumy J., Alferova I., Tobal N., He-rault S. Adaptation of the left heart, cerebral and femoral arteries, and jugular and femoral veins during short- and long-term head-down tilt and spaceflights. Eur. J. Appl. Physiol. 2001. 86. 157-168. doi: 10.1007/s004210100473.
9. Armstrong P.J., Sutherland R., Scott D.H. The effect of position and different manoeuvres on internal jugular vein diameter size. Acta Anaesthesiol. Scand. 1994. 38. 229-231. doi: 10.1111/j.1399-6576.1994.tb03879.x.
10. Arvanitakis Z., Capuano A.W., Leurgans S.Е. et al. The relationship of cerebral vessel pathology to brain microinfarcts. Brain Pathol. 2017. 27. 77-85. doi: 10.1111/bpa.12365.
11. Arvanitakis Z., Leurgans S.E., Barnes L.L. et al. Microinfarct pathology, dementia, and cognitive systems. Stroke. 2011. 42. 722-727. doi: 10.1161/STROKEAHA.110.595082; Fulop G.A., Tarantini S., Yabluchanskiy A. et al. Role of age-related alterations of the cerebral venous circulation in the pathogenesis of vascular cognitive impairment. AJP-Heart Circ. Physiol. doi: 10.1152/ajpheart.00776.2018. Downloaded from journals.physiology.org/journal/ajpheart (195.016.078.094) on July 27, 2021.
12. Ashpole N.М., Logan S., Yabluchanskiy A. et al. IGF-1 has sexually dimorphic, pleiotropic, and time-dependent effects on healthspan, pathology, and lifespan. Geroscience. 2017. 39. 129-145. doi: 10.1007/s11357-017-9971-0.
13. Atwood C.S., Hayashi K., Meethal S.V., Gonzales T., Bo-wen R.L. Does the degree of endocrine dyscrasia post-reproduction dictate post-reproductive lifespan? Lessons from semelparous and iteroparous species. Geroscience. 2017. 39. 103-116. doi: 10.1007/s11357-016-9955-5.
14. Auletta L., Greco A., Albanese S., Meomartino L., Salvatore M., Mancini M. Original research: feasibility and safety of two surgical techniques for the development of an animal model of jugular vein occlusion. Exp. Biol. Med. (Maywood). 2017. 242. 22-28. doi: 10.1177/1535370216657446.
15. Bailey-Downs L.C., Mitschelen M., Sosnowska D. et al. Li-ver-specific knockdown of IGF-1 decreases vascular oxidative stress resistance by impairing the Nrf2-dependent antioxidant response: a novel model of vascular aging. J. Gerontol. A Biol. Sci. Med. Sci. 2012. 67A. 313-329. doi: 10.1093/gerona/ glr164.
16. Banki E., Sosnowska D., Tucsek Z. et al. Age-related decline of autocrine pituitary adenylate cyclase-activating polypeptide impairs angiogenic capacity of rat cerebromicrovascular endothelial cells. J. Gerontol. A Biol. Sci. Med. Sci. 2015. 70. 665-674. doi: 10.1093/gerona/glu116.
17. Bateman G.A. The pathophysiology of idiopathic normal pressure hydrocephalus: cerebral ischemia or altered venous hemodyna-mics? AJNR Am. J. Neuroradiol. 2008. 29. 198-203. doi: 10.3174/ajnr.A0739.
18. Bateman G.A. Pulse-wave encephalopathy: a comparative study of the hydrodynamics of leukoaraiosis and normal-pressure hydrocephalus. Neuroradiology. 2002. 44. 740-748. doi: 10.1007/s00234-002-0812-0.
19. Bateman G.А., Levi C.R., Schofield P., Wang Y., Lovett E.C. The venous manifestations of pulse wave encephalopathy: windkessel dysfunction in normal aging and senile dementia. Neuroradiology. 2008. 50. 491-497. doi: 10.1007/s00234-008-0374-x.
20. Beer C., Ebenezer E., Fenner S., Lautenschlager N.Т., Arnolda L., Flicker L., Almeida O.P. Contributors to cognitive impairment in congestive heart failure: a pilot case-control study. Intern. Med. J. 2009. 39. 600-605. doi: 10.1111/j.1445-5994.2008.01790.x.
21. Beggs C.B. Venous hemodynamics in neurological disorders: an analytical review with hydrodynamic analysis. BMC Med. 2013. 11. 142. doi: 10.1186/1741-7015-11-142.
22. Beggs C., Chung C.Р., Bergsland N. et al. Jugular venous reflux and brain parenchyma volumes in elderly patients with mild cognitive impairment and Alzheimer’s disease. BMC Neurol. 2013. 13. 157. doi: 10.1186/1471-377-13-157.
23. Belghali M., Chastan N., Cignetti F., Davenne D., Dec-ker L.M. Loss of gait control assessed by cognitive-motor dual-tasks: pros and cons in detecting people at risk of developing Alzheimer’s and Parkinson’s diseases. Geroscience. 2017. 39. 305-329. doi: 10.1007/s11357-017-9977-7.
24. Belov P., Magnano C., Krawiecki J. еt al. Age-related brain atrophy may be mitigated by internal jugular vein enlargement in male individuals without neurologic disease. Phlebology. 2017. 32. 125-134. doi: 10.1177/0268355516633610.
25. Bennis M.Т., Schneider A., Victoria B. et al. The role of transplanted visceral fat from the long-lived growth hormone receptor knockout mice on insulin signaling. Geroscience. 2017. 39. 51-59. doi: 10.1007/s11357-017-9957-y.
26. Benveniste H., Lee H., Volkow N.D. The glymphatic pathway: waste removal from the CNS via cerebrospinal fluid transport. Neuroscientist. 2017. 23. 454-465. doi: 10.1177/1073858417691030.
27. Bérczi V., Molnár A.А., Apor A. et al. Non-invasive assessment of human large vein diameter, capacity, distensibility and ellipticity in situ: dependence on anatomical location, age, body position and pressure. Eur. J. Appl. Physiol. 2005. 95. 283-289. doi: 10.1007/s00421-005-0002-y.
28. Bernier M., Wahl D., Ali A. et al. Resveratrol supplementation confers neuroprotection in cortical brain tissue of non-human primates fed a high-fat/sucrose diet. Aging (Albany NY). 2016. 8. 899-916. doi: 10.18632/aging.100942.
29. Bilston L.Е., Fletcher D.F., Brodbelt A.R., Stoodley M.A. Arterial pulsation-driven cerebrospinal fluid flow in the perivascular space: a computational model. Comput. Methods Biomech. Biomed. Engin. 2003. 6. 235-241. doi: 10.1080/10255840310001606116.
30. Ble A., Ranzini M., Zurlo A. et al. Leukoaraiosis is associated with functional impairment in older patients with Alzheimer’s disease but not vascular dementia. J. Nutr. Health Aging. 2006. 10. 31-35.
31. Blodgett J.M., Theou O., Howlett S.Е., Rockwood K. A frailty index from common clinical and laboratory tests predicts increased risk of death across the life course. Geroscience. 2017. 39. 447-455. doi: 10.1007/ s11357-017-9993-7.
32. Bouvy W.Н., Kuijf H.J., Zwanenburg J.J. et al.; Utrecht Vascular Cognitive Impairment (VCI) Study group. Abnormalities of cerebral deep medullary veins on 7 Tesla MRI in amnestic mild cognitive impairment and early Alzheimer’s disease: a pilot study. J. Alzheimers Dis. 2017. 57. 705-710. doi: 10.3233/JAD-160952.
33. Brinker T., Stopa E., Morrison J., Klinge P. A new look at cerebrospinal fluid circulation. Fluids Barriers CNS. 2014. 11. 10. doi: 10.1186/2045-8118-11-10.
34. Brown W.R., Moody D.М., Challa V.R., Thore C.R., Anstrom J.A. Venous collagenosis and arteriolar tortuosity in leukoaraiosis. J. Neurol. Sci. 2002. 203–204. 159-163. doi: 10.1016/S0022-510X(02)00283-6.
35. Brundel M., de Bresser J., van Dillen J.J., Kappelle L.J., Biessels G.J. Cerebral microinfarcts: a systematic review of neuropathological studies. J. Cereb. Blood Flow Metab. 2012. 32. 425-436. doi: 10.1038/jcbfm.2011.200.
36. Caldas J.R., Panerai R.В., Haunton V.J. et al. Cerebral blood flow autoregulation in ischemic heart failure. Am. J. Physiol. Regul. Integr. Comp. Physiol. 2017. 312. R108-R113. doi: 10.1152/ajpregu.00361.2016.
37. Chai C., Wang Z., Fan L. et al. Increased number and distribution of cerebral microbleeds is a risk factor for cognitive dysfunction in hemodialysis patients: a longitudinal study. Medicine (Baltimore). 2016. 95. e2974. doi: 10.1097/MD.0000000000002974.
38. Chapman-Davies A., Lazarevic A. Valsalva maculopathy. Clin. Exp Optom. 2002. 85. 42-45. doi: 10.1111/j.1444-0938.2002.tb03071.x.
39. Cheung C.Y., Ong Y.Т., Ikram M.K. еt al. Microvascular network alterations in the retina of patients with Alzheimer’s di-sease. Alzheimers Dement. 2014. 10. 135-142. doi: 10.1016/j.jalz. 2013.06.009.
40. Childs B.G., Baker D.J., Wijshake T. et al. Senescent intimal foam cells are deleterious at all stages of atherosclerosis. Science. 2016. 354. 472-477. doi: 10.1126/science.aaf6659.
41. Choi B.R., Kim J.S., Yang Y.J. et al. Factors associated with decreased cerebral blood flow in congestive heart failure seconda-ry to idiopathic dilated cardiomyopathy. Am. J. Cardiol. 2006. 97. 13651369. doi: 10.1016/j.amjcard.2005.11.059.
42. Chung C.Р., Beggs C., Wang P.N. et al. Jugular venous reflux and white matter abnormalities in Alzheimer’s disease: a pilot study. J. Alzheimers Dis. 2014. 39. 601-609. doi: 10.3233/JAD-131112.
43. Chung C.Р., Cheng C.Y., Zivadinov R. et al. Jugular venous reflux and plasma endothelin-1 are associated with cough syncope: a case control pilot study. BMC Neurol. 2013. 13. 9. doi: 10.1186/1471-2377-13-9.
44. Chung C.Р., Hu H.H. Pathogenesis of leukoaraiosis: role of jugular venous reflux. Med. Hypotheses. 2010. 75. 85-90. doi: 10.1016/j.mehy. 2010.01.042.
45. Chung C.Р., Lin Y.J., Chao A.С. et al. Jugular venous hemodynamic changes with aging. Ultrasound Med. Biol. 2010. 36. 1776-1782. doi: 10.1016/j.ultrasmedbio.2010.07.006.
46. Coffman J.A., Torello M.W., Bornstein R.А. et al. Leukoaraiosis in asymptomatic adult offspring of individuals with Alzheimer’s disease. Biol. Psychiatry. 1990. 27. 1244-1248. doi: 10.1016/0006-3223(90)90422-X.
47. Comi G., Battaglia M.А., Bertolotto A. et al. Italian multicentre observational study of the prevalence of CCSVI in multiple sclerosis (CoSMo study): rationale, design, and methodology. Neurol. Sci. 2013. 34. 1297-1307. doi: 10.1007/s10072-012-1269-5.
48. Cornwell W.К. 3rd, Levine B.D. Patients with heart failure with reduced ejection fraction have exaggerated reductions in cerebral blood flow during upright posture. JACC Heart Fail. 2015. 3. 176-179. doi: 10.1016/j.jchf.2014.10.006.
49. Coutinho E., Silva A.М., Freitas C., Santos E. Graves disease presenting as pseudotumor cerebri: a case report. J. Med. Case Reports. 2011. 5. 68. doi: 10.1186/1752-1947-5-68.
50. Crawford P.М., West C.R., Chadwick D.W., Shaw M.D. Arteriovenous malformations of the brain: natural history in unopera-ted patients. J. Neurol. Neurosurg. Psychiatry. 1986. 49. 1-10. doi: 10.1136/jnnp.49.1.1.
51. Csiszar A., Gautam T., Sosnowska D. et al. Caloric restriction confers persistent antioxidative, pro-angiogenic, and anti-inflammatory effects and promotes anti-aging miRNA expression profile in cerebromicrovascular endothelial cells of aged rats. Am. J. Physiol. Heart Circ. Physiol. 2014. 307. H292-H306. doi: 10.1152/ajpheart.00307.2014.
52. Csiszar A., Labinskyy N., Jimenez R. et al. Anti-oxidative and anti-inflammatory vasoprotective effects of caloric restriction in aging: role of circulating factors and SIRT1. Mech. Ageing Dev. 2009. 130. 518-527. doi: 10.1016/j.mad.2009.06.004.
53. Csiszar A., Labinskyy N., Smith K., Rivera A., Orosz Z., Ungvari Z. Vasculoprotective effects of anti-tumor necrosis factor-β treatment in aging. Am. J. Pathol. 2007. 170. 388-698. doi: 10.2353/ajpath.2007.060708.
54. Csiszar A., Sosnowska D., Wang M. et al. Age-associated proinflammatory secretory phenotype in vascular smooth muscle cells from the non-human primate Macaca mulatta: reversal by resveratrol treatment. J. Gerontol. A Biol. Sci. Med. Sci. 2012. 67. 811-820. doi: 10.1093/gerona/glr228.
55. Csiszar A., Tarantini S., Fülöp G.А. et al. Hypertension impairs neurovascular coupling and promotes microvascular injury: role in exacerbation of Alzheimer’s disease. Geroscience. 2017. 39. 359-372. doi: 10. 1007/s11357-017-9991-9.
56. Csiszar A., Ungvari Z., Edwards J.G. et al. Aging-induced phenotypic changes and oxidative stress impair coronary arteriolar function. Circ. Res. 2002. 90. 1159-1166. doi: 10.1161/01.RES.0000020401.61826.EA.
57. Csiszar A., Ungvari Z., Koller A., Edwards J.G., Kaley G. Aging-induced proinflammatory shift in cytokine expression profile in coronary arteries. FASEB J. 2003. 17. 1183-1185. doi: 10.1096/fj.02-1049fje.
58. Csiszar A., Ungvari Z., Koller A., Edwards J.G., Kaley G. Proinflammatory phenotype of coronary arteries promotes endothelial apoptosis in aging. Physiol. Genomics. 2004. 17. 21-30. doi: 10.1152/physiolgenomics. 00136.2003.
59. Dawson J.W. XVIII. The histology of disseminated sclerosis. Trans. R. Soc. Edinb. 1916. 50. 517-740. doi: 10.1017/S0080456800027174.
60. Deepa S.S., Bhaskaran S., Espinoza S. et al. A new mouse model of frailty: the Cu/Zn superoxide dismutase knockout mouse. Geroscience. 2017. 39. 187-198. doi: 10.1007/s11357-017-9975-9.
61. dela Paz N.G., D’Amore P.A. Arterial versus venous endothelial cells. Cell Tissue Res. 2009. 335. 5-16. doi: 10.1007/s00441-008-0706-5.
62. Dhanger S., Vaidiyanathan B., Tripathy D.K. Internal jugular venous valve: Well-known but mostly neglected. Indian J. Anaesth. 2016. 60. 602-603. doi: 10.4103/0019-5049.187813.
63. Dichgans M., Leys D. Vascular cognitive impairment. Circ. Res. 2017. 120. 573-591. doi: 10.1161/CIRCRESAHA.116.308426.
64. Doepp F., Schreiber S.J., von Münster T. et al. How does the blood leave the brain? A systematic ultrasound analysis of cerebral venous drainage patterns. Neuroradiology. 2004. 46. 565-570. doi: 10.1007/s00234-004-1213-3.
65. Egemen E., Solaroglu I. Anatomy of Cerebral Veins and Dural Sinuses. In: Primer on Cerebrovascular Diseases, 2nd ed., edited by Caplan L.R., Leary M.С., Thomas A.J., Zhang J.H., Biller J., Lo E.Н., and Yenari M. London: Academic, 2017.
66. Eide P.К., Pripp A.H. Increased prevalence of cardiovascular disease in idiopathic normal pressure hydrocephalus patients compared to a population-based cohort from the HUNT3 survey. Fluids Barriers CNS. 2014. 11. 19. doi: 10.1186/2045-8118-11-19.
67. Espay A.J., Da Prat G.А. et al. Deconstructing normal pressure hydrocephalus: ventriculomegaly as early sign of neurodegeneration. Ann. Neurol. 2017. 82. 503-513. doi: 10.1002/ana.25046.
68. Fang Y., McFadden S., Darcy J. et al. Differential effects of early-life nutrient restriction in long-lived GHR-KO and normal mice. Geroscience. 2017. 39. 347-356. doi: 10.1007/s11357-017-9978-6.
69. Farkas E., Luiten P.G. Cerebral microvascular pathology in aging and Alzheimer’s disease. Prog. Neurobiol. 2001. 64. 575-611. doi: 10.1016/ S0301-0082(00)00068-X.
70. Fisher J., Vaghaiwalla F., Tsitlik J. et al. Determinants and clinical significance of jugular venous valve competence. Circulation. 1982. 65. 188-196. doi: 10.1161/01.CIR.65.1.188.
71. Fronek A., Criqui M.Н., Denenberg J., Langer R.D. Common femoral vein dimensions and hemodynamics including Valsalva response as a function of sex, age, and ethnicity in a population study. J. Vasc. Surg. 2001. 33. 1050-1056. doi: 10.1067/mva.2001.113496.
72. Fukazawa K., Aguina L., Pretto E.А. Jr. Internal jugular valve and central catheter placement. Anesthesiology. 2010. 112. 979. doi: 10.1097/ ALN.0b013e3181d436de.
73. Fulop G.А., Kiss T., Tarantini S. et al. Nrf2 deficiency in aged mice exacerbates cellular senescence promoting cerebrovascular inflammation. Geroscience. 2018. 40. 513-521. doi: 10.1007/s11357-018-0047-6.
74. Fulop G.А., Ramirez-Perez F.I., Kiss T. et al. IGF-1 deficiency promotes pathological remodeling of cerebral arteries: a potential mechanism contributing to the pathogenesis of intracerebral hemorrhages in aging. J. Gerontol. A Biol. Sci. Med. Sci. 2019. 74. 446-454. doi: 10.1093/gerona/ gly144.
75. Gascho J.A., Fanelli C., Zelis R. Aging reduces venous distensibility and the venodilatory response to nitroglycerin in normal subjects. Am. J. Cardiol. 1989. 63. 1267-1270. doi: 10.1016/0002-9149(89)90188-4.
76. Georgiadis D., Sievert M., Cencetti S. et al. Сеrebrovascular reactivity is impaired in patients with cardiac failure. Eur. Heart J. 2000. 21. 407-413. doi: 10.1053/euhj. 1999.1742.
77. Gold G., Giannakopoulos P., Herrmann F.R., Bouras C., Kövari E. Identification of Alzheimer and vascular lesion thresholds for mixed dementia. Brain 2007. 130. 2830-2836. doi: 10.1093/brain/awm228.
78. Gopinath B., Flood V.M., Wang J.J., Rochtchina E., Wong T.Y., Mitchell P. Is quality of diet associated with the microvasculature? An analysis of diet quality and retinal vascular calibre in older adults. Br. J. Nutr. 2013. 110. 739-746. doi: 10.1017/S0007114512005491.
79. Gorelick P.В., Scuteri A., Black S.Е. et al.; American Heart Association Stroke Council, Council on Epidemiology and Prevention, Council on Cardiovascular Nursing, Council on Cardiovascular Radiology and Intervention, and Council on Cardiovascular Surgery and Anesthesia. Vascular contributions to cognitive impairment and dementia: a statement for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2011. 42. 2672-2713. doi: 10.1161/STR.0b013e3182299496.
80. Grant C.D., Jafari N., Hou L. et al. A longitudinal study of DNA methylation as a potential mediator of age-related diabetes risk. Geroscience. 2017. 39. 475-489. doi: 10.1007/s11357-017-0001-z.
81. Grimmig B., Kim S.H., Nash K., Bickford P.С., Douglas Shytle R. Neuroprotective mechanisms of astaxanthin: a potential therapeutic role in preserving cognitive function in age and neurodegeneration. Geroscience. 2017. 39. 19-32. doi: 10.1007/s11357-017-9958-x.
82. Gruhn N., Larsen F.S., Boesgaard S. et al. Cerebral blood flow in patients with chronic heart failure before and after heart transplantation. Stroke. 2001. 32. 2530-2533. doi: 10.1161/hs1101.098360.
83. Han H.C. Twisted blood vessels: symptoms, etiology and biomechanical mechanisms. J. Vasc. Res. 2012. 49. 185-197. doi: 10.1159/000335123.
84. Hanif S., Abodunde O., Ali Z., Pidgeon C. Age related outcome in acute subdural haematoma following traumatic head injury. Ir. Med. J. 2009. 102. 255-257.
85. Hartmann D.А., Hyacinth H.І., Liao F.F., Shih A.Y. Does pathology of small venules contribute to cerebral microinfarcts and dementia? J. Neurochem. 2018. 144. 517-526. doi: 10.1111/jnc.14228.
86. He L., Vanlandewijck M., Mäe M.А. et al. Single-cell RNA sequencing of mouse brain and lung vascular and vessel-associated cell types. Sci. Data. 2018. 5. 180160. doi: 10.1038/sdata.2018.160.
87. Hemmeryckx B., Emmerechts J., Bovill E.G., Hoylaerts M.F., Lijnen H.R. Effect of ageing on the murine venous circulation. Histochem. Cell Biol. 2012. 137. 537-546. doi: 10.1007/s00418-012-0913-8.
88. Hernandez J.P., Franke W.D. Effects of a 6-mo endurance-training program on venous compliance and maximal lower body negative pressure in older men and women. J. Appl. Physiol. 2005. 99. 1070-1077. doi: 10.1152/japplphysiol.01169.2004.
89. Hilal S., Saini M., Tan C.S. et al. Cerebral microbleeds and cognition: the epidemiology of dementia in Singapore study. Alzheimer. Dis. Assoc. Disord. 2014. 28. 106-112. doi: 10.1097/WAD.0000000000000015.
90. Hooghiemstra A.M., Bertens A.S., Leeuwis A.E. et al.; Heart-Brain Connection Consortium. The missing link in the pathophysio-logy of vascular cognitive impairment: design of the Heart-Brain Study. Cerebrovasc. Dis. Extra. 2017. 7. 140-152. doi: 10.1159/000480738.
91. Iliff J.J., Wang M., Liao Y. et al. A paravascular pathway facilitates CSF flow through the brain parenchyma and the clearance of interstitial solutes, including amyloid. Sci. Transl. Med. 2012. 4. 147ra111. doi: 10.1126/scitranslmed.3003748.
92. Inano S., Itoh D., Takao H. et al. High signal intensity in the dural sinuses on 3D-TOF MR angiography at 3.0 T. Clin. Imaging. 2010. 34. 332-336. doi: 10.1016/ j.clinimag.2009.06.028.
93. Jackson S.E., Redeker A., Arens R. et al. CMV immune evasion and manipulation of the immune system with aging. Geroscience. 2017. 39. 273-291.
94. Jacobs H.I., Clerx L., Gronenschild E.Н., Aalten Р., Verhey F.R. White matter hyperintensities are positively associated with cortical thickness in Alzheimer’s disease. J. Alzheimers Dis. 2014. 39. 409-422. doi: 10.3233/JAD-131232.
95. Jahrling J.B., Lin A.L., DeRosa N. et al. mTOR drives cerebral blood flow and memory deficits in LDLR-/- mice modeling athe-rosclerosis and vascular cognitive impairment. J. Cereb. Blood Flow Metab. 2018. 38. 58-74. doi: 10.1177/0271678X17705973.
96. Jang J., Kim B.S., Kim B.Y. et al. Reflux venous flow in dural sinus and internal jugular vein on 3D time-of-flight MR angiography. Neuroradiology. 2013. 55. 1205-1211. doi: 10.1007/s00234-013-1239-5.
97. Jefferson A.L., Himali J.J., Beiser A.S. et al. Cardiac index is associated with brain aging: the Framingham Heart Study. Circulation. 2010. 122. 690-697. doi: 10.1161/ CIRCULATIONAHA.109.905091.
98. Jessen N.А., Munk A.S., Lundgaard I., Nedergaard M. The glymphatic system: a beginner’s guide. Neurochem. Res. 2015. 40. 2583-2599. doi: 10.1007/s11064-015-1581-6.
99. Jin B.J., Smith A.J., Verkman A.S. Spatial model of convective solute transport in brain extracellular space does not support a “glymphatic” mechanism. J. Gen. Physiol. 2016. 148. 489-501. doi: 10.1085/jgp. 201611684.
100. Jorgensen D.R., Shaaban C.Е., Wiley C.А. et al. A population neuroscience approach to the study of cerebral small vessel disease in midlife and late life: an invited review. Am. J. Physiol. Heart Circ. Physiol. 2018. 314. H1117-H1136. doi: 10.1152/ajpheart.00535.2017.
101. Juurlink B.H. Is there a pulse wave encephalopathy component to multiple sclerosis? Curr. Neurovasc. Res. 2015. 12. 199-209. doi: 10.2174/1567202612666150311113205.
102. Kandel B.М., Avants B.В., Gee J.C. et al. White matter hyperintensities are more highly associated with preclinical Alz-heimer’s disease than imaging and cognitive markers of neurodegeneration. Alzheimers Dement. (Amst). 2016. 4. 18-27. doi: 10.1016/j.dadm.2016.03.001.
103. Kang Y., Kim E., Kim J.H. et al. Time of flight MR angiography assessment casts doubt on the association between transient global amnesia and intracranial jugular venous reflux. Eur. Radiol. 2015. 25. 703-709. doi: 10.1007/s00330-014-3448-7.
104. Keith J., Gao F.Q., Noor R. et al. Collagenosis of the deep medullary veins: an underrecognized pathologic correlate of white matter hyperintensities and periventricular infarction? J. Neuropathol. Exp. Neurol.2017. 76. 299-312. doi: 10.1093/jnen/nlx009.
105. Shaaban C.Е., Aizenstein H.J., Jorgensen D.R. et al.; LIFE Study Group. In vivo imaging of venous side cerebral small-vessel dise-ase in older adults: an MRI method at 7T. AJNR: Am. J. Neuroradiol. 2017. 38. 1923-1928. doi: 10.3174/ajnr.A5327.
106. https://biopax.ru/articles/gesperidin/

/51.jpg)