Місцеві, або трансдермальні, форми нестероїдних протизапальних препаратів (НПЗП) широко застосовуються при травмах і захворюваннях опорно-рухового апарату. Звісно, монотерапія місцевими формами НПЗП не дозволяє ефективно боротися з інтенсивним больовим синдромом, проте численні клінічні дослідження демонструють їх ефективність у лікуванні больового синдрому середньої та легкої інтенсивності. Американський коледж лікарів (The American College of Physicians, ACP) та Американська академія сімейних лікарів (American Academy of Family Physicians, AAFP) розробили настанову для надання клінічних рекомендацій щодо немедикаментозного та медикаментозного лікування гострого болю, спричиненого травмами та запальними захворюваннями опорно-рухового апарату в дорослих в амбулаторних умовах. Дана настанова базується на систематичному огляді доказів щодо порівняльної ефективності та безпеки нефармакологічного та фармакологічного лікування гострого болю в попереку, травм опорно-рухового апарату в дорослих в амбулаторних умовах та систематичного огляду передвісників тривалого застосування опіоїдів. Дослідниками була проведена оцінка за допомогою системи GRADE (оцінювання, розвиток та оцінка рекомендацій) таких клінічних результатів: біль, фізична функція, полегшення симптомів, задоволеність лікуванням і побічні ефекти.
За результатами проведеного аналізу фахівці ACP та AAFP рекомендують клініцистам лікувати пацієнтів із гострим болем у попереку і травмами опорно-рухового апарату місцевими нестероїдними протизапальними препаратами з ментоловим гелем або без нього як засобами першої лінії для зменшення або полегшення симптомів, включаючи біль; поліпшення функціональної спроможності та покращення задоволення пацієнта лікуванням (оцінка: сильна рекомендація; докази помірної впевненості). І лише за умови неефективності монотерапії місцевими формами НПЗП додавати до схеми лікування перорально ацетамінофен і пероральні НПЗП [6].
Перевагою місцевих форм НПЗП є їх здатність створювати високу концентрацію діючого засобу у вогнищі запалення. При цьому вдається уникнути значної кількості побічних ефектів, що є невід’ємним наслідком системного застосування НПЗП (ульцерогенного, гепатотоксичного, кардіотоксичного тощо) [17]. Сьогодні серед розмаїття даних лікарських засобів у вигляді гелів, пластирів, мазей досить складно виділити якийсь один засіб, оскільки порівняльних досліджень, присвячених вивченню клінічної ефективності та безпечності діючих речовин, що входять до трансдермальних форм НПЗП, практично немає. А серед існуючих нечисленних досліджень переважна більшість представлена порівнянням того чи іншого препарату з плацебо, що робить результати наперед прогнозованими. Більшість досліджень ефективності локальних форм НПЗП присвячені диклофенаку і кетопрофену [16]. Підвищена увага до них обумовлена тим, що диклофенак є єдиним НПЗП, топічні форми випуску якого схвалені американським Управлінням з санітарного нагляду за якістю харчових продуктів та медикаментів (FDA), а кетопрофен — препарат, дозволений у більшості країн світу [4]. Водночас варто зазначити, що крім основної діючої речовини до складу більшості локальних форм НПЗП входять і так звані допоміжні речовини (ментол, диметилсульфоксид та ін.), які суттєво впливають як на клінічну ефективність засобу в цілому, так і на розвиток місцевих та системних побічних ефектів [9, 11]. Тому для отримання вірогідних результатів порівняльного дослідження слід використовувати максимально стандартизовані форми НПЗП як за діючою речовиною, так і за допоміжними компонентами, що з технічної точки зору є досить проблематичним.
Гелева форма є найбільш поширеною — 65,0 % від загальної кількості місцевих форм протизапальних засобів. Креми, мазі та спреї становлять 17,3; 19,5 та 19,6 % відповідно. 3,2 % припадає на решту продуктів (лініменти, розчини тощо) [13]. В доступних джерелах ми знайшли лише одне дослідження, в якому був проведений порівняльний аналіз ефективності гелевих форм НПЗП з дотриманням принципу максимально можливої стандартизації [4]. Авторами використовувався хемореактомний аналіз із використанням систем штучного інтелекту в галузі постгеномної фармакології. Суть даної методики полягає в аналізі фармакологічних можливостей молекул шляхом порівняння хімічної структури досліджуваної молекули із структурою інших молекул, молекулярно-фармакологічні властивості яких вже були вивчені в експериментальних та клінічних дослідженнях [2, 8]. Це дозволило отримати профілі властивостей досліджуваних НПЗП, що є надзвичайно важливими для оцінки відмінностей фармакологічної дії трансдермальних форм даних лікарських засобів.
Після застосування даної методики І.Ю. Торшин із співавт. [4] провели порівняльний аналіз фармакологічної дії гелевих форм на основі мелоксикаму, декскетопрофену, диклофенаку, кетопрофену, ібупрофену та німесуліду. Отримані результати дали змогу провести порівняльний аналіз рівнів накопичення даних НПЗП у різних тканинах організму людини, дозозалежних характеристик протинабрякового ефекту й оцінити системні ефекти трансдермальних форм.
В результаті дослідження було встановлено, що найбільшу здатність до накопичення у шкірі має декскетопрофен. У м’язовій тканині першу трійку лідерів за рівнем накопичення становлять мелоксикам, диклофенак і декскетопрофен. Максимальний рівень щодо накопичення у хрящовій тканині продемонстрували кетопрофен та ібупрофен. В нервовій тканині декскетопрофен показав високий рівень накопичення в нейронах, мієліні та гіпоталамусі. Разом з тим декскетопрофен продемонстрував помірну здатність до накопичення у клітинах крові та у внутрішніх органах (серці, підшлунковій залозі, гонадах) (рис. 1).
Проведений хемореактомний аналіз показав, що серед досліджуваних НПЗП декскетопрофен відрізнявся досить високими значеннями ймовірності накопичення в нейронах, що може сприяти підвищенню протибольового ефекту при нейрозапаленні. Треба відзначити, що декскетопрофен відрізняється досить низьким рівнем накопичення у хрящовій тканині та в тканинах серця, що свідчить про мінімальний вплив на морфологію сполучної тканини хряща і серця.
В цілому досліджені НПЗП відрізнялись накопиченням у підшлунковій залозі, гонадах, кератиноцитах, тромбоцитах і лімфоцитах, що може впливати на фармакологічні ефекти, які розвиваються в цих тканинах і клітинах (вплив на гемостаз, імунітет, секрецію інсуліну тощо) (рис. 1).
Аналіз профілів належності НПЗП до різних класів анатомо-терапевтично-хімічної класифікації показав, що декскетопрофен разом із мелоксикамом і диклофенаком входить до трійки лідерів щодо оцінки приналежності до класів препаратів для місцевого застосування в лікуванні суглобового та м’язового болю.
При захворюваннях, асоційованих з хронічним запаленням, стан мікробіому шкіри зсувається в бік патогенної флори (зокрема, грибів Candida albicans). Заселення шкіри патогенною грибковою флорою сприяє погіршенню стану шкіри й ускладнює загоєння ран. Певні фармацевтичні препарати, зокрема глюкокортикоїди, сприяють посиленню грибкової інвазії шкіри та слизових оболонок [6]. Фармакоінформаційні профілі дозволяють припустити, що при місцевому застосуванні декскетопрофену можна очікувати на слабку фунгіцидну дію, що, без сумніву, є корисним при місцевому застосуванні даного препарату в таких пацієнтів.
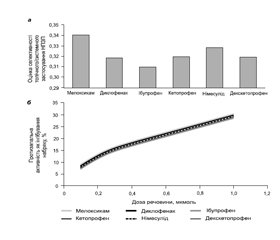
Результати хемореактомного аналізу продемонстрували селективність топічного застосування досліджуваних НПЗП в експерименті. Найбільшою селективністю трансдермальної дії відрізнялися декскетопрофен, мелоксикам і кетопрофен (рис. 2).
Найголовнішим завданням трансдермального застосування НПЗП є ліквідація локального набряку, спричиненого запаленням. Хемореактомний аналіз дозволив отримати оцінку селективності топічного застосування різних НПЗП у щурів.
Декскетопрофен відрізнявся високою селективністю трансдермальної дії порівняно з системною дією та вираженим протинабряковим ефектом при трансдермальному застосуванні (рис. 3).
/46.jpg)
При трансдермальному застосуванні НПЗП системні ефекти можуть виникати у зв’язку з підвищенням всмоктування НПЗП через шкіру внаслідок підвищення температури, пошкоджень шкіри, високих доз, збільшення рекомендованої частоти нанесення мазі на шкіру та ін. Гелі відрізняються від мазей тим, що містять етанол, що збільшує всмоктування НПЗП через шкіру. Тому під час хемореактомного аналізу була проведена оцінка системних ефектів вивчених НПЗП, в тому числі ступеня взаємодії кожного з НПЗП із ферментною системою цитохромів Р450, а також із ферментами метаболізму ліпідів, вітамінів і нейротрансмітерів [15]. Декскетопрофен продемонстрував низький рівень взаємодії з ферментними ситемами цитохромів, ліпідів і вітамінів, що є показником низької ймовірності виникнення небажаних системних ефектів даного фармакологічного засобу.
Трансдермальне використання НПЗП вирішує важливе завдання — ліквідацію локального запалення, що має надзвичайно велике значення для терапії больового синдрому. Досліджувані І.Ю. Торшиним із співавт. трансдермальні форми гелів із НПЗП (мелоксикам, диклофенак, ібупрофен, кетопрофен, німесулід, декскетопрофен) характеризуються різними можливостями щодо накопичення у шкірі, м’язах і нервовій тканині. Так, декскетопрофен з великою вірогідністю накопичувався у шкірі, м’язах, нервовій тканині та мав виражений протинабряковий ефект. Водночас, проникаючи в подальшому у кровотік, декскетопрофен навіть при тривалому застосуванні зовнішньо суттєво менше накопичувався у тканинах серця, лімфоцитах, гонадах і хрящі. Тобто декскетопрофен є одним із небагатьох НПЗП, що не стимулює дегенеративні зміни тканини хряща, оскільки не пригнічує синтез протеогліканів хондроцитами [7].
Декскетопрофену трометамол — трометамінова сіль (S)-(+)-2-(3-бензоїлфеніл) пропіонової кислоти й активний енантіомер НПЗП кетопрофену. Механізм його дії заснований на зменшенні синтезу простагландинів за рахунок пригнічення циклооксигенази (ЦОГ). Зокрема, гальмується перетворення арахідонової кислоти в циклічні ендопероксиди PGG2 і PGH2, з яких утворюються простагландини PGE1, PGE2, PGF2a, PGD2, а також простациклін PGI2 і тромбоксани ТхА2 і ТхВ2. Крім того, пригнічення синтезу простагландинів може впливати на інші медіатори запалення, такі як кініни, що також справляє побічний вплив на основну дію декскетопрофену. Доведено, що кетопрофен є ефективним анальгетичним, протизапальним і жарознижуючим засобом виключно у вигляді енантіомера. Під час досліджень інгібування ЦОГ встановлено, що R(–)-енантіомер фармакологічно неактивний, а за фармакологічну активність рацемату відповідає S(+)-енантіомер, або декскетопрофен. Дослідження in vivo на тваринах і за участю людей підтверджують ці дані.
При місцевому застосуванні гелю досягається висока місцева концентрація декскетопрофену, тоді як концентрація у плазмі крові є дуже низькою. Клінічні дослідження фармакокінетики показують, що після застосування і підшкірного всмоктування Cmax декскетопрофену у плазмі крові досягається протягом 4 год. Активна терапевтична концентрація виявлена в синовіальній рідині. Відзначається, що рівень декскетопрофену (при застосуванні в концентрації 12,5 мг/г) у синовіальній рідині еквівалентний або вище від рівня рацемічного кетопрофену (при застосуванні в концентрації 25 мг/г). Інверсія активного (S)-енантіомера в неактивний (R)-енантіомер не відбувається.
Препарат призначений для зовнішнього застосування. В цілому його рекомендується застосовувати 2–3 рази на добу. Кількість гелю залежить від розміру ураженої ділянки. Добова доза не повинна перевищувати 7,5 г, що відповідає близько 14 см гелю. Гель наноситься легким втиранням для полегшення всмоктування. Тривалість лікування не повинна перевищувати 7 днів.
Системні реакції гіперчутливості (кропив’янка, бронхоспазм) та місцеві реакції з боку шкіри та підшкірної клітковини (дерматит, еритема, свербіж, запалення, печіння) зустрічаються досить нечасто [1].
Опосередкованим підтвердженням високої клінічної ефективності декскетопрофену у вигляді гелю є той факт, що в країнах Західної Європи, зокрема в Іспанії, серед усіх місцевих форм декскетопрофен (Enangel Menarini) входить до трійки лідерів з призначення/застосування/продажів поряд з Voltaren Emulgel (діюча речовина — вольтарен) та Calmatel від Almirall Prodesfarma (діюча речовина — кетопрофен) [13].
Таким чином, серед досліджуваних НПЗП у вигляді гелів декскетопрофен (Сертофен гель) відрізняється хорошим профілем ефективності та безпечності, що обумовлює можливість тривалого використання даного препарату для місцевого застосування при травмах і захворюваннях опорно-рухового апарату [12, 14, 16].
Безпека довготривалого застосування препарату на основі декскетопрофену трометамолу є особливо актуальною для терапії хронічних захворювань опорно-рухового апарату, що супроводжуються тривалим запаленням і стійким хронічним больовим синдромом.
Конфлікт інтересів. Не заявлений.
Отримано/Received 20.08.2021
Рецензовано/Revised 06.09.2021
Прийнято до друку/Accepted 10.09.2021
Список литературы
1. Компендиум. Лекарственные препараты. Сертофен гель. Инструкция по применению. https://compendium.com.ua/info/355269/sertofen-gel_/
2. Торшин И.Ю., Громова О.А., Сардарян И.С., Федотова Л.Э. Сравнительный хемореактомный анализ мексидола. Журнал неврологии и психиатрии им. C.C. Корсакова. 2017. 117(1–2). 75-83.
3. Торшин И.Ю., Громова О.А., Стаховская Л.В. и др. Дифференциальный хемореактомный анализ синергидных комбинаций толперизона и нестероидных противовоспалительных препаратов. Неврология, нейропсихиатрия, психосоматика. 2019. 11(2). 78-85. doi: 10.14412/2074-2711-2019-2-78-85.
4. Торшин И.Ю., Громова О.А., Гришина Т.Р., Семенов В.А. Положительные и отрицательные эффекты применения трансдермальных форм нестероидных противовоспалительных препаратов. Хемореактомный анализ. Неврология, нейропсихиатрия, психосоматика. 2020. 12(5). 123-129.
5. Qaseem А., McLean R.M., O’Gurek D., Batur P., Lin K., Kansagara D.L., Clinical Guidelines Committee of the American College of Physicians; Commission on Health of the Public and Science of the American Academy of Family Physicians; Cooney T.G., Forciea M.A., Crandall C.J., Fitterman N., Hicks L.A., Horwitch C., Maroto M., McLean R.M., Mustafa R.A., Tufte J., Vijan S., Williams J.W. Jr. Nonpharmacologic and Pharmacologic Management of Acute Pain From Non-Low Back, Musculoskeletal Injuries in Adults: A Clinical Guideline From the American College of Physicians and American Academy of Family Physicians. Ann. Intern. Med. 2020 Nov 3. 173(9). 739-748. doi: 10.7326/M19-3602. Epub 2020 Aug 18.
6. Arikan A.A., Omay O., Kanko M. et al. Treatment of Candida sternal infection following cardiac surgery — a review of literature. Infect. Dis. (Lond). 2019 Jan. 51(1). 1-11. doi: 10.1080/23744235.2018.1518583. Epub 2018 Sep 28.
7. Beltrán J., Figueroa M., Granados M., Sanmartí R., Artigas R., Torres F., Forns M., Mauleón D. Comparison of dexketoprofen trometamol and ketoprofen in the treatment of osteoarthritis of the knee. J. Clin. Pharmacol. 1998 Dec. 38(S1). 74S-80S.
8. Bolton E., Wang Y., Thiessen P.A., Bryant S.H. PubChem: Integrated Platform of Small Molecules and Biological Activities. Chapter 12. In: Annual Reports in Computational Chemistry. Vol. 4. American Chemical Society, Washington, DC, 2008 Apr. (pubchem.ncbi.nlm.nih.gov).
9. Grahame R. Transdermal non-steroidal antiinflammatory agents. Br. J. Clin. Pract. 1995 Jan-Feb. 49(1). 33-5.
10. Honvo G., Leclercq V., Geerinck A. et al. Safety of Topical Non-steroidal Anti-Inflammatory Drugs in Osteoarthritis: Outcomes of a Systematic Review and Meta-Analysis. Drugs Aging. 2019 Apr. 36(suppl. 1). 45-64. doi: 10.1007/s40266-019- 00661-0. Información De Mercado. Vol. 20. Núm. 2. Febrero 2006. P. 42-46.
11. Kumar L., Verma S., Singh M. et al. Advanced Drug Delivery Systems for Transdermal Delivery of Non-Steroidal Anti-Inflammatory Drugs: A Review. Curr. Drug Deliv. 2018. 15(8). 1087-99. doi: 10.2174/1567201815666180605114131.
12. Hanna M., Moon J.Y. A review of dexketoprofen trometamol in acute pain. Curr. Med. Res. Opin. 2019 Feb. 35(2).189-202.
13. Divins M.-J. Antiinflamatorios tópicos. Farmacia Profesional.
14. Mauleón D., Artigas R., García M.L., Carganico G. Preclinical and clinical development of dexketoprofen. Drugs. 1996. 52 (suppl. 5). 24-45.
15. Mering C., Jensen L., Snel B. et al. STRING: known and predicted protein – protein associations, integrated and transferred across organisms. Nucl. Acids Res. 2005. 33(Database issue). D433-7. doi: 10.1093/nar/gki005.
16. Serinken M., Eken C., Tunay K., Golcuk Y. Ketoprofen gel improves low back pain in addition to IV dexketoprofen: a randomized placebo-controlled trial. Am. J. Emerg. Med. 2016 Aug. 34(8). 1458-61.
17. Zeng C., Wei J., Persson M.S.M. et al. Relative efficacy and safety of topical non-steroidal antiinflammatory drugs for osteoarthritis: a systematic review and network meta-analysis of randomised controlled trials and observational studies. Br. J. Sports Med. 2018 May. 52(10). 642-50. doi: 10.1136/bjsports-2017-098043. Epub 2018 Feb 7.

/45.jpg)
/46.jpg)