Журнал "Гастроэнтерология" Том 55, №3, 2021
Вернуться к номеру
Ендоскопічна ультразвукова сонографія в діагностиці патології шлунково-кишкового тракту
Авторы: Степанов Ю.М., Пролом Н.В., Коненко І.С., Тарабаров С.О., Недзвецька Н.В.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
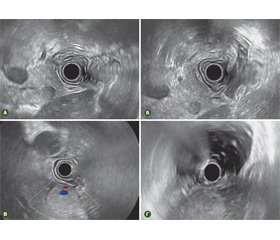
Ендоскопічна ультрасонографія є порівняно новим методом дослідження для визначення інвазії пухлини шлунково-кишкового тракту, виявлення й визначення розмірів утворень підшлункової залози, діагностики хронічного панкреатиту, патології жовчовивідних шляхів. Метод поєднує можливості двох досліджень: ендоскопічного та ультразвукового. Дослідження проводиться за допомогою відеоендоскопа, на кінці якого розташований скануючий ультразвуковий датчик. Перевагою ендоскопічного ультразвуку перед традиційним ультразвуковим дослідженням через передню стінку живота полягає в тому, що ультразвуковий датчик по просвіту травної трубки під візуальним контролем можна провести безпосередньо до досліджуваного об’єкта. Використання під час дослідження дуже високих частот ультразвуку забезпечує високу якість зображення з роздільною здатністю менше 1 мм, що не властиве іншим методам дослідження (ультразвуковому дослідженню, комп’ютерній та магнітно-резонансній томографіям, ендоскопічній холангіопанкреатографії).
Endoscopic ultrasonography is a relatively new endoscopic method of examination to determine the invasion of tumors of the gastrointestinal tract, detection and sizing of pancreatic tumors, diagnosis of chronic pancreatitis, pathology of the biliary tract. The method combines the possibilities of two studies: endoscopic and ultrasound. The study is performed using a video endoscope, at the end of which is a scanning ultrasound sensor. The advantages of endoscopic ultrasound over traditional ultrasound examination through the anterior abdominal wall are that the ultrasound sensor under visual control through the lumen of the digestive tract can be carried out directly to the investigated object. The use of very high frequencies of ultrasound provides high image quality with a resolution of less than 1 mm, inaccessible to other research methods (ultrasound, computer tomography and magnetic resonance imaging, endoscopic cholangiopancreatography).
ендосонографія; еластометрія; захворювання шлунково-кишкового тракту
endosonography; elastometry; diseases of the gastrointestinal tract
Вступ
Основні ділянки для застосування ЕУС
- Fu W.X., Wang Q., Zhang Y.S. et al. Application of ultrasound technology in the diagnosis and treatment of digestive tract diseases. Eur. Rev. Med. Pharmacol. Sci. 2015 Feb. 19(4). 602-606. PMID: 25753877 Review.
- Hocke M., Braden B., Jenssen C., Dietrich C.F. Present status and perspectives of endosonography 2017 in gastroenterology. Korean J. Intern. Med. 2018 Jan. 33(1). 36-63. doi: 10.3904/kjim.2017.212. Epub 2017, Nov 23. PMID: 29161800 Free PMC article. Review.
- Seicean A., Mosteanu O., Seicean R.Maximizing the endosonography: The role of contrast harmonics, elastography and confocal endomicroscopy. World J. Gastroenterol. 2017, Jan 7. 23(1). 25-41. doi: 10.3748/wjg.v23.i1.25. PMID: 28104978 Free PMC article. Review.
- Simons-Linares C.R., Wander P., Vargo J., Chahal P. Endoscopic ultrasonography: An inside view. Cleve Clin. J. Med. 2020, Mar. 87(3). 175-183. doi: 10.3949/ccjm.87a.19003. PMID: 32127442 Review.
- Тишкова Н.В., Дриго С.А. Эндосонография: новый уровень диагностики в гастроэнтерологии: практ. пособие для врачей. Гомель: ГУ «РНПЦ РМиЭЧ», 2014. 30 с.
- Ветшева Н.Н., Кармазановский Г.Г. Дифференциальная диагностика солидно-псевдопапилярных опухолей поджелудочной железы. Клиническая и экспериментальная хирургия. Журнал им. академика Б.В. Петровского. 2018. Т.6. № 2. С. 40-47. DOI: 10.24411/2308-1198-2018-12005.
- Годжелло Є.А. Хрусталева М.В., Булганина Н.А. и др. Комплексная диагностика и лечение редкого новообразования пищевода (клиническое наблюдение). Клиническая и экспериментальная хирургия. Журнал им. академика Б.В. Петровского. 2018. Т.6. № 2. С. 87-92. DOI: 10.24411/2308-1198-2018-12012.
- Kitano M., Yoshida T., Itonaga M., Tamura T., Hatamaru K., Yamashita Y. Impact of endoscopic ultrasonography on diagnosis of pancreatic cancer. J. Gastroenterol. 2019 Jan. 54(1). 19-32. doi: 10.1007/s00535-018-1519-2. Epub. 2018, Nov 7. PMID: 30406288 Free PMC article. Review.
- Солоницын Е.Г., Кащенко В.А., Сишкова Е.А. и соавт. Эндоскопическая ультрасонография в дифференциальной диагностике хронического панкреатита. Сборник материалов IV Всероссийской научно-практической конференции «Актуальные вопросы эндоскопии», 28–29 марта 2013 г. Санкт-Петербург. С. 111-112.
- Qiu E.Q., Guo W., Cheng T.M., Yao Y.L., Zhu W., Liu S.D., Zhi F.C. Diagnostic classification of endosonography for differentiating colorectal ulcerative diseases: A new statistical method. World J. Gastroenterol. 2017, Dec 14. 23(46). 8207-8216. doi: 10.3748/wjg.v23.i46.8207. PMID: 29290657 Free PMC article.
- Candoli P., Ceron L., Trisolini R. Competence in endosonographic techniques. Panminerva Med. 2019 Sep. 61(3). 249-279. doi: 10.23736/S0031-0808.18.03570-X. Epub. 2018, Nov 9. PMID: 30421897 Review.
- Двойникова Е.Р., Стегний К.В., Гончарук Р.А. и др. Оценка эффективности тонкоигольной аспирационной и инцизионной биопсии под контролем эндосонографии при заболеваниях поджелудочной железы на этапе освоения методики. Тихоокеанский медицинский журнал. 2018. № 1. С. 57-59. DOI: 10.17238/PmJ1609-1175.2018.1.57-59.
- Годжелло Э.А., Булганина Н.А., Хрусталева М.В. Эндоскопическое ультразвуковое исследование — современный метод диагностики гастроинтестинальных стромальных опухолей. Ультразвуковая и функциональная диагностика. 2013. № 2. С. 78-90.
- Domagk D., Oppong K.W., Aabakken L., Czakó L. et al. Performance measures for ERCP and endoscopic ultrasound: a European Society of Gastrointestinal Endoscopy (ESGE) Quality Improvement Initiative. Endoscopy. 2018 Nov. 50(11). 1116-1127. doi: 10.1055/a-0749-8767. Epub. 2018, Oct 19. PMID: 30340220.
- Старков Ю.Г., Солодинина Е.Н., Новожилова А.В. Подслизистые новообразования желудочно-кишечного тракта в эндоскопической практике. Хирургия. 2010. № 2. С. 51-59.
- Балалыкин А.С., Оноприев А.В., Муцуров Х.С. и соавт. Эндоскопическая диагностика и лечение опухолей большого дуоденального сосочка. Сборник материалов IV Всероссийской научно-практической конференции Актуальные вопросы эндоскопии, 28–29 марта 2013 г., Санкт-Петербург. С. 22-24.
- Sato H., Liss A.S., Mizukami Y. Large-duct pattern invasive adenocarcinoma of the pancreas-a variant mimicking pancrea–tic cystic neoplasms: A minireview. World J. Gastroenterol. 2021, Jun 21. 27(23). 3262-3278. doi: 10.3748/wjg.v27.i23.3262. PMID: 34163110; PMCID: PMC8218369.
- Морозова Т.Г., Борсуков А.В. Диагностические возможности эластографии печени при эндосонографии. Вестник новых медицинских технологий. 2014. Т. 21. № 1. С. 44-47.
- Krupa Ł., Lorenc J., Staroń R., Partyka M., Chmielarz Ł., Gutkowski K. Endosonography guided treatment of a large infected pseudocyst sustained after posttraumatic acute pancreatitis in a critically ill patient. Pol. Arch. Intern. Med. 2018, May 30. 128(5). 317-318. doi: 10.20452/pamw.4248. Epub. 2018, Apr 17. PMID: 29870031 No abstract available.
- Somani P., Sunkara T., Sharma M. Role of endoscopic ultrasound in idiopathic pancreatitis. World J. Gastroenterol. 2017, Oct 14. 23(38). 6952-6961. doi: 10.3748/wjg.v23.i38.6952. PMID: 29097868 Free PMC article. Review.
- Issa Y., Kempeneers M.A., van Santvoort H.C., Bollen T.L., Bipat S., Boermeester M.A. Diagnostic performance of imaging modalities in chronic pancreatitis: a systematic review and meta-analysis. Eur. Radiol. 2017 Sep. 27(9). 3820-3844. doi: 10.1007/s00330-016-4720-9. Epub. 2017, Jan 27. PMID: 28130609 Free PMC article. Review.
- Vilmann A.S., Menachery J., Tang S.J., Srinivasan I., Vilmann P. Endosonography guided management of pancreatic fluid collections. World J. Gastroenterol. 2015, Nov 7. 21(41). 11 842-11853. doi: 10.3748/wjg.v21.i41.11842. PMID: 26557008 Free PMC article. Review.
- Wangermez M. Endoscopic ultrasound of pancreatic tumors. Diagn. Interv. Imaging. 2016 Dec. 97(12). 1287-1295. doi: 10.1016/j.diii.2016.10.002. Epub. 2016, Nov 17. PMID: 27866871 Review.
- Cui X.W., Chang J.M., Kan Q.C., Chiorean L., Ignee A., Dietrich C.F. Endoscopic ultrasound elastography: Current status and future perspectives. World J. Gastroenterol. 2015. 21(47). 13212-13224 [PMID: 26715804 DOI: 10.3748/wjg.v21.i47.13212.
- Nakai Y., Sato T., Hakuta R. et al. Management of Difficult Bile Duct Stones by Large Balloon, Cholangioscopy, Enteroscopy and Endosonography. Gut. Liver. 2020, May 15. 14(3). 297-305. doi: 10.5009/gnl19157. PMID: 31581389 Free PMC article. Review.
- Giljaca V., Gurusamy K.S., Takwoingi Y., Higgie D., Poropat G., Štimac D., Davidson B.R. Endoscopic ultrasound versus magnetic resonance cholangiopancreatography for common bile duct stones. Cochrane Database Syst. Rev. 2015, Feb 26. 2015(2). CD011549. doi: 10.1002/14651858.CD011549. PMID: 25719224 Free PMC article. Review.
- Manes G., Paspatis G., Aabakken L. Endoscopic management of common bile duct stones: European Society of Gastrointestinal Endoscopy (ESGE) guideline. Endoscopy. 2019 May. 51(5). 472-491. doi: 10.1055/a-0862-0346. Epub. 2019, Apr 3. PMID: 30943551.

/63.jpg)
/64.jpg)
/65.jpg)
/66.jpg)