Сенільний остеопороз, відомий як ІІ тип системного остеопорозу, проявляється після 70–75 років [1–3]. Як і інші типи остеопорозу, він призводить до крихкості кісток із підвищеним ризиком перелому. Від сенільного остеопорозу частіше страждають жінки. Загалом співвідношення захворювання в чоловіків та жінок становить 1 до 2. Деякі автори сенільний остеопороз розглядають як основний геріатричний синдром [4].
Фактором ризику cенільного остеопорозу, як і інших типів остеопорозу, може бути низький пік кісткової маси, набутий до 30 років. В основному дана хвороба виникає внаслідок хронічних захворювань, тривалого застосування препаратів, які негативно впливають на кісткову тканину, куріння та інших факторів ризику. Проте основний чинник сенільного остеопорозу — особливості кісткового обміну внаслідок вікових системних змін в організмі, зокрема дисфункції статевих гормонів.
Вітамін D і паратиреоїдний гормон
У патогенезі сенільного остеопорозу велике значення має вітамін D, дефіцит якого може виникати внаслідок зниження його споживання чи утворення в шкірі в умовах недостатньої інсоляції [5]. Суттєву роль у патогенезі сенільного остеопорозу відводять дефіциту рецепторів 1,25(ОН)D3 у клітинах кісткової тканини, кишечника тощо, а також можливому поліморфізму гена рецептора вітаміну D. Дефіцит активних метаболітів вітаміну D у сироватці крові знижується з віком у зв’язку з інволютивними змінами в нирках і зменшенням активності ферменту 1α-гідроксилази. Даний фермент знаходиться під впливом багатьох регулюючих факторів, основним з яких є паратиреоїдний гормон (ПТГ), що впливає на ремоделювання кісткової тканини на різних рівнях. Зі свого боку, однією з найважливіших фізіологічних функцій вітаміну D є контроль секреції та синтезу даного гормона. Секреція ПТГ збільшується внаслідок низького рівня кальцію в крові (вторинний сенільний гіперпаратиреоз) і знижується в умовах підвищеного рівня кальцитріолу, рецептори до якого розташовані в клітинах паращитоподібних залоз [1, 6]. Розвиток гіпогонадизму з віком сприяє також втраті кісткової тканини у 20–30 % осіб літнього віку, що призводить до розвитку вторинного гіперпаратиреозу. Із віком внаслідок мальабсорбції знижується рівень кальцію, посилюються темпи ремоделювання кістки. Вищевказані фактори пояснюють, чому при сенільному остеопорозі гіперпаратиреоз розглядається як один з основних механізмів його патогенезу [4].
Ремоделювання кістки у хворих на сенільний остеопороз
Основним патофізіологічним механізмом, як і в усіх випадках остеопорозу, є негативне ремоделювання кістки, тобто дисбаланс між резорбцією та кісткоутворенням. При сенільному остеопорозі воно перебігає в умовах підвищеної резорбції. Порушення механізмів проліферації та диференціювання кісткових клітин у розвитку сенільного остеопорозу є багатофакторними. Під час старіння спостерігаються зниження темпів кісткоутворення, збільшення вмісту жирової тканини в кістковому мозку, перехід мезенхімальних стромальних клітин від остеобластогенезу до переважно адипогенезу [6–8], що індукує зміни клітин остеобластичного диферону — зменшуються їх проліферація та активність (рис. 1) [7, 9].
/53.jpg)
Крім того, вікові зміни стану кісткової тканини можливо розглядати як системні негативні зміни в організмі внаслідок пригнічення Runx2, що відповідає за диференціювання остеобластів, тоді як підвищення пероксисомного проліфераторактивованого рецептора γ (рeroxisome proliferator-activated receptor γ — PPAR-γ) призводить до підвищення темпів адипогенезу (рис. 1) [10].
Проведений геномний аналіз експресії генів під час диференціювання мезенхімальних стромальних клітин [11]. Виявлено, що ген Id4 є провідним кандидатом, що контролює диференціацію даних клітин у напрямку адипоцитів або остеобластів. Пригнічення експресії Id4 посилювало диференціювання в адипоцити, і, навпаки, високий рівень експресії Id4 у мезенхімальних стромальних клітинах сприяв диференціації остеобластів і послабленню темпів адипогенезу. Більше того, Id4-мутантні миші показали аномальне накопичення ліпідних крапель у кістковому мозку й порушення активності кісткоутворення. На підставі підвищення адипоцитів у кістковому мозку та його ожиріння пропонується розглядати сенільний остеопороз як тип ліпотоксичного захворювання, оскільки встановлено, що адипоцити сприяють ожирінню кісткового мозку та надають токсичну дію на остеобласти [7, 12]. В умовах сумісного культивування адипоцитів та остеобластів виявлено, що адипоцити гальмують активність остеобластів та їх виживання, можливо, за рахунок вивільнення адипокінів та жирних кислот [13]. Однак роль збільшення кількості адипоцитів у кістковому мозку все ще є незрозумілою, що спонукає дослідників проводити подальші дослідження. Використовуючи мишей лінії SAM-P6, яких розглядають як модель сенільного остеопорозу, було визначено в кістковому мозку низький рівень біосинтезу остеогліцину, що сприяє ослабленій здатності мезенхімальних стромальних клітин до диференціювання в напрямку остеогенезу [10]. Відомо, що нормальний або підвищений рівень остеогліцину може пригнічувати експресію гена маркера адипогенезу aP2 і сприяє експресії генів маркерів диференціювання остеобластів Wnt5b, RUNX2, остеокальцину, лужної фосфатази та колагену (Colla1), зменшуючи експресію маркера адипогенезу PPAR-γ2. Тобто отримані авторами дані свідчать про те, що остеогліцин відіграє важливу роль у розвитку сенільного остеопорозу, регулюючи експресію генів остео- й адипогенезу, а підвищення його рівня може стати потенційною мішенню для терапевтичного втручання [10]. Один із можливих механізмів вікових змін, що призводить до остеопорозу, наведений на рис. 2.
Ризик остеопорозу підвищується при зниженні локальних регуляторів оточення остеобластів — IGF-1, IL-11, TGF-β, BMP, біосинтез яких зменшується з віком. Також визначено, що в розвитку сенільного остеопорозу центральну роль відіграє запалення, що спільно з імунологічними механізмами є детермінантою кісткової резорбції [14] (рис. 2). Відомо, що велика кількість цитокінів та факторів росту бере участь у регуляції функціональної активності та життєздатності остеобластів та остеокластів. Прозапальні цитокіни є критичними медіаторами запального процесу, що прямим або непрямим шляхом впливають на модуляцію остеокластів. Це інтерлейкіни 1 та 6 (IL-1, IL-6), фактор некрозу пухлини α (TNF-α), молекула RANKL сімейства TNF та інші [8, 12, 15]. Існують важливі імунорегуляторні механізми, які контролюють баланс між втратою кісткової тканини та кісткоутворенням. Насамперед опосередковано T-клітини впливають на остеокласти, переважно через пригнічення остеопротегерину (OPG) та підвищення експресії цитокінів, які стимулюють RANKL-індуковану проліферацію та активацію остеокластів. RANKL впливає на рецептор остеокластів RANK, після активації якого сигнали в клітину передаються через рецепторасоційовані фактори некрозу пухлин (TRAFs), можливо, TRAF6. Це один із досліджених механізмів, що розглядають як основний в процесі остеокластогенезу й, відповідно, резорбції кістки з віком (рис. 3).
Крім того, хронічна активація Т-клітин призводить до порушення контррегуляторних механізмів, серед яких антивірусний цитокіновий інтерферон γ (IFN-γ), що пригнічує розвиток й активацію остеокластів через вплив на убіквітинпротеасомний шлях, що викликає деградацію білків в остеокластах [16]. Т-клітини також активують біосинтез макромолекул запалення, що впливає на розвиток остеопорозу та сприяє погіршенню формування кісткової тканини [3].
Інші фактори
Існують дані, що в патогенезі сенільного остеопорозу значну роль відіграє, можливо, дефіцит цинку. З огляду на наявні експериментальні і клінічні дані розглянутий наступний механізм впливу дефіциту цинку на підвищення рівня ендогенного гепарину, найімовірніше, внаслідок дегрануляції тучних клітин і вивільнення гепарину, що збільшує руйнуючу дію простагландину Е2 на кістку [17]. Імовірно, ендогенний гепарин і простагландин Е2 є кофакторами ПТГ, що в патогенезі сенільного остеопорозу підсилюють його дію.
Пропонують розглянути внесок у розвиток остеопорозу гена Клото (Kloto) як фактора, що сповільнює темпи старіння за впливом на фосфорилювання тирозину, інсуліну та IGF-1 [12, 18]. Автори пропонують його як новий системний чинник, що регулює вікову втрату кісткової маси, а порушення його експресії з віком може призвести до сенільного остеопорозу. Вперше встановлено, що миші з мутацією гена Kloto мали остеопенію, порушення будови кортексу, зміни в якому були ідентичні кортексу хворих на сенільний остеопороз. У ремоделюванні переважали зниження формування кістки та підвищення резорбції, що відображало стан остеопенії з низьким рівнем обмінних процесів у кістковій тканині. На основі вивчення патофізіологічних змін можуть бути наведені й нові докази патофізіології сенільного остеопорозу, що може бути використано в розробці схем його лікування.
Таким чином, у механізмі розвитку сенільного остеопорозу може існувати декілька патогенетичних ланок, які впливають, найімовірніше, поєднано.
Морфологічні зміни в кістках
Якщо в разі постменопаузального остеопорозу насамперед страждає губчаста кістка, то в умовах сенільного остеопорозу виражені зміни простежуються в компактній кістці за рахунок збільшення її пористості. Проведене дослідження голівок стегнових кісток, які отримані від хворих (55–82 років) на сенільний остеопороз. Автори встановили, що в кортексі шийки стегнової кістки наявні остеони різної форми та розмірів, кісткові пластини, які оточують центральний канал, нерегулярно розташовані, щільність остеоцитів між кістковими пластинками низька [19]. Більшість остеоцитів мали пікнотичні гіперхромні ядра. Центральні канали остеонів були збільшені та деформовані. Таким чином, збільшена пористість кортексу виступає фактором ризику перелому стегнової кістки.
Втрату маси кортикальної кістки розглядають як наслідок двох одночасних, але протилежно направлених процесів: субперіостального нашарування та резорбції кісткової тканини, що переважає в ендостальній частині та значно підвищується з віком. Після четвертого десятиліття життя відбувається зменшення періостального кісткоутворення й збільшується кількість одиниць ремоделювання в ділянках ендосту, що призводить до лінійного збільшення пористості кортексу, його розрідження та супроводжується втратою маси кортикальної кістки [20]. Даний процес розглядають як незалежний від гормонів і тісно пов’язаний із потенційними віковими механізмами [21].
Із розвитком захворювання знижуються щільність та ширина кісткових трабекул у губчастій кістці. При низькій щільності остеобластів регенерація мікропереломів кісткових трабекул уповільнюється, що призводить до підвищеної схильності хворих до низькоенергетичного перелому тіл хребців. У губчастій кістці в міжтрабекулярних просторах розташовується жовтий кістковий мозок із поодинокими гемопоетичними клітинами.
Клінічні прояви сенільного остеопорозу
Найбільш поширеним симптомом сенільного остеопорозу є гострий або хронічний біль у нижній частині спини. Пацієнти повідомляють про слабкість, скутість, кіфоз, зниження зросту та вазомоторні порушення [1]. Біль, як правило, виникає в разі стояння протягом тривалого періоду часу. Приступи болю в спині пов’язані з деформацією хребта, підвищеним тонусом м’язів, стисканням нервових корінців [1].
Ускладненнями сенільного остеопорозу можуть бути переломи тіл хребців, що призводить до зниження зросту, прогресуючого кіфозу, супроводжується болем і збільшенням дефіциту фізичного, психологічного та/або соціального функціонування. Сутулість та кіфоз призводять до дихальної недостатності, порушення ходи, зменшення зросту хворого на 10–15 см, тоді як у разі фізіологічного старіння зріст зменшується лише на 2–5 см.
Пацієнти із сенільним остеопорозом мають підвищений ризик переломів у ділянках скелета, де переважає кортикальна кістка, наприклад шийка стегнової кістки, кістки таза, проксимальний відділ плечової кістки та проксимальний відділ гомілки [3].
Дефіцит естрогенів й активних метаболітів вітаміну D сприяє зменшенню показників мінеральної щільності кісткової тканини (МЩКТ), призводить до м’язової слабкості, порушення нервово-м’язової координації, що може пояснювати підвищення частоти падінь в осіб літнього й старечого віку, зниження захисних механізмів у разі травматичних ушкоджень.
Знання щодо сенільного остеопорозу були розширені при використанні нокаутних мишей SIRT6, особливістю яких є наявність вікового остеопорозу, що відносять до сенільного [22]. Базальна експресія гена SIRT6 була виявлена в кістковому мозку мишей, що також підтверджено й на людині. Визначено, що SIRT6 бере участь у процесах формування кісткової тканини — від стромальної клітини до остеоцита. Миші з відсутністю гена SIRT6 демонструють зміни в будові трабекулярної мережі та кортикальної кістки, порушення кісткового метаболізму, які подібні до проявів вікового остеопорозу в людини. У нокаутних мишей формування кісткової тканини пригнічується, МЩКТ знижена. Додатково культивували первинні стромальні клітини кісткового мозку тварин SIRT6. У результаті визначені пригнічення остеобластогенезу, підвищення остеокластогенезу зі збільшенням числа дрібних остеокластів. Ці дані розширили уявлення щодо патогенезу сенільного остеопорозу.
Діагностика сенільного остеопорозу
На першому етапі необхідно зібрати анамнестичні дані з визначенням факторів ризику, бажано використовувати опитувальники.
Діагностика сенільного остеопорозу може бути проведена з використанням рентгенографії хребта в бічній проєкції. На рентгенограмах хребта найчастіше виявляють зниження висоти тіл хребців із визначенням клиноподібної деформації. Компресійну деформацію визначають значно рідше. Характерною особливістю сенільного остеопорозу є збільшення висоти міжхребцевих дисків, що супроводжується порушенням їх форми та множинними розривами гіалінових замикальних пластинок.
Оцінка показників МЩКТ за допомогою двохенергетичної рентгенівської абсорбціометрії — найпоширеніший метод обстеження осіб для діагностики остеопорозу. Проведення кісткової денситометрії дає можливість визначити МЩКТ у різних ділянках скелета для підтвердження діагнозу остеопорозу та контролю ефективності лікування після призначення антирезорбтивних препаратів.
При визначенні ділянок дослідження МЩКТ у хворих на сенільний остеопороз наявна точка зору, що дискутується: для встановлення діагнозу та контролю за лікуванням необхідно досліджувати шийку стегнової кістки або зміни МЩКТ у хребті [23]? Із віком сенільний остеопороз призводить до виражених змін у руховому хребтовому сегменті: формуються крайові остеофіти, наявні дегенеративні зміни в дуговідросткових суглобах, зменшуються тіла хребців у розмірах внаслідок втрати висоти та компресійних переломів, може бути наявний спондилолістез, визначають ділянки склерозу кістки, дегенеративні прояви змін міжхребцевих дисків призводять до зменшення їх розмірів [24].
У дослідженні, яке проведене за участю 630 жінок середнього віку (73,3 ± 6,9 року), визначено, що дегенеративні захворювання хребта пов’язані зі збільшенням показників МЩКТ поперекового відділу хребта [24]. На підставі отриманих даних автори вважають, що визначення МЩКТ шийки стегнової кістки може бути більш доцільним, ніж оцінка МЩКТ поперекового відділу хребта, для підтвердження діагнозу сенільного остеопорозу в літніх жінок. Прихильниками даної думки є й інші дослідники [25, 26]. Однак в іншому дослідженні, учасниками якого були 395 осіб віком від 67 до 89 років, визначали МЩКТ за допомогою двохенергетичної рентгенівської абсорбціометрії та, крім того, виконували вимірювання передньої, середньої та задньої висоти, а також передньо-задніх розмірів хребців (L1–L5) та 6 міжхребцевих дисків (від T12–L1 до L5–S1) [27]. Визначено збільшення індексу двовипуклості диска, а зниження МЩКТ було пов’язане із загальним зменшенням обсягу як хребців, так і дисків. Наведені дані свідчать, що у хворих літнього віку для встановлення діагнозу остеопорозу та контролю за схемами лікування потрібен індивідуальний підхід із визначенням зміни розмірів тіл хребців та урахуванням стану міжхребцевого диску.
Більше інформації про зміни МЩКТ, викликані дегенерацією міжхребцевих дисків та змінами тіл хребців із віком, при вимірюванні в ділянках тіл хребців може надати кількісна комп’ютерна томографія. Можливості в оцінці якості кісткової тканини розширює новий метод TBS, а за допомогою використання алгоритму FRAX можливо прогнозувати десятирічний ризик низькоенергетичного перелому. Обстеження хворих із використанням кісткових маркерів дає змогу оцінити темпи ремоделювання кістки, а саме стан резорбції та кісткоутворення.
Проведене дослідження, в якому визначено, що існує тісний взаємозв’язок між сенільним остеопорозом і гіпертонією, ішемічною хворобою серця й церебральним інсультом [28], тобто наявність остеопорозу може бути використана як предиктор раннього скринінгу захворюваності на дані хвороби в осіб літнього віку.
На підставі вивчення клінічних особливостей, гормональних змін і взаємозв’язку між сенільним остеопорозом та іншими захворюваннями В.В. Поворознюк [1] рекомендує використовувати критерії, що розроблені B.L. Riggs, L.J. Melton III [29] для диференціювання двох типів остеопорозу — постменопаузального та сенільного (табл. 1). Визначені певні відмінності за частотою захворювання за статтю, швидкістю втрати кісткової тканини, локалізацією і характером переломів хребців та ін.
Клінічний приклад сенільного остеопорозу
Пацієнтка А., 85 років. Скарги на біль у грудному та поперековому відділах хребта, що турбує протягом 5 років; спостерігається зменшення зросту.
Захворювання та стани з доведеним впливом на кісткову тканину, зокрема наявність ревматоїдного артриту, підвищену функцію щитоподібної та паращитоподібної залоз, порушення оваріоменструального циклу та прийом глюкокортикостероїдів в анамнезі заперечує. Супутні захворювання — ішемічна хвороба серця, гіпертонічна хвороба ІІ ст., остеоартрит колінних суглобів I–II ступеня (клінічно), стадія ремісії. Травми та переломи в анамнезі заперечує, за виключенням перелому ребра у віці 70 років при падінні з висоти власного зросту.
Жінка правильної тілобудови, зріст — 150 см, маса тіла — 67 кг, індекс маси тіла — 29,8 кг/м2. Постава кіфотична.
Результати інструментальних досліджень
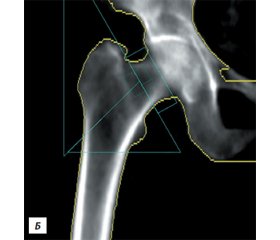
Двофотонна рентгенівська абсорбціометрія (08.11.2017): МЩКТ відповідає остеопорозу згідно з критеріями Всесвітньої організації охорони здоров’я (на рівні поперекового відділу хребта Т = –3,2 SD, проксимального відділу стегнової кістки — Т = –2,8 SD, усього скелета — Т = –3,4 SD та кісток передпліччя — Т = –4,5 SD) (рис. 4).
За результатами рентгеноморфометричного аналізу виявлено множинні клиноподібні та компресійні деформації тіл хребців (Th7–Th12, L1, L2, L4) (рис. 5).
За дослідженням метаболізму кісткової тканини відхилень не виявлено: кальцій загальний — 2,52 (норма: 2,2–2,55 ммоль/л), фосфор — 1,08 (0,81–1,45 ммоль/л), інтактний паратгормон — 31,2 (15,0–65,0 пг/мл), вітамін D загальний (25(ОН)D) — 30,31 (30,0–50,0 нг/мл).
Маркери ремоделювання кісткової тканини: пропептиди проколагену I типу (P1NP) — 53,21 (16,27–73,87 нг/мл), β-термінальні телопептиди колагену I типу (β-СТх) — 0,46 (< 1,008 нг/мл). Ці дані свідчать про низький кістковий метаболізм у хворої, що в науковій літературі визначають як «лінива кістка».
Висновки
Таким чином, кумулятивні ефекти старіння, дефіциту кальцію та вітаміну D за рахунок різних причин: дисфункції остеобластів, підвищення резорбції кістки, що супроводжується стимуляцією остеокластів та пригніченням функції остеобластів, імунопов’язаних механізмів запалення, які опосередковано впливають на кістку, на тлі дисфункції статевих гормонів — сприяють розвитку сенільного остеопорозу. Важливою ланкою в розвитку сенільного остеопорозу є ожиріння кісткового мозку з підвищенням адипогенезу, що призводить до зменшення кількості остеобластів та порушень ремоделювання кістки. Незважаючи на успіхи, досягнуті у вивченні механізмів розвитку сенільного остеопорозу, необхідні подальші дослідження, спрямовані на вивчення локальних і системних факторів, що впливають на кісткову тканину й беруть участь у розвитку даного захворювання.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Внесок авторів: Шаповалов В.С. — збір літературних джерел щодо проблеми, робота з джерелами, написання статті; Мусієнко А.С. — збір літератури за темою статті, участь в її написанні.
Отримано/Received 17.09.2021
Рецензовано/Revised 01.10.2021
Прийнято до друку/Accepted 06.10.2021
Список литературы
1. Поворознюк В.В. Остеопороз позвоночника: механизмы развития, факторы риска, клиника, диагностика, профилактика и лечение. В кн.: Повреждение позвоночника и спинного мезга: механизмы, клиника, диагностика и лечение (ред. Полищук Н.Е., Корж Н.А., Фищенко В.Я). К.: Книга плюс, 2001.
2. Bono C.M., Einhorn T.A. Overview of osteoporosis: pathophysiology and determinants of bone strength. Available from: http://eknygos.lsmuni.lt/springer/22/08-14.pdf.
3. Griffith J.F., Genant H.K. Imaging of Osteoporosis. In: Osteoporosis (4th ed.). 2013. Available from: https://www.sciencedirect.com/topics/veterinary-science-and-veterinary-medicine/senile-osteoporosis.
4. Duque G., Troen B.R. Understanding the mechanisms of senile osteoporosis: new facts for a major geriatric syndrome. J. Am. Geriatr. Soc. 2008. 56(5). 935-941. doi: 10.1111/j.1532-5415.2008.01764.x.
5. Поворознюк В.В., Плудовски П. (ред). Дефицит и недостаточность витамина D: эпидемиология, диагностика, профилактика и лечение: монография. К.: Издатель Заславский А.Ю., 2015. 262 с.
6. Поворознюк В.В., Поліщук Н. Вторинний остеопороз — мультидисциплінарна проблема сучасної медицини. Здоров’я України. 2003. 9(70). 22-23.
7. Manolagas S.C. Birth and death of bone cells: basic regulatory mechanisms and implications for the pathogenesis and treatment of osteoporosis. Endocr. Rev. 2000. 21(2). 115-1137. doi: 10.1210/edrv.21.2.0395.
8. Alonso-Bouzon C., Duque G. Osteoporosis senil: una actualización [Senile osteoporosis: an update]. Rev. Esp. Geriatr. Gerontol. 2011. 46(4). 223-229. Spanish. doi: 10.1016/j.regg.2011.02.010.
9. Rosen C.J., Bouxsein M.L. Mechanisms of disease: is osteoporosis the obesity of bone? Nat. Clin. Pract. Rheumatol. 2006. 2(1). 35-43. doi: 10.1038/ncprheum0070.
10. Chen X., Chen J., Xu D. еt al. Effects of Osteoglycin (OGN) on treating senile osteoporosis by regulating MSCs. BMC Musculoskelet Disord. 2017. 18(1). 423. doi: 10.1186/s12891-017-1779-7.
11. Tokuzawa Y., Yagi K., Yamashita Y. еt al. Id4, a new candidate gene for senile osteoporosis, acts as a molecular switch promoting osteoblast differentiation. PLoS. Genet. 2010. 6(7). e1001019. doi: 10.1371/journal.pgen.1001019.
12. Kawaguchi H. Osteoporosis pathophysiology: the updated mechanism. Clin. Case Rep. Rev. 2015. 1(9). 194-198. DOI: 10.15761/CCRR.1000165.
13. Maurin A.C., Chavassieux P.M., Frappart L. еt al. Influence of mature adipocytes on osteoblast proliferation in human primary cocultures. Bone. 2000. 26(5). 485-489. doi: 10.1016/S8756-3282(00)00252-0.
14. De Martinis M., Di Benedetto M.C., Mengoli L.P. et al. Senile osteoporosis: is it an immune-mediated disease? Inflamm. Res. 2006. 55(10). 399-404. doi: 10.1007/s00011-006-6034-x.
15. Musacchio E., Priante G., Budakovic A. et al. Effects of unsaturated free fatty acids on adhesion and on gene expression of extracellular matrix macromolecules in human osteoblast-like cell cultures. Connect. Tissue Res. 2007. 48(1). 34-38. doi: 10.1080/03008200601056528.
16. Wu H., Arron J.R. TRAF6, a molecular bridge spanning adaptive immunity, innate immunity and osteoimmunology. Bioessays. 2003. 25(11). 1096-1105. doi: 10.1002/bies.10352.
17. Atik O.S., Uslu M.M., Eksioglu F. et al. Etiology of senile osteoporosis: a hypothesis. Clin. Orthop. Relat. Res. 2006. 443. 25-27. doi: 10.1097/01.blo.0000200235.76565.c8.
18. Tatar M., Bartke A., Antebi A. The endocrine regulation of aging by insulin-like signals. Science. 2003. 299(5611). 1346-1351. doi: 10.1126/science.1081447.
19. Ionovici N., Mogoanta L., Grecu D. et al. Histological study of the femural head and neck microscopic architecture in persons with senile osteoporosis. Rom. J. Morphol. Embryol. 2004. 45. 127-132.
20. Demontiero O., Vidal C., Duque G. Aging and bone loss: new insights for the clinician. Ther. Adv. Musculoskelet Dis. 2012. 4(2). 61-76. doi: 10.1177/1759720X11430858.
21. Priyanka K., Amoldeep, Neetu. Overview of Osteoporosis. Ortho & Rheum. Open Access. 2017. 5(5). 555673. doi: 10.19080/OROAJ.2017.05.555673.
22. Zhang D.M., Cui D.X., Xu R.S. et al. Phenotypic research on senile osteoporosis caused by SIRT6 deficiency. Int. J. Oral. Sci. 2016. 8(2). 84-92. doi: 10.1038/ijos.2015.57.
23. Wáng Y.X.J. Senile osteoporosis is associated with disc degeneration. Quantitative Imaging in Medicine and Surgery. 2018. 8(6). 551-556. doi: 10.21037/qims.2018.07.04.
24. Muraki S., Yamamoto S., Ishibashi H. et al. Impact of degenerative spinal diseases on bone mineral density of the lumbar spine in elderly women. Osteoporos. Int. 2004. 15(9). 724-728. doi: 10.1007/s00198-004-1600-y.
25. Pye S.R., Reid D.M., Adams J.E. et al. Radiographic features of lumbar disc degeneration and bone mineral density in men and women. Ann. Rheum. Dis. 2006. 65(2). 234-238. doi: 10.1136/ard.2005.038224.
26. Salo S., Leinonen V., Rikkonen T. et al. Association between bone mineral density and lumbar disc degeneration. Maturitas. 2014. 79(4). 449-455. doi: 10.1016/j.maturitas.2014.09.003.
27. Kwok A.W., Wang Y.X., Griffith J.F. et al. Morphological changes of lumbar vertebral bodies and intervertebral discs associated with decrease in bone mineral density of the spine: a cross-sectional study in elderly subjects. Spine (Phila Pa 1976). 2012. 37(23). 1415-1421. doi: 10.1097/BRS.0b013e31826f561e.
28. Hu X., Ma S., Yang C. et al. Relationship between senile osteoporosis and cardiovascular and cerebrovascular diseases. Experimental and Therapeutic Medicine. 2019. 17(6). 4417-4420. doi: 10.3892/etm.2019.7518.
29. Riggs B.L., Melton L.J. 3rd. Involutional osteoporosis. N. Engl. J. Med. 1986. 314(26). 1676-1686. doi: 10.1056/NEJM198606263142605.
/58.jpg)

/53.jpg)
/54.jpg)
/56.jpg)
/57.jpg)