Международный эндокринологический журнал Том 17, №5, 2021
Вернуться к номеру
Вплив йодної недостатності на перебіг рекурентної респіраторної інфекції в дітей, які мешкають у йододефіцитному регіоні
Авторы: Сорокман Т.В., Макарова О.В.
Буковинський державний медичний університет, м. Чернівці, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Актуальність. Наслідком дефіциту йоду є зниження секреції тиреоїдних гормонів, що негативно впливає на імунну систему з розвитком соматичних та схильністю до частих респіраторних захворювань. Мета: вивчити йодну забезпеченість організму дітей із рекурентними респіраторними інфекціями (РРІ) шляхом дослідження органіфікованої та неорганічної фракцій йоду в сироватці крові та екскреції йоду з сечею. Матеріали та методи. Дослідження проводилося методом простої вибірки з урахуванням особливостей клініки респіраторного захворювання. Проведено клініко-лабораторне та інструментальне обстеження 60 дітей віком від 3 до 11 років із діагнозом РРІ. Досліджували концентрацію йоду в сечі, рівень неорганічного й органіфікованого йоду у крові. Результати. У клінічній картині спостерігалися типові для РРІ симптоми інтоксикації, лихоманка та катаральні симптоми. У дітей із тяжким перебігом РРІ чітко простежується зниження рівня показника йодурії до 57,34 мкг/л (p < 0,05), вмісту загального й органіфікованого йоду у крові — на 31,12 і 39,11 % (p < 0,001) відповідно. При цьому концентрація неорганічного йоду була вірогідно вищою (p < 0,001). Такі результати свідчать про «неправильний» субклітинний розподіл йоду на фракції при запальному процесі, зумовленому РРІ. У дітей із виявленим йодним дефіцитом відзначається більш тяжкий перебіг РРІ. Виявлено помірно негативний зв’язок рівня органіфікованого та неорганічного йоду (r = –0,515, p < 0,05) і прямий зв’язок між концентрацією загального й органіфікованого йоду (r = 0,899, p < 0,05) у крові. Висновки. Перебіг РРІ в пацієнтів із йодним дефіцитом характеризується зростанням рівня неорганічного йоду, зниженням рівня органіфікованого та загального йоду. Поглиблення цих змін корелює з тяжкістю респіраторного захворювання.
Background. The consequence of iodine deficiency is a decrease in the secretion of thyroid hormones, which adversely affects the immune system with the development of somatic and predisposition to frequent respiratory diseases. The purpose was to investigate the iodine supply of the body of children with recurrent respiratory infections (RRI) by studying the organification and inorganic fractions of iodine in the serum and excretion of iodine in the urine. Materials and methods. The study was conducted by simple sampling, taking into account the characteristics of the clinic course of respiratory disease. Clinical and laboratory and instrumental examination was performed in 60 children aged 3 to 11 years with a diagnosis of RRI. The concentration of iodine in urine, the level of inorganic and organification iodine in the blood were studied. Results. The clinical picture presented with the symptoms of intoxication, fever, and catarrhal symptoms typical of RRI. In children with severe RRI experienced a clear decrease in the iodine level to 57.34 μg/l (p < 0.05) and a decline in the blood content of total iodine and iodine organification by 31.12 and 39.11 % (p < 0.001), respectively. The concentration of inorganic iodine was significantly higher (p < 0.001). Such results indicate a “wrong” subcellular distribution of iodine into fractions in the inflammatory process caused by RRI. The children with detected iodine deficiency demonstrated a more severe course of RRI. There was a moderately negative relationship between the levels of organification and inorganic iodine (r = –0.515; p < 0.05) and a direct relationship between the blood concentrations of total and organification iodine (r = 0.899; p < 0.05). Conclusions. The course of RRI in patients with iodine deficiency is characterized by an increase in the level of inorganic iodine, a decrease in organification iodine and total iodine, the deepening of these changes correlates with the severity of the respiratory disease.
діти; дефіцит йоду; рекурентні респіраторні інфекції; органіфікований і неорганічний йод
children; iodine deficiency; recurrent respiratory infections, organification and inorganic iodine
Вступ
Матеріали та методи
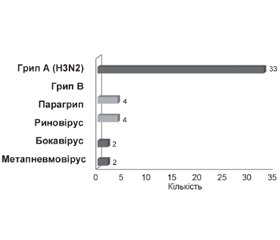
Результати
/84.jpg)
Обговорення
Висновки
- Van Meel E.R., den Dekker H.T., Elbert N.J., Jansen P.W., Moll H.A., Reiss I.K., de Jongste J.C. et al. A population-based prospective cohort study examining the influence of early-life respiratory tract infections on school-age lung function and asthma. Thorax. 2018. 73(2). 167-173. doi: 10.1136/thoraxjnl-2017-210149.
- El-Azami-El-Idrissi M., Lakhdar-Idrissi M., Chaouki S., Atmani S., Bouharrou A., Hida M. Pediatric recurrent respiratory tract infections: when and how to explore the immune system? (About 53 cases). Pan. Afr. Med. J. 2016. 24. 53. doi: 10.11604/pamj.2016.24.53.3481.
- Li Y., Fu X., Ma J. et al. Altered respiratory virome and serum cytokine profile associated with recurrent respiratory tract infections in children. Nat. Commun. 2019. 10(1). 2288. doi: 10.1038/s41467-019-10294-x.
- Pecora F., Persico F., Argentiero A., Neglia C., Esposito S. The Role of Micronutrients in Support of the Immune Response against Viral Infections. Nutrients. 2020. 12(10). 3198. doi: 10.3390/nu12103198.
- Kravchenko V.I., Medvedev B.K. The biological role of iodine and iodine deficiency as pathogenetic factor of thyroid pathology in pregnant women and its prevention. International Journal of Endocrinology (Ukraine). 2018. 14(2). 111-118. doi: 10.22141/2224-0721.14.2.2018.130552. (in Ukrainian)
- Verheesen R.H., Traksel R.A.M. Iodine, a preventive and curative agent in the COVID-19 pandemic? Med. Hypotheses. 2020. 144. 109860. doi: 10.1016/j.mehy.2020.109860.
- Iannaccone M., Ianni A., Elgendy R., Martino C., Giantin M., Cerretani L., Dacasto M., Martino G. Iodine Supplemented Diet Positively Affect Immune Response and Dairy Product Quality in Fresian Cow. Animals (Basel). 2019. 9(11). 866. doi: 10.3390/ani9110866.
- Bilal M.Y., Dambaeva S., Kwak-Kim J., Gilman-Sachs A., Beaman K.D. A Role for Iodide and Thyroglobulin in Modulating the Function of Human Immune Cells. Front. Immunol. 2017. 8. 1573. doi: 10.3389/fimmu.2017.01573.
- Sorokman T.V., Bachu M.I. Social and hygienic characteristics of children from the iodine deficiency region. International Journal of Endocrinology (Ukraine). 2021. 17(1). 111-116. doi: 10.22141/2224-0721.17.1.2021.226438.
- Júnior D.S.T. Environmental and individual factors associated with protection and predisposition to autoimmune diseases. Int. J. Health Sci (Qassim). 2020. 14(6). 13-23. PMID: 33192227. PMCID: PMC7644454.
- Unified clinical protocol of primary, secondary (specialized) medical care for adults and children “Influenza”. Order of the Ministry of Health of Ukraine № 499 of July 16, 2014. Klinichna imunolohiya. Alerholohiya. Infektolohiya. Klinichna imunolohiya. Alerholohiya. Infektolohiya. 2015. 2(81). 37-43.
- Arbuzova M.I., Mahmudov A.A., Gerasimov G.A., Ilyin A.V. The iodine micromethod for wetting. Clinical and Experimental Thyroidology. 2007. 2(3). 15-18. (in Russian)
- Shidlovsky V.O., Stolyar O.B., Osadchuk D.V. et al. Patent for utility model 45332. Method for determining the concentration of iodine in the biosubstrate. G09B 23/28 (2006.01) 10.11.2009, Bul. № 21. (in Ukrainian)
- Koukkou E.G., Roupas N.D., Markou K.B. Effect of excess iodine intake on thyroid on human health. Minerva Med. 2017. 108(2). 136-146. doi: 10.23736/S0026-4806.17.04923-0.
- Boelen A., Kwakkel J., Fliers E. Beyond low plasma T3: local thyroid hormone metabolism during inflammation and infection. Endocr. Rev. 2011. 32(5). 670-93. doi: 10.1210/er.2011-0007.
- Zimmermann M.B., Boelaert K. Iodine deficiency and thyroid disorders. Lancet Diabetes Endocrinol. 2015. 3. 286-295. https://doi.org/10.1016/S2213-8587(14)70225-6
- Walther B., Wechsler D., Schlegel P., Haldimann M. Iodine in Swiss milk depending on production (conventional versus organic) and on processing (raw versus UHT) and the contribution of milk to the human iodine supply. J. Trace Elem. Med. Biol. 2018. 46. 138-143. doi: 10.1016/j.jtemb.2017.12.004.

/83.jpg)
/84_2.jpg)