Международный неврологический журнал Том 17, №5, 2021
Вернуться к номеру
Диклоберл® — оптимальний НПЗП для лікування захворювань опорно-рухового апарату (літературний огляд та власні спостереження)
Авторы: Єгудіна Є.Д.
Клініка сучасної ревматології, м. Київ, Україна
Рубрики: Неврология
Разделы: Справочник специалиста
Версия для печати
На сьогодні нестероїдні протизапальні препарати (НПЗП) залишаються одними з найбільш важливих лікарських засобів для лікування більшості ревматичних захворювань. Основними показаннями для їх призначення є запальні процеси, гострий і хронічний біль, лихоманка, профілактика тромбозів. Ця група препаратів є унікальною, тому що вона поєднує протизапальні, аналгетичні, жарознижуючі й антитромботичні властивості, що дозволяє впливати на характерні симптоми. Жодна інша відома група лікарських засобів не має такого поєднання позитивних ефектів. Через це НПЗП широко використовуються як у ревматології, так і в кардіології, неврології, онкології тощо.
Однак призначення НПЗП чинить і негативний вплив на організм людини, викликаючи частий розвиток побічних реакцій, у першу чергу з боку шлунково-кишкового тракту, навіть до таких загрозливих станів, як шлунково-кишкові кровотечі, перфорації та виразкові утворення, а також серцево-судинні ускладнення, такі як підвищення артеріального тиску (АТ), інфаркти та інші. Тому сьогодні актуальним залишається питання вибору найбільш безпечного й ефективного НПЗП.
Нестероїдні протизапальні препарати мають добре відомий механізм дії, відзначаються доведеною ефективністю, зручністю застосування та доступністю. При деяких хронічних ревматичних захворюваннях НПЗП відіграють роль важливого патогенетичного засобу, впливаючи на зупинку прогресування хвороби.
Усі НПЗП поділяються на неселективні, селективні й високоселективні. Селективність НПЗП щодо ізоформ циклооксигенази (ЦОГ) прийнято оцінювати за відношенням ступеня інгібування ЦОГ-1 до ЦОГ-2 (коефіцієнт селективності). Селективними інгібіторами ЦОГ-2 вважаються ті НПЗП, у яких даний коефіцієнт становить понад 5, високоселективними інгібіторами — у яких даний коефіцієнт становить понад 50. Традиційні (неселективні) інгібітори ЦОГ-1 і ЦОГ-2 — це диклофенак, індометацин, ібупрофен, кеторолак, кетопрофен, напроксен. Селективні інгібітори ЦОГ-2, які меншою мірою впливають на ЦОГ-1, — лорноксикам, мелоксикам, набуметон, німесулід. Високоселективні інгібітори ЦОГ-2 практично не діють на ЦОГ-1 (парекоксиб, рофекоксиб, целекоксиб, еторикоксиб).
НПЗП призначаються при широкому спектрі захворювань, зокрема хворобах кістково-м’язової системи: остеоартриті, неспецифічному болі у спині, ревматоїдному артриті, спондилоартриті, подагрі та інших кристал-індукованих артропатіях, локальному запаленні м’яких тканин ревматичного характеру (тендиніт, тендовагініт, бурсит, ентезит). Вони показані при травмах та інших станах, що супроводжуються болем, викликаним пошкодженням або гострим запаленням, зокрема при стоматологічних захворюваннях. НПЗП необхідні для лікування післяопераційного болю, головного болю напруження та мігрені. НПЗП застосовуються при нирковій і біліарній коліках, онкологічних захворюваннях (як компонент паліативної знеболювальної терапії), гінекологічних захворюваннях, дисменореї.
Тривалість прийому НПЗП може бути різною, виділяють короткострокове і хронічне застосування. Крім того, НПЗП можуть застосовуватися постійно або за вимогою. Зазвичай розглядається передбачувана тривалість лікування протягом 4 тижнів або більше як хронічна терапія НПЗП, незалежно від регулярного або дозованого графіку прийому. При цьому кумулятивна частота побічних ефектів залежить від тривалості застосування НПЗП. Тому при короткостроковому застосуванні, наприклад для купірування гострого подагричного нападу, гострого неспецифічного болю у спині, загострення остеоартриту, доцільно призначати той препарат, який завдяки своїй високій протизапальній і знеболювальній активності дозволить зменшити тривалість застосування НПЗП. Результати метааналізу (Da Costa B.R., 2017) 76 рандомізованих клінічних досліджень (РКД), під час якого була проаналізована ефективність застосування різних НПЗП щодо величини знеболювального ефекту у 58 451 хворого на остеоартрит, показали, що найбільший знеболювальний ефект має диклофенак у дозі 150 мг. При цьому напроксен значно програє за величиною знеболювального ефекту диклофенаку та еторикоксибу (рис. 1).
У дослідженні A. Hecken et al. (2000) було виявлено, що диклофенак максимально ефективно пригнічує синтез прозапальних простагландинів Е2 (PGЕ2). Його застосування дозволяє знизити рівень PGE2 на 93 %, що значно (майже на 20 %) ефективніше за аналогічні показники як ЦОГ-2-селективних препаратів — рофекоксибу, мелоксикаму, так і неселективних — ібупрофену та напроксену. Крім того, диклофенак був ефективнішим за мелоксикам клінічно.
Згідно з результатами дослідження MELISSA, в якому взяли участь понад 9 тис. осіб з остеоартритом, пацієнти, які застосовували мелоксикам, на 38 % частіше вiдмовлялися від лікування через його неефективність (80 із 4635; р < 0,01) порівняно з хворими, які отримували диклофенак (48 із 4688). Тобто при порівнюванні ефективності щодо знеболювальної дії мелоксикам значно програвав диклофенаку.
Ще одним засобом, що виявляє досить швидкий знеболювальний ефект та має дуже швидкий початок дії, є препарат Німесил. Властивістю препарату, що визначає його призначення при гострому больовому синдромі, є швидкий початок дії. Вже через 30 хвилин після перорального прийому досягається значна концентрація препарату у крові, яка становить не менше 25 % від максимальної, а знеболювальна і протизапальна дія повністю реалізується через 1–3 год після прийому.
Раніше при захворюваннях кістково-м’язової системи експерти рекомендували використовувати НПЗП короткими курсами, достатніми для купірування гострого болю або пригнічення епізодів посилення хронічного болю. Однак є дані, що тривале безперервне застосування НПЗП може забезпечити кращий контроль симптомів хвороби, ніж їх використання в режимі «на вимогу». Про це свідчать, зокрема, дані РКД (Strand V. еt al., 2011), у якому 853 хворі на ОА протягом 6 міс. отримували НПЗП на вимогу (тільки при загостренні) або постійно (незалежно від наявності болю). Якщо на тлі прийому НПЗП на вимогу загострення виникали практично щомісяця (0,93 епізоду на місяць), то в тих, хто приймав НПЗП постійно, — майже вдвічі рідше (0,54; р < 0,001).
В європейських і американських рекомендаціях щодо лікування пацієнтів з остеоартритом рекомендація щодо прийому пероральних і локальних НПЗП належить до категорії сильних з огляду на їх високу ефективність щодо зменшення болю і поліпшення функції.
В алгоритмі лікування ОА колінного суглоба, розробленому міжнародною групою експертів ESCEO, при недостатній ефективності немедикаментозних методів, парацетамолу й симптом-модифікуючих повільнодіючих засобів (хондропротекторів) рекомендується використовувати пероральні НПЗП «переривчасто або постійно (тривалими циклами)».
При гострому подагричному артриті НПЗП використовують у максимальних протизапальних дозах курсами, необхідними для повного пригнічення болю й зникнення ознак запалення. Використання НПЗП після купірування гострого нападу подагри й початку уратознижувальної терапії необхідно пролонгувати до 3–6 міс. для запобігання рецидиву артриту.
НПЗП призначаються при периферичному та аксіальному спондилоартриті й анкілозуючому спондиліті (АС). Вони відзначаються не тільки симптом-модифікуючою, але й структурно-модифікуючою дією, сповільнюючи прогресування сакроілеїту, формування синдесмофітів і анкілозів.
Пацієнтам зі спондилоартритом та АС, які відчувають біль і скутість, слід приймати НПЗП у середніх і високих дозах (аж до максимальної дози) як терапію першої лінії, обов’язково з огляду на співвідношення ризику/користі, їх рекомендується використовувати тривалий час, безперервно, навіть після ослаблення симптомів. Для пацієнтів з хорошою відповіддю на НПЗП постійний прийом краще, ніж симптоматичний (на вимогу). Безперервний прийом НПЗП уповільнює прогресування АС, у той час як прийом на вимогу, тобто при болях, на прогресування практично не впливає.
У дослідженні А. Wanders et al. (2005) 205 хворих з анкілозуючим спондилітом протягом 2 років отримували НПЗП, половина з них — щодня, незалежно від наявності симптомів, а друга половина — тільки за необхідності купірувати біль (на вимогу). Основним критерієм ефективності терапії була динаміка рентгенологічних змін хребта. За період спостереження погіршення рентгенологічної картини на тлі постійного прийому НПЗП було відзначено вдвічі рідше, ніж при його застосуванні на вимогу. Так, частка хворих, які мали якісь зміни рентгенологічної картини, становила в досліджуваних групах 23 і 45 %, частка пацієнтів, у яких відзначалась серйозна негативна динаміка, — 11 і 23 % відповідно (p < 0,001) (рис. 2).
/54.jpg)
НПЗП використовуються для зменшення скелетно-м’язових ознак і симптомів. Для синовіту при псоріатичному артриті або несиновіальних ознаках, включно з осьовими симптомами, самих лише НПЗП може бути достатньо для контролю симптомів, особливо при супутніх локальних ін’єкціях глюкокортикоїдів. При домінуванні осьового або ентезального залучення в клінічній картині при спондилоартриті має бути використана тривала терапія НПЗП за умови, що вони викликали зменшення симптомів на 4 тижні.
НПЗП мають виражену токсичну дію на багато органів і систем, що пов’язано з пригніченням синтезу простагландинів. З боку шлунково-кишкового тракту їх застосування нерідко супроводжується розвитком НПЗП-гастропатії, НПЗП-асоційованої диспепсії, НПЗП-асоційованої ентеропатії, з боку серцево-судинної системи — тромбоемболічними ускладненнями, артеріальною гіпертензією, НПЗП-нефропатією.
Негативний вплив НПЗП на артеріальний тиск пов’язаний з блокадою ЦОГ-2 і зниженням синтезу PGЕ2 і простацикліну. У тканині нирок експресія ЦОГ-2 відбувається у відповідь на підвищення системного АТ, а посилення синтезу PGЕ2 і простацикліну в цій ситуації є елементом природного контролю, що перешкоджає розвитку стійкої артеріальної гіпертензії (АГ). НПЗП, блокуючи цей захисний механізм, чинять прогіпертензивну дію.
За даними серії РКД, частота розвитку або дестабілізації АГ, що вимагала переривання лікування або госпіталізації, на тлі прийому різних НПЗП коливається в широких межах: від 0,5 до 6 %. Щодо цього показовими є дані дослідження PRECISION (n = 24 081),
учасниками якого були пацієнти з початково високим кардіоваскулярним ризиком. Тривалий прийом НПЗП асоціювався з відносно низькою частотою розвитку тяжкої АГ, що вимагає госпіталізації: на тлі прийому целекоксибу, напроксену й ібупрофену вона становила 0,3; 0,4 і 0,5 % відповідно (рис. 3). Також було виявлено, що збільшення АТ є більш вираженим у пацієнтів, які отримують інгібітори ангіотензинперетворювального ферменту (ІАПФ) або блокатори рецепторів ангіотензину (БРА). Підсумовуючи, варто зазначити: більшість досліджень свідчать, що ібупрофен, еторикоксиб і рофекоксиб викликають виражене підвищення артеріального тиску. Таким чином, при плануванні терапії з застосуванням НПЗП необхідно здійснювати контроль артеріального тиску до початку терапії, а також протягом 4 тижнів хронічного прийому НПЗП (на прийомі в лікаря) та наголошувати на необхідності моніторингу артеріального тиску в домашніх умовах (навіть якщо немає артеріальної гіпертензії). Крім того, варто рекомендувати пацієнту проводити самоконтроль затримки рідини за допомогою зважування та перевірки набряку гомілок і стоп.
Щодо контролю артеріальної гіпертензії й артеріального тиску на тлі прийому НПЗП існують такі рекомендації:
— вимірювати АТ до початку прийому НПЗП;
— контролювати АТ після початку хронічної терапії НПЗП;
— вимірювати АТ через 4 тижні після початку прийому НПЗП (або раніше, якщо це показано) на прийомі в лікаря;
— проводити моніторинг АТ у домашніх умовах;
— проводити самоконтроль затримки рідини за допомогою зважування й перевірки набряку гомілок і стоп.
Прийом НПЗП переважно асоційований із двома типами серцево-судинних захворювань: застійною серцевою недостатністю й атеросклеротичними серцево-судинними подіями. Найбільший серцево-судинний ризик розвитку інфаркту міокарда виникає на тлі прийому еторикоксибу, найменший — целекоксибу й напроксену.
До хворих дуже високого серцево-судинного ризику належать пацієнти, які мають ішемічну судинну подію в анамнезі (перенесений інфаркт міокарда, гострий коронарний синдром, реваскуляризація коронарних та інших артерій, гостре порушення мозкового кровообігу, транзиторна ішемічна атака); з клінічно вираженою ішемічною хворобою серця; аневризмою аорти; захворюваннями периферичних артерій; тяжкою серцевою недостатністю ІІІ–ІV функціонального класу за NYHA, з документально підтвердженим атеросклерозом сон-них і коронарних артерій; за наявності ускладнень цукрового діабету (ЦД) 2-го типу з ураженням органів-мішеней, хронічної хвороби нирок (ХХН) 4-го ступеня (ШКФ < 30 мл/хв/1,73 м2); SCORE ≥ 10 %. При високому серцево-судинному ризику рекомендується уникати хронічної терапії НПЗП.
Високий ризик — це значно підвищені фактори ризику, холестерин ≥ 8 ммоль/л, або ліпопротеїди низької щільності > 6 ммоль/л, або АТ ≥ 180/100 мм рт.ст.; ХХН (ШКФ 30–59 мл/хв/1,73 м2); ЦД 2-го типу без ураження органів-мішеней (за винятком молодих пацієнтів із ЦД 1-го типу без факторів ризику); 5 % ≤ SCORE ≤ 10 %. Застосовувати НПЗП необхідно з обережністю, у мінімальних дозах, коротким курсом.
До помірного серцево-судинного ризику належать пацієнти з 1 % ≤ SCORE ≤ 5 %. Їм призначаються будь-які НПЗП, але з обережністю. При низькому ризику — SCORE < 1 % — можуть застосовуватися будь-які НПЗП.
НПЗП-асоційована диспепсія — найбільш поширене небажане явище, пов’язане з прийомом нестероїдних протизапальних препаратів. Вона виникає або посилюється у 20–30 % хворих, які регулярно приймають ці препарати. Диспепсія не загрожує життю, але істотно впливає на його якість і є основним суб’єктивним критерієм переносимості НПЗП. Через диспепсію понад 10 % хворих припиняють прийом призначених НПЗП.
Для лікування диспепсії, пов’язаної з прийомом НПЗП, рекомендується використовувати інгібітори протонної помпи (ІПП). Метааналіз 30 досліджень показав, що комбінація неселективного НПЗП (н-НПЗП) та ІПП знижує ризик диспепсії на 66 %, у той час як ізольований прийом селективного НПЗП (с-НПЗП) знижував ризик тільки на 12 % (рис. 4). Систематичний огляд шести РКД показав, що ІПП були значно більш ефективними, ніж антагоністи Н2-рецепторів або антациди, для лікування неспецифічної НПЗП-диспепсії. Тому не рекомендується використовувати антациди або антагоністи Н2-рецепторів для профілактики НПЗП-гастропатій.
/55.jpg)
Для пацієнтів з помірним ризиком виразкової хвороби рекомендується терапія н-НПЗП і ІПП або с-НПЗП. У пацієнтів з високим ризиком — с-НПЗП і ІПП. Кумулятивна частота рецидивуючих виразкових кровотеч за 18 місяців становила 5,6 % у групі «целекоксиб + омепразол» і 12,3 % у групі «напроксен + омепразол».
Пацієнтам з незрозумілою залізодефіцитною анемією, яким потрібен НПЗП, рекомендується консультація гастроентеролога і призначення с-НПЗП, тому що близько 10–15 % хворих, які тривалий час приймають аспірин або інші НПЗП, мають залізодефіцитну анемію, ймовірно пов’язану з гастроінтестинальною кровотечею легкого ступеня.
До факторів ризику НПЗП-гастропатій належать: виразковий анамнез; наявність в анамнезі шлунково-кишкової кровотечі; супутній прийом препаратів, що впливають на систему згортання крові (зокрема, низьких доз аспірину); похилий вік (> 65 років); паління; прийом глюкокортикоїдів; наявність диспепсії в анамнезі; наявність Н.pylori.
Поєднання Н.pylori з прийомом НПЗП збільшує ризик шлунково-кишкової кровотечі в 6,13 раза. Ерадикація Н.pylori дозволяє істотно знизити ризик розвитку НПЗП-гастропатії — після ерадикації і без неї частота виразок становила 6,4 і 11,8 % відповідно.
Пацієнт з анамнезом раніше ускладненої виразки шлунка або ДПК, одночасним застосуванням аспірину (низькі та високі дози), антиагрегантів, кортикостероїдів має високий гастроінтестинальний ризик. Йому рекомендується прийом селективних НПЗП і інгібіторів протонної помпи. Помірний ризик визначає наявність одного або двох таких факторів ризику: вік понад 65 років, неускладнена виразка шлунка або ДПК в анамнезі, інфікованість Н.pylori, диспепсія, паління. Таким пацієнтам призначаються неселективні НПЗП + ІПП або селективні НПЗП. Низький ризик — це відсутність факторів ризику, тому можуть застосовуватися будь-які НПЗП.
Усі НПЗП можуть спричиняти порушення функції печінки, однак тяжкі гепатотоксичні реакції, що супроводжуються клінічно вираженим холестазом або розвитком гострої печінкової недостатності, спостерігаються вкрай рідко (не більше ніж 1 випадок на 10 тис. пацієнтів). В європейському епідеміологічному дослідженні (Traversa G. et al., 2003), що включало близько 400 тис. осіб, які приймали НПЗП, не показано суттєвих відмінностей у гепатотоксичності німесуліду й низки інших препаратів цієї групи, таких як диклофенак та ібупрофен. Подібні дані були продемонстровані в популяційному дослідженні 2010–2014 рр., у якому вивчались причини розвитку гострої патології печінки у 2232 пацієнтів. Сумарний ризик для НПЗП становив 1,69; для німесуліду — 2,1; для ібупрофену — 1,92; для диклофенаку — 1,5; для парацетамолу — 2,97.
За даними Європейського агентства з лікарських засобів ЕМА 2015 р., німесулід є одним із 5 найбезпечніших НПЗП для печінки (целекоксиб, диклофенак, кетопрофен, напроксен, німесулід). Для шлунково-кишкового тракту, за даними ЕМА, найбезпечнішим вважається німесулід, він удвічі безпечніший за ібупрофен, диклофенак, мелоксикам. Серцево-судинна безпека німесуліду вища від мелоксикаму, кетопрофену, диклофенаку, індометацину, піроксикаму (ЕМА-2012).
НПЗП можуть порушувати функцію нирок, що пов’язано з пригніченням синтезу PGE2 і простацикліну (ЦОГ-1- і ЦОГ-2-залежний процес), які регулюють тонус ниркових артеріол, швидкість клубочкової фільтрації, а також екскрецію солі та води в ниркових канальцях. Характер і тяжкість ниркових ускладнень можуть варіювати в широких межах. На тлі прийому НПЗП описано розвиток мембранозної нефропатії, інтерстиціального нефриту з нефротичним синдромом і гострого папілярного некрозу. Відомий зв’язок між розвитком гострої ниркової недостатності і прийомом НПЗП. Разом з тим не доведено, що той або інший НПЗП має більшу чи меншу нефротоксичність.
За даними 18-місячного РКД MIDAL (n = 34 700), порушення функції нирок призвело до припинення лікування в 0,4–2,3 % хворих, які отримували еторикоксиб 90 і 60 мг, і 0,4–1,0 % пацієнтів, які прий-мали диклофенак 150 мг. Під час 20-місячного РКД PRECISION (n = 24 081) ниркові ускладнення були відзначені на тлі прийому целекоксибу в 0,7 % хворих, напроксену — у 0,9 %, ібупрофену – в 1,1 %.
Для запобігання нефротоксичному впливу НПЗП розроблені такі рекомендації:
1) рекомендується уникати прийому НПЗП пацієнтам з тяжкою ХХН (рШКФ < 30 мл/хв/1,73 м2) або з помірною ХХН (рШКФ 30–59 мл/хв/1,73 м2), які отримують ІАПФ, БРА або діуретики;
2) при призначенні НПЗП пацієнтам з високим ризиком розвитку ХХН рекомендується виконати тести, що оцінюють функцію нирок, якщо вони не були проведені протягом останніх 6 місяців;
3) щодо прийому НПЗП пацієнтами з ХХН немає даних про вибір того або іншого конкретного препарату;
4) рекомендується проводити моніторинг ниркової функції через 1 тиждень після початку прийому НПЗП;
5) регулярний моніторинг ниркової функції під час хронічної терапії НПЗП є бажаним. До загальних провокуючих чинників належать супутні інфекції, дегідратація, одночасний прийом сечогінних препаратів, ІАПФ або БРА, а також вплив рентгенконтрастних речовин;
6) рекомендується перевірити функцію нирок, якщо розвивається затримка рідини або є клінічні ознаки погіршення функції нирок під час НПЗП-терапії.
Наводимо також власні результати опитування сімейних лікарів і ревматологів щодо вибору НПЗП у реальній клінічній практиці. На підставі цього наводимо рейтинг нестероїдних протизапальних препаратів. Серед сімейних лікарів 68 % часто призначали НПЗП, 31 % — рідко, 1 % — ніколи, серед ревматологів ці показники становили 91, 9 і 0 % відповідно.
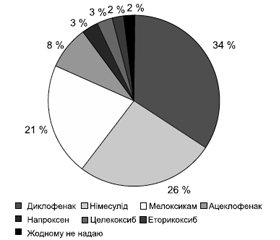
Більшість сімейних лікарів при короткостроковому призначенні (до 14 днів) застосовують диклофенак — 34 %, німесулід — 26 % або мелоксикам — 21 % (рис. 3). Ревматологи також обрали диклофенак — 40 %, німесулід — 28 % і мелоксикам — 11 % (рис. 5, 6).
При довгостроковому призначенні НПЗП (більше 14 днів) сімейні лікарі віддають перевагу мелоксикаму — 29 %, целекоксибу — 18 % або жодному з препаратів — 13 %. Ревматологи призначають мелоксикам — 33 %, ацеклофенак — 16 % і диклофенак — 14 %.
Важливим аспектом раціонального вибору НПЗП є врахування наявного в пацієнта серцево-судинного або гастроінтестинального ризику. У пацієнтів з підвищеним серцевим ризиком 29 % сімейних лікарів віддали перевагу мелоксикаму, 14 % — не віддавали переваги жодному з препаратів, 11 % — віддали перевагу німесуліду. На користь напроксену проголосували 31 % ревматологів, целекоксибу — 22 % і мелоксикаму — 15 %. При шлунково-кишковому ризику сімейні лікарі обрали мелоксикам — 26 %, жоден препарат — 19 %, целекоксиб — 18 %. Вибір ревматологів: еторикоксиб — 25 %, мелоксикам — 25 % і целекоксиб — 19 %.
Серед факторів, що обмежують застосування НПЗП, 50 % сімейних лікарів назвали шлунково-кишковий ризик, 23 % — підвищений серцево-судинний ризик і 11 % — нирковий ризик. Обмежуючими факторами використання НПЗП 38 % ревматологів назвали шлунково-кишковий ризик, 31 % — серцево-судинний ризик і 24 % — нирковий ризик.
Оскільки диклофенак при короткостроковому призначенні зайняв провідну позицію при опитуванні як лікарів різних спеціальностей, так і ревматологів, було проведене додаткове опитування щодо того, яким саме препаратам диклофенаку за торговою назвою лікарі надають перевагу. Відповідно до отриманих результатів опитування, найбільшою популярністю серед опитаних лікарів користується препарат Диклоберл® компанії «Берлін-Хемі/А. Менаріні Україна ГмбХ». Він має зручне дозування та велику різноманітність форм випуску, що робить його призначення зручним при різноманітних клінічних ситуаціях. Диклоберл® випускається в формі кишковорозчинних капсул, та його можна приймати лише один раз на добу.
Таким чином, найкращий знеболюючий ефект має диклофенак. Згідно з результатами опитування сімейних лікарів і ревматологів, популярною торговою маркою препаратів диклофенаку і препаратом вибору для призначення на термін до 14 днів є Диклоберл®, другу позицію займає німесулід. При підвищеному серцево-судинному ризику, за версією ревматологів, топ-5 НПЗП становлять напроксен, целекоксиб, мелоксикам, диклофенак і німесулід, при підвищеному гастроінтестинальному ризику лікарі різних спеціальностей надають перевагу мелоксикаму, целекоксибу та німесуліду.

/53.jpg)
/54_2.jpg)
/57.jpg)