Журнал «Здоровье ребенка» Том 16, №5, 2021
Вернуться к номеру
Сучасний стан проблеми діагностики та лікування алергічного риніту в педіатричній практиці
Авторы: Крючко Т.О., Ткаченко О.Я., Щербак В.В., Коленко І.О., Бубир Л.М.
Полтавський державний медичний університет, м. Полтава, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
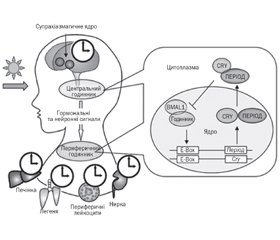
Серед всіх алергічних захворювань у педіатричній практиці алергічний риніт посідає одне з найбільш вагомих місць серед патологій верхніх дихальних шляхів. Даний огляд присвячений проблемі сучасних принципів діагностики та лікування алергічного риніту в дітей на підставі аналізу літературних джерел із використанням електронних баз даних PubMed, Web of Science, MedLine, The Cochrane Library. Алергічний риніт є важливою медико-соціальною проблемою сучасності, значення якого істотно збільшується протягом останніх років. Зростаюче число осіб, сенсибілізованих пилком, різноманітність симптомів та негативний вплив на якість життя пацієнтів роблять алергію на пилок однією з вагомих проблем педіатрії. Незважаючи на розробку міжнародних національних протоколів і клінічних рекомендацій, у багатьох країнах контроль за виявленням алергічного риніту в дітей залишається на недостатньому рівні. Тому необхідно враховувати індивідуальні особливості пацієнтів, звертати увагу як на назальні, так і на екстраназальні симптоми захворювання, враховувати всі патогномонічні діагностичні аспекти, оскільки гіподіагностика даного алергологічного захворювання призводить до неадекватної терапії, розвитку ускладнень, формування більш тяжких форм атопії та зниження якості життя в дітей загалом. Останнім часом з’являється все більше даних про необхідність персоніфікованого підбору найбільш ефективної терапії алергічного риніту в дітей. Поглиблене вивчення патогенетичної ролі циркадіанного молекулярного годинника в дітей із сезонним алергічним ринітом за допомогою інформативних молекулярно-генетичних методів може дозволити детально охарактеризувати механізм регуляції алергічного запалення слизової оболонки верхніх дихальних шляхів й оцінити роль досліджуваних циркадіанних генів у розвитку алергічних захворювань, зокрема алергічного риніту. У подальшому дані дослідження можуть стати альтернативою для покращення контролю за перебігом алергопатології та організації комплексної системи моніторингу, розробки нових стратегій лікування і профілактики алергічного риніту в дітей.
Among all allergic diseases in pediatric practice, allergic rhinitis is one of the most common pathologies of the upper respiratory tract. This review deals with the problem of modern principles for the diagnosis and treatment of allergic rhinitis in children based on the analysis of literature sources using electronic databases PubMed, Web of Science, MedLine, the Cochrane Library. Allergic rhinitis is an important medical and social problem of our time the importance of which has increased significantly in recent years. The growing number of people sensitized to pollen, the variety of symptoms and the negative impact on the quality of life of patients make pollen allergy one of the major problems in pediatrics. Despite the development of international national protocols and clinical guidelines, in many countries the control of allergic rhinitis in children remains insufficient. Therefore, it is necessary to take into account the individual characteristics of patients, pay attention to both nasal and extranasal symptoms, consider all pathognomonic diagnostic aspects, because the underdiagnosis of this allergic disease leads to inadequate therapy, complications, more severe atopy and reduced quality of children’s life in general. Recently, there is growing evidence of the need for personalized selection of the most effective therapy for allergic rhinitis in children. In-depth study of the pathogenetic role of circadian molecular clock in children with seasonal allergic rhinitis using informative molecular genetic methods may allow characterizing in detail the mechanism of regulation of allergic inflammation of the upper airway mucosa and evaluating the role of circadian genes in the development of allergic diseases, in particular allergic rhinitis. In the future, these studies may become an alternative to improve control over the course of allergy and the organization of a comprehensive monitoring system, development of new strategies for the treatment and prevention of allergic rhinitis in children.
алергічний риніт; діти; лікування; циркадіанний молекулярний годинник; огляд
allergic rhinitis; children; treatment; circadian molecular clock; review
- Lake I.R., Jones N.R., Agnew M. et al. Climate change and future pollen allergy in Europe. Environ Health Perspect. 2017. 125(3). 385-391. doi: 10.1289/EHP173.
- Zuberbier T., Lotvall J., Simoens S., Subramanian S.V., Church M.K. Economic burden of inadequate management of allergic diseases in the European Union: a GA (2) LEN review. J. Allergy. 2014. 69(10). 1275-1279. doi: 10.1111/all.12470. PMID: 24965386.
- Turner P.J., Kemp A.S. Allergic rhinitis in children. Journal of Paediatrics and Child Health. 2012. Vol. 48. P. 302-310.
- Stróżek J., Samoliński B., Kłak A., Gawińska-Drużba E. et al. THE INDIRECT COSTS OF ALLERGIC DISEASES. Int. J. Occup. Med. Environ. Health. 2019. Jun 14. 32(3). 281-290. doi: https://doi.org/10.13075/ijomeh.1896.01275.
- Keith P.K., Desrosiers M., Laister T., Schellenberg R.R., Waserman S. The burden of allergic rhinitis (AR) in Canada: perspectives of physicians and patients. Allergy Asthma Clin. Immunol. 2012, Jun 1. 8(1). 7. doi: 10.1186/1710-1492-8-7. PMID: 22656186.
- Охотнікова О.М. Труднощі первинної діагностики та сучасні можливості лікування алергічного риніту у дітей раннього віку. Педіатрія. 2021. № 2(58). С. 35.
- Зайков С.В., Гацька Д.О., Корицька І.В. Спектр сенсибілізації до алергенів у дітей та молоді Вінницької області з респіраторною алергією. Астма та алергія. 2016. № 4. С. 25-29.
- Клименко В.А., Серветник А.В. Этиологический спектр поллинозов весеннего сезона в Харьковском регионе. Актуальні проблеми сучасної медицини. 2016. Т. 16. Вип. 4. С. 121-125.
- Pawankar R., Mori S., Ozu C., Kimura S. Overview on the pathomechanisms of allergic rhinitis. Asia Pac. Allergy. 2011 Oct. 1(3). 157-167.
- Scadding G.K. Optimal management of allergic rhinitis. Arch. Dis. Child. 2015 Jun. 100(6). 576-582. doi: 10.1136/archdischild-2014-306300.
- Vandenplas O., Vinnikov D., Blanc P.D. et al. Impact of rhinitis on work productivity: A systematic review. J. Allergy Clin. Immunol. Pract. 2018 Jul-Aug. 6(4). 1274-1286. e1279. doi: 10.1016/j.jaip.2017.09.002.
- Blaiss M.S., Hammerby E., Robinson S., Kennedy-Martin T., Buchs S. The burden of allergic rhinitis and allergic rhinoconjunctivitis on adolescents: A literature review. Ann Allergy Asthma Immunol. 2018 Jul. 121(1). 43-52.e3. doi: 10.1016/j.anai.2018.03.028. PMID: 29626629.
- Weissenbruch R., Klimek L., Gálffy G. MP-AzeFlu Improves the Quality-of-Life of Patients with Allergic Rhinitis. J. Asthma Allergy. 2020, Dec 2. 13. 633-645. doi: 10.2147/JAA.S277734. PMID: 33293835.
- Brown T. Diagnosis and Management of Allergic Rhinitis in Children. Pediatric Annals. 2019. 48(12). 485-488. doi: 10.3928/19382359-20191111-01.
- Dass K., Petrusan A.J., Beaumont J., Zee P., Lai J., Fishbein A. Assessment of sleep disturbance in children with allergic rhinitis. Ann Allergy Asthma Immunol. 2017. 118. 505-506. doi: 10.1016/j.anai.2016.12.022.
- Loekmanwidjaja J., Carneiro A.C., Nishinaka M.L. Sleep disorders in children with moderate to severe persistent allergic rhinitis. Braz. J. Otorhinolaryngol. Mar-Apr 2018. 84(2). 178-184. doi: 10.1016/j.bjorl.2017.01.008.
- Lin S., Wang S., Lu M., Wang C., Koo M. Acute rhinosinusitis among pediatric patients with allergic rhinitis: A nationwide, population-based cohort study. PLoS One. 2019, Feb. 12. 14(2). e0211547. doi: 10.1371/journal.pone.0211547.
- Hsieh M.T., Liang S.H., Yang Y. et al. Allergic rhinitis increases the risk of incident panic disorder among young individuals: A nationwide population-based cohort study in Taiwan. J. Affect. Disord. 2019. 1. 252. 60-67. doi: 10.1016/j.jad.2019.04.037.
- Campbell A.P., Hoehle L.P., Phillips K.M., Caradonna D.S., Gray S.T., Sedaghat A.R. Depressed mood is associated with loss of productivity in allergic rhinitis. Allergy. 2018. 73(5). 1141-1144. doi: 10.1111/all.13387.
- Ткаченко О.Я. Актуальність вивчення показника якості життя в дітей з алергічними захворюваннями. Здоров’я дитини. 2013. № 8. С. 151-155.
- Охотнікова О.М., Глогуш І.І. Алергічний риніт і бронхіальна астма у дітей дошкільного віку: можливості сучасної терапії коморбідних захворювань. Современная педиатрия. 2017. 5(85). 73-86. doi 10.15574/SP.2017.85.73.
- Gani F., Lombardi C., Barrocu L. et al. The control of allergic rhinitis in real life: a multicenter cross-sectional Italian study. Clin. Mol. Allergy. 2018. 16. 4. doi: 10.1186/s12948-018-0082-y. PMID: 29434524.
- Tosca M.A., Del Barba P., Licari A., Ciprandi G., Asthma Rhinitis Control Study Group. The Measurement of Asthma and Allergic Rhinitis Control in Children and Adolescents. Children (Basil). 2020. 7(5). 43. doi:10.3390/children7050043.
- Linhares D.V., da Fonseca J.A., Borrego L.M. et al. Validation of control of allergic rhinitis and asthma test for children (CARATKids) — a prospective multicenter study. Pediatr. Allergy Immunol. 2014. 25(2). 173-179. doi: 10.1111/pai.12218.
- Bousquet J., Devillier P., Arnavielhe S. et al. Treatment of allergic rhinitis using mobile technology with real-world data: The MASK observational pilot study. Allergy. 2018. 73(9). 1763-1774. doi: 10.1111/all.13406.
- Охотнікова О.М., Гладуш Ю.І., Бондаренко Л.В. та ін. Алергічний риніт у дітей: нагальні питання діагностики і терапії. Клінічна імунологія. Алергологія. Інфектологія. № 1(80). 2015. С. 26-36.
- Уманець Т.Р., Матвєєва С.Ю. Алергічний риніт у дітей: на допомогу лікарю-педіатру. Здоровье ребенка. 2016. 5 (73). С. 137-140. doi: http://dx.doi.org/10.22141/2224-0551.5.73.2016.78313.
- Наумова О.О., Коломійченка О.С., Гогунська І.В. Застосування молекулярної алергодіагностики для прогнозу ефективності АСІТ і тяжкості перебігу перехресної харчової алергії у пацієнтів з сезонним алергічним ринітом із сенсибілізацією до пилку дерев. Клінічна імунологія. Алергологія. Інфектологія. 1-allergo. 2017. С. 12-21.
- Lombardi C., Musicco E., Rastrelli F., Bettoncelli G., Passalacqua G., Canonica G.W. The patient with rhinitis in the pharmacy. A cross-sectional study in real life. Asthma Res. Pract. 2015. 4. 1. 4. doi: 10.1186/s40733-015-0002-6.
- Brozek J.L., Bousquet J., Agache I. et al. Allergic rhinitis and its impact on asthma (ARIA) guidelines — 2016 revision. J. Allergy Clin. Immunol. 2017. 140. 950-958. doi: 10.1016/j.jaci.2017.03.050.
- Крючко Т.А., Ткаченко О.Я., Вовк Ю.А., Луканин А.В. Лікування алергічного риніту: шлях від доказової до практичної медицини. Современная педиатрия. 2014. 5(61). С. 83-86.
- Bousquet J., Schünemann H.J., Togias A. et al. Next-generation Allergic Rhinitis and Its Impact on Asthma (ARIA) guidelines for allergic rhinitis based on Grading of Recommendations Assessment, Development and Evaluation (GRADE) and real-world evidence. J. Allergy Clin. Immunol. 2020. 145(1). 70-80. e3. doi: 10.1016/j.jaci.2019.06.049.
- Klimek L., Jutel M., Akdis C. et al. Handling of allergen immunotherapy in the COVID-19 pandemic: An ARIA-EAACI statement. Allergy. 2020. Jul. 75(7). 1546-1554. doi: 10.1111/all.14336.
- Ballesta A., Innominato P.F., Dallmann R., Rand D.A., Lévi F.A. Systems Chronotherapeutics. Pharmacol Rev. 2017 Apr. 69(2). 161-199. doi: 10.1124/pr.116.013441.
- Moitra S., Haldar P., Moitra S. Individual chronotype may confound with asthma symptoms and therapy. Am. J. Respir. Crit. Care Med. 2018. Vol. 199. Is. 3. doi:10.1164/rccm.201809-1630LE.
- Nakao A. Circadian Regulation of the Biology of Allergic Disease: Clock Disruption Can Promote Allergy. Front. Immunol. 2020, Jun. 12. 11. 1237. doi: 10.3389/fimmu.2020.01237.
- Kaidashev I. Роль молекулярных часов циркадианных ритмов в патогенезе метаболического синдрома. Ендокринологія. 2020. 25. 2 (черв. 2020). 158-170.
- Nakao A., Nakamura Y., Shibata S. The circadian clock functions as a potent regulator of allergic reaction. Allergy. 2015. 70 (5). 467-73. doi: 10.1111 / усі.12596.
- Waggoner S.N. Circadian Rhythms in Immunity. Curr. Allergy Asthma Rep. 2020, Jan 10. 20(1). 2. doi: 10.1007/s11882-020-0896-9.
- Bujara S. Telling Time by Asthma, Allergy Symptom Severity. 2018. [Electronic resource] https://www.pulmonologyadvisor.com/home/topics/allergies/telling-time-by-asthma-allergy-symptom-severity/2/
- Paganelli R., Petrarca C., Di Gioacchino M. Biological clocks: their relevance to immune-allergic diseases. Clin. Mol. Allergy. 2018, Jan 10. 16. 1. doi: 10.1186/s12948-018-0080-0.
- Durrington H.J., Farrow S.N., Loudon A.S., Ray D.W. The circadian clock and asthma. Thorax. 2014 Jan. 69(1). 90-92. doi: 10.1136/thoraxjnl-2013-203482.
- NobelPrize.org. [Electronic resource] The Nobel Prize in Physiology or Medicine 2017. Nobel Media AB 2018. https://www.nobelprize.org/prizes/medicine/2017/summary/. Accessed November 17, 2018.
- Nakao A. Clockwork allergy: How the circadian clock underpins allergic reactions. J. Allergy Clin. Immunol. 2018 Oct. 142(4). 1021-1031. doi: 10.1016/j.jaci.2018.08.007.
- Ohdo S., Koyanagi S., Matsunaga N. Chronopharmacological strategies focused on chrono-drug discovery. Pharmacology & Therapeutics. Vol. 202. Oct 2019. P. 72-90. https://doi.org/10.1016/j.pharmthera.2019.05.018.
- Ando N., Nakamura Y., Ishimaru K. et al. Allergen-specific basophil reactivity exhibits daily variations in seasonal allergic rhinitis. Allergy. 2015 Mar. 70(3). 319-322. doi: 10.1111/all.12552.
- Honma A., Yamada Y., Nakamaru Y., Fukuda S., Honma K., Honma S. Glucocorticoids Reset the Nasal Circadian Clock in Mice. Endocrinology. 2015 Nov. 156(11). 4302-4311. doi: 10.1210/en.2015-1490.
- Nakamura Y., Nakano N., Ishimaru K. Inhibition of IgE-mediated allergic reactions by pharmacologically targeting the circadian clock. J. Allergy Clin. Immunol. 2016 Apr. 137(4). 1226-1235. doi: 10.1016/j.jaci.2015.08.052.
- Dallmann R., Okyar A., Lévi F. Dosing-Time Makes the Poison: Circadian Regulation and Pharmacotherapy. Trends Mol. Med. 2016 May. 22(5). 430-445. doi: 10.1016/j.molmed.2016.03.004.

/79.jpg)
/80.jpg)