Введение
В настоящее время воспалительные заболевания тканей пародонта рассматриваются как комплекс заболеваний, влияющий на весь организм в целом. Многие ученые уже описали потенциальную связь развития заболеваний тканей пародонта с другими состояниями, например рождением плода на ранних сроках беременности, хроническим обструктивным заболеванием легких, сахарным диабетом, остеопорозом, ревматоидным артритом [1, 3]. Также наличие хронических воспалительных заболеваний в настоящее время рассматривается как возможный фактор риска раннего атеросклероза, в основе которого лежит развитие системного воспалительного ответа, а также таких заболеваний, как ишемическая болезнь сердца, инфаркт миокарда, стенокардия, артериальная гипертензия, заболевания периферических артерий и инсульт [8, 17].
Наибольшую распространенность среди воспалительных заболеваний пародонта имеет генерализованный пародонтит, который является дистрофически-воспалительным процессом, возникающим вследствие сочетанного воздействия различных экзо- и эндогенных факторов. Большинство исследователей едины во мнении, что основным этиологическим фактором заболеваний тканей пародонта являются микроорганизмы зубной бляшки и продукты их жизнедеятельности (эндотоксины). Усиление патогенного потенциала микроорганизмов происходит на фоне реализации комплекса факторов как местных (ретенция зубной бляшки), так и общих механизмов защиты (иммуновоспалительный ответ), определяющих сопротивляемость тканей пародонта патогенным воздействиям. Биопленка представлена специализированной бактериальной экосистемой, которая окружена защитным матриксом, не позволяющим антибактериальным препаратам из слюны или десневой жидкости проникать внутрь микробной биопленки [14, 16]. Поэтому микроорганизмы в бактериальной экосистеме более устойчивы к антибиотикам и антимикробным средствам [14]. В пародонтологии назначение антибактериальных препаратов без механического снятия над- и поддесневой микробной биопленки неэффективно; более того, такой подход обусловливает развитие резистентных штаммов микроорганизмов [2].
Совершенствование методов диагностики в микробиологии позволило более полно и точно выявить наиболее патогенные виды микроорганизмов, характерных для этого заболевания. Авторы разделили микроорганизмы полости рта на 5 различных цветовых кластеров в зависимости от степени выраженности влияния на развитие заболеваний: зеленый, желтый, фиолетовый, оранжевый и красный [14]. К зеленому комплексу относят различные виды Capnocytophaga: С.ochracea, C.sputigena; Campylobacter concisus, Eubacteria nodatum и Streptococcus constellatus. Желтый включает несколько видов Streptococcus: S.sanguis, S.oralis, S.intermedius, S.gordonii и S.mitis. Фиолетовый комплекс включает Veillonella parvula, Actinomyces odontolyticus, Selenomonas noxia, Actinomyces naeslundii, Actinomyces viscosus. Авторы отметили, что появление на поверхности зубов бактериальных колоний первых трех кластеров является предвестником колонизации бактериями оранжевого или красного кластеров. Появление оранжевого (включает подвиды Fusobacterium periodonticum, Prevotella intermedia, P.nigrescens, Peptostreptococcus micros, C.rectus, C.gracilis, C.showae, Eubacterium nodatum и S.constellatus) и красного (3 близкородственных вида — T.forsythensis, P.gingivalis и T.denticola) кластеров тесно связано с выраженными признаками развития клинической картины поражения пародонта, а именно — с увеличением глубины и кровоточивости образующихся пародонтальных карманов [14]. Ученые поддерживают точку зрения, что микрофлора полости рта обладает особыми патогенными свойствами, когда действует в ассоциациях, отмечают синергизм и антагонизм между пародонтальными патогенами и другими бактериями полости рта [14, 16].
Роль микробной флоры полости рта в развитии сердечно-сосудистой патологии
Согласно современным данным, постоянно персистирующая пародонтопатогенная микрофлора может влиять на сердечно-сосудистую патологию двумя путями. Первый путь — бактерии воздействуют на эндотелиальные клетки кровеносных сосудов. Бактерии P.gingivalis, P.intermedia (Dorn B.R. et al., 1999) и S.mutans (Abranches J. et al., 2009) могут проникать в эндотелиальные клетки аорты in vitro и персистировать внутри них, что приводит к развитию вторичной хронической инфекции. Инфицирование эндотелиальных клеток бактериями может вызывать развитие эндотелиальной дисфункции — одного из основных проявлений атеросклероза [13, 18] (рис. 1). Следовательно, проникновение бактерий в эндотелиальные клетки может приводить к уменьшению выраженности противовоспалительных и антиатерогенных свойств этих клеток, способствуя дальнейшему развитию эндотелиальной дисфункции.
Другой путь — инвазия бактерий приводит к активации реакций врожденного иммунитета, происходит стимулирование продукции медиаторов с атерогенным и провоспалительным системным эффектом (интерлейкин-1, интерлейкин-6, простагландин Е2, фактор некроза опухоли альфа) [20, 21]. По мнению ряда авторов, цитокины (интерлейкин-1, интерлейкин-6, TNF-α) и другие медиаторы воспаления, продуцируемые клетками-респондерами, высвобождаются при пародонтите и обладают способностью стимулировать гепатоциты для производства С-реактивного белка (CРБ) (рис. 2).
/21.jpg)
С-реактивный белок является одним из доказанных биохимических маркеров выраженной атеросклеротической эндотелиальной дисфункции. В исследованиях Dye et al. авторы увидели взаимосвязь между высоким уровнем титра в сыворотке крови к микроорганизму P.gingivalis и высоким уровнем CРБ [5, 6]. Напротив, титр A.actinomycetecomitans не был связан с высокими уровнями CРБ. Аналогичные результаты для P.gingivalis наблюдались также в исследованиях Pitiphat et al. [5]. Другие исследования показали, что пародонтологическое лечение может значительно снизить уровень CРБ в сыворотке крови [5, 6]. Чтобы поддержать эту концепцию, D’Aiuto et al. провели исследование, в котором наблюдали снижение сывороточного уровня CРБ после завершения пародонтологического лечения. Авторы пришли к выводу, что контроль пародонтита может быть достигнут с помощью нехирургического пародонтологического лечения, что значительно снижает уровень медиаторов и маркеров острого иммуновоспалительного ответа. Поскольку CРБ представляет собой острый фазовый белок, когда устраняется пародонтопатогенная микрофлора, запустившая иммуновоспалительную реакцию, уровень CРБ снижается [5, 6].
Гематогенный путь распространения микробной флоры из полости рта в органы и ткани организма
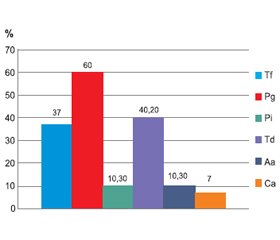
Рабочая группа Европейской ассоциации пародонтологии и Американской академии пародонтологии в 2013 г. опубликовала результаты биологических и эпидемиологических исследований. Результаты исследований показали, что статистически значимые риски для развития заболеваний сердца и сосудов, независимые от установленных сердечно-сосудистых факторов риска, были у лиц с заболеваниями пародонта. По данным ряда авторов, наличие в полости рта участка пораженного эпителия размером 8–20 мм у пациентов со средней тяжестью течения генерализованного пародонтита способствует ускоренному прямому попаданию бактерий в кровоток уже во время приема пищи или чистки зубов [8]. В работе Forner et al. [11] было показано, что гематогенная распространенность микроорганизмов после ультразвукового скейлинга была значительно выше у пациентов с генерализованным пародонтитом по сравнению с пациентами с гингивитом и здоровыми людьми. У пациентов с пародонтитом величина бактериемии была связана с воспалением и количеством участков с кровоточивостью при зондировании пародонтального кармана. Также причиной транзиторной бактериемии, вызванной различными микроорганизмами, могут быть стоматологические манипуляции: проведение профессиональной гигиены (88 %), удаление зуба (60 %) [19]. В исследованиях И.П. Мазур, Н.Л. Харченко [3], изучавших распространенность транзиторной бактериемии после стоматологических процедур, было продемонстрировано, что на 15-й минуте после проведения стоматологических манипуляций у 44,1 % пациентов зарегистрировано наличие патогенной микрофлоры в кровяном русле: Staphylococcus aureus (16,3 %), Staphylococcus pyogenes (11,6 %), Streptococcus viridans (14,0 %). На 30-й минуте после проведения стоматологических манипуляций у 16,2 % пациентов зарегистрировано наличие этой же патогенной микрофлоры в кровяном русле. Можно утверждать, что микроорганизмы из пародонтального кармана (Streptococcus viridans, Staphylococcus pyogenes, Staphylococcus aureus) и стоматологические манипуляции являются фактором риска развития транзиторной бактериемии. Результаты исследований И.П. Мазур и М.В. Слободяник [3, 4], которые включали пациентов, госпитализированных в Национальный институт сердечно-сосудистой хирургии им. Н.М. Амосова, нуждающихся в протезировании сердца механическим клапаном, продемонстрировали более высокую распространенность пародонтопатогенов в пародонтальных карманах у больных с клапанной патологией сердца (р < 0,01). Высокий уровень обсемененности пародонтопатогенами обусловливает и большую частоту распространенности этих пародонтопатогенов на клапанах сердца у больных с клапанной патологией сердца. Полученные результаты исследования свидетельствуют о высокой статистически значимой зависимости наличия патогенной микрофлоры в биологическом материале (клапан сердца) от ее присутствия в пародонтальных карманах (р < 0,01) [4] (рис. 3, 4).
/22.jpg)
На основании этого Американская ассоциация сердечно-сосудистых заболеваний рекомендует антибиотикопрофилактику перед стоматологическими манипуляциями, сопровождающимися значительным кровотечением (пародонтальной хирургией, скейлингом и профессиональной гигиеной) в группах пациентов с высоким риском развития инфекционного эндокардита. Кроме того, в настоящее время в соответствии с европейскими рекомендациями по лечению инфекционного эндокардита антибиотикопрофилактика проводится при стоматологических манипуляциях, связанных с экстракцией зуба или процедурами на периапикальных зонах зубов.
Взаимодействие микробной флоры полости рта с тромбоцитами крови
Важным аспектом влияния пародонтопатогенных бактерий на кровеносные сосуды является их способность реагировать и взаимодействовать с тромбоцитами крови. В исследованиях установлено, что многие виды Streptococcus, особенно S.viridans, S.sanguinis, S.gordonii, S.mutans и S.mitis, могут индуцировать адгезию и агрегацию тромбоцитов in vitro [11], что способно приводить к дальнейшему формированию тромбоэмболий сосудов. Как показали исследования, агрегацию тромбоцитов in vitro могут вызывать не только некоторые виды Streptococcus, но и P.gingivalis. Способность P.gingivalis вызывать агрегацию тромбоцитов изначально приписывали фимбриям [15], потому что фимбрии помогают бактерии зацепиться за тромбоцит, и тогда поверхностно экспрессирующие белки везикул (капсулы, содержащие многие вирулентные факторы) взаимодействуют с рецепторами тромбоцитов, что вызывает их последующую агрегацию [19, 20, 24]. В недавних публикациях указано, что P.gingivalis вызывает агрегацию тромбоцитов через TLR-2 зависимые механизмы [24]. Свидетельств, касающихся влияния других пародонтопатогенных микроорганизмов на агрегацию тромбоцитов, не выявлено. Но представленные данные свидетельствуют о способности пародонтопатогенной микрофлоры вызывать адгезию и агрегацию тромбоцитов, что может быть одним из основных факторов, способствующих развитию и прогрессированию тромбозов кровеносных сосудов.
Выводы
Таким образом, представленные данные позволяют осветить современные взгляды на взаимосвязь между состоянием пародонтопатогенной микрофлоры ротовой полости и развитием сердечно-сосудистых заболеваний. Дальнейшие исследования в данном направлении позволят раскрыть глубинные механизмы данной взаимосвязи и на более высоком уровне подойти к планированию эффективных профилактических и терапевтических подходов, направленных на предотвращение развития этих патологических состояний.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
Отримано/Received 14.05.2021
Рецензовано/Revised 28.05.2021
Прийнято до друку/Accepted 07.06.2021
Список литературы
1. Мазур І.П. Превенція неінфекційних захворювань: роль стоматолога. Здоров’я України. 2018. № 15–16 (436–437). С. 24-25. https://health-ua.com/article/38999-preventcya-nenfektcjnih-zahvoryuvan-rol-stomatologa
2. Мазур И.П., Слободяник М.В. Системные антибактериальные препараты в пародонтологии. Современная стоматология. 2017. № 1. С. 18-22.
3. Витовский Р.М., Мазур И.П., Слободяник М.В. Микробиомы пародонтальных карманов и биологического материала у пациентов с генерализованным пародонтитом и клапанной патологией сердца. Стоматология. Эстетика. Инновации. 2018. № 2. С. 185-201.
4. Витовский Р.М., Мазур И.П., Слободяник М.В., Мартыщенко И.В. Взаимосвязь патологии сердечно-сосудистой системы и заболеваний тканей пародонта. Вісник серцево-судинної хірургії. 2018. № 1. С. 72-78.
5. Paraskevas S., Huizinga J.D., Loos B.G. A systematic review and meta-analyses on C-reactive protein in relation to periodontitis. J. Clin. Periodontal. 2008. Vol. 35. P. 277-90.
6. Salzberg T.N., Overstreet B.T., Rogers J.D. et al. C-reactive protein levels in patients with aggressive periodontitis. J. Periodontol. 2006. Vol. 77. P. 933-39.
7. Davis D. Understanding biofilm resistance to antibacterial agents. Nat. Rev. Drug Discov. 2003. № 2(2). Р. 114-22.
8. Aquino A.R., Lima K.C., Paiva M.S. et al. Periodontal pathogens in atheromatous plaques. A controlled clinical and laboratory trial. J. Periodontal. Res. 2011. Vol. 46(3). P. 303-309.
9. Naito M., Sakai E., Shi Y. et al. Porphyromonas gingivalis-induced platelet aggregation in plasma depends on Hgp44 adhesin but not Rgp proteinase. Mol. Microbiol. 2006. Vol. 59(1). P. 152-167.
10. Boudoulas K.D., Borer J.S., Boudoulas H. Etiology of valvular heart disease in the 21st century. J. Cardiology. 2013. Vol. 126. P. 139-152.
11. Forner L., Larsen T., Kilian M. Incidence of bacteremia after chewing, tooth brush-ing and scaling in individuals with periodontal inflammation. J. Clin. Periodontol. 2006 Jun. Vol. 33 (6). P. 401-7.
12. Aarabi G., Heydecke G., Seedorf U. Roles of Oral Infections in the Pathomechanism of Atherosclerosis. International Journal of Molecular Sciences. 2018. Vol. 19(7).
13. Oliveira F.A.F., Forte C.P.F. Molecular Analysis of Oral Bacteria in Heart Valve of Patients With Cardiovascular Disease by Real-Time Polymerase Chain Reaction. Medicine. 2015. Vol. 47. P. 1-5.
14. Hajishengallis G., Lamont R.J. Beyond the red complex and into more complexity: the polymicrobial synergy and dysbiosis (PSD) model of periodontal disease etiology. Oral. Microbiol. 2012. Vol. 27. P. 409-419.
15. Haraszthy V.I., Zambon J.J., Trevisan M. et al. Identification of periodontal pathogens in atheromatous plaques. J. Periodontol. 2012. Vol. 71. P. 1554-1560.
16. Oral Biofilms and Calculus. J. Lindhe, N.P. Lang, T. Karring, eds. Clinical Periodontology and Implant Dentistry. 5th ed. Oxford: Blackswell-Munksgaard, 2008. Р. 183-267.
17. Humphrey L.L., Fu R., Buckley D.I. et al. Periodontal disease and coronary heart disease incidence: a systematic review and meta-analysis. J. Gen. Intern. Med. 2012. Vol. 23. P. 2079-2086.
18. Sravya L., Warad S., Vijayalaxmi K., Sejal P., Hazeil D.J. Role of Systemic Markers in Periodontal Diseases: A Possible Inflammatory Burden and Risk Factor for Cardiovascular Diseases? Ann. Med. Health Sci Res. 2014. Vol. 4(3). P. 388-392.
19. Reyes L., Herrera D., Kozarov E., Roldan S., Progulske-Fox A. Periodontal bacterial invasion and infection: contribution to atherosclerotic pathology. J. Clin. Periodontol. 2013. Vol. 40. P. 30-50.
20. Schaudinn C., Gorur A., Keller D., Sedghizadeh P.P., Costerton J.W. Periodontitis: an archetypical biofilm disease. J. Am. Dent. Assoc. 2009. № 140(8). Р. 978-86.
21. Wu T. et al. Periodontal disease and risk of cerebrovascular disease: The First National Health and Nutrition Examination Survey and its follow-up study. Arch. Intern. Med. 2000. Vol. 160. P. 2749-55.
22. Yakob M., Meurman J.H. et al. Prevotella nigrescens and Porphyromonas gingivalis are associated with signs of carotid atherosclerosis in subjects with and without periodontitis. J. Periodontal. Res. 2011. Vol. 46. P. 749-55.
23. Dhadse P., Gattani D., Mishra R. The link between periodontal disease and cardiovascular disease: How far we have come in last two decades? J. Indian. Soc. Periodontol. 2010 Jul-Sep. Vol. 14 (3). P. 148-154.
24. Akamatsu Y., Yamamoto T. Porphyromonasgingivalis induces myocarditis and/or myocardial infarction in mice and IL-17A is involved in pathogenesis of these diseases/oral biology. 2011. № 56. Р. 1290-1298.

/21.jpg)
/22.jpg)