Международный эндокринологический журнал Том 17, №4, 2021
Вернуться к номеру
Цукровий діабет і гострі коронарні синдроми
Авторы: Сергієнко В.О., Сергієнко О.О.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
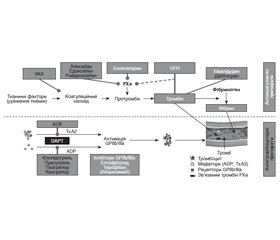
В огляді проведений аналіз літературних джерел, присвячених сучасному стану проблеми цукрового діабету і гострих коронарних синдромів (ГКС). Зокрема, аналізуються питання, пов’язані з етіологією, епідеміологією, основними патофізіологічними особливостями, класифікацією гострих коронарних синдромів, гострих коронарних синдромів без стійкого підйому сегмента ST на ЕКГ, гострих коронарних синдромів із підйомом сегмента ST, неатеросклеротичними причинами гострого коронарного синдрому, лабораторними та інструментальними діагностичними дослідженнями. Аналізуються питання, пов’язані з основними підходами до лікування гострих коронарних синдромів, ведення хворих на цукровий діабет із гострими коронарними синдромами, рекомендаціями із вторинної профілактики. Першопочаткове лікування всіх ГКС включає ацетилсаліцилову кислоту, болюсне призначення гепарину та внутрішньовенну інфузію гепарину (за відсутності протипоказань). Також рекомендується антиагрегантна терапія тікагрелором або клопідогрелем. Забезпечують контроль болю за допомогою морфіну/фентанілу та кисню у разі гіпоксії. З метою зняття болю також можна використовувати нітрогліцерин сублінгвально або інфузійно. Необхідний постійний моніторинг діяльності міокарда на предмет аритмії. Вибір стратегії реперфузії у хворих на цукровий діабет повинен базуватися на багатьох чинниках, зокрема, на оцінці клінічного статусу (гемодинамічна/електрична нестабільність, тривала ішемія), ускладнень хронічного коронарного синдрому, ішемічного навантаження, ЕхоКГ-оцінці функції лівого шлуночка та будь-яких інших супутніх захворювань. Крім того, для прийняття остаточного рішення потрібно використовувати різні методи оцінки уражень коронарних артерій та прогнозування хірургічної смертності внаслідок оперативного втручання.
This review article summarizes the existing literature on the current state of the problem of diabetes mellitus and acute coronary syndromes. In particular, the issues are analyzed related to the etiology, epidemiology, main pathophysiological features, classification of acute coronary syndromes, acute coronary syndromes without persistent ST-segment elevation on the electrocardiogram, acute coronary syndromes with ST-segment elevation, non-atherosclerotic causes of acute coronary syndrome, laboratory and instrumental diagnostic tests. Issues were analyzed related to the main approaches to the treatment of acute coronary syndromes, management of patients with diabetes mellitus and acute coronary syndromes, recommendations for secondary prevention. Initial treatment with corticosteroids includes acetylsalicylic acid, bolus heparin and intravenous heparin infusion (in the absence of contraindications). Antiplatelet therapy with ticagrelor or clopidogrel is also recommended. Pain is controlled using morphine/fentanyl and oxygen in case of hypoxia. Nitroglycerin can also be used sublingually or by infusion to relieve pain. Continuous monitoring of myocardial activity for arrhythmia is required. The choice of reperfusion strategy in patients with diabetes mellitus should be based on many factors, including assessment of clinical status (hemodynamic/electrical instability, prolonged ischemia), complications of chronic coronary syndrome, ischemic load, echocardiography, assessment of left ventricular function and any other comorbidities. In addition, various methods for assessing coronary artery disease and predicting mortality due to surgery are needed to make a final decision. Advances in the sensitivity of cardiac biomarkers and the use of risk assessment tools now enable rapid diagnosis within a few hours of symptom onset. Advances in the invasive management and drug therapy have resulted in improved clinical outcomes with resultant decline in mortality associated with acute coronary syndrome.
цукровий діабет; гострі коронарні синдроми; огляд
diabetes mellitus; acute coronary syndromes; review
Основні етіологічні чинники
Епідеміологія
Основні патофізіологічні особливості
Скринінг цукрового діабету у хворих із гострими коронарними синдромами
Діагноз
Лікування
Інше медикаментозне лікування
Інвазивне лікування
Прогноз
- 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. The Task Force for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC). Eur. Heart J. 2020. Aug. 29. 1-79. doi: 10.1093/eurheartj/ehaa575.
- Khan M.A.B., Hashim M.J., King J.K., Govender R.D., Mustafa H., Al Kaabi J. Epidemiology of Type 2 Diabetes — Global Burden of Disease and Forecasted Trends. J. Epidemiol. Glob. Health. 2020. 10(1). 107-111. doi: 10.2991/jegh.k.191028.001.
- Serhiyenko V.A., Serhiyenko L.M., Serhiyenko A.A. Recent advances in the treatment of neuropathies in type 2 diabetes mellitus patients: Focus on benfotiamine (review and own data). In: Berhardt L.V., ed. Advances in Medicine and Biology (Numbered series). New York: Nova Science Publishers. 2020. 166. Charter 1. 1-80. ISBN: 978-1-53618-324-5. Library of Congress Cataloging-in-Publication Data.
- Tillin T., Hughes A.D., Mayet J., Whincup P., Sattar N., Forouhi N.G., McKeigue P.M. et al. The relationship between metabolic risk factors and incident cardiovascular disease in Europeans, South Asians, and African Caribbeans: SABRE (Southall and Brent Revisited) — a prospective population-based study. J. Am. Coll. Cardiol. 2013. 61(17). 1777-86. doi: 10.1016/j.jacc.2012.12.046.
- Arnold S.V., Lipska K.J., Li Y., McGuire D.K., Goyal A., Spertus J.A., Kosiborod M. Prevalence of glucose abnormalities among patients presenting with an acute myocardial infarction. Am. Heart J. 2014. 168(4). 466-70e1. doi: 10.1016/j.ahj.2014.06.023.
- O’Donoghue M.L., Vaidya A., Afsal R., Alfredsson J., Boden W.E., Braunwald E. et al. An invasive or conservative strategy in patients with diabetes mellitus and non-ST-segment elevation acute coronary syndromes: A collaborative meta-analysis of randomized trials. J. Am. Coll. Cardiol. 2012. 60(2). 106-11. doi: 10.1016/j.jacc.2012.02.059.
- President’s page. Acute coronary syndromes and diabetes mellitus. Hellenic J. Cardiol. 2016. 57. 375-7. doi.org/10.1016/j.hjc.2016.12.012.
- Planer D., Witzenbichler B., Guagliumi G., Peruga J.Z., Brodie B.R., Xu K., Fahy M. et al. Impact of hyperglycemia in patients with ST-segment elevation myocardial infarction undergoing percutaneous coronary intervention: the HORIZONS-AMI trial. Int. J. Cardiol. 2013. 167(6). 2572-9. doi: 10.1016/j.ijcard.2012.06.054.
- Ekmekci A., Cicek G., Uluganyan M., Gungor B., Osman F., Ozcan K.S., Bozbay M. et al. Admission hyperglycemia predicts inhospital mortality and major adverse cardiac events after primary percutaneous coronary intervention in patients without diabetes mellitus. Angiology. 2014. 65(2). 154-9. doi: 10.1177/0003319713488930.
- Lettino M., Andell P., Zeymer U., Widimsky P., Danchin N., Bardaji B., Barrabes J.A. et al.; on behalf of the PIRAEUS group. Diabetic patients with acute coronary syndromes in contemporary European registries: characteristics and outcomes. EHJ-CVP. 2017. 3(4). 198-213. doi: 10.1093/ehjcvp/pvw049.
- Giraldez R.R., Clare R.M., Lopes R.D., Dalby A.J., Prabhakaran D., Brogan G.X. Jr., Giugliano R.P. Prevalence and clinical outcomes of undiagnosed diabetes mellitus and prediabetes among patients with high-risk non-ST-segment elevation acute coronary syndrome. Am. Heart J. 2013. 165(6). 918-25.e2. doi: 10.1016/j.ahj.2013.01.005.
- Gustafsson I., Hvelplund A., Hansen K.W., Galatius S., Madsen M., Jensen J.S., Tilsted H.-E. et al. Underuse of an invasive strategy for patients with diabetes with acute coronary syndrome: A nationwide study. Open Heart. 2015. 2. e000165. doi: 10.1136/ openhrt-2014-000165.
- Tardif J.-C., L’Allier P.L., Fitchett D.H. 2018 Clinical Practice Guidelines. Management of Acute Coronary Syndromes. Diabetes Canada Clinical Practice Guidelines Expert Committee. Can. J. Diabetes. 2018. 42. 190-5. doi: 10.1016/j.jcjd.2017.10.029.
- Nikitina E.A. Impact of type 2 diabetes mellitus on clinical and functional features and prognosis in patients with acute coronary syndrome. Eruditio Juvenium. 2019. 7(1). 11-8. doi: 10.23888/HMJ20197111-18. (In Russian).
- Diagnostics and treatment of acute coronary syndrome in patients without ST-segment elevation on electrocardiogram. Recommendations of the Society of Specialists in Emergency Cardiology. MH RF, M., 2015. Available from: http://webmed.irkutsk.ru › doc › pdf › acsnstru. (In Russian).
- 2020 Clinical practice guidelines for acute ST-segment elevation myocardial infarction. Russ. J. Cardiol. 2020. 25(11). 4103. doi: 10.15829/1560-4071-2020-4103. (In Russian).
- Zègre-Hemsey J.K., Asafu-Adjei J., Fernandez A., Brice J. Characteristics of prehospital electrocardiogram use in North Carolina using a novel linkage of emergency medical services and emergency department data. Prehosp. Emerg. Care. 2019. 23(6). 772-9. doi: 10.1080/10903127.2019.1597230.
- Alomari M., Bratton H., Musmar A., Al Momani L.A., Young M. Ticagrelor-induced diarrhea in a patient with acute coronary syndrome requiring percutaneous coronary artery Intervention. Cureus. 2019. 11(1). e3874. doi: 10.7759/cureus.3874.
- Kerneis M., Nafee T., Yee M.K., Kazmi H.A., Datta S., Zeitouni M., Afzal M.K. et al. Most promising therapies interventional cardiology. Curr. Cardiol. Rep. 2019. 21(4). 26. doi: 10.1007/s11886-019-1108-x.
- Alekseeva M.A., Asymbekova E.U. Acute coronary syndrome in diabetes mellitus. Clin. Physiol. Circulation. 2018. 15(3). 162-8. doi: 10.24022/1814-6910-2018-15-3-162-168. (In Russian).
- Voudris K.V., Kavinsky C.J. Advances in management of stable coronary artery disease: the role of revascularization? Curr. Treat. Options Cardiovasc. Med. 2019. 21(3). 15. doi: 10.1007/s11936-019-0720-9.
- Pop C., Matei C., Petris A. Anticoagulation in acute coronary syndrome: review of major therapeutic advances. Am. J. Ther. 2019. 26(2). e184-e97. doi: 10.1097/MJT.0000000000000913.
- Singh A., Museedi A.S., Grossman S.A. Acute coronary syndrome. StatPearls Publishing LLC. 2020. Bookshelf ID: NBK459157PMID: 29083796.
- Wei C.H., Litwin S.E. Hyperglycemia and adverse outcomes in acute coronary syndromes: is serum glucose the provocateur or innocent bystander? Diabetes. 2014. 63(7). 2209-12. doi: 10.2337/db14-0571.
- Severino P., D’Amato A., Pucci M., Infusino F., Adamo F., Birtolo L.I., Netti L. et al. Ischemic heart disease pathophysiology paradigms overview: From plaque activation to microvascular dysfunction. Int. J. Mol. Sci. 2020. 21(21). 8118. doi: 10.3390/ijms21218118.
- Sweis R.N., Jivan A. Overview of acute coronary syndromes (ACS) 2020. Merck manual professional version. Available from: www.merckmanuals.com.
- 2020 Clinical practice guidelines for acute coronary syndrome without ST-segment elevation of the electrocardiogram. Russian Society of Cardiology with the participation: Russian Association of Cardiovascular Surgeons. M., 2020. Available from: https://scardio.ru/content/Guidelines/2020/Clinic_rekom_OKS_bST.pdf. (In Russian).
- Montalescot G., Sechtem U., Achenbach S., Andreotti F., Arden C., Budaj A., Bugiardini R. et al. 2013 ESC guidelines on the management of stable coronary artery disease: The Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur. Heart J. 2013. 34(38). 2949-3003. doi: 10.1093/eurheartj/eht296.
- Lee J.-W., Moon J.S., Kang D.R., Lee S.J., Son J.-W., Jin Youn Y.J., Ahn S.G. et al. Сlinical impact of atypical chest pain and diabetes mellitus in patients with acute myocardial infarction from prospective KAMIR-NIH registry. J. Clin. Med. 2020. 9. 505. doi: 10.3390/jcm9020505.
- Waterbury T.M., Tarantini G., Vogel B., Mehran R., Gersh B.J., Gulati R. Non-atherosclerotic causes of acute coronary syndromes. Nat. Rev. Cardiol. 2020. 17(4). 229-41. doi: 10.1038/s41569-019-0273-3.
- Luciano L.S.C., Silva R.L.D., Londero Filho O.M., Waldrich L., Panata L., Trombetta A.P., Preve J.C. et al. Analysis of the appropriate use criteria for coronary angiography in two cardiology services of Southern Brazil. Arq. Bras. Cardiol. 2019. 112(5). 526-31. doi: 10.5935/abc.20190055.
- Campanile A., Castellani C., Santucci A., Annunziata R., Tutarini C., Reccia M.R., Del Pinto M. et al. Predictors of in-hospital and long-term mortality in unselected patients admitted to a modern coronary care unit. J. Cardiovasc. Med. (Hagerstown). 2019. 20(5). 327-34. doi: 10.2459/JCM.0000000000000785.
- Chen W.W.C., Law K.K., Li S.K., Chan W.C.K., Cheong A., Fong P.C., Hung Y.T. et al. Extended dual antiplatelet therapy for Asian patients with acute coronary syndrome: expert recommendations. Intern. Med. J. 2019. 49 (Suppl 1). 5-8. doi: 10.1111/imj.14153.
- Aksoy A., Agirbasli M. Application of high-sensitivity troponin in suspected myocardial infarction. N. Engl. J. Med. 2019. 381(25). 2482-3. doi: 10.1056/NEJMc1913971.
- Stadnik S.M. Cardiac troponins in clinical practice. Emergency Med. 2020. 16(1). 45-51. doi: 10.22141/2224-0586.16.1.2020.196928. (In Ukrainian).
- Gao X., Zeng R., Liao P., Zhu H., Zhang M. Relation of N-terminal pro-brain natriuretic peptide and new-onset atrial fibrillation in patients with acute coronary syndrome: a systematic review and meta-analysis. Scand. J. Clin. Lab. Invest. 2016. 76(6). 460-4. doi: 10.1080/00365513.2016.1199048.
- Ibanez B., James S., Agewall S., Antunes M.J., Bucciarelli-Ducci C., Bueno H., Caforio A.L.P. et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: the task force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology. Eur. Heart J. 2018. 39(2). 119-77. doi: 10.1093/eurheartj/ehx637.
- Armstrong P.W., Gershlick A.H., Goldstein P., Wilcox R., Danays T., Lambert Y., Sulimov V. et al. STREAM Investigative Team. Fibrinolysis or primary PCI in ST-segment elevation myocardial infarction. N. Engl. J. Med. 2013. 368(15). 1379-87. doi: 10.1056/nejmoa1301092.
- Ahn K.T., Seong S.W., Choi U.L., Jin S.A., Kim J.H., Lee J.H., Choi S.W. et al. Korea Acute Myocardial Infarction Registry — National Institute of Health (KAMIR-NIH) Investigators. Comparison of 1-year clinical outcomes between prasugrel and ticagrelor versus clopidogrel in type 2 diabetes patients with acute myocardial infarction underwent successful percutaneous coronary intervention. Medicine (Baltimore). 2019. 98(11). e14833. doi: 10.1097/MD.0000000000014833.
- Duarte G.S., Nunes-Ferreira A., Rodrigues F.B., Pinto F.J., Ferreira J.J., Costa J., Caldeira D. Morphine in acute coronary syndrome: systematic review and meta-analysis. BMJ Open. 2019. 9(3). e025232. doi: 10.1136/bmjopen-2018-025232.
- Gilutz H., Shindel S., Shoham-Vardi I. Adherence to NSTEMI Guidelines in the emergency department: Regression to reality. Crit. Pathw. Cardiol. 2019. 18(1). 40-6. doi: 10.1097/HPC.0000000000000165.
- Klein M.D., Williams A.K., Lee C.R., Stouffer G.A. Clinical utility of CYP2C19 genotyping to Guide antiplatelet therapy in patients with an acute coronary syndrome or undergoing percutaneous coronary intervention. Arterioscler. Thromb. Vasc. Biol. 2019. 39(4). 647-52. doi: 10.1161/ATVBAHA.118.311963.
- Koval S.M., Yushko K.O., Snihurska I.O., Starchenko T.G., Pankiv V.I., Lytvynova O.M., Mysnychenko O.V. Relations of angiotensin-(1-7) with hemodynamic and cardiac structural and functional parameters in patients with hypertension and type 2 diabetes. Arterial Hypertension (Poland). 2019. 23(3). 183-189. doi: 10.5603/AH.a2019.0012.
- Kappetein A.P., Head S.J., Morice M.C., Banning A.P., Serruys P.W., Mohr F.W., Dawkins K.D. et al. SYNTAX Investigators. Treatment of complex coronary artery disease in patients with diabetes: 5-year results comparing outcomes of bypass surgery and percutaneous coronary intervention in the SYNTAX trial. Eur. J. Cardiothorac. Surg. 2013. 43(5). 1006-13. doi: 10.1093/ejcts/ezt017.
- Bonin M., Mewton N., Roubille F., Morel O., Cayla G., Angoulvant D., Elbaz M. et al. CIRCUS Study Investigators. Effect and safety of morphine use in acute anterior ST-segment elevation myocardial infarction. J. Am. Heart Assoc. 2018. 7(4). e006833. doi: 10.1161/JAHA.117.006833.
- McMurray J.J., Packer M., Desai A.S., Gong J., Lefkowitz M.P., Rizkala A.R., Rouleau L.L. et al. for the PARADIGM-HF Investigators and Committees. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N. Engl. J. Med. 2014. 371(11). 993-1004. doi: 10.1056/NEJMoa1409077.
- Shah R., Rashid A., Hwang I., Fan T.M., Khouzam R.N., Reed G.L. Meta-analysis of the relative efficacy and safety of oral P2Y12 inhibitors in patients with acute coronary syndrome. Am. J. Cardiol. 2017. 119(11). 1723-8. doi: 10.1016/j.amjcard.2017.03.011.
- Sabatine M.S., Giugliano R.P., Keech A.C., Honarpour N., Wiviott S.D., Murphy S.A., Kuder J.F. et al. FOURIER Steering Committee and Investigators. Evolocumab and clinical outcomes in patients with cardiovascular disease. N. Engl. J. Med. 2017. 376(18). 1713-22. doi: 10.1056/NEJMoa1615664.
- Han X., Zhang Y., Yin L., Zhang L., Wang Y., Zhang H., Li B. Statin in the treatment of patients with myocardial infarction: A meta-analysis. Medicine (Baltimore). 2018. 97(12). e0167. doi: 10.1097/MD.0000000000010167.
- Schwartz G.G., Steg G., Szarek M., Bhatt D.L., Bittner V.A., Diaz R., Edelberg J.M. et al., for the ODYSSEY OUTCOMES Committees and Investigators. Alirocumab and cardiovascular outcomes after acute coronary syndrome. N. Engl. J. Med. 2018. 379(22). 2097-107. doi: 10.1056/NEJMoa1801174.
- Bonaca M.P., Bhatt D.L., Steg P.G., Storey R.F., Cohen M., Im K., Oude Ophuis T. et al. Ischaemic risk and efficacy of ticagrelor in relation to time from P2Y12 inhibitor withdrawal in patients with prior myocardial infarction: Insights from PEGASUS-TIMI 54. Eur. Heart J. 2016. 37(14). 1133-42. doi: 10.1093/eurheartj/ehv531.
- Schjerning Olsen A.M., Lindhardsen J., Gislason G.H., McGettigan P., Hlatky M.A., Fosbøl E., Køber L. et al. Impact of proton pump inhibitor treatment on gastrointestinal bleeding associated with non-steroidal anti-inflammatory drug use among post-myocardial infarction patients taking antithrombotics: Nation-wide study. BMJ. 2015. 351. h5096. doi: 10.1136/bmj.h5096.
- Sehested T.S., Carlson N., Hansen P.W., Gerds T., Charlot M.G., Torp-Pedersen C., Kober L. et al. Reduced risk of gastrointestinal bleeding associated with proton pump inhibitor therapy in patients treated with dual antiplatelet therapy after myocardial infarction. Eur. Heart J. 2019. 40(24). 1963-70. doi: 10.1093/eurheartj/ehz104.
- James S., Angiolillo D.J., Cornel J.H., Erlinge D., Husted S., Kontny F., Maya J. et al. Ticagrelor vs. clopidogrel in patients with acute coronary syndromes and diabetes: A substudy from the PLATelet inhibition and patient outcomes (PLATO) trial. Eur. Heart J. 2010. 31(24). 3006-16. doi: 10.1093/eurheartj/ehq325.
- Ruda M.Ya., Averkov O.V., Panchenko E.P., Yavelov I.S. Guideline for the management of patients with non-ST-elevation acute coronary syndromes (part 2). Russ. Cardiol. Bull. 2018. 13(1). 58-62. doi: 10.17116/Cardiobulletin201813159-62. (In Russian).
- Cannon C.P., Harrington R.A., James S., Ardissino D., Becker R.C., Emanuelsson H., Husted S. et al. Comparison of ticagrelor with clopidogrel in patients with a planned invasive strategy for acute coronary syndromes (PLATO): A randomised double-blind study. Lancet. 2010. 375(9711). 283-93. doi: 10.1016/S0140-6736(09)62191-7.
- Bhatt D.L., Bonaca M.P., Bansilal S., Angiolillo D.J., Cohen M., Storey R.F., Im K. et al. Reduction in ischemic events with ticagrelor in diabetic patients with prior myocardial infarction in PEGASUS-TIMI 54. J. Am. Coll. Cardiol. 2016. 67(23). 2732-40. doi: 10.1016/j.jacc.2016.03.529.
- Serhiyenko V.A., Serhiyenko A.A. Diabetes mellitus and chronic coronary syndrome. International Journal of Endocrinology (Ukraine). 2021. 17(1). 62-74. doi: 10.22141/2224-0721.17.1.2021.226431.
- Abdur Rehman K., Wazni O.M., Barakat A.F., Saliba W.I., Shah S., Tarakji K.G., Rickard J. et al. Life-threatening complications of atrial fibrillation ablation: 16-year experience in a large prospective tertiary care cohort. JACC Clin. Electrophysiol. 2019. 5(3). 284-91. doi: org/10.1016/j.jacep.2018.11.013.
- Xia K., Wang L.F., Yang X.C., Jiang H.Y., Zhang L.J., Yao D.K., Hu D.Y. et al. Comparing the effects of depression, anxiety, and comorbidity on quality-of-life, adverse outcomes, and medical expenditure in Chinese patients with acute coronary syndrome. Chin. Med. J. (Engl). 2019. 132(9). 1045-52. doi: 10.1097/CM9.0000000000000215.

/97.jpg)
/99.jpg)
/101.jpg)
/103.jpg)
/105.jpg)