Вступ
Однією з найчастіших причин болю спини є міофасціальний больовий синдром (МФБС). Близько 84 % дорослого населення хоча б раз у житті має епізод болю в попереку, а 40–70 % — у шиї. МФБС може існувати як самостійно, так і в структурі вертеброгенного рефлекторного м’язово-тонічного синдрому [1].
Гіпертонус при МФБС — це не просто неприємно. У тригерній точці гіпертонусу змінюється обмін речовин. Нам відомо, що там відбувається накопичення біологічно активних речовин: кінінів, простагландинів, гепарину, гістаміну. Це веде до ішемії м’яза, хронічної нестачі кисню, закислення середовища, порушення мікроциркуляції в капілярах, активізації ноцицепторів та появи ще більшого больового синдрому.
Прийнято вважати, що тригерні точки містять ділянки сенсибілізованих низькопорогових ноцицепторів (вільних нервових закінчень) із дисфункціональними моторними кінцевими пластинами. Ці моторні кінцеві пластини з’єднуються з групою сенсибілізованих сенсорних нейронів, що відповідають за передачу інформації про біль від спинного до головного мозку [2].
Уражений м’яз із тригерною точкою пов’язаний із руховою дисфункцією та зазвичай містить при пальпації тугу смужку або вузликове утворення в товщі м’яза. Вважається, що ця натягнута ділянка являє собою стійку смужку спазмованого м’яза через підвищену концентрацію ацетилхоліну (ACh) в синаптичній щілині, зміну активності рецептора AСh та/або зміну активності холінестерази.
Коли біль, спричинений активною тригерною точкою, стає стійким, у пацієнта можуть розвинутися сателітні тригерні точки. Сателітна тригерна точка локалізована в реферальній зоні первинної тригерної точки (тобто в активній тригерній точці, яка спочатку була активована), зазвичай у перевантаженому синергістичному м’язі. Цей біль пацієнти часто описують як дифузний, що зазвичай віддалений від місця розташування активної тригерної точки. Це пояснюється ефектами центральної сенсибілізації (сенситизації), кожна тригерна точка має свою власну реферальну зону.
Серед м’язово-тонічних реакцій, обумовлених захворюваннями хребта, виділяють регіональні вертебральні синдроми (цервікалгія, торакалгія та люмбаго) та екстравертебральні синдроми при включенні в патологічний процес окремих м’язів та груп м’язів (брахіалгія, глюталгія, пекталгія, міофасціальний синдром тазового дна та ін.). Спазм м’язів призводить до іммобілізації ураженого сегмента, що з часом стає фактором, який підтримує біль. Найчастішими місцями локалізації м’язово-тонічних синдромів є трапецієподібний, драбинчастий, ромбоподібний, грушеподібний, середній сідничний та паравертебральні м’язи.
Ще однією цікавою клінічною характеристикою є спонтанна електрична активність (SЕА), що реєструється в ділянках міофасціальних тригерних точок за допомогою голчастої електроміографії [3]. Місце цієї електричної активності називається активним локусом. SEA складається з безперервних шумоподібних потенціалів дії в діапазоні від 5 до 50 мкВ із переривчастими викидами великої амплітуди до 600 мкВ. Цей аномальний потенціал замикальної пластинки викликаний надмірним вивільненням ацетилхоліну на замикальній пластині аксона. Величина SEA пов’язана з інтенсивністю болю в пацієнтів із міофасціальними тригерами.
Препаратами вибору при лікуванні МФБС вважають міорелаксанти. У 2020 році в Україні з’явився новий ін’єкційний центральний міорелаксант — метокарбамол (Дорсум).
Метокарбамол — це складний ефір карбамінової кислоти. Фармакологічно метокарбамол є міорелаксантом центральної дії. Ефект метокарбамолу пов’язують із загальною пригнічувальною дією на структури ЦНС. Вважають, що він впливає на структури спинного мозку, інгібуючи в такий спосіб м’язовий спазм, не впливаючи на нейром’язові синаптичні з’єднання, хоча точний механізм його дії не встановлений. Його дія проявляється полегшенням болю, зменшенням спазму м’язів та підвищенням рухливості ураженого м’яза. Полегшення больових відчуттів зумовлене змінами у сприйнятті болю. На відміну від нервово-м’язових блокаторів метокарбамол не впливає на нейронну провідність, нервово-м’язову передачу та збудливість м’язів. Метокарбамол чинить тривалу блокуючу дію на полісинаптичні рефлекторні шляхи при дозах, які істотно не змінюють передачу через моносинаптичні рефлекторні дуги, і перериває патологічні імпульси з ділянок ураження м’язів. Він не чинить прямої дії на механізм скорочення поперечно-смугастих м’язів, моторного синапса або нервового волокна.
Більш вірогідним є інгібуючий вплив метокарбамолу на полісинаптичну рефлекторну активність у спинному мозку та певною мірою і на супраспінальному рівні [4].
Метокарбамол вважають ефективним засобом при болі в попереку або шиї, фіброміалгії, головному болі напруження та міофасціальному больовому синдромі. Він характеризується сприятливим профілем безпеки при прийомі всередину або у формі ін’єкцій. Частота побічних ефектів при застосуванні метокарбамолу не є більшою, ніж при застосуванні інших часто використовуваних міорелаксантів. Метокарбамол виявився достатньо ефективним міорелаксантом із гарною переносимістю при використанні як доповнення до режиму обмеженої фізичної активності (м’язового відпочинку), фізіотерапії та інших заходів для полегшення дискомфорту, пов’язаного із гострим болем при захворюваннях опорно-рухового апарату [4].
Існують численні дослідження, присвячені ефективності та переносимості як таблетованого, так і ін’єкційного метокарбамолу.
Подвійне сліпе плацебо-контрольоване дослідження метокарбамолу було проведене Valtonen у 118 пацієнтів (по 59 пацієнтів у кожній групі) із болючим м’язовим спазмом [5]. Метокарбамол (per os по 1500 мг 4 рази/добу 7 діб) був удвічі ефективнішим за плацебо (57,6 vs 28,8 % відповідно, р < 0,01). Частота побічних ефектів метокарбамолу була порівнянна з плацебо.
У 2010–2011 роках Looke et al. провели ретроспективне дослідження 150 пацієнтів, які перенесли оперативне втручання з метою первинного протезування кульшового та колінного суглобів [6]. Цим пацієнтам вводили метокарбамол та ацетамінофен внутрішньовенно в передопераційний період. Отримані дані порівнювали з результатами контрольної групи (150 осіб), яка отримувала пероральні аналгетики, включно з пероральним оксикодоном, ацетамінофеном та прегабаліном. Порівняно з групою, яка приймала пероральні форми аналгетиків до оперативного втручання, група, у якій призначали внутрішньовенну форму метокарбамолу та ацетамінофену, показала значно нижчу потребу в післяопераційному прийомі опіоїдних аналгетиків в усі часові інтервали (середнє споживання опіатів відповідно 6,1 ± 3,0 мг та 7,5 ± 3,4 мг, р < 0,01), в цій групі були помітно кращі результати при фізіотерапії зі згинанням коліна, значно покращилася середня та максимальна тривалість прогулянки під час реабілітації, а перебування в лікарні було коротшим (3,6 ± 1,0 та 4,0 ± 1,1 дня) [6]. Це дослідження демонструє значне поліпшення післяопераційного відновлення при передопераційному застосуванні внутрішньовенного метокарбамолу.
За даними проспективного рандомізованого простого сліпого порівняльного дослідження в одному центрі, пероральний метокарбамол перевершив пероральний тіоколхікозид за ефективністю та безпекою [7]. 201 пацієнт був рандомізований для отримання протягом 7 днів метокарбамолу 500 мг перорально тричі на день (група М) або тіоколхікозиду 8 мг перорально двічі на день (група Т), обидві групи отримували парацетамол 650 мг перорально двічі на день. Інтенсивність болю, виміряна за допомогою візуальної аналогової шкали (ВАШ), показала вірогідне зменшення болю в обох групах на 3-й та 7-й день, але покращення було більшим у групі М порівняно з групою Т (р < 0,0001): на 3-й день біль зменшився на 32,2 % у групі М та на 16,6 % — у групі Т; на 7-й день біль зменшився на 57,2 % у групі М та на 33,8 % — у групі Т. Відстань від руки до підлоги та м’язовий спазм суттєво зменшились (p < 0,005 для відстані руки від підлоги, p < 0,006 для візуального та p < 0,0001 для пальпаторного визначення спазму) на 7-й день у групі M порівняно з групою T. Зокрема, на 3-й день відстань від руки до підлоги зменшилася на 37,2 % у групі М та на 17,8 % — у групі Т, а на 7-й день зменшилася на 64,9 % у групі М та на 35,2 % — у групі Т. Загальна оцінка пацієнтів показала, що 80 % хворих групи М оцінили лікування як дуже добре. Обидва способи лікування добре переносились, але група Т мала більше несприятливих наслідків, найпоширенішим із яких була діарея [7].
Було проведене ще одне клінічне дослідження щодо ефективності метокарбамолу при гострих болях у спині [8]. Це було рандомізоване плацебо-конт-рольоване багатоцентрове дослідження. Сюди входили пацієнти, які мали гострий біль у спині (тазовому/поперековому відділі) та порушення мобільності принаймні протягом 24 годин. Пацієнти отримували або метокарбамол (n = 98), або плацебо (n = 104). Лікування тривало не більше 8 днів, але його можна було припинити індивідуально, як тільки був досягнутий стійкий аналгетичний ефект. У групі метокарбамолу 44 % пацієнтів закінчили лікування передчасно, оскільки біль зник (у групі плацебо — лише 18 %), та 19 % — через відсутність ефективності (52 % — у групі плацебо; p < 0,0001). Відповідно до показників гнучкості м’язів, виміряних методом Шобера, наприкінці дослідження у групі метокарбамолу 67 % пацієнтів, згідно з самооцінкою (і лише 35 % у групі плацебо), та 70 % пацієнтів, за оцінкою лікарів (і лише 35 % у групі плацебо), вважали лікування ефективним. Серйозних побічних ефектів не виявлено [8].
У неінтервенційному когортному дослідженні, заснованому на анонімних рутинних даних німецького реєстру больових станів, була проведена ретроспективна оцінка пацієнтів із рефрактерним болем у попереку/спині, які вперше отримували лікування метокарбамолом і документували відповідь на лікування протягом принаймні 4 тижнів (n = 251) [9]. Протягом 4-тижневого періоду оцінки пацієнти відзначили клінічно значуще поліпшення: зменшення інтенсивності болю (з 53,0 ± 10,5 мм до 19,0 ± 10,0 мм за ВАШ); зменшення тимчасової непрацездатності, пов’язаної з болем, в днях (mPDI: від 42,1 ± 12,5 до 15,5 ± 10,8); поліпшення якості життя (QLIP: з 18,6 ± 6,3 до 34,0 ± 5,5), р < 0,001 порівняно з початковим рівнем. Паралельно покращувалася поперекова рухливість (тест Шобера) із 10,7 ± 0,7 см до 14,7 ± 0,7 см (р < 0,001).
Протягом 2015–2018 років у медичному центрі Монтефіоре проведене контрольоване клінічне випробування орфенадрину та метокарбамолу при болях у поперековому відділі хребта нетравматичного та нерадикулярного походження [10]. Це було рандомізоване плацебо-контрольоване перехресне дослідження, до якого увійшли 240 пацієнтів обох статей віком від 18 до 69 років, які звернулися через гострий біль у поперековому відділі хребта нетравматичного та нерадикулярного походження, що тривав більше 2 тижнів. Пацієнтів рандомізували на три групи: 1) напроксен (таблетки 500 мг) двічі на день + плацебо (доза плацебо — 1 капсула перорально двічі на день або 1 або 2 капсули перорально тричі на день; напроксен + плацебо приймали протягом 10 днів ); 2) напроксен (таблетки 500 мг) двічі на день + орфенадрин (100 мг) двічі на день протягом 10 днів; 3) напроксен (таблетки 500 мг) двічі на день + метокарбамол (750 мг) двічі на день протягом 10 днів. Основним критерієм оцінки терапевтичних ефектів був ступінь функціональних порушень, оцінений за допомогою опитувальника Роланда — Морріса (оцінки були зроблені протягом тижня). За цим критерієм оцінки метокарбамол надавав більш виражений терапевтичний ефект, ніж орфенадрин. Аналогічно група метокарбамолу мала найменшу кількість відмов продовжувати участь у дослідженні.
Таким чином, метокарбамол є ефективним терапевтичним засобом із гарною переносимістю для пацієнтів із гострим болем у нижній частині спини та супутніми руховими обмеженнями [4].
Метою даного дослідження було порівняти ефективність та переносимість ін’єкційних міорелаксантів центральної дії, що схвалені до застосування в Україні, — тіоколхікозиду та метокарбамолу при неспецифічному болі у спині з м’язово-тонічним синдромом та міофасціальному больовому синдромі спини.
Матеріали та методи
Це було багатоцентрове порівняльне дослідження, що проводилося у 3 центрах Закарпаття. До дослідження були включені пацієнти, яким чітко показаний міорелаксант, що використовується при класичному міофасціальному синдромі, та які не потребували застосування нестероїдних протизапальних препаратів (НПЗП). Ми мали два основні типи діагнозів: неспецифічний біль у спині з м’язово-тонічним синдромом та міофасціальний больовий синдром спини. За необхідності пацієнтам було виконано рентгенографічне та МРТ-дослідження хребта.
До дослідження були включені 90 пацієнтів, яких розподілили на 3 групи (2 активні групи порівняння та група контролю) по 30 пацієнтів у кожній.
У 1-й активній групі (n = 30) застосовувався ін’єкційний метокарбамол (Дорсум), 2 ампули на день внутрішньом’язово протягом 3 днів поспіль.
У 2-й активній групі (n = 30) застосовувався ін’єкційний тіоколхікозид, 2 ампули на день внутрішньом’язово протягом 3 днів поспіль.
У 3-й групі (контролю, n = 30) застосовувався нестероїдний протизапальний засіб (на вибір лікаря з урахуванням коморбідності) протягом 3 днів.
Оцінку ефективності проводили на основі:
1) оцінки больового синдрому за ВАШ до початку лікування та через 3 дні лікування;
2) оцінки показників голкової електронейроміографії (ЕНМГ) до початку лікування та через 3 дні лікування; ЕНМГ проводилася в половини пацієнтів (по 15 пацієнтів із кожної групи).
Оцінку переносимості лікування проводили тільки в активних групах (група 1 та 2) шляхом реєстрації скарг протягом 3 днів застосування метокарбамолу та тіоколхікозиду.
На момент проведення дослідження вся вибірка пацієнтів не мала серйозних супутніх захворювань. Тільки двоє пацієнтів з трьох груп (n = 90) мали легкий ступінь гіпохромної анемії.
Критеріями включення в дослідження були: чоловіки та жінки віком від 18 років; діагноз: МФБС та неспецифічний біль у спині з м’язово-тонічним синдромом; підписана інформована згода про обробку та використання особистої інформації.
Критерії виключення з дослідження: пацієнти з наявними тяжкими супутніми діагнозами; лактація та період вагітності; відмова від підписання інформованої згоди.
Для виявлення критеріїв виключення кожному пацієнту проводили загальний аналіз крові та сечі.
У кожного пацієнта був проведений контроль стану після застосування препаратів відповідно до груп розподілу.
Результати та обговорення
Оцінка результатів проводилася перед початком лікування та після 3 днів лікування у всіх трьох групах.
Оцінка динаміки болю в спині за ВАШ (рис. 1):
1) 1-ша група — ін’єкційний метокарбамол (Дор-сум), n = 30: до початку лікування — 6,13 бала, через 3 дні — 3,13 бала, поліпшення становило 48,9 %;
2) 2-га група — ін’єкційний тіоколхікозид, n = 30: до початку лікування — 6,36 бала, через 3 дні — 4,1 бала, поліпшення — 35,5 %;
3) 3-тя група (контроль) — НПЗП, n = 30: до початку лікування — 5,76 бала, через 3 дні — 4,8 бала, поліпшення — 16,7 %.
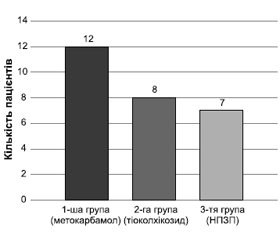
При оцінці даних ЕНМГ позитивним результатом вважалося зникнення електроміографічних ознак м’язового спазму на повторній голковій ЕНМГ через 3 дні застосування препаратів (рис. 2):
1) 1-ша група — ін’єкційний метокарбамол (Дор-сум), n = 15: нормалізація показників за голковою ЕНМГ відзначалася у 12 пацієнтів із 15, що становило 80 %;
2) 2-га група — ін’єкційний тіоколхікозид, n = 15: нормалізація показників за голковою ЕНМГ відзначалася у 8 пацієнтів із 15, що становило 53,3 %;
3) 3-тя група (контроль) — НПЗП, n = 15: нормалізація показників за голковою ЕНМГ відзначалася в 7 пацієнтів із 15, що становило 46,7 %.
У групі, що використовувала ін’єкційний метокарбамол (Дорсум), не було зареєстровано побічних дій під час лікування. У групі ін’єкційного тіоколхікозиду про побічну дію повідомили 7 пацієнтів: троє пацієнтів відмітили відчуття сонливості, двоє — відчуття нудоти, в одного з них було одноразове блювання, ще у двох — біль в епігастрії (табл. 1).
Клінічний випадок
Хворий Б., 32 років, звернувся з болями в міжлопатковій ділянці та відчуттям спазмуючого болю в лівій підлопатковій ділянці. Дані скарги пред’являє близько 3 днів, що пов’язує з надмірним фізичним навантаженням. Анамнез життя не обтяжений. Об’єктивно клінічний стан задовільний. При пальпації відмічається виражена напруженість m. latissimus dorsi зліва та його болючість. Обмеження та поява болю при приведенні, розгинанні та пронації лівого плеча. Вогнищевої неврологічної симптоматики не виявлено. Був встановлений попередній діагноз: торакалгія, МФБС m. latissimus dorsi зліва. Призначено Дорсум по 2 ампули на день. Пацієнту проведено голкову ЕНМГ у перший та четвертий дні (рис. 3, 4).
Ми бачимо, що при виконанні голкової ЕНМГ до початку лікування був виражений спазм м’яза, через 3 дні лікування відзначений його нормальний стан — відбулася стабілізація амплітуди.
Висновки
Аналізуючи ефективність застосування різних міорелаксантів та групи пацієнтів, які застосовували НПЗП, нам вдалося виявити високу клінічну ефективність ін’єкційного метокарбамолу (Дорсум) при триденному внутрішньом’язовому використанні.
Дорсум продемонстрував швидший і більш виражений антиспастичний ефект, ніж ін’єкційний тіоколхікозид. Дорсум показав гарну переносимість та на відміну від ін’єкційного тіоколхікозіду не призводив до седативного ефекту та диспептичних розладів. З огляду на отримані дані Дорсум (метокарбамол) можна вважати препаратом вибору серед ін’єкційних міорелаксантів центральної дії при неспецифічному болі у спині з м’язово-тонічним синдромом та міофасціальному больовому синдромі спини.
Отримано/Received 28.05.2021
Рецензовано/Revised 15.06.2021
Прийнято до друку/Accepted 27.06.2021
/67_2.jpg)

/66.jpg)
/67.jpg)
/67_3.jpg)