Вступ
Синдром Рея (Reye Syndrome) — це рідкісний, дуже небезпечний невідкладний стан, що виникає в дітей при дії на організм речовин, які здатні інгібувати β-окиснення жирних кислот із порушенням мітохондріального окисного фосфорилювання на фоні перебігу вірусної інфекції, та характеризується швидко прогресуючою токсичною енцефалопатією з жировою дегенерацією внутрішніх органів [9].
Уперше клінічний стан, що отримав назву синдрому Рея, був описаний австралійським патоморфологом Дугласом Рейє в 1963 році після дослідження 21 випадку захворювання в дітей, які спостерігалися в період із 1951 по 1962 рік в одній із лікарень Австралії та в яких була гостра прогресуюча енцефалопатія, що поєднувалась із жировою інфільтрацією внутрішніх органів. Даний стан розвивався в дітей із грипом типу В, які отримували саліцилати. Сімнадцять із 21 наведеного випадку захворювання закінчилися летально. Такі зміни описувались раніше, проте після публікації Д. Рейє стали загальноприйнятим синдромом [1].
Згодом був доведений зв’язок розвитку синдрому Рея з прийомом ацетилсаліцилової кислоти, що використовувалась як антипіретик у терапії гострої респіраторної вірусної інфекції (60–80 %), вітряної віспи (20–30 %), ентеро- та ротавірусної інфекції (5–15 %), у поодиноких випадках гепатиту А, вірусу імунного дефіциту людини, а також і бактеріальної інфекції: коклюшу, шигел, сальмонел, хламідій, мікоплазм тощо [4–6].
Згідно з даними Центру з контроля і профілактики захворювань, пік захворювання був зареєстрований із 1979 по 1980 рік, коли були описані 555 випадків. Дослідження, проведені в Сполучених Штатах Америки в період із 1978 по 1989 рік, показали зв’язок між синдромом Рея і прийомом аспірину під час вірусної інфекції в дітей. Зниження частоти розвитку синдрому Рея пояснюється поширенням рекомендацій Комітету з безпеки лікарських засобів з обмеження використання аспірину в дітей віком до 12 років під час перебігу вірусної інфекції [15].
Пізніше в результаті клінічних спостережень, лабораторних досліджень в поєднанні з гістологічним та електронно-мікроскопічним дослідженням біоптату внутрішніх органів, а також патоморфологічним дослідженням секційного матеріалу при проведенні автопсії летальних випадків були виявлені й інші препарати, що здатні викликати подібні клінічні симптоми синдрому Рея. Такими лікарськими засобами є антибіотики тетрациклінового ряду, зидовудин, диклофенак натрію, аміодарон, варфарин, похідні фенотіазину, димедрол, вальпроєва кислота, мефенамова кислота та багато інших медичних препаратів. Разом із лікарськими засобами як тригерні чинники синдрому можуть бути пестициди, гербіциди, гепатотоксичні гриби (афлатоксин) [7, 8].
Таким чином, прийнято виділяти класичний (аспіринасоційований, ідіопатичний) та атиповий синдром Рея (Рея-подібний синдром).
У 1990 році Центр з контролю за захворюванням в Атланті представив такі клініко-лабораторні та морфологічні критерії діагнозу синдрому Рея [14]:
І. Гостра, незапальна енцефалопатія, що підтверджується клінічно:
а) зміна свідомості;
б) спинномозкова рідина містить 8 лейкоцитів на 1 мкл.
ІІ. Гепатопатія, підтверджена:
а) біопсією печінки або автопсією з характерними для синдрому Рея даними (дрібнокраплинна жирова дистрофія гепатоцитів, масивний стеатоз, зменшення глікогенових включень у гепатоцитах, набряк та набухання мітохондрій, відсутність запальних клітинних інфільтратів), або
б) триразовим або більше підвищенням рівня аланінамінотрансферази (АлАТ), аспартатамінотрансферази (АсАТ) або аміаку в сироватці крові.
ІІІ. Якщо доступно — гістологічний зразок з ознаками дегенерації нейронів, церебральний набряк без перивентрикулярного або менінгеального запалення.
ІV. Немає інших розумних пояснень для церебральних та печінкових змін.
У подальшому було запропоновано епідеміологічне визначення синдрому Рея: дитина до 16 років із незрозумілою незапальною енцефалопатією в поєднанні з одною ознакою чи більше: триразове чи більше підвищення рівня АлАТ, АсАТ або аміаку в сироватці чи характерна жирова дистрофія печінки [16].
В основі класичного синдрому Рея лежить генералізоване пошкодження мітохондрій, насамперед мозку, що містить найбільшу кількість мітохондріальних органел із всіх органів організму людини, що й визначає тяжкість стану, а також печінки (без печінкової недостатності), нирок, міокарда та підшлункової залози (клінічно незначимої) із порушенням у них β-окиснення жирних кислот, окисного фосфорилювання та розвитком жирової дистрофії внутрішніх органів різного ступеня вираженості [3].
Основним патогенетичним механізмом пошкодження мітохондрій при класичному синдромі Рея є прийом саліцилатів на фоні вірусної інфекції.
За своїми хімічними властивостями ацетилсаліцилова кислота проявляє властивості слабкої кислоти, що, потрапляючи перорально в шлунково-кишковий тракт, у кислому середовищі шлунка практично не іонізується, що збільшує її біодоступність. На відміну від більшості лікарських засобів початковий метаболізм ацетилсаліцилової кислоти відбувається не в печінці, а в тонкому кишечнику під дією ентероцитарної гідролази з утворенням саліцилової кислоти. Всмоктування ацетилсаліцилової та саліцилової кислот через базальну мембрану ентероцитів відбувається шляхом простої дифузії, причому дифузія через біліпідний шар мембрани ентероцитів відбувається тільки для неіонізованої молекули. Через апікальну мембрану ентероцитів ацетилсаліцилова та саліцилова кислоти потряпляють у кровотік, де зв’язуються з білками плазми крові та по ворітній вені (vena portae) доставляється до гепатоцитів печінки, де відбуваються кінцева біотрансформація ацетилсаліцилової кислоти шляхом її гідролізу із залученням цитоплазматичної гідролази та кон’югація з глюкуроновою кислотою та гліцином (амінооцтова кислота) до саліцилової кислоти, саліцилфенол глюкуроніду, саліцилацил глюкуроніду, гентезинової та гентезиновосечової кислот [13].
Виводиться саліцилова кислота переважно нирками, шляхом активної секреції в канальцях нефронів у незмінній формі (близько 60–65 %) та у вигляді метаболітів. Причому виведення саліцилової кислоти залежить від рН сечі (у лужному середовищі збільшується іонізація саліцилатів, погіршується їх реабсорбція і значно підвищується елімінація із сечею) (рис. 1) [11].
В експерименті J.F. Glasgow (1999, 2001) на культурах фібробластів продемонстрована можливість продуктів розпаду ацетилсаліцилової кислоти інгібувати ферментативний процес β-окиснення довголанцюгових жирних кислот, як у клітинах пацієнтів. При цьому клітини пацієнтів із синдромом Рея більш чутливі до таких дій (пригнічення β-окиснення жирних кислот відбувається при більш низьких концентраціях саліцилатів порівняно з контрольною групою) [17].
У зв’язку з порушенням внутрішньоклітинного розпаду жирних кислот швидко зростає активність ліпази, відбувається ліполіз тригліцеридів у складі ліпопротеїдів дуже низької щільності з утворенням вільних жирних кислот, які транспортуються в клітини тканин та органів.
У нормі внутрішньоклітинна біотрансформація жирних кислот починається з їх активації в цитоплазмі за дії ферменту ацил-КоА-синтетази з формуванням ацил-КоА. Сформований комплекс включається в основний шлях перетворення жирних кислот в організмі людини — їх β-окиснення, що проходить у матриксі мітохондрій. Однак внутрішня мембрана мітохондрій непроникна для довголанцюгових ацильних похідних КоА. Тому на внутрішній мітохондріальній мембрані функціонує спеціальна транспортна система, що включає аміноспирт карнітин, який бере участь у перенесенні молекул ацил-КоА до матриксу мітохондрій, де останній включається в цикл β-окиснення жирних кислот. У результаті окиснення відщеплюється двокарбоновий фрагмент у вигляді ацетил-КоА (рис. 2) [12].
/74.jpg)
Синдром Рея супроводжується порушенням β-окиснення жирних кислот, що призводить до зниження кількості кінцевих продуктів метаболізму ліпідів — ацетил-КоА, а відповідно, і кетонових тіл, що викликає дефіцит аденозинтрифосфату (АТФ) та пригнічує глюконеогенез внаслідок зниження активності мітохондріального ферменту піруваткарбоксилази [12]. Сформована гіпоглікемія при синдромі Рея є додатковим фактором порушення роботи внутрішніх органів, особливо головного мозку.
Разом із порушенням β-окиснення жирних кислот сформовані в цитоплазмі клітин ацилкарнітинові комплекси елімінуються з організму шляхом ниркової екскреції, при цьому зменшення вмісту вільного карнітину призводить до формування порочного кола, тобто порушення транспортування молекул ацил-КоА до матриксу мітохондрій [12].
Інгібування окисного фосфорилювання та β-окиснення довголанцюгових жирних кислот супроводжується внутрішньоклітинним накопиченням у вигляді дрібновузлових жирових включень.
Ацетилсаліцилова кислота in vitro здатна відкривати циклоспоринчутливі канали, збільшувати проникність іонів Н+ для внутрішньої мембрани мітохондрій, що призводить до їх набухання, деполяризації і порушення окисного фосфорилювання, розвитку генералізованої мітохондріальної дисфункції та наступної загибелі клітин шляхом апоптозу [12].
Вторинним наслідком порушення β-окиснення жирних кислот є порушення орнітинового циклу синтезу сечовини. Розглядаються два можливі механізми порушення даного процесу:
1) блок на рівні орнітинкарбамоїлтрансферази, викликаний зменшенням або відсутністю ферментативної активності, що спостерігається при спадкових типах синдрому Рея;
2) пошкодження мембран та ферментів мітохондрій, що беруть участь у метаболізмі аміаку (у тому числі карбамоїлфосфатсинтетази І, орнітинкарбамоїлсинтетази), що характерно для набутого типу синдрому [12].
На здатність пригнічувати синтез сечовини з аміаку також впливає рівень довголанцюгових та середньоланцюгових жирних кислот та їх проміжні продукти метаболізму, які за участю простагландинів здатні інгібувати ферменти синтезу сечовини [12].
Сформована надлишкова кількість аміаку, що виділяється при посиленому розпаді амінокислот, чинить нейротоксичну дію. У клітинах головного мозку аміак здатен пригнічувати функціонування циклу трикарбонових кислот внаслідок взаємодії амоніаку з α-кетоглутаратом у реакції відновлювального амінування [12]. Гальмування циклу Кребса та зниження рівня АТФ у нервовій тканині спричиняють деполяризацію мембран нервових клітин, порушення синаптичної передачі, цитотоксичний набряк головного мозку, що клінічно проявляється енцефалопатією (нудота, багаторазове блювання, головокружіння, судоми, втрата свідомості) та в тяжких випадках розвитком коматозного стану.
Зв’язок вірусної інфекції та прийом ацетилсаліцилової кислоти в патогенезі синдрому Рея полягають у здатності вірусів, що є екзогенними пірогенами, стимулювати вироблення імунними клітинами ендогенних пірогенів, найбільш значущими з яких є IL-1, IL-6, TNF-α. При цьому було виявлено, що TNF-α безпосередньо здатен інгібувати окисне фосфорилювання, а на фоні прийому ацетилсаліцилової кислоти можливе збільшення рівня TNF-α в сироватці крові у хворих на вірусні інфекції [18].
Клінічно для синдрому Рея характерний продромальний період у вигляді гострого респіраторного захворювання або кишкової інфекції, що триває кілька днів. Через 3–7 днів стан хворого різко погіршується, починається багаторазове блювання, що не приносить полегшення, з’являються геморагічний синдром у вигляді петехіальних висипань або екхімозів на шкірі, помірна гіпертермія, гепатомегалія, зниження діурезу, ознаки наростаючого впродовж декількох днів ураження центральної нервової системи (зміна поведінки хворого, дезорієнтація, порушення свідомості, судоми, кома).
Загальноприйнятою класифікацією для визначення клінічної стадії синдрому Рея є 5-стадійна класифікація, що ґрунтується на неврологічних розладах (табл. 1).
Летальність на І стадії становить 5 %, тоді як на ІІІ — 50–60 %, а на V — 95 %.
Окремо виділяють клінічну та електроенцефалографічну стадії синдрому Рея, що наведені в табл. 2 [2].
Лабораторним підтвердженням діагнозу є підвищення рівня сироваткових АлАТ і АсАТ у 3 рази та більше порівняно з нормою, зміна показників коагулограми (збільшення протромбінового часу), гіперамоніємія при нормальному рівні білірубіну. Збільшення рівня трансаміназ відбувається паралельно зі збільшенням кількості глутаміново-піровиноградної і глутаміново-щавлево-оцтової кислот в крові. Дані зміни зазвичай такі ж сталі, як і гіперамоніємія, і значно підвищуються в перші 2–3 дні захворювання. Практично завжди має місце порушення гемостазу — відзначається помірне зниження активності сироваткових факторів згортання: І, ІІ, V, VІІ, ІХ та Х. Рівень VІІІ фактора та кількість тромбоцитів нормальні, продукти деградації фібрину відсутні. Спинномозкова рідина зазвичай нормальна, за винятком зниження рівня глюкози [10].
/77_2.jpg)
Диференціювати класичний синдром Рея потрібно від Рея-подібного синдрому в дітей зі спадковими порушеннями метаболізму, що мають подібні клінічні симптоми, однак реєструються в дітей до 5 років. Із найчастіших вроджених порушень метаболізму слід виділити хворобу Тея — Сакса (рання дитяча амавротична ідіотія), Німанна — Піка, Гоше, синдром Цельвегера (цереброгепаторенальний синдром). Разом із генетично детермінованими порушеннями ліпідного обміну слід виділити екзогенно спровокований Рея-подібний синдром при вживанні незрілих або сирих плодів акі, до складу якої входить похідний α-амінопропанової кислоти токсин — гіпогліцин, що здатен інактивувати ацил-КоА-дегідрогеназу [12].
Зважаючи на значний перехрест між двома типами синдрому Рея, пацієнти із синдромом Рея (Рея-подібним захворюванням) після одужання повинні обстежуватися в медико-генетичному центрі для виключення вроджених вад метаболізму.
На сьогодні не розроблена патогенетична терапія синдрому Рея. Медикаментозна терапія при цій нозології повинна включати комплекс заходів боротьби із набряком мозку, застосування протисудомної терапії, корекцію гіпоглікемії та гіперамоніємії, гемодинамічну підтримку, підтримку вітальних функцій.
З урахуванням фармакокінетики зменшити біодоступність ацетилсаліцилової кислоти в шлунково-кишковому тракті можна шляхом проведення промивання шлунка лужними розчинами до чистих промивних вод у перші 24 години після прийому препарату та проведення лужного пиття (збільшення рН середовища шлунково-кишкового тракту в лужну сторону збільшить кількість іонізованих молекул ацетилсаліцилової кислоти, заблокувавши її транспорт через базальну мембрану ентероцитів шляхом простої дифузії, — єдиний механізм, що можливий тільки для неіонізованої форми ацетилсаліцилової кислоти) [11].
Оскільки більша кількість метаболітів ацетилсаліцилової кислоти елімінується нирками та саліцилова кислота є слабкою, то при значеннях рН, близьких до 6,0, молекула знаходиться в неіонізованій формі. У такій формі саліцилова кислота фільтрується гломерулами і частково реабсорбується в ниркових канальцях (іонізована саліцилова кислота має меншу властивість до реабсорбції). Екскреція саліцилової кислоти збільшується в 4 рази при рН 8,0 (порівняно з рН 7,0). Це необхідно використовувати для збільшення рН сечі у хворих дітей, в яких мало місце застосування ацетилсаліцилвмісних препаратів. Таке збільшення рН досягається внутрішньовенним введенням бікарбонатів натрію, доповнюючи інфузійну терапію [11].
Наводимо власний клінічний випадок клініко-параклінічного перебігу синдрому Рея в дитини. Хворий Г., 2 роки, захворів гостро. Зі слів матері, захворювання почалося з клініки гострої респіраторної інфекції (покашлювання, загальна слабкість, підвищення температури тіла до 38,7 °С, нежить). Наприкінці першої доби від початку захворювання з’явилися блювання, ознаки дегідратації, наростали прояви інтоксикаційного синдрому. Наступного дня у зв’язку з погіршенням загального стану дитини мати звернулася в стаціонар районної лікарні. При надходженні установлений діагноз: гостра респіраторна вірусна інфекція. Ацетонемічний синдром. У динаміці під час перебування в стаціонарі стан дитини різко погіршився, до вищевказаних скарг приєдналися сонливість, прояви геморагічного синдрому у вигляді блювання «кавовою гущею» з наступною втратою свідомості. У зв’язку з раптовим погіршенням клінічного стану дитину перевели в реанімаційне відділення ОКНП «Чернівецька обласна дитяча клінічна лікарня».
При надходженні в клініку загальний стан хворого розцінювався як вкрай тяжкий, передусім внаслідок неврологічної симптоматики, проявів ДВЗ-синдрому, кардіореспіраторного дистресу. При зібранні анамнезу встановлено, що з метою зниження температури тіла дитині бабуся одноразово дала ацетилсаліцилову кислоту. При об’єктивному обстеженні в стаціонарі відзначено, що на больові подразнення хворий реагував лише слабким стогіном та слабкими рухами кінцівок. Зіниці рівномірно розширені, фотореакція млява, двосторонній мідріаз. Менінгеальні симптоми сумнівні, вогнищеві — відсутні. Відмічався гіпертонус м’язів розгиначів нижніх кінцівок. Шкірні покриви бліді, чисті. Слизова губ бліда, суха. Зів гіперемований. Кінцівки теплі на дотик. Тургор та еластичність тканин незначно знижені. Тони серця ритмічні, тахікардія, ЧСС — 150/хв.
Дихання спонтанне, прискорине, глибоке ацидотичне, ЧД — 58/хв. У видихуваному повітрі відчувався запах ацетону. Над легенями на фоні жорсткого дихання вислуховувалися великокаліберні вологі хрипи. Живіт доступний пальпації, перистальтика кишечника послаблена. По орогастральному зонду відходила помірна кількість «кавової гущі». Температура тіла — 37,5 °С. При надходженні мала місце гіпоглікемія (глюкоза сироватки крові — 2,8 ммоль/л), що скоригована інфузією 10% розчином глюкози.
Упродовж наступних днів, незважаючи на проведене лікування, стан дитини критично погіршувався через наростання неврологічної симптоматики. У зв’язку з неефективністю самостійного дихання хворого переведено на штучну вентиляцію легень. Свідомість порушена — кома ІІІ–ІV ступеня. Зіниці рівномірно розширені, фотореакція та рухи очних яблук відсутні. Загальна атонія, арефлексія. Реакція на больові подразники відсутня. Децеребральна поза. Відзначалося підсихання слизових оболонок обох очей. При огляді очного дна візуалізувалися крововиливи, більше виражені зліва, набряк сітківки, застій дисків зорових нервів.
Під час перебування хворого в стаціонарі проводився моніторинг клінічних та параклінічних досліджень, результати яких характеризували зміни в загальному аналізі сечі: кетонурія (кетонові тіла ++++), протеїнурія (білок 1,07 г/л). У біохімічному аналізі крові відмічалися: підвищення рівня АлАТ із 2,4 до 4,2 ммоль/л (N = 0,1–0,68 ммоль/л), АсАТ — із 1,9 до 2,0 ммоль/л (N = 0,1–0,45 ммоль/л) на фоні нормального рівня білірубіну — з 16,1 до 20,5 мкмоль/л (N = 8,5–20,5 мкмоль/л), гіпоглікемія — із 2,8 до 3,4 ммоль/л (N = 3,3–5,5 ммоль/л), поступове порушення азотовидільної функції нирок: наростання рівня сечовини з 6,0 до 30,0 ммоль/л (N = 3,3–8,32 ммоль/л), креатиніну — із 98,8 до 160,8 мколь/л (N = 44,0–106,0 мкмоль/л). Показники коагулограми були представлені зменшенням рівня протромбінового індексу до 63 % (N = 80–120 %).
При ультразвуковому дослідженні внутрішніх органів виявлені гепатомегалія (+1,8 см), дифузні зміни печінки, нирок.
На електрокардіограмі реєструвалися ознаки порушення реполяризації міокарда, вірогідно стенокардіальна ішемія міокарда передньо-верхньобічної стінки лівого шлуночка.
При проведенні електроенцефалографії (ЕЕГ) виявлялися грубі дифузні зміни біоелектричної активності головного мозку, стійкі ділянки відсутності біоелектричної активності головного мозку, нестійка відповідність на тактильні подразники (короткочастотні гіперактивні хвилі). У динаміці, незважаючи на проведену гемодинамічну підтримку, що включала застосування глюкозо-сольових розчинів, тривале застосування вазоактивних препаратів, лікування набряку мозку, проведення замісної терапії, біоелектрична активність головного мозку на ЕЕГ не виявлялася, реакції на подразники відсутні.
Дослідження ліквору дозволило виключити інфекцію нервової системи (цитоз 14 клітин у 3 полях зору).
З огляду на анамнез захворювання (початок на фоні гострої респіраторної інфекції, прийом ацетилсаліцилової кислоти), клінічні дані (прояви енцефалопатії, геморагічного синдрому, явища поліорганної недостатності), дані лабораторного дослідження (наростання показників цитолізу на фоні нормального рівня білірубіну, розвиток геморагічного синдрому), а також інструментальні дані (гепатомегалія, дифузні зміни печінки, нирок, набряк сітківки, застій дисків зорових нервів) встановлений діагноз: синдром Рея внаслідок реакції на випадкове застосування ацетилсаліцилової кислоти.
Незважаючи на проведення впродовж місяця комплексу заходів, що направлені на підтримку вітальних функцій, проведення антибактеріальної, глюкокортикоїдної, дегідратаційної (маніт, фуросемід), інфузійної, інотропної та замісної гемостатичної (канавіт, дицинон, трансфузія свіжозамороженої плазми), седаційної терапії, перебіг захворювання закінчився летально.
При проведенні автопсії тіла виявлені виражені патоморфологічні макроскопічні зміни внутрішніх органів зі сторони головного мозку у вигляді вогнищевих крововиливів під тверду мозкову оболонку, набряку м’якої мозкової оболонки, порушення анатомічної структурності речовини головного мозку, що представлена розпушеною, кашоподібною його консистенцією. Печінка розмірами 21,0 × 12,0 × 11,0 × 7,5 × 5,0 см, тканина на розрізах ущільнена, повнокровна, червоно-коричневого кольору з вогнищевими маслянистими, жовтого кольору включеннями. Підшлункова залоза розмірами 10,5 × 1,2 × 0,8 см, на розрізах тканина повнокровна, щільна, рожево-сірого кольору, часточковість помірно виражена.
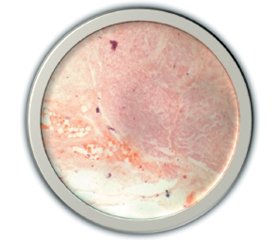
При мікроскопічному дослідженні секційного матеріалу, забарвленого гематоксилін-еозином та суданом ІІІ, патоморфологічні зміни головного мозку (рис. 3) представлені вираженими вогнищевими дистрофічними змінами нейронів кори у вигляді хроматолізу та вакуолізації цитоплазми дрібнокрапельними жировими включеннями, явищами каріопікнозу зі зморщенням і розпадом окремих клітин, проліферації мікроглії, ендотелію капілярів; подекуди у зрізах наявні вогнищеві некрози, які оточують діапедезні крововиливи; виражений набряк сполучнотканинних елементів твердої мозкової оболонки.
У міокарді (рис. 4) візуалізувалися стаз капілярів, нерівномірне кровонаповнення артерій, кардіоміоцити звичайних розмірів, ядра в них збережені, саркоплазма оксифільна, кардіоміоцити вогнищево містять дрібнокрапельні жирові включення.
У паренхімі нирки (рис. 5) відзначалися діапедезні крововиливи в кірковий та мозковий шари, клубочки різко малокровні; помірна гомогенізація інтерстицію; вогнищеві дистрофічні зміни, вогнища некрозу епітелію звивистих канальців із їх дрібнокрапельними жировими включеннями, що зливаються між собою.
Гепатоцити печінки (рис. 6) звичайних розмірів, у цитоплазмі містяться дифузні дрібнокрапельні жирові включення, ядра в них збережені; портальні тракти дещо потовщені; вогнищево інфільтровані лімфоцитами.
У підшлунковій залозі (рис. 7) периваскулярно та вогнищево перидуктально відмічаються розростання волокнистої сполучної тканини; у товщі часточок містяться дрібнокрапельні жирові включення; в одному із полів зору паренхіма інфільтрована лімфоцитами.
Підсумки: вогнищеві субдуральні крововиливи; вогнищеві дистрофічні зміни клітин речовини головного мозку; вогнищеві некрози тканини головного мозку; набряк м’якої мозкової оболонки; набряк речовини головного мозку; набряк твердої мозкової оболонки; вогнищевий некронефроз; периваскулярний, вогнищевий перидуктальний склероз підшлункової залози; дрібнокрапельна жирова дистрофія внутрішніх органів.
При проведенні токсикологічного дослідження крові та внутрішніх органів у ранньому постмортальному періоді ацетилсаліцилової кислоти, її метаболітів (саліцилової кислоти), гепато- та нефротоксичних речовин не виявлено (тому що період напіввиведення для ацетилсаліцилової кислоти становить 20 хвилин, а для саліцилової кислоти збільшується пропорційно прийнятій дозі препарату і становить 2, 4 та 20 годин для доз 0,5, 1,0 та 5,0 г відповідно) [13].
Висновок
Наданий у статті клінічний випадок наглядно відображає класичний перебіг синдрому Рея.
З огляду на відсутність мінімальної безпечної дози ацетилсаліцилової кислоти, швидке прогресування неврологічної симптоматики, відсутність чітких предикторів розвитку синдрому Рея та високий рівень летальності заборонено використання ацетилсаліцилвмісних препаратів у дітей на фоні лихоманки вірусної етіології.
Надзвичайно важливо, щоб у практичних лікарів зберігалася настороженість щодо можливого розвитку синдрому Рея в дітей при застосуванні лікарських препаратів, що містять ацетилсаліцилову кислоту, за умови появи таких симптомів, як нудота, блювання, пригнічення свідомості.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 13.05.2021
Рецензовано/Revised 26.05.2021
Прийнято до друку/Accepted 04.06.2021
/73.jpg)

/74.jpg)
/75.jpg)
/77_2.jpg)
/77.jpg)
/78.jpg)