Журнал «Боль. Суставы. Позвоночник» Том 11, №2, 2021
Вернуться к номеру
Изменения Modic в поясничном отделе позвоночника: гистология, факторы риска, клиническая картина и лечение
Авторы: Шаповалов В.С.(1), Быстрицкая М.А.(2), Дедух Н.В.(2), Балык А.И.(2)
(1) — Киевская городская клиническая больница скорой медицинской помощи, г. Киев, Украина
(2) — ГУ «Институт геронтологии имени Д.Ф. Чеботарева НАМН Украины», г. Киев, Украина
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
У статті наведені дані огляду літератури, присвяченого змінам замикаючої пластинки тіла хребця, описаним M.T. Modic (МСs), які з високою частотою визначаються в поперековому відділі хребта у пацієнтів із хронічним болем у спині. Етіологія МСs невідома, найбільш імовірними сьогодні вважають три причини: механічну, інфекційну та біохімічну, загальним механізмом для всіх є міграція прозапальних молекул із дегенеративно зміненого диска. Був виявлений і описаний тісний зв’язок між МСs і неспецифічним хронічним болем у спині. За дегенерації диску підвищене навантаження на замикальні пластинки може привести до мікротріщин у них, через які медіатори запалення надходять у кістковий мозок і провокують MCs. Протоколів лікування МСs із позиції доказової медицини не існує. Певні успіхи отримані при використанні антибіотикотерапії, ін’єкцій стероїдів і антирезорбентів, досліджується ефективність анти-TNF-α терапії. Наявні поодинокі дані літератури свідчать, що пацієнтам із МСs і хронічним болем у спині, нестабільністю, які не відповідають на консервативне лікування, може бути показано хірургічне лікування для зняття болю й покращення якості життя. Однак не всі з представлених методів хірургічного лікування пацієнтів із хронічним болем у спині ефективні в осіб зі змінами Modic. Розбіжності в результатах лікування пацієнтів, наведені в різних джерелах, свідчать про необхідність подальших досліджень задля розуміння патогенезу МСs і розроблення патогенетичних підходів до лікування цієї патології.
В статье представлены данные обзора литературы, посвященного изменениям замыкательной пластинки тела позвонка, описанным Modic (МСs), которые с высокой частотой определяются в поясничном отделе позвоночника у пациентов с хронической болью в спине. Этиология МСs неизвестна, наиболее вероятными сегодня считаются три причины: механическая, инфекционная и биохимическая, общим механизмом для всех является миграция провоспалительных молекул из дегенеративно измененного диска. Была выявлена и описана тесная связь между МСs и неспецифической хронической болью в спине. При дегенерации диска повышенное напряжение на замыкательные пластинки может привести к их микротрещинам, через которые медиаторы воспаления поступают в костный мозг и провоцируют MCs. Протоколов лечения МСs с позиции доказательной медицины не существует. Определенные успехи получены при использовании антибиотикотерапии, инъекций стероидов и антирезорбентов, исследуется эффективность анти-TNF-α терапии. Имеющиеся единичные данные литературы свидетельствуют, что пациентам с МСs и хронической болью в спине, нестабильностью, не отвечающим на консервативное лечение, может быть показано хирургическое лечение для купирования боли и повышения качества жизни. Однако не все из представленных методов хирургического лечения пациентов с хронической болью в спине эффективны у лиц с изменениями Modic. Расхождения в результатах лечения пациентов, представленные в различных источниках, свидетельствуют о необходимости дальнейших исследований для понимания патогенеза МСs и разработки патогенетических подходов к лечению этой патологии.
The article presents a literature review on the Modic changes (MCs) in the vertebral endplates, which are frequently detected in patients with chronic low back pain. The etiology of MCs is unknown; however, there are three causes which are considered the most probable today: mechanical, infectious and biochemical. They share a common mechanism of pro-inflammatory molecule migration from the degenerative disk. A close association has been identified and described between the MCs and a non-specific chronic low back pain. Disc degeneration exerts a further stress on the endplates and produces microcracks, through which the inflammatory mediators enter the bone marrow and provoke the MCs. At present, there are no evidence-based treatment protocols for the MCs. A certain progress has been made with antibiotic therapy, injections of steroids and antiresorbents; the effectiveness of anti-TNF-α therapy is being explored. The sporadic reference data on our disposal indicate that patients with MCs and chronic low back pain, along with instability, who do not respond to a conservative treatment, may be referred for the surgical treatment to relieve pain and improve quality of life. However, not all of the presented methods of surgical treatment with chronic back pain are effective in patients with the Modic changes. The divergence of patient treatment outcomes presented by various sources indicates the need for a further research to understand the MC pathogenesis and develop pathogenetic approaches to the treatment of this pathology.
біль у спині; зміни Modic; міжхребцевий диск; замикальна пластинка тіла хребця
боль в спине; изменения Modic; межпозвонковый диск; замыкательная пластинка тела позвонка
back pain; Modic changes; intervertebral disc; vertebral endplate
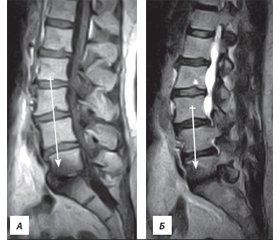
Интерпретация изменений Modic по данным МРТ
/46.jpg)
Гистологические нарушения
Факторы риска возникновения изменений Modic
Клинические проявления изменений Modic
Диагностика
Лечение
Выводы
- Shmagel A., Foley R., Ibrahim H. Epidemiology of chronic low back pain in US adults: data from the 2009–2010 National health and nutrition examination survey. Arthritis care&research, 2016. 68 (11). 1688-1694. doi: 10.1002/acr.22890.
- Oliveira C.B., Maher C.G., Pinto R.Z. et al. Clinical practice guidelines for the management of non-specific low back pain in primary care: an updated overview. Eur. Spine J. 2018. 27. 2791-2803.
- Will J.S., Bury D.C., Miller J. A. Mechanical low back pain. Am. Fam. Physician. 2018. 98 (7). 421-428. PMID: 30252425.
- Barrey C.Y., Le Huec J.C. French society for spine surgery. Chronic low back pain: relevance of a new classification based on the injury pattern. Orthop. Traumatol. Surg Res. 2019. 105 (2). 339-346. doi: 10.1016/j.otsr.2018.11.021
- Allegri M., Montella S., Salici F. et al. Mechanisms of low back pain: a guide for diagnosis and therapy. F1000Research. 2016. 5. Faculty Rev-1530. doi: 10.12688/f1000research.8105.2.
- Berry J.A., Elia C., Saini H.S., Miulli D.E. A review of lumbar radiculopathy, diagnosis, and treatment. Cureus. 2019. 11 (10). e5934. doi: 10.7759/cureus.5934.
- Perolat R., Kastler A., Nicot B. et al. Facet joint syndrome: from diagnosis to interventional management. Insights into imaging. 2018. 9 (5). 773-789. doi: 10.1007/s13244-018-0638-x.
- Deer T., Sayed D., Michels J., Josephson Y., Li S., Calodney A.K. A review of lumbar spinal stenosis with intermittent neurogenic claudication: disease and diagnosis. Pain Med. 2019. 1 (20). Suppl 2. 32-44. doi: 10.1093/pm/pnz161.
- Dowdell J., Erwin M., Choma T., Vaccaro A., Iatridis J., Cho S.K. Intervertebral disk degeneration and repair. Neurosurgery. 2017. 80. 46-54.
- Modic M.T., Steinberg P.M., Ross J.S., Masaryk T.J., Carter J.R. Degenerative disk disease: assessment of changes in vertebral body marrow with MR imaging. Radiology. 1988. 166. 193-199.
- Kuisma M., Karppinen J., Haapea M., Lammentausta E., Niinimäki J., Tervonen O. Modic changes in vertebral endplates: a comparison of MR imaging and multislice CT. Skeletal Radiol. 2009. 38. 141-147. doi: 10.1007/s00256-008-0590-9.
- Jensen R.K., Leboeuf-Yde C. Is the presence of Modic changes associated with the outcomes of different treatments? A systematic critical review. BMC Musculoskelet. Disord. 2011. 12. 183. doi: 10.1186/1471-2474-12-183.
- Fields A.J., Liebenberg E.C., Lotz J.C. Innervation of pathologies in the lumbar vertebral endplate and intervertebral disc. Spine J. 2014. 14 (3). 513-521. doi: 10.1016/j.spinee.2013.06.075.
- Perilli E., Parkinson I.H., Truong L.H. et al. Modic (endplate) changes in the lumbar spine: bone micro-architecture and remodelling. Eur. Spine J. 2015. 24 (9). 1926-34. doi: 10.1007/s00586-014-3455-z.
- Torkki M., Majuri M.L., Wolff H. et al. Osteoclast activators are elevated in intervertebral disks with Modic changes among patients operated for herniated nucleus pulposus. Eur. Spine J. 2016. 25 (1). 207-216. doi: 10.1007/s00586-015-3897-y.
- Splendiani A., Bruno F., Marsecano C. et al. Modic I changes size increase from supine to standing MRI correlates with increase in pain intensity in standing position: uncovering the “biomechanical stress” and “active discopathy” theories in low back pain. Eur. Spine J. 2019. 28 (5). 983. doi: 10.1007/s00586-019-05974-7.
- Dudli S., Fields A.J, Samartzis D., Karppinen J., Lotz J.C. Pathobiology of Modic changes. Eur. Spine J. 2016. 25 (11). 3723-3734. doi: 10.1007/s00586-016-4459-7
- Crockett M.T., Kelly B.S., van Baarsel S., Kavanagh E.C. Modic type 1 vertebral endplate changes: injury, inflammation, or infection? Am. J. Roentgenol. 2017. 209 (1). 167-170. doi: 10.2214/AJR.16.17403.
- Marjoram T. The endplate and trabecular bone in lumbar degenerative disc disease: a narrative review. SN Comprehensive Clinical Medicine. 2020. 2. 332-337. doi: 10.1007/s42399-020-00234-y.
- Portella S.T., Acioly M.A. The course of Modic vertebral body changes after posterolateral lumbar fusion on fused and adjacent levels: A systematic review of the literature. J. Clin. Neurosci. 2017. 41. 6-10. doi: 10.1016/j.jocn.2017.04.007.
- Kerttula L., Luoma K., Vehmas T., Grönblad M., Kääpä E. Modic type I change may predict rapid progressive, deforming disc degeneration: A prospective 1-year follow-up study. Eur. Spine J. 2012. 21. 1135-1142.
- Eser O., Gomleksiz C., Sasani M. et al. Dynamic stabilisation in the treatment of degenerative disc disease with modic changes. Adv. Orthop. 2013. 2013. 806267. doi: 10.1155/2013/806267.
- Farshad-Amacker N.A., Hughes A., Herzog R.J. Seifert B., Farshad M. The intervertebral disc, the endplates and the vertebral bone marrow as a unit in the process of degeneration. Eur. Radiol. 2017. 27. 2507-2520. doi: 10.1007/s00330-016-4584-z.
- Johnson Z.I., Schoepflin Z.R., Choi H., Shapiro I.M., Risbud M.V. Disc in flames: roles of TNF-α and IL-1β in intervertebral disc degeneration. Eur. Cell Mater. 2015. 21. 30. 104-117. doi: 10.22203/ecm.v030a08.
- Altun I. Cytokine profile in degenerated painful intervertebral disc: variability with respect to duration of symptoms and type of disease. Spine J. 2016. 16 (7). 857-861. doi: 10.1016/j.spinee.2016.03.019.
- Nguyen C., Jousse M., Poiraudeau S., Feydy A., Rannou F. Intervertebral disc and vertebral endplate subchondral changes associated with Modic I changes of the lumbar spine: a cross-sectional study. BMC Musculoskelet. Disord. 2017. 23. 18 (1). 34. doi: 10.1186/s12891-017-1407-6.
- Rade M., Määttä J.H., Freidin M.B., Airaksinen O., Karppinen J., Williams F.M.K. Vertebral endplate defect as initiating factor in intervertebral disc degeneration: strong association between endplate defect and disc degeneration in the general population. Spine (Phila Pa 1976). 2018. 15. 43 (6). 412-419. doi: 10.1097/BRS.0000000000002352.
- Albert H.B., Lambert P., Rollason J. et al. Does nuclear tissue infected with bacteria following disc herniations lead to Modic changes in the adjacent vertebrae? Eur. Spine J. 2013. 22 (4). 690-696. doi: 10.1007/s00586-013-2674-z.
- Fritzell P., Welinder-Olsson C., Jönsson B. et al. Bacteria: back pain, leg pain and Modic sign — a surgical multicentre comparative study. Eur. Spine J. 2019. 28 (12). 2981-2989. doi: 10.1007/s00586-019-06164-1.
- Georgy M., Stern M., Murphy K. What Is the role of the bacterium propionibacterium acnes in type 1 modic changes? A review of the literature. Canadian Association of Radiologists Journal. 2017. 68 (4). 419-424. doi: 10.1016/j.carj.2017.07.004.
- Lin Y., Jiao Y., Yuan Y. et al. Propionibacterium acnes induces intervertebral disc degeneration by promoting nucleus pulposus cell apoptosis via the TLR2/JNK/mitochondrial-mediated pathway. Emerging microbes & infections. 2018. 7 (1). 1. https://doi.org/10.1038/s41426-017-0002-0.
- Perry A., Lambert P. Propionibacterium acnes: infection beyond the skin. Expert Rev. Anti Infect. Ther. 2011. 9. 1149-1156.
- Chen Z., Cao P., Zhou Z., Yuan Y., Jiao Y. Overview: the role of Propionibacterium acnes in nonpyogenic intervertebral discs. Int. Orthop. 2016. 40. 1291-1298.
- Dudli S., Liebenberg E., Magnitsky S., Miller S., Demir-Deviren S., Lotz J.C. Propionibacterium acnes infected intervertebral discs cause vertebral bone marrow lesions consistent with Modic changes. J. Orthop. Res. 2016. 34 (8). 1447-55. doi: 10.1002/jor.23265.
- Chen Z., Zheng Y., Yuan Y., Jiao Y., Xiao J., Zhou Z., Cao P. Modic changes and disc degeneration caused by inoculation of Propionibacterium acnes inside intervertebral discs of rabbits: a pilot study. BioMed. Res. Int. 2016. 9612437. doi: 10.1155/2016/9612437.
- Rigal J., Thelen T., Byrne F. et al. Prospective study using anterior approach did not show association between Modic I changes and low grade infection in lumbar spine. Eur. Spine J. 2016. 25. 1000-1005. doi: 10.1007/s00586-016-4396-5.
- Urquhart D.M., Zheng Y., Cheng A.C. et al. Could low grade bacterial infection contribute to low back pain? A systematic review. BMC Med. 2015. 22 (13). 13. doi: 10.1186/s12916-015-0267-x.
- Gilligan C.J., Cohen S.P., Fischetti V.A., Hirsch J.A., Czaplewski L.G. Chronic low back pain, bacterial infection and treatment with antibiotics. Spine J. 2021. 19. 1529-9430 (21)00084-X. doi: 10.1016/j.spinee.2021.02.013.
- Mok F.P., Samartzis D., Karppinen J., Fong D.Y., Luk K.D., Cheung K.M. Modic changes of the lumbar spine: prevalence, risk factors, and association with disc degeneration and low back pain in a large-scale population-based cohort. Spine. 2016. 6 (1). 32-41. doi: 10.1016/j.spinee.2015.09.060.
- Viswanathan V.K., Shetty A.P., Rajasekaran S. Modic changes — an evidence-based, narrative review on its patho-physiology, clinical significance and role in chronic low back pain. J. Clin. Orthop. Trauma. 2020. 11 (5). 761-769. doi: 10.1016/j.jcot.2020.06.025.
- Kanna R.M., Shanmuganathan R., Rajagopalan V.R. et al. Prevalence, patterns, and genetic association analysis of Modic vertebral endplate changes. Asian Spine J. 2017. 11 (4). 594-600. doi: 10.4184/asj.2017.11.4.594.
- Karppinen J., Daavittila I., Solovieva S. et al. Genetic factors are associated with modic changes in endplates of lumbar vertebral bodies. Spine (Phila Pa 1976). 2008. 15. 33 (11). 1236-1241. doi: 10.1097/BRS.0b013e318170fd0e.
- Jensen T.S., Karppinen J., Sorensen J.S. et al. Vertebral endplate signal changes (Modic change): a systematic literature review of prevalence and association with non-specific low back pain. Eur. Spine J. 2008. 17. 1407-1422. doi: 10.1007/s00586-008-0770-2.
- Jensen O.K., Nielsen C.V., Sørensen J.S., Stengaard-Pedersen K. Type 1 Modic changes was a significant risk factor for 1-year outcome in sick-listed low back pain patients: a nested cohort study using magnetic resonance imaging of the lumbar spine. Spine J. 2014. 1. 14 (11). 2568-81. doi: 10.1016/j.spinee.2014.02.018.
- Bailly F., Maigne J.Y., Genevay S. et al. Inflammatory pain pattern and pain with lumbar extension associated with Modic I changes on MRI: a prospective case-control study of 120 patients. Eur. Spine J. 2014. 23. 493-497.
- Määttä J.H., Karppinen J., Paananen M. et al. Refined phenotyping of Modic changes: imaging biomarkers of prolonged severe low back pain and disability. Medicine (Baltimore). 2016. 95 (22). e3495. doi: 10.1097/MD.0000000000003495.
- Boisson M., Lefèvre-Colau M.M., Rannou F., Nguyen C. Active discopathy: a clinical reality. RMD Open. 2018. 4 (1). e000660. doi: 10.1136/rmdopen-2018-000660.
- Kääpä E., Luoma K., Pitkäniemi J., Kerttula L., Grönblad M. Correlation of size and type of Modic type 1 and 2 lesion with clinical symptoms — a descriptive study in a subgroup of chronic low back pain patients based on a university hospital patient sample. Spine (Phila Pa 1976). 2012. 37. 134-139.
- Järvinen J., Niinimäki J., Haapea M., Grönblad M., Luoma K., Rinne E. Association between changes in lumbar Modic changes and low back symptoms over a two-year period. BMC Musculoskeletal Disorders. 2015. 16. 98. doi: 10.1186/s12891-015-0540-3.
- Rannou F., Ouanes W., Boutron I. et al. High-sensitivity C-reactive protein in chronic low back pain with vertebral end-plate Modic signal changes. Arthritis Rheum. 2007. 15. 57 (7). 1311-5. doi: 10.1002/art.22985.
- Boisson M., Borderie D., Henrotin Y., Teboul-Coré S., Lefèvre-Colau M.M., Rannou F., Nguyen C. Serum biomarkers in people with chronic low back pain and Modic I changes: a case-control study. Sci. Rep. 2019. 10. 9 (1). 10005. doi: 10.1038/s41598-019-46508-x.
- Karppinen J., Koivisto K., Ketola J. et al. Serum biomarkers for Modic changes in patients with chronic low back pain. Eur. Spine J. 2021. Jan 9. doi: 10.1007/s00586-020-06713-z.
- Dudli S., Sing D.C., Hu S.S. еt al. ISSLS Prize in basic science 2017: Intervertebral disc/bone marrow cross-talk with Modic changes. Eur. Spine J. 2017. 26 (5). 1362-1373. doi: 10.1007/s00586-017-4955-4.
- Albert H.B., Sorensen J.S., Christensen B.S., Manniche C. Antibiotic treatment in patients with chronic low back pain and vertebral bone edema (Modic type 1 changes): a double-blind randomized clinical controlled trial of efficacy. Eur. Spine J. 2013. 22 (4). 697-707. doi: 10.1007/s00586-013-2675-y.
- Braten L.C.H., Rolfsen M.P., Espeland A. et al. Efficacy of antibiotic treatment in patients with chronic low back pain and Modic changes (the AIM study): double blind, randomised, placebo controlled, multicentre trial. BMJ. 2019. 367. l5654. doi: 10.1136/bmj.l5654.
- Al-Falahi M.A., Salal M.H., Abdul-Wahab D.M. et al. Antibiotic Treatment in Patients with Chronic Low Back Pain and Vertebral Bone Edema (Modic Type I Changes): A Randomized Clinical Controlled Trial of Efficacy. Iraqi Postgraduate Medical Journal. 2014. 13 (3). 390-397.
- Manniche C., Morsø L., Kiertzner L. Vertebral endplate changes / Modic changes: an audit study using antibiotics in 147 chronic low back pain patients. Global Spine Journal. 2016. 6 (1). 0036-1582898-s-0036-1582898. doi: 10.1055/s-0036-1582898.
- Fritzell P., Bergström T., Jönsson B. et al. Antibiotics should not be used for back/leg pain. Acta Orthop. 2021. 92 (1). 1-3. doi: 10.1080/17453674.2020.1855561.
- Ohrt-Nissen S., Fritz B.G., Walbom J. et al. Bacterial biofilms: a possible mechanism for chronic infection in patients with lumbar disc herniation — a prospective proof-of-concept study using fluorescence in situ hybridization. Apmis. 2018. 126 (5). 440-447.
- Cai G., Laslett L.L., Aitken D., Halliday A. et al. Effect of zoledronic acid and denosumab in patients with low back pain and Modic change: a proof-of-principle trial. Journal of Bone and Mineral Research. 2018. 33 (5). 773-782. doi: 10.1002/jbmr.3376.
- Koivisto K., Karppinen J., Haapea M. et al. The effect of zoledronic acid on serum biomarkers among patients with chronic low back pain and Modic changes in lumbar magnetic resonance imaging. Diagnostics. 2019. 9 (4). 212. doi: 10.3390/diagnostics9040212.
- Korhonen T., Karppinen J., Paimela L. et al. The treatment of disc-herniation-induced sciatica with infliximab: one-year follow-up results of FIRST II, a randomized controlled trial. Spine (Phila Pa 1976). 2006. 31 (24). 2759-2766. doi: 10.1097/01.brs.0000245873.23876.1e.
- Gjefsen E., Bråten L.C.H., Goll G.L. et al. The effect of infliximab in patients with chronic low back pain and Modic changes (the BackToBasic study): study protocol of a randomized, double blind, placebo-controlled, multicenter trial. BMC Musculoskelet. Disord. 2020. 21 (1). 698. doi: 10.1186/s12891-020-03720-5.
- Nguyen C., Boutron I., Baron G. et al. Intradiscal glucocorticoid injection for patients with chronic low back pain associated with active discopathy: a randomized trial. Ann. Intern. Med. 2017. 18. 166 (8). 547-556. doi: 10.7326/M16-1700.
- Fayad F., Lefevre-Colau M.M., Rannou F. et al. Relation of inflammatory modic changes to intradiscal steroid injection outcome in chronic low back pain. Eur. Spine J. 2007. 16 (7). 925-931. doi: 10.1007/s00586-006-0301-y.
- Muzin S., Zacharia I., Walker J. The role of intradiscal steroids in the treatment of discogenic low back pain. Current Reviews in Musculoskeletal Medicine. 2007. 1 (2). 103-107. doi: 10.1007/s12178-007-9015-y.
- Nguyen C., Benichou M., Revel M., Poiraudeau S., Rannou F. Association of accelerated switch from vertebral end-plate Modic I to Modic 0 signal changes with clinical benefit of intradiscal corticosteroid injection for chronic low back pain. Arthritis & Rheumatism. 2011. 63 (9). 2828-2831. doi: 10.1002/art.30443.
- Mayahi R., Khot A., Sharp D.J., Powell J. Can modic changes on MRI predict clinical response to steroids in discogenic low back pain? J. Bone Joint Surg. (Br). 2005. 87-B (Suppl. 3). 233.
- Cao P., Jiang L., Zhuang C., Yang Y., Zhang Z., Chen W., Zheng T. Intradiscal injection therapy for degenerative chronic discogenic low back pain with end plate Modic changes. Spine J. 2011. 11 (2). 100-6. doi: 10.1016/j.spinee.2010.07.001.
- Bora S., Hari Krishnan S.V. Epidural steroid reduces discogenic pain in acute flare up of degenerative disc disease with Modic changes than conservative management. J. Evid. Based Med. Healthc. 2018. 5 (10). 913-917. doi: 10.18410/jebmh/2018/186.
- Kim H.S., Adsul N., Yudoyono F. et al. Transforaminal epiduroscopic basivertebral nerve laser ablation for chronic low back pain associated with Modic changes: a preliminary open-label study. Pain Res. Manag. 2018. 14. 2018. 6857983. doi: 10.1155/2018/6857983.
- Khalil J.G., Smuck M., Koreckij T. et al. A prospective, randomized, multicenter study of intraosseous basivertebral nerve ablation for the treatment of chronic low back pain. Spine J. 2019. 19 (10). 1620-1632. doi: 10.1016/j.spinee.2019.05.598.
- Laustsen A.F., Bech-Azeddine R. Do Modic changes have an impact on clinical outcome in lumbar spine surgery? A systematic literature review. Eur. Spine J. 2016. 25 (11). 3735-3745. doi: 10.1007/s00586-016-4609-y.
- Bostelmann R., Petridis A., Fischer K. et al. New insights into the natural course and clinical relevance of Modic changes over 2 years following lumbar limited discectomy: analysis of prospective collected data. Eur. Spine J. 2019. 28. 2551-2561. doi: 10.1007/s00586-019-05988-1.
- Ghodsi S.M., Rouhani R., Abdollahzade S., Khadivi M., Faghih Jouibari M. Frequency of vertebral endplate modic changes in patients with unstable lumbar spine and its effect on surgical outcome. Asian Spine J. 2015. 9. 737-740.
- Shahmohammadi M.R., Behrouzian S. Effect of preoperative Modic change in the outcome of patients with low back pain following posterior spinal fusion or laminectomy. Asian journal of neurosurgery. 2019. 14 (2). 432-435. doi: 10.4103/ajns.AJNS_41_18.
- Masala S., Anselmetti G.C., Marcia S. et al. Treatment of painful Modic type I changes by vertebral augmentation with bioactive resorbable bone cement. Neuroradiology. 2014. 56 (8). 637-45. doi: 10.1007/s00234-014-1372-9.
- Kavanagh L., Byrne C., Kavanagh E., Eustace S. Vertebroplasty in the treatment of recalcitrant lower back pain attributed to Modic I changes. BJR Case Rep. 2018. 4. 20170092. doi: 10.1259/bjrcr.20170092.
- Airaksinen O., Brox J.I., Cedraschi C. et al. European guidelines for the management of chronic nonspecific low back pain. Eur. Spine J. 2006. 15. 2. 192-300. doi: 10.1007/s00586-006-1072-1.

/45.jpg)