Вступ
Хронічний біль становить серйозну проблему для багатьох країн світу, спричинюючи страждання як окремого пацієнта, так і його сім’ї, оточення й суспільства в цілому [1, 2]. Згідно з даними літератури, поширеність хронічного болю досить велика й, за різними оцінками, варіює від 20 до 40 % у загальній популяції [3–5]. Хронічний запальний (ноцицептивний) біль зазвичай спричинюється травмою або пошкодженням тканини, тоді як хронічний нейропатичний біль викликаний пошкодженням соматосенсорної нервової системи [6–8]. Важливо відзначити, що при хронічному болі переважно запального/автоімунного генезу (наприклад, при ревматоїдному артриті) може мати місце нейропатичний компонент болю [9, 10]. У свою чергу, переважно в нижніх кінцівках біль може також супроводжуватися активацією імунних клітин і запальними реакціями [10, 11].
Лікування хронічного болю є складним завданням. Зараз у клінічній практиці застосовуються такі класи знеболювальних препаратів: нестероїдні протизапальні препарати, антиконвульсанти, антидепресанти, місцеві анестетики, прості аналгетики, опіоїди. Незважаючи на досить широкий спектр класів препаратів, рідко вдається досягти повного усунення хронічного болю, а в частини пацієнтів під час терапії відзначаються побічні ефекти, через які доводиться коригувати схему лікування [12]. Пошук і розробка ефективних і безпечних методів терапії хронічного болю є вкрай актуальним завданням для сучасної медичної та фармацевтичної науки.
Оскільки передача больових імпульсів відбувається по нейронах, механізм дії більшості доступних сьогодні на ринку препаратів націлений саме на них [13]. Однак у разі хронічного болю нейрони соматосенсорної системи не є єдиними учасниками процесу. Велика кількість літературних даних свідчить про важливість запальних процесів (нейрозапалення) і гліальних клітин, які беруть у цьому участь [14, 15]. Нейрозапалення характеризується інфільтрацією ураженої тканини імунними клітинами, активацією здорових та гліальних клітин і підвищенням вироблення прозапальних медіаторів, які відіграють важливу роль у підтримці процесів хронічного болю на рівні периферичної та центральної нервової системи [16–18]. Стан хронічного нейрозапалення може довго підтримуватися за рахунок дисбалансу між про- та протизапальними медіаторами [19–21].
Механізми хронізації болю
Виходячи з визначення нейропатичного болю, прийнято вважати, що його виникненню повинна передувати травма нерва. Однак пошкодження нерва не завжди призводить до нейропатичного болю [22, 23]. Одним із можливих механізмів хронізації болю є запалення в певній ділянці периферичної або центральної нервової системи, що спостерігається вже після відновлення структури в місці первинного ушкодження нерва [24, 25]. Це нейрозапалення призводить до виникнення гліальної дисфункції, яка ще більше посилює й підтримує запальні реакції. До інших механізмів, які сприяють хронізації болю, відносяться тривала потенціація, периферична і центральна сенситизація, патологічна нейропластичність, ектопічна нейрональна активність і дизінгібіція. У рамках цієї статті ці механізми детально розглядатися не будуть.
Мікроглія й тучні клітини
Тучні клітини (ТК) уперше були описані в 1878 році лауреатом Нобелівської премії Паулем Ерліхом, який охарактеризував гістохімічні властивості й характерні морфологічні фенотипи цих клітин [26]. ТК у людей беруть свій початок із клітин кісткового мозку, а саме із CD34+/CD117+ плюрипотентних клітин-попередників [27]. ТК циркулюють у кровоносному руслі як клітини-прекурсори й завершують свою диференціацію в тих тканинах, де вони будуть функціонувати. Добре вивчена роль ТК у процесах алергічних і запальних реакцій, пов’язаних з імуноглобуліном типу Е [28, 29].
Пошкодження периферичної нервової системи призводить до виникнення слабо виражених запальних процесів. Виділяються такі прозапальні медіатори, як оксид азоту, брадикінін і простагландин. Під їх дією ендотелій кровоносних судин у місці пошкодження стає більш проникним, лейкоцити мігрують у пошкоджену тканину [30].
У центральній нервовій системі (ЦНС) ці процеси призводять до порушення функції гематоенцефалічного бар’єра й збільшення його проникності. Це стає причиною міграції лейкоцитів із кров’яного русла в оточуючу тканину, де вони трансформуються в клітини мікроглії [31–34]. Активована мікроглія продукує ще більше прозапальних цитокінів, таких як інтерлейкін-1 і фактор некрозу пухлини. У свою чергу, інтерлейкін-1 активує астроцити, які продукують ще більше інтерлейкіну-1, створюючи замкнуте коло патологічних реакцій [35–37]. Ці зміни пов’язані з утворенням нових синаптичних зв’язків, які підтримують передачу больових імпульсів і сприяють перебудові існуючих нейрональних зв’язків [38–40].
Мікроглія й астроцити
Клітини мікроглії й астроцити (представники макроглії) є нейрональними за своєю природою, проте не мають властивості збудження під дією нервових імпульсів [21, 41, 42]. Навпаки, вони оточують і взаємодіють із нейронами і відіграють важливу роль у їх модуляції й підтримці запальних процесів у нервовій тканині, що призводить до підвищення збудливості нейронів, посилення й пролонгації передачі больової імпульсації [43, 44].
У кількісному вираженні клітини мікроглії й астроцити представлені найбільше і становлять 70 % усіх клітин нервової системи [45]. Клітини мікроглії запускають процеси нейрозапалення в ЦНС. Було показано, що вже через 2 доби після пошкодження периферичного нерва відзначається виражена проліферація клітин мікроглії в спинному мозку [46]. Таким чином, можна сказати, що мікроглія відіграє роль «спускового гачка» процесів нейрозапалення, які потім ще більше розвиваються й підтримуються астроцитами [24].
Астроцити є найбільш представленими в кількісному вираженні клітинами в ЦНС і значимо впливають на нейрональну активність. Астроцити мають зірчасту форму з довгими тонкими відростками й займають у ЦНС стратегічне положення між судинами й нейронами, таким чином впливаючи на нейрональну активність і вироблення нейротрансмітерів [43]. Астроцити мають на своїй поверхні рецептори й можуть виробляти велику кількість прозапальних речовин. Усього один астроцит своїми численними відростками може контактувати зі 100 000 синапсів [47, 48]. Даний факт обумовлює колосальний вплив астроцитів на синаптичну активність.
Одним із механізмів впливу астроцитів на синаптичну активність є Ca2+, який міститься всередині клітин. Вивільнення Ca2+ може стимулюватися різними прозапальними субстанціями [49, 50]. G-протеїни зв’язуються з рецепторами на поверхні астроцитів, що призводить до вивільнення Ca2+ з ендоплазматичного ретикулума астроцитів і створення так званої кальцієвої хвилі [51]. Ця «хвиля» здатна модулювати нейрональну синаптичну активність, значно підвищуючи кількість імпульсацій і сприяючи таким чином процесам хронізації болю [52, 53].
Відомі на сьогодні механізми хронізації болю дозволяють припустити, що майбутні напрямки в пошуку й розробці нових молекул для лікування хронічного болю будуть спрямовані саме на клітини мікроглії й тучні клітини, вплив на які буде сприяти відновленню балансу про- та протизапальних медіаторів [19–21].
Можливості впливу на клітини глії
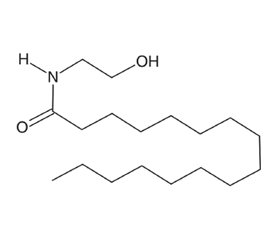
Однією з уже відомих і добре вивчених речовин, здатних впливати на клітини мікроглії й астроцити, є пальмітоїлетаноламід (ПЕА). Ця молекула є представником класу ендогенних ацилетаноламідів, які у великій кількості представлені в різних тканинах, включаючи нервову (рис. 1) [54]. Уперше молекула була виділена в 1990-х роках дослідницькою групою нобелівського лауреата Р.Л. Монтальчіні [55]. Було встановлено, що ПЕА впливає на тучні клітини і клітини глії, знижуючи їх активність [56–58]. ПЕА в нормі синтезується організмом і підтримується на певному рівні залежно від його функціонального стану [54]. Так, у разі стресу, пошкодження тканини або станів, що супроводжуються болем, рівень ПЕА знижується [59].
У дослідженнях на тваринах було встановлено здатність ПЕА впливати на запалення, зменшуючи його і, як наслідок, больові відчуття [60]. Цей ефект був дозозалежним і на моделях хронічного запалення і хронічного нейропатичного болю дозволяв не тільки зменшити біль, а й сприяти збереженню морфології периферичних нервів, зменшенню ендоневрального набряку, активації тучних клітин і виробленню прозапальних медіаторів у місці пошкодження тканини [61–64]. Таким чином, ґрунтуючись на даних експериментальних досліджень, можна зробити висновок про те, що ПЕА, впливаючи на різні процеси в нервовій тканині, має хвороба-модифікуючі властивості.
Останніми роками з’явилася велика кількість клінічних досліджень, що підтверджують протибольові властивості ПЕА при різних станах, що супроводжуються хронічним болем [65, 66].
Одним із ключових досліджень ПЕА в клінічній практиці стала робота групи італійських дослідників на чолі з Guida [67]. Авторами було проведене подвійне сліпе плацебо-контрольоване рандомізоване дослідження 636 пацієнтів, які страждають від болю в нижній частині спини, з підтвердженою компресією нервових корінців попереково-крижової локалізації. Середній рівень болю за візуальною аналоговою шкалою (ВАШ) становив 6,5 бала. Пацієнти були розділені на 3 групи: перша отримувала плацебо, друга — ПЕА 300 мг/добу, третя — ПЕА 600 мг/добу. Результати через 3 тижні від початку лікування були такими: у групі плацебо рівень болю зменшився з 6,5 до 4,5 бала за ВАШ; у групі ПЕА 300 мг/добу — із 6,5 до 3,5 бала; у групі ПЕА 600 мг/добу — із 7,1 до 2,1 бала. ПЕА в меншій дозі (300 мг) був значно кращим порівняно з плацебо, а ПЕА в більш високих дозах (600 мг) був значно кращим порівняно як і з більш низькою дозою, так і з плацебо. Небажаних явищ не було відзначено в жодного пацієнта.
/39.jpg)
В іншому спостережному клінічному дослідженні Domenico Chirchiglia та співавт. ПЕА призначався пацієнтам, які страждають від хронічного болю, пов’язаного з корінцевою патологією поперекового відділу хребта, без показань до хірургічного лікування [55]. Був проведений ретроспективний аналіз серії з 100 клінічних випадків пацієнтів, кожен із яких пройшов клініко-діагностичні дослідження, які показали наявність патологій тіла хребця і міжхребцевих дисків, переважно дегенеративного характеру (спондилоартроз, спондилодискартроз, протрузія диска), виключаючи грижі диска, які відносилися до випадків, що вимагають хірургічного втручання. Усі пацієнти отримували ультрамікронізований ПЕА (умПЕА): перші 10 днів по 1200 мг/добу у формі саше, потім ще 20 днів по 1200 мг/добу у формі таблеток, а потім ще 1 місяць по 600 мг/добу у формі таблеток. Протягом перших 4 днів пацієнти також приймали 500 мг парацетамолу з 30 мг кодеїну 1 раз на добу, а далі — тільки за потребою. Були отримані досить цікаві результати щодо зменшення рівня больових відчуттів (рис. 2–4). Примітне те, що при цьому в жодного пацієнта не відзначалося будь-яких побічних ефектів.
/40.jpg)
В іншому дослідженні оцінювалася ефективність умПЕА 1200 мг 1 раз на добу як доповнення до базової терапії пацієнтів із діабетичним або посттравматичним нейропатичним болем [68]. 30 пацієнтів із хронічним нейропатичним болем були обстежені на старті додаткової терапії, а також на 10-й і 40-й дні лікування. Базова терапія залишалася без змін. У результаті застосування додаткової терапії відзначалося значне зниження рівня болю за ВАШ на 10-ту добу із 8,20 ± 1,53 бала до 6,40 ± 1,83 бала (р < 0,002). На 40-й день терапії рівень болю за ВАШ знизився до 5,80 ± 2,04 бала (р < 0,001). Дослідження показало значне зниження рівня болю на тлі прийому умПЕА, проте мало низку обмежень, які включали короткий наглядовий період і відкритий дизайн дослідження.
Лікарська форма ПЕА
ПЕА погано розчиняється у воді, тому коефіцієнт розчинності часто є бар’єром до досягнення високої біодоступності при прийомі препарату всередину. Коефіцієнт розчинності залежить від низки факторів, одним із яких є розмір частинок ПЕА. У більшості клінічних досліджень застосовується мікронізований або ультрамікронізований ПЕА. Менший розмір частинок дозволяє домогтися більш швидкого всмоктування за рахунок збільшення загальної площі поверхні частинок (рис. 5) [65].
В іншому дослідженні була показана ефективність ПЕА щодо зменшення болю при остеоартриті (ОА) [69]. Біль при ОА вважається змішаним, він має ноцицептивний і нейропатичний компоненти одночасно. Було проведене подвійне сліпе рандомізоване групове контрольоване дослідження 24 пацієнтів, які страждають від ОА скронево-нижньощелепного суглоба. Пацієнти були розділені на дві групи: перша (n = 12) отримувала ПЕА (300 мг вранці плюс 600 мг ввечері протягом 7 днів, потім 300 мг 2 рази на добу протягом ще 7 діб); друга (n = 12) отримувала ібупрофен (600 мг 3 рази на добу протягом двох тижнів). Параметрами, які контролювалися в даному дослідженні, були частота виникнення й інтенсивність спонтанного болю, а також градус максимального відкриття рота. У результаті лікування обидва параметри вірогідно покращилися в групі ПЕА порівняно з групою ібупрофену.
ПЕА був досліджений у 8 клінічних випробуваннях у пацієнтів із болем у спині, компресією сідничного нерва й тунельними синдромами серединного нерва, у яких сумарно взяли участь 1366 пацієнтів. Gatti з колегами провели одне з найбільш великих спостережних досліджень за участю 610 пацієнтів, які страждають від різних хронічних больових синдромів [70]. 331 пацієнт страждав від люмбоішіалгії, 54 — від болю в суглобах, 44 — від постгерпетичної невралгії, 32 — від діабетичного нейропатичного болю, 76 — від болю після невдалої операції на спині, 22 — від онкологічного болю і 51 — від змішаних больових синдромів. Середній рівень болю за ВАШ на початку дослідження становив 6,5 бала. Пацієнти отримували ПЕА 600 мг 2 рази на добу протягом 3 тижнів із наступним переходом на одноразовий добовий прийом протягом 4 тижнів. ПЕА був доданий до базової протибольової терапії або застосовувався як монотерапія. На тлі прийому ПЕА середній рівень болю за ВАШ зменшився з 6,4 ± 1,4 бала до 2,5 ± 1,3 бала. У пацієнтів, які не приймали базову терапію, монотерапія ПЕА була однаково ефективна щодо зменшення рівня хронічного болю. При цьому при прийомі ПЕА не відзначалося ні побічних ефектів, ні лікарських взаємодій.
Висновки
Проаналізувавши наявні на сьогодні літературні дані, можна сказати, що клітини нейроглії й тучні клітини відіграють важливу роль у розвитку та підтримці процесів хронічного болю й нейрозапалення. Результати, які демонструє ПЕА в різних клінічних дослідженнях, дозволяють говорити про ПЕА як про перспективну молекулу, яку доцільно застосовувати в складі комплексної терапії, враховуючи добру переносимість і низьку імовірність виникнення побічних ефектів при прийомі препарату.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 20.05.2021
Рецензовано/Revised 04.06.2021
Прийнято до друку/Accepted 14.06.2021
Список литературы
1. Langley P., Müller-Schwefe G., Nicolaou A., Liedgens H., Pergolizzi J., Varrassi G. The societal impact of pain in the European Union: health-related quality of life and healthcare resource utilization. Journal of Medical Economics. 2010 Sep. 13(3). 571-81.
2. Langley P., Müller-Schwefe G., Nicolaou A., Liedgens H., Pergolizzi J., Varrassi G. The impact of pain on labor force participation, absenteeism and presenteeism in the European Union. Journal of Medical Economics. 2010 Dec. 13(4). 662-72.
3. Breivik H., Collett B., Ventafridda V., Cohen R., Gallacher D. Survey of chronic pain in Europe. Prevalence, impact on daily life, and treatment. European Journal of Pain. 2006 May. 10(4). 287-287.
4. Bouhassira D., Lantéri-Minet M., Attal N., Laurent B., Touboul C. Prevalence of chronic pain with neuropathic characteristics in the general population. Pain. 2008 Jun. 136(3). 380-7.
5. Todd A., McNamara C.L., Balaj M., Huijts T., Akhter N., Thomson K. et al. The Europain Epidemic: pain prevalence and socioeconomic inequalities in pain across 19 European countries. Eur. J. Pain. 2019 Apr 30. ejp.1409.
6. Miller R.E., Miller R.J., Malfait A.-M. Osteoarthritis joint pain: The cytokine connection. Cytokine. 2014 Dec. 70(2). 185-93.
7. Loeser J.D., Treede R.-D. The Kyoto protocol of IASP Basic Pain Terminology. Pain. 2008 Jul. 137(3). 473-7.
8. Jay G.W., Barkin R.L. Neuropathic pain: Etiology, pathophysiology, mechanisms, and evaluations. Disease-a-Month. 2014 Jan. 60(1). 6-47.
9. Van de Laar M. Pain Treatment in Arthritis-Related Pain: Beyond NSAIDs. TORJ. 2012 Dec 12. 6(1). 320-30.
10. Dimitroulas T., Duarte R.V., Behura A. et al. Neuropathic pain in osteoarthritis: A review of pathophysiological mechanisms and implications for treatment. Seminars in Arthritis and Rheumatism. 2014 Oct. 44(2). 145-54.
11. Walters E.T. Neuroinflammatory contributions to pain after SCI: Roles for central glial mechanisms and nociceptor-mediated host defense. Experimental Neurology. 2014 Aug. 258. 48-61.
12. Dworkin R.Н., O’Connor A.В., Audette J. et al. Recommendations for the Pharmacological Management of Neuropathic Pain: An Overview and Literature Update. Mayo Clinic Proceedings. 2010 Mar. 85(3). S3-14.
13. Paladini A., Fusco M., Cenacchi T. et al. Palmitoylethanolamide, a Special Food for Medical Purposes, in the Treatment of Chronic Pain: A Pooled Data Meta-analysis. Pain Physician. 2016 Feb. 19(2). 11-24.
14. Qian Y. Mast Cells and Neuroinflammation. Med. Sci Monit. Basic Res. 2014. 20. 200-6.
15. Block L. Glial dysfunction and persistent neuropathic postsurgical pain. Scandinavian Journal of Pain. 2016 Jan 1. 10(1). 74-81.
16. Mika J., Zychowska M., Popiolek-Barczyk K., Rojewska E., Przewlocka B. Importance of glial activation in neuropathic pain. European Journal of Pharmacology. 2013 Sep. 716(1–3). 106-19.
17. Ji R.-R., Xu Z.-Z., Gao Y.-J. Emerging targets in neuroinflammation-driven chronic pain. Nat. Rev. Drug Discov. 2014 Jul. 13(7). 533-48.
18. Tiwari V., Guan Y., Raja S.N. Modulating the delicate glial-neuronal interactions in neuropathic pain: Promises and potential caveats. Neuroscience & Biobehavioral Reviews. 2014 Sep. 45. 19-27.
19. Serhan C.N., Savill J. Resolution of inflammation: the beginning programs the end. Nat. Immunol. 2005 Dec. 6(12). 1191-7.
20. Buckley C.D., Gilroy D.W., Serhan C.N., Stockinger B., Tak P.P. The resolution of inflammation. Nat. Rev. Immunol. 2013 Jan. 13(1). 59-66.
21. Skaper S.D., Facci L., Giusti P. Mast cells, glia and neuroinflammation: partners in crime? Immunology. 2014 Mar. 141(3). 314-27.
22. Dualé C., Ouchchane L., Schoeffler P. et al. Neuropathic Aspects of Persistent Postsurgical Pain: A French Multicenter Survey With a 6-Month Prospective Follow-Up. The Journal of Pain. 2014 Jan. 15(1).
23. Martinez V., Ammar S.В., Judet T., Bouhassira D., Chauvin M., Fletcher D. Risk factors predictive of chronic postsurgical neuropathic pain: The value of the iliac crest bone harvest model. Pain. 2012 Jul. 153(7). 1478-83.
24. Calvo M., Bennett D.L.H. The mechanisms of microgliosis and pain following peripheral nerve injury. Experimental Neurology. 2012 Apr. 234(2). 271-82.
25. Ellis A., Bennett D.L.H. Neuroinflammation and the generation of neuropathic pain. British Journal of Anaesthesia. 2013 Jul. 111(1). 26-37.
26. Beaven M.A. Our perception of the mast cell from Paul Ehrlich to now. Eur. J. Immunol. 2009 Jan. 39(1). 11-25.
27. Gilfillan A.М., Austin S.J., Metcalfe D.D. Mast Cell Biology: Introduction and Overview. In: Gilfillan A.М., Metcalfe D.D., editors. Mast Cell Biology [Internet]. Boston, MA: Springer US, 2011 [cited 2019 Jul 19]. 2-12. Available from: http://link.springer.com/10.1007/978-1-4419-9533-9_1
28. Skaper S.D., Giusti P., Facci L. Microglia and mast cells: two tracks on the road to neuroinflammation. The FASEB Journal. 2012 Aug. 26(8). 3103-17.
29. Stone K.D., Prussin C., Metcalfe D.D. IgE, mast cells, basophils, and eosinophils. Journal of Allergy and Clinical Immunology. 2010 Feb. 125(2). S73-80.
30. Medzhitov R. Origin and physiological roles of inflammation. Nature. 2008 Jul. 454(7203). 428-35.
31. De Vries H.Е. et al. The influence of cytokines on the integrity of the blood-brain barrier in vitro. Journal of Neuroimmunology. 1996 Jan. 64(1). 37-43.
32. Huber J.D., Witt K.А., Hom S. et al. Inflammatory pain alters blood-brain barrier permeability and tight junctional protein expression. American Journal of Physiology-Heart and Circulatory Physiology. 2001 Mar. 280(3). H1241-8.
33. Abbott N.J, Rönnbäck L., Hansson E. Astrocyte-endothelial interactions at the blood-brain barrier. Nat. Rev. Neurosci. 2006 Jan. 7(1). 41-53.
34. Beggs S., Liu X.J., Kwan C., Salter M.W. Peripheral Nerve Injury and TRPV1-Expressing Primary Afferent C-Fibers Cause Opening of the Blood-Brain Barrier. Mol. Pain. 2010 Jan 29. 6.
35. Ren K., Dubner R. Neuron-glia crosstalk gets serious: role in pain hypersensitivity. Current Opinion in Anaesthesiology. 2008 Oct. 21(5). 570-9.
36. Araque A., Sanzgiri R.Р., Parpura V., Haydon P.G. Astrocyte-induced modulation of synaptic transmission. Can. J. Physiol. Pharmacol. 1999 Oct 10. 77(9). 699-706.
37. Haydon P.G., Carmignoto G. Astrocyte Control of Synaptic Transmission and Neurovascular Coupling. Physiological Reviews. 2006 Jul. 86(3). 1009-31.
38. De Leo J.А., Tawfik V.L., LaCroix-Fralish M.L. The tetrapartite synapse: Path to CNS sensitization and chronic pain. Pain. 2006 May. 122(1). 17-21.
39. Di Castro M.А., Chuquet J., Liaudet N. et al. Local Ca2+ detection and modulation of synaptic release by astrocytes. Nat. Neurosci. 2011 Oct. 14(10). 1276-84.
40. Chiang C.-Y., Sessle B.J., Dostrovsky J.O. Role of Astrocytes in Pain. Neurochem. Res. 2012 Nov. 37(11). 2419-31.
41. Watkins L.R., Milligan E.D., Maier S.F. Glial proinflammatory cytokines mediate exaggerated pain states: implications for clinical pain. Adv. Exp. Med. Biol. 2003. 521. 1-21.
42. Milligan E.D., Watkins L.R. Pathological and protective roles of glia in chronic pain. Nat. Rev. Neurosci. 2009 Jan. 10(1). 23-36.
43. Araque A., Parpura V., Sanzgiri R.Р., Haydon P.G. Tripartite synapses: glia, the unacknowledged partner. Trends in Neurosciences. 1999 May. 22(5). 208-15.
44. Guo W., Wang H., Watanabe M. et al. Glial-Cytokine-Neuronal Interactions Underlying the Mechanisms of Persistent Pain. Journal of Neuroscience. 2007 May 30. 27(22). 6006-18.
45. Watkins L.R., Milligan E.D., Maier S.F. Glial activation: a driving force for pathological pain. Trends in Neurosciences. 2001 Aug. 24(8). 450-5.
46. Fu K.-Y., Light A.R., Matsushima G.К., Maixner W. Microglial reactions after subcutaneous formalin injection into the rat hind paw. Brain Research. 1999 Apr. 825(1–2). 59-67.
47. Bushong E.А., Martone M.Е., Jones Y.Z., Ellisman M.H. Protoplasmic Astrocytes in CA1 Stratum Radiatum Occupy Separate Anatomical Domains. J. Neurosci. 2002 Jan 1. 22(1). 183-92.
48. Oberheim N.А., Goldman S.А., Nedergaard M. Heterogeneity of Astrocytic Form and Function. In: Milner R., editor. Astrocytes [Internet]. Totowa, NJ: Humana Press. 2012 [cited 2019 Jul 19]. Available from: http://link.springer.com/10.1007/978-1-61779-452-0_3
49. Santello M., Calì C., Bezzi P. Gliotransmission and the Tripartite Synapse. In: Kreutz M.R., Sala C., editors. Synaptic Plasticity [Internet]. Vienna: Springer Vienna, 2012 [cited 2019 Jul 19]. 307-31. Available from: http://link.springer.com/10.1007/978-3-7091-0932-8_14
50. Zorec R., Araque A., Carmignoto G., Haydon P.G., Verkhratsky A., Parpura V. Astroglial Excitability and Gliotransmission: An Appraisal of Ca2+ as a Signalling Route. ASN Neuro. 2012 Feb. 4(2). AN20110061.
51. Lencesova L., O’Neill A., Resneck W.G., Bloch R.J., Blaustein M.P. Plasma Membrane-Cytoskeleton-Endoplasmic Reticulum Complexes in Neurons and Astrocytes. J. Biol. Chem. 2004 Jan 23. 279(4). 2885-93.
52. Hansson E. Could chronic pain and spread of pain sensation be induced and maintained by glial activation? Acta Physiol. 2006 May. 187(1–2). 321-7.
53. Delbro D., Westerlund A., Björklund U., Hansson E. In inflammatory reactive astrocytes co-cultured with brain endothelial cells nicotine-evoked Ca2+ transients are attenuated due to interleukin-1β release and rearrangement of actin filaments. Neuroscience. 2009 Mar. 159(2). 770-9.
54. Esposito E., Cuzzocrea S. Palmitoylethanolamide is a New Possible Pharmacological Treatment for the Inflammation Associated with Trauma. Mini Reviews in Medicinal Chemistry. 2013 Feb 1. 13(2). 237-55.
55. Chirchiglia D., Chirchiglia P., Signorelli F. Nonsurgical lumbar radiculopathies treated with ultramicronized palmitoylethanolamide (umPEA): A series of 100 cases. Neurologia i Neurochirurgia Polska. 2018 Jan. 52(1). 44-7.
56. Facci L., Dal Toso R., Romanello S., Buriani A., Skaper S.D., Leon A. Mast cells express a peripheral cannabinoid receptor with differential sensitivity to anandamide and palmitoylethanolamide. Proceedings of the National Academy of Sciences. 1995 Apr 11. 92(8). 3376-80.
57. Cerrato S., Brazis P., della Valle M.F., Miolo A., Puigdemont A. Effects of palmitoylethanolamide on immunologically induced histamine, PGD2 and TNFα release from canine skin mast cells. Veterinary Immunology and Immunopathology. 2010 Jan. 133(1). 9-15.
58. Franklin A., Parmentier-Batteur S., Walter L., Greenberg D.А., Stella N. Palmitoylethanolamide Increases after Focal Cerebral Ischemia and Potentiates Microglial Cell Motility. J. Neurosci. 2003 Aug 27. 23(21). 7767-75.
59. Petrosino S., Palazzo E., de Novellis V., Bisogno T., Rossi F., Maione S. et al. Changes in spinal and supraspinal endocannabinoid levels in neuropathic rats. Neuropharmacology. 2007 Feb. 52(2). 415-22.
60. Mazzari S., Canella R., Petrelli L., Marcolongo G., Leon A. N-(2-Hydroxyethyl)hexadecanamide is orally active in reducing edema formation and inflammatory hyperalgesia by down-modulating mast cell activation. European Journal of Pharmacology. 1996 Apr. 300(3). 227-36.
61. Luongo L., Guida F., Boccella S. et al. Palmitoylethanolamide reduces formalin-induced neuropathic-like behaviour through spinal glial/microglial phenotypical changes in mice. CNS Neurol Disord Drug Targets. 2013 Feb 1. 12(1). 45-54.
62. Calignano A., Rana G.L., Giuffrida A., Piomelli D. Control of pain initiation by endogenous cannabinoids. Nature. 1998 Jul. 394(6690). 27-81.
63. Jaggar S.І., Hasnie F.S., Sellaturay S., Rice A.S.C. The anti-hyperalgesic actions of the cannabinoid anandamide and the putative CB2 receptor agonist palmitoylethanolamide in visceral and somatic inflammatory pain. Pain. 1998 May. 76(1). 189-99.
64. Romero T.R.L., Duarte I.D.G. N-Palmitoyl-ethanolamine (PEA) Induces Peripheral Antinociceptive Effect by ATP-Sensitive K+-Channel Activation. J. Pharmacol. Sci. 2012. 118(2). 156-60.
65. Skaper S.D., Facci L., Fusco M., della Valle M.F., Zusso M., Costa B. et al. Palmitoylethanolamide, a naturally occurring disease-modifying agent in neuropathic pain. Inflammopharmacol. 2014 Apr. 22(2). 79-94.
66. Freitag C.М., Miller R.J. Peroxisome proliferator-activated receptor agonists modulate neuropathic pain: a link to chemokines? Front Cell Neurosci [Internet]. 2014 Aug 20 [cited 2019 Jul 20]. Available from: http://journal.frontiersin.org/article/10.3389/fncel.2014.00238/abstract
67. Guida G., De Martino M., De Fabiani A. et al. La Palmitoiletanolamide (Normast) en el dolor neuropático crónico por lumbociatalgia de tipo compresivo: Estudio clinico multícéntrico. Dolor. 2010. (25). 35-42.
68. Cocito D., Peci E., Ciaramitaro P., Merola A., Lopiano L. Short-Term Efficacy of Ultramicronized Palmitoylethanolamide in Peripheral Neuropathic Pain. Pain Research and Treatment. 2014. 2014. 1-4.
69. Marini I., Bartolucci M.L., Bortolotti F., Gatto M.R., Bonetti G.A. Palmitoylethanolamide versus a nonsteroidal anti-inflammatory drug in the treatment of temporomandibular joint inflammatory pain. J. Orofac. Pain. 2012. 26(2). 99-104.
70. Gatti A., Lazzari M., Gianfelice V., Di Paolo A., Sabato E., Sabato A.F. Palmitoylethanolamide in the Treatment of Chronic Pain Caused by Different Etiopathogenesis. Pain Med. 2012 Sep. 13(9). 1121-30.

/39.jpg)
/40.jpg)