Вступ
Під час виконання операцій ендопротезування в пацієнтів зі зміненою анатомією та з остеопорозом кульшової западини дуже складним завданням є стабільна фіксація ацетабулярного компонента ендопротеза [1–5].
На сьогодні найбільш біологічною формою фіксації ендопротезів є остеоінтеграція, тому проводяться численні дослідження з метою розробки оптимальної поверхні імплантату для досягнення міцного блока між імплантатом та кісткою з метою подовження тривалості фіксації ендопротеза в кістковій тканині [6–9]. Для остеоінтеграції ацетабулярних компонентів ендопротезів кульшового суглоба виготовляють різні поверхні, що мають структуру у вигляді спечених шариків, волокнистої сітки, шпаристого металу, із напиленням гідроксилапатиту або без нього [10, 11].
Існують дослідження з вивчення зчеплення кісткової тканини з титановими [10–13], танталовими [14, 15] та керамічними [3, 16, 17] покриттями ендопротезів. Проте недостатньо даних щодо впливу міцнісних характеристик сучасних поверхонь ацетабулярних компонентів ендопротезів кульшового суглоба на розподіл механічних напружень у кістковій тканині навколо імплантованих компонентів.
Мета роботи: вивчити на математичній моделі зміни напружено-деформованого стану системи «ендопротез — кістка» в результаті використання чашки ендопротеза з пористого титану.
Матеріали та методи
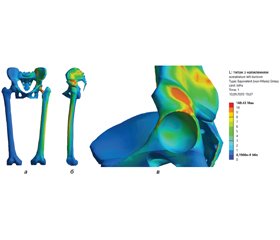
У лабораторії біомеханіки ДУ «Інститут патології хребта та суглобів ім. проф. М.І. Ситенка НАМН України» проведене математичне моделювання напружено-деформованого стану кульшового суглоба людини при ендопротезуванні з використанням чашки з пористих матеріалів. Для вирішення поставленого завдання була розроблена скінчено-елементна модель, що містила таз, нижні кінцівки. На правій кінцівці був змодельований ендопротез кульшового суглоба. Загальний вигляд моделі наведений на рис. 1.
Під час дослідження моделювали дефект титану вертлюжної западини, заповнений кістковим імплантатом, що фіксований двома гвинтами. Зовнішній вигляд моделі наведений на рис. 2.
Також моделювали дефект дна вертлюжної западини, заповнений кістковими чипсами (рис. 3).
Конструкцію чашки ендопротеза моделювали у двох варіантах: із цільного титану з напиленням шару з пористого титану; цілком із пористого титану. Механічні властивості біологічних тканин обирали за даними літературних джерел [18, 19]. Механічні властивості кісткових чипсів обирали за даними експериментальних досліджень [20]. Характеристики штучних матеріалів обирали за даними технічної літератури [21, 22].
Для моделювання остеоінтеграції на поверхні чашки ендопротеза відокремлювали тонкий прошарок завтовшки 2 мм, що імітував пористий титан із порами, заповненими кістковою тканиною. Ураховували пористість титану, рівною 80 %. З огляду на це розраховували модуль пружності прошарку пористого титану, заповненого кістковою тканиною, за формулою розрахунку модуля пружності композитного матеріалу [23, 24]:
Ек = К1Е1 + К2Е2, (1)
де Е1 — модуль пружності титану, Е1 = 54,0 ГПа; Е2 — модуль пружності кортикальної кістки, Е2 = 18,4 ГПа; К1 — частка титану в композиті 20 %, К1 = 0,2; Е2 — частка кортикальної кістки в композиті 80 %, К2 = 0,8.
Підставимо значення коефіцієнтів до рівняння (1) й отримуємо величину модуля пружності кістково-титанового композиту:
ЕК = 0,2 ∙ 54,0 + 0,8 ∙ 18,4.
ЕК = 25,52 ГПа.
Механічні характеристики матеріалів, що використовували в розрахунках, наведені в табл. 1.
Матеріал вважали однорідним та ізотропним. Як скінчений елемент був обраний 10-вузловий тетраедр із квадратичною апроксимацією.
При проведенні досліджень до крижі прикладали розподілене навантаження величиною 540 Н, що відповідає вазі верхньої частини тіла людини вагою 70 кг [25]. Між крилом таза та великим вертлюгом стегнової кістки прикладали навантаження, що моделювали дію середнього сідничного м’яза — 1150 Н та малого сідничного м’яза — 50 Н [26]. Схема навантаження моделей наведена на рис. 4.
Для порівняння різних варіантів остеосинтезу проводили реєстрацію величин напружень у кістковій тканині навколо вертлюжної западини в певних контрольних точках моделей. Схема розташування контрольних точок наведена на рис. 5.
Дослідження напружено-деформованого стану моделей виконували за допомогою методу кінцевих елементів. Як критерій оцінки напруженого стану моделей використовували напруження за Мізесом [2].
Моделювання виконували за допомогою системи автоматизованого проектування SolidWorks. Розрахунки напружено-деформованого стану моделей виконували за допомогою програмного комплексу Cosmos/M [28].
Результати та їх обговорення
Першим етапом роботи досліджували моделі з нормальним станом вертлюжної западини. Напружено-деформований стан моделі з чашкою з напиленням пористого титану можна розглянути на рис. 6.
Використання чашки з напиленням пористого титану при нормальному стані вертлюжної западини призводить до виникнення напружень максимальної величини (15,9 МПа) в її задньоверхній частині. Мінімальні напруження (4,6 МПа) спостерігаються в центрі вертлюжної западини.
Напружено-деформований стан моделі з чашкою з пористого титану наведений на рис. 7.
Використання ендопротеза з чашкою з пористого титану при нормальному стані вертлюжної западини дозволяє знизити рівень напружень у кістковій тканині навколо чашки у всіх досліджених контрольних точках. Дані про величини напружень у контрольних точках моделей із нормальним тазом при різних матеріалах чашки ендопротеза наведені в табл. 2.
Для наочного порівняння величин напружень у контрольних точках моделей із нормальним тазом при різних матеріалах чашки ендопротеза побудована діаграма, яка наведена на рис. 8.
Як показало проведене дослідження при нормальному стані вертлюжної западини, використання ендопротеза кульшового суглоба з чашкою з пористого титану викликає значно менше напруження в кістковій тканині навколо вертлюжної западини, ніж чашка із цільного титану та напиленням шару пористого титану.
На наступному етапі роботи вивчали розподіл напружень у моделях із дефектом покрівлі вертлюжної западини. Картина напружено-деформованого стану моделі з чашкою із цільного титану та напиленням шару пористого титану наведена на рис. 9.
За наявності дефекту покрівлі вертлюжної западини, заміщеного кістковим трансплантатом, що фіксований гвинтами, ендопротез із чашкою із цільного титану та напиленням пористого титану викликає напруження максимальної величини (12,5 МПа) саме у верхній частині западини, тобто на кістковому трансплантаті. Ззаду та в центрі вертлюжної западини напруження мінімальні й визначаються на рівні 6,5 та 4,8 МПа відповідно.
Розподіл напружень у моделі з дефектом покрівлі вертлюжної западини та ендопротезом із чашкою з пористого титану можна спостерігати на рис. 10.
Використання чашки ендопротеза з пористого титану за наявності дефекту покрівлі вертлюжної западини дозволяє знизити рівень напружень кісткової тканини навколо всіх контрольних точок. Особливо помітне зниження рівня напружень у передній частині вертлюжної западини, де вони визначаються на рівні 7,8 МПа порівняно з 11,8 МПа в моделі з чашкою з напиленням пористого титану. Слід відмітити, що саме на кістковому трансплантаті рівень напружень залишається практично незмінним і становить 12,2 МПа. Дані про величини напружень у контрольних точках моделей із дефектом покрівлі вертлюжної западини, заміщеним кістковим трансплантатом, при різних матеріалах чашки ендопротеза наведені в табл. 3.
Порівняти величини напружень у контрольних точках моделей із дефектом покрівлі вертлюжної западини, заміщеним кістковим трансплантатом, при різних матеріалах чашки ендопротеза допоможе діаграма, яка наведена на рис. 11.
Результати проведеного моделювання дозволяють стверджувати, що за наявності дефекту покрівлі вертлюжної западини ендопротез кульшового суглоба з чашкою з пористого титану викликає напруження меншої величини, ніж чашка із цільного титану з напиленням пористого титану. Але саме на трансплантаті рівень напружень залишається практично незмінним незалежно від типу чашки. Це можна пояснити тим, що високий рівень напружень більш обумовлений наявністю двох фіксуючих гвинтів у кістковому трансплантаті, що заміщує дефект, ніж матеріалом, з якого виготовлені чашки ендопротеза.
На останньому етапі дослідження вивчали характер розподілу напружень у моделях із дефектом дна вертлюжної западини, заповненим кістковими чипсами. Напружено-деформований стан моделі з ендопротезом кульшового суглоба з чашкою з напиленням пористого титану наведений на рис. 12.
Як і в попередніх дослідженнях, за наявності дефекту дна вертлюжної западини, заповненого кістковими чипсами, чашка із цільного титану з напиленням пористого титану призводить до виникнення зони максимальних напружень у кістковій тканині у верхній (22,6 МПа) та задньоверхній (22,3 МПа) ділянках вертлюжної западини. На дні вертлюжної западини, незважаючи на наявність дефекту, рівень напружень визначається на мінімальному рівні та не перевищує позначки 6,4 МПа.
Картину розподілу напружень у моделі з дефектом дна вертлюжної западини, заміщеним кістковим трансплантатом, та ендопротезом кульшового суглоба з чашкою з пористого титану можна спостерігати на рис. 13.
Використання чашки з пористого титану за наявності дефекту дна вертлюжної западини викликає значно менші напруження в кістковій тканині навколо неї у всіх контрольних точках моделі порівняно із цільнометалевою чашкою з напиленням. Дані про величини напружень у контрольних точках моделей із дефектом дна вертлюжної западини, заміщеним кістковим транс-
плантатом, при різних матеріалах чашки ендопротеза наведені в табл. 4.
Наочно порівняти величини напружень у конт-рольних точках моделей із дефектом дна вертлюжної западини, заміщеним кістковим трансплантатом, при різних матеріалах чашки ендопротеза можна за допомогою діаграми, яка наведена на рис. 14.
Як бачимо на діаграмі, за наявності дефекту дна вертлюжної западини рівень напружень у кістковій тканині навколо неї нижчий у всіх контрольних точках моделі при використанні чашки з пористого титану, ніж при використанні цільного титану з напиленням пористого титану.
Висновки
Чашка ендопротеза кульшового суглоба, виготовлена з пористого титану, викликає напруження значно нижчого рівня у всіх контрольних точках моделі порівняно з чашкою з цільного титану з напиленням пористого титану як за наявності дефектів покрівлі та дна вертлюжної западини, так і без них.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 14.04.2021
Рецензовано/Revised 07.05.2021
Прийнято до друку/Accepted 13.05.2021
Список литературы
1. Корж Н.А., Филиппенко В.А., Танькут В.А. и др. Применение чашки эндопротеза тазобедренного сустава с танталовым покрытием при дефектах стенок вертлужной впадины и остеопорозе. Мат. IX съезда травматологов-ортопедов Республики Беларусь. Мн., 2014. С. 260-266.
2. Олійник О.Є. Ендопротезування кульшового суглоба при деформаціях та дефектах проксимального відділу стегнової кістки і кульшової западини: Автореф. дис... д-ра мед. наук: 14.01.21/О.Є.Олійник; Ін-т патології хребта та суглобів ім. М.І. Ситенка АМН України. Х., 2011. 36 с.
3. Лоскутов А.Е. и др. Эндопротезирование тазобедренного сустава: Монография; под ред. лауреата Гос. премии, засл. деят. науки и техники Украины, проф. А.Е. Лоскутова. Д.: Лира, 2010. 344 с.
4. Филиппенко В.А., Хмызов С.А., Жигун А.И. и др. Особенности эндопротезирования пациентов с последствиями невправленных переломовывихов в тазобедренном суставе. Вісник ортопедії, травматології та протезування. 2015. № 2. С. 28-33.
5. Филипенко В.А. и др. Эндопротезирование тазобедренного сустава: Монография; под ред. В.А. Филиппенко, Н.А. Коржа. Х.: Колегіум, 2015. 220 с.
6. Biemond J.E., Hannink G., Jurrius A.M. et al. In vivo assessment of bone ingrowth potential of three-dimensional e-beam produced implant surfaces and the effect of additional treatment by acid etching and hydroxyapatite coating. J. Biomater. Appl. 2012. № 26(7). P. 861-875.
7. Biemond J.E., Eufrásio T.S., Hannink G. et al. Assessment of bone ingrowth potential of biomimetic hydroxyapatite and brushite coated porous E-beam structures. J. Mater. Sci. Mater. Med. 2011. № 22(4). P. 917-925.
8. Kusakabe H., Sakamaki T., Nihei K. et al. Osseointegration of a hydroxyapatite-coated multilayered mesh stem. Biomaterials. 2004. № 25(15). P. 2957-2969.
9. Manders P.J., Wolke J.G., Jansen J.A. Bone response adjacent to calcium phosphate electrostatic spray deposition coated implants: an experimental study in goats. Clin. Oral Implants Res. 2006. № 17(5). P. 548-553.
10. Karageorgiou V., Kaplan D. Porosity of 3D biomaterial scaffolds and osteogenesis. Biomaterials. 2005. № 26(27). P. 5474-5491.
11. Bone-Implant Interface in Orthopedic Surgery: Basic Science to Clinical Applications. Ed. by Karachalios, Theofilos. Springer-Verlag London, 2014. 342 p.
12. Руцкий А.В., Минченя В.Т., Маслов А.П. Оценки объемной пористой титановой структуры в эндопротезах тазобедренного сустава SLPS. Ars medica. 2011. № 17(53). С. 25-30.
13. Baad-Hansen T., Kold S., Nielsen P.T. et al. Comparison of trabecular metal cups and titanium fiber-mesh cups in primary hip arthroplasty: a randomized RSA and bone mineral densitometry study of 50 hips. Acta Orthop. 2011. № 82(2). P. 155-160.
14. Bobyn J.D., Stackpool G.J., Hacking S.A.et al. Cha-racteristics of bone ingrowth and interface mechanics of a new porous tantalum biomaterial. J. Bone Joint Surg. Br. 1999. № 81(5). P. 907-914.
15. Bobyn J.D., Poggie R.A., Krygier J.J. et al. Clinical validation of a structural porous tantalum biomaterial for adult reconstruction. Ibid. 2004. Vol. 86-A. S.2. P. 123-129.
16. Гайко Г.В., Підгаєцький В.М. Пористе титанове та титан-гідроксилапатитне покриття для безцементного ендопротеза кульшового суглоба. Ортопедия, травматология и протезирование. 2008. № 4. С. 47-53.
17. Moroni et al. A Comparison of Hydroxyapatite-Coated, Titanium-Coated, and Uncoated Tapered External-Fixation Pins. An in Vivo Study in Sheep. J. Bone Joint Surg. Am. 1998. № 80. P. 547-554.
18. Bone mechanics handbook. Ed. by Stephen C. Cowin. CRC Press Reference, 2001. 980 р.
19. Boccaccio A., Pappalettere C. Mechanobiology of Fracture Healing: Basic Principles and Applications in Orthodontics and Orthopaedics. Theoretical Biomechanics. Dr Vaclav Klika (ed.). 2011.
20. Філіпенко В.А., Мезенцев В.О., Карпінський М.Ю., Карпінська О.Д. Експериментальне дослідження механічних властивостей матеріалів у вигляді гранул та чипсів для заповнення кісткових дефектів. Травма. 2020. Т. 21. № 1. С. 23-30. doi: 10.22141/1608-1706.1.21.2020.197795.
21. Mitsuo Niinomi. Mechanical biocompatibilities of titanium alloys for biomedical applications. Journal of the mecha-nical behavior of biomedical materials. 2008. 1. Р. 30-42. doi: 10.1016/j.jmbbm.2007.07.001.
22. Regis M., Marin E., Fedrizzi L., Pressacco M. Additive manufacturing of Trabecular Titanium orthopedic implants. MRS BULLETIN. Feb 2015. Vol. 40. doi: 10.1557/mrs.2015.1.
23. Карпинский М.Ю., Суббота И.А., Карпинская Е.Д., Попов А.И. Экспериментально-теоретическое обоснование состава композитного материала для заполнения костных дефектов. Медицина и..., 2008. № 3(21).
24. Хвисюк О.М., Павлов О.Д., Карпінський М.Ю., Карпінська О.Д. Розрахунок міцнісних характеристик композитного матеріалу на основі полілактиду трикальційфосфату та гідроксіапатиту. Травма. 2020. Т. 21. № 1. Р. 85-91. doi: 10.22141/1608-1706.1.21.2020.197802.
25. Образцов И.Ф., Адамович И.С., Барер И.С. и др. Проблема прочности в биомеханике: Учебное пособие для технич. и биол. спец. вузов. М.: Высш. школа, 1988. 311 с.
26. Carhart M.R. Biomechanical Analysis of Compensatory Stepping: Implications for Paraplegics Standing Via FNS: Ph.D. Dissertation. Arizona State University, 2000.
27. Зенкевич О.К. Метод конечных элементов в технике. М.: Мир, 1978. 519 с.
28. Алямовский А.А. SolidWorks/COSMOSWorks. Инженерный анализ методом конечных элементов. М.: ДМК Пресс, 2004. 432 с.

/36.jpg)
/36_2.jpg)
/37_2.jpg)
/37.jpg)
/38.jpg)
/39.jpg)
/40.jpg)
/42.jpg)
/41.jpg)
/42_2.jpg)