Анемія — клініко-гематологічний синдром, обумовлений зниженням рівня гемоглобіну і в більшості випадків зменшенням кількості еритроцитів в одиниці об’єму крові.
Анемія — найчастіше ускладнення хронічної хвороби нирок (ХХН), що виникає в результаті порушення синтезу еритропоетину в поєднанні з абсолютним або функціональним дефіцитом заліза або іншими супутніми факторами, такими як крововтрата, запалення, метаболічні порушення, скорочена тривалість життя еритроцитів тощо [1, 2].
За даними як різних загальнонаціональних досліджень і реєстрів, так і окремих нефрологічних клінік, поширеність анемії в пацієнтів із ХХН збільшується з прогресуванням нефросклерозу. Згідно з настановами KDIGO 2012 року, поширеність анемії в пацієнтів зі швидкістю клубочкової фільтрації (ШКФ) ≥ 90 мл/хв/1,73 м2 становить 4 %, а при ШКФ < 30 мл/хв/1,73 м2 — 51,5 % (табл. 1) [3]. Загальнонаціональне сучасне дослідження поширеності анемії у шведській популяції пацієнтів із ХХН 3–5-ї стадії продемонструвало, що анемія зустрічається в 60 % пацієнтів із недіалізною ХХН і в 93 % пацієнтів, які отримують діаліз [1]. Загальна поширеність анемії в пацієнтів із ХХН, за результатами національного дослідження в Ірландії, становила 37,8 % [4]. Дані амбулаторних нефрологічних клінік Каталонії документували поширеність анемії серед пацієнтів із ХХН 3–5-ї стадії у 58,5 % випадків [5]. У той же час, за результатами корейського когортного дослідження, що охоплювало пацієнтів із ХХН 1–5-ї стадії, поширеність анемії становила 45 % [6]. У США на підставі даних NHANES поширеність анемії збільшувалась від 8,4 % у пацієнтів із ХХН 1-ї ст. до 53,4 % у пацієнтів із ХХН 5-ї ст. [7].
Сучасні інтерв’ю з якісним виявленням концепцій і когнітивним дебрифінгом для оцінки частоти, тривалості і серйозності симптомів і впливів, пов’язаних з анемією при ХХН (табл. 2), проходили з використанням опитувальника CKD-AQ; у майбутніх дослідженнях будуть оцінювати психометричні властивості й потенційну користь при лікуванні анемії [8].
Анемія, її причини й методи лікування в пацієнтів із ХХН знаходяться в центрі уваги дослідників протягом 40 років. Величезні успіхи, пов’язані з відкриттям еритропоетину й розробкою еритропоезстимулюючих агентів (ЕСА), ініціювали проведення рандомізованих контрольованих клінічних випробувань, які змінили клінічну практику [9].
Керуючись настановами KDIGO 2012 року (Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease), анемію діагностують у дорослих і дітей > 15 років із ХХН за наявності концентрації гемоглобіну < 130 г/л в осіб чоловічої статі і < 120 г/л — у жінок, < 110 г/л — у дітей віком 0,5–5 років, < 115 г/л — у дітей 5–12 років, < 120 г/л — у дітей 12–15 років [3].
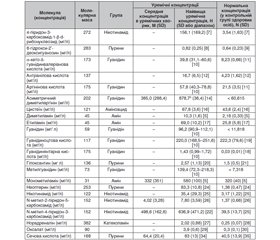
Частота проведення тестів на анемію згідно з настановами KDIGO 2012 року наведена в табл. 3 [10].
У пацієнтів із ХХН та анемією (незалежно від віку та стадії ХХН) слід використовувати для первинної оцінки такі тести: загальний аналіз крові, що повинен включати концентрацію гемоглобіну, кількість еритроцитів, лейкоцитів із формулою, тромбоцитів; абсолютна кількість ретикулоцитів; рівень феритину в сироватці крові; насичення трансферину в сироватці крові (TSAT); рівень вітаміну В12 у сироватці крові та фолієвої кислоти [10].
Лікування препаратами заліза. Для дорослих пацієнтів із ХХН з анемією, які не отримують препарати заліза або ЕСА, ми пропонуємо випробувати призначення в/в заліза (або для пацієнтів із недіалізною ХХН як альтернативу призначення пероральної терапії залізом протягом 1–3 місяців), якщо бажане збільшення концентрації гемоглобіну без застосування лікування ЕСА, TSAT становить ≤ 30 %, феритин становить ≤ 500 нг/мл
(≤ 500 мкг/л) (2С). Для дорослих пацієнтів із ХХН, які отримують терапію ЕСА, але не отримують препарати заліза, ми пропонуємо випробувати призначення в/в заліза (або у хворих із недіалізною ХХН альтернативно випробувати призначення упродовж 1–3 місяців пероральної терапії залізом), якщо бажане збільшення концентрації гемоглобіну або зниження дози ЕСА і TSAT становить ≤ 30 %, а феритин становить ≤ 500 нг/мл
(≤ 500 мкг/л) (2С). Для всіх педіатричних пацієнтів із ХХН і анемією, які не отримують залізо або терапію ЕСА, ми рекомендуємо пероральний прийом препаратів заліза (або в/в заліза при ХХН 5-ї ст. у пацієнтів на ГД) за наявності TSAT ≤ 20 % і феритину ≤ 100 нг/мл (≤ 100 мкг/л) (1D). Для всіх педіатричних пацієнтів із ХХН, які отримують терапію ЕСА, але не приймають препарати заліза, ми рекомендуємо призначення перорального заліза (або в/в заліза у пацієнтів із ХХН 5-ї ст. на ГД) для підтримки TSAT > 20 % і феритину > 100 нг/мл (> 100 мкг/л) (1D) [10].
Використання ЕСА для лікування анемії у хворих із ХХН. В ініціюванні та підтриманні ЕСА-терапії ми рекомендуємо взаємну оцінку потенційних переваг зменшення кількості переливань крові і симптомів, пов’язаних з анемією, з ризиками заподіяння шкоди окремим пацієнтам (наприклад, інсульт, втрата судинних доступів, гіпертензія) (1В). Для дорослих пацієнтів із недіалізною ХХН із концентрацією гемоглобіну ≥ 10,0 г/дл (≥ 100 г/л) ми пропонуємо не починати ЕСА-терапію (2D). Для дорослих пацієнтів із недіалізною ХХН із концентрацією гемоглобіну < 10,0 г/дл (< 100 г/л) ми пропонуємо, щоб рішення про початок терапії ЕСА було індивідуалізованим та заснованим на швидкості зменшення концентрації гемоглобіну, попередній відповіді на терапію залізом, ризику необхідності переливання крові та ризиках, пов’язаних з терапією ЕСА, та наявності симптомів, властивих анемії (2С). Для дорослих пацієнтів із діаліззалежною ХХН 5-ї ст. ми пропонуємо використання ЕСА-терапії для уникнення зменшення концентрації гемоглобіну нижче від 9,0 г/дл (90 г/л) шляхом її призначення при рівні гемоглобіну 9,0–10,0 г/дл (90–100 г/л) (2В). Індивідуалізація терапії є розумним рішенням, оскільки в деяких пацієнтів може поліпшуватися якість життя при більш високому рівні гемоглобіну й терапія ЕСА може бути розпочата при рівнях вище від 10,0 г/дл (100 г/л). Для всіх педіатричних пацієнтів із ХХН ми пропонуємо, щоб вибір концентрації гемоглобіну, при якому починається терапія ЕСА в кожного окремого пацієнта, включав аналіз потенційних переваг (наприклад, поліпшення якості життя, відвідування школи/продуктивність, уникнення переливання крові) і потенційної шкоди (2D) [10].
Підтримуюча терапія ЕСА. Загалом ми вважаємо, що ЕСА не повинні бути використані для підтримки концентрації гемоглобіну вище від 11,5 г/дл (115 г/л) у дорослих пацієнтів із ХХН (2С). Індивідуалізація терапії необхідна, оскільки в деяких пацієнтів може поліпшуватися якість життя при рівні гемоглобіну понад 11,5 г/дл (115 г/л) із готовністю на ризик. У всіх дорослих пацієнтів ми рекомендуємо не використовувати ЕСА для навмисного збільшення концентрації гемоглобіну понад 13 г/дл (130 г/л) (1А). Ми вважаємо, що у всіх педіатричних пацієнтів із ХХН, які отримують терапію ЕСА, цільова концентрація гемоглобіну знаходиться в діапазоні від 11,0 до 12,0 г/дл (110–120 г/л) (2D) [10].
На сьогодні перелік ЕСА далеко не обмежується рекомбінантними людськими еритропоетинами. Класифікація ЕСА наведена нижче.
Класифікаця ЕСА
1. ЕСА на білковій основі:
— еритропоетини (альфа, бета, дельта, омега);
— біологічно-подібні еритропоетини;
— дарбопоетин альфа;
— CERA;
— синтетичний еритропоетичний білок (SEP);
— рекомбінантні синтезовані білкові еритропоетини;
— EPO-EPO;
— GM-CSF-EPO;
— Fc-EPO;
— STNO 528 синтетичний білок EPO-міметичної дії.
2. Низькомолекулярні ЕСА:
— на пептидній основі (Hematide);
— на непептидній основі (EPO-міметики).
3. Інші варіанти стимуляції еритропоезу:
— інгібітори пролілгідроксилази (стабілізатори HIF-індукованого гіпоксією транскрипційного фактора);
— інгібітори GATA (родина транскрипційних факторів);
— інгібітори клітинної гемопоетичної фосфатази;
— терапія генами еритропоетину.
Застосування ЕСА для корекції анемії в пацієнтів із ХХН сьогодні — це фрагмент ренопротекції, що передбачає застосування комплексу заходів, спрямованих на збереження функціонального стану нирок і відстрочення термінальної стадії ниркової недостатності.
Епобіокрин — рекомбінантний еритропоетин людини, за біологічною та імунологічною активністю відповідає еритропоетину людини — природному глікопротеїновому гормону, що відіграє роль мітозстимулюючого чинника, та є гормоном, що стимулює еритропоез, процес формування еритроцитів від попередників стовбурової клітини. У нормі в здорової людини еритропоетин синтезується нирками (90 %) і купферівськими клітинами печінки (10 %). Рівень його синтезу визначається рівнем насиченості крові киснем. Еритропоетин стимулює проліферацію й диференціацію еритроїдних клітин у зрілі еритроцити. Його дія здійснюється на ранніх стадіях еритропоезу на рівні кластероутворювальних одиниць-еритроцитів і колонієутворювальних одиниць-еритроцитів, далі — на рівні проеритробласта, еритробласта й ретикулоцита (чутливість цих клітин до еритропоетину пропорційна ступеню їх зрілості). Еритропоетин нормалізує рівень гемоглобіну й гематокриту й усуває симптоми, пов’язані з анемією.
Молекулярна маса епоетину альфа — приблизно 30 600 дальтонів. Білкова частина становить приблизно 60 % молекулярної маси та містить 165 амінокислот. Чотири вуглеводневі ланцюги приєднані до білка трьома N-глікозидними зв’язками та одним О-глікозидним зв’язком.
Різноманітність доз Епобіокрину (1 мл розчину містить рекомбінантного еритропоетину людини 1000, або 2000, або 4000, або 10 000 МО) дозволяє використовувати його лікувальний потенціал у фазі корекції й у фазі підтримуючої терапії анемії в пацієнтів із ХХН різного віку. А фармакокінетичні характеристики препарату обумовлюють можливість його внутрішньовенного та підшкірного введення.
Показаннями до застосування Епобіокрину є лікування симптоматичної анемії, пов’язаної з хронічною нирковою недостатністю: лікування анемії, пов’язаної з хронічною нирковою недостатністю, у дітей та дорослих на ГД та дорослих пацієнтів на ПД; лікування тяжкої анемії ниркового походження, що супроводжується клінічними симптомами, у дорослих пацієнтів із нирковою недостатністю, які ще не проходили ГД [11, 12]. Епобіокрин застосовується також для лікування анемії та зниження об’єму необхідних гемотрансфузій у дорослих пацієнтів, які отримують хіміотерапію з причини немієломної пухлини, злоякісної лімфоми або множинної мієломи та у яких підвищений ризик трансфузії, оцінений за загальним станом пацієнта (у тому числі серцево-судинний стан, існуюча анемія до початку хіміотерапії). Епобіокрин можна застосовувати у межах предепозитної програми перед значними хірургічними втручаннями пацієнтам із помірними проявами анемії (рівень гемоглобіну 10–13 г/дл) для полегшення відбору автологічної крові та зменшення ризику, пов’язаного з використанням алогенних гемотрансфузій, якщо очікувана потреба у крові для переливання перевищує кількість, яку можна одержати методом автологічного відбору без застосування епоетину альфа. Епобіокрин застосовують дорослим пацієнтам із легким та середнім ступенем анемії (гемоглобін у межах 10–13 г/дл за відсутності залізодефіциту) перед проведенням великих ортопедичних операцій з очікуваним середнім ступенем втрати крові (900–1800 мл крові) для зменшення потреби в алогенних гемотрансфузіях та полегшення відновлення системи еритропоезу.
Під час лікування Епобіокрином слід постійно контролювати артеріальний тиск у всіх пацієнтів. Препарат з обережністю застосовують пацієнтам із нелікованою артеріальною гіпертензією або незадовільним її контролем. При лікуванні Епобіокрином може виникнути необхідність розпочати або посилити антигіпертензивну терапію. Якщо тиск не вдається контролювати, застосування епоетину альфа слід припинити. Перед початком лікування епоетином альфа слід ретельно зважити ризики судинних захворювань з тромботичними ускладненнями, особливо в пацієнтів із наявними факторами ризику, включаючи надмірну масу тіла та судинні захворювання в анамнезі (наприклад, тромбоз глибоких вен, легенева емболія та інсульт).
Слід ретельно контролювати рівень гемоглобіну в усіх пацієнтів через потенційний підвищений ризик тромбоемболічних ускладнень та летального кінця у випадку застосування препарату при рівні гемоглобіну, вищому від цільового у показаннях для застосування.
Публікації останніх років присвячуються питанням міжнародних відмінностей у методах оцінки й лікування анемії при ХХН, типах ЕСА й ризику виникнення термінальної стадії ниркової недостатності й смертності в пацієнтів із недіалізною і діалізною ХХН [13–16]. Крос-секційний аналіз лабораторного моніторингу, поширеності й лікування анемії в межах проспективного дослідження CKDopps включив 6766 учасників із ХХН 3а–5ND із нефрологічних клінік Бразилії, Франції, Німеччини і США. Отримані результати продемонстрували, що анемія на різних стадіях ХХН була більш поширеною в США і Бразилії, ніж у Франції і Німеччині. Частка пацієнтів з анемією з рівнем феритину < 100 нг/мл або сатурацією трансферину < 20 % варіювалася від 42 % в Бразилії до 53 % у Франції і Німеччині. Частка пацієнтів із гемоглобіном < 10 г/дл, які отримували ЕСА, коливалась від 28 % в США до 57 % у Німеччині [16]. Отримані результати підтверджують концепцію, згідно з якою лікування анемії серед пацієнтів із недіалізною ХХН в реальних умовах не є оптимальним [13].
Також пандемія коронавірусної інфекції внесла корективи в перебіг низки захворювань, ускладнюючись розвитком сепсису, гострого ураження нирок (ГУН), поліорганної недостатності та атипової форми гострого респіраторного дистрес-синдрому. Анемія й порушення обміну заліза часто зустрічаються в пацієнтів із COVID-19. В обсерваційному дослідженні серед 11 265 пацієнтів із 13 академічних лікарень Нью-Йорка, госпіталізованих з 1 березня по 27 квітня 2020 року, підвищення рівня D-димера було пов’язане з більш низьким медіанним рівнем гемоглобіну й більш високим рівнем феритину сироватки крові. Аналогічна ситуація відмічалась у пацієнтів із COVID-19 і ГУН, і в пацієнтів на програмному діалізі [17, 18]. У пацієнтів із тяжкою формою COVID-19 часто спостерігається інтенсивна запальна фаза і протромботичний стан. У цих випадках ефективність ЕСА обмежена, і вони можуть навіть бути потенційно небезпечними. Fishbane зі співавт. пропонує уникати терапії ЕСА [18]. У випадку програмного діалізу, якщо пацієнт вже знаходився на цьому лікуванні, автори рекомендують продовжити ЕСА в тій же дозі, але з метою досягнення більш низьких цільових показників гемоглобіну (8–9 г/дл). Деякі інші автори розмірковують про потенційну роль HIF-PHD як захисних агентів проти COVID-19 [19]. Що стосується препаратів заліза, то системні запальні процеси, у тому числі і при тяжкій формі COVID-19, знижують доступність заліза. Крім того, залізо сприяє реплікації вірусів й асоціюється з поганим прогнозом [20, 21].
Анемія — найчастіше ускладнення в пацієнтів із ХХН, пов’язане зі зниженням якості життя, а також із підвищеною захворюваністю та смертністю. Патогенез анемії при ХХН є багатофакторним і складним, але найбільш важливими механізмами є дефіцит заліза й відносне зниження продукції еритропоетину [22, 23]. Ці патофізіологічні процеси є основою сучасного лікування анемії при ХХН. Лікування ЕСА компенсує недостатню продукцію еритропоетину, зменшує гіпертрофію лівого шлуночка, сприяє достатньому постачанню тканин організму киснем, покращує фізичне самопочуття, розумові здібності, якість і тривалість життя пацієнта з анемією. Раннє лікування ниркової анемії покращує віддалений прогноз пацієнтів із ХХН. Даний підхід має потенційну перевагу у вигляді профілактики розвитку серцево-судинних ускладнень і дозволяє зробити більш оптимістичний прогноз про стан серцево-судинної системи пацієнта та його соціально-професійну реабілітацію.
Конфлікт інтересів. Не заявлений.
Рецензенти: зав. відділом дитячої урології ДУ «Інститут урології НАМНУ», д.м.н. Петербургський В.Ф.; завідувач кафедри педіатрії № 2 НУОЗ України імені П.Л. Шупика, д.м.н., професор Марушко Т.В.
Отримано/Received 04.05.2021
Рецензовано/Revised 18.05.2021
Прийнято до друку/Accepted 28.05.2021

/56.jpg)