Жовчні кислоти (ЖК) є основними складовими жовчі, вони поділяються на первинні ЖК — холева кислота (ХК) і хенодезоксихолева кислота (ХДХК), вторинні ЖК — дезоксихолева кислота (ДХК) і літохолева кислота (ЛХК) і третинні ЖК — урсодезоксихолева кислота (УДХК) [1] .
Первинні ЖК синтезуються в печінці з холестерину й накопичуються в жовчному міхурі. Після прийому їжі ЖК із жовчного міхура виділяються у дванадцятипалу кишку, де, у свою чергу, відбувається синтез вторинних ЖК (кишкова мікробіота модифікує первинні ЖК під час реакцій 7α-дегідроксилювання, декон’югації, окиснення, епімеризації гідроксильних груп) [2].
Вторинні ЖК утворюються в процесі дегідроксилювання ХК і ХДХК відповідно. Епімеризація гідроксильних груп ХДХК під впливом гідроксистероїд-дегідрогенази приводить до утворення третинної ЖК — УДХК (рис. 1).
Далі в результаті її кон’югації з таурином утворюється тауроурсодезоксихолева кислота. Потім ЖК перенаправляються в печінку через ворітну вену (ентерогепатична циркуляція), 95 % некон’югованих ЖК реабсорбуються ентероцитами в процесі пасивної дифузії в порожній і товстій кишці, а кон’юговані ЖК завдяки активній дифузії поглинаються в клубовій кишці за допомогою специфічних ЖК натрійзалежних транспортних білків. 5 % некон’югованих ЖК виводяться з фекаліями. Більшість ЖК, адсорбованих ентероцитами й секретованих у ворітну вену, надходять до печінки для рециркуляції. 10 % ЖК потрапляють у системну циркуляцію [2, 4].
Особливу увагу клініцистів і вчених привертає УДХК. Її хімічну структуру було визначено японським хіміком Т. Iwasaki в 1936 р. У 1954 р. японський вчений T. Kanazawa і співавт. вперше синтезували УДХК і описали метод її синтезу [5].
Застосування УДХК у медицині почалося у другій половині XX століття, коли в 1957 р. компанія Tokyo Tanabe (Японія) зареєструвала її під торговою назвою Urso, що стало поштовхом для вивчення й відкритя цілющих властивостей УДХК, які тривають і донині.
За сучасними уявленнями, УДХК має холеретичну, літолітичну, антиапоптичну, протизапальну, імуномодулюючу, цитопротективну, антифібротичну й гіпохолестеринемічну дію, що можуть відбуватися одночасно за декількома різними механізмами [2, 5, 6].
Механізми дії УДХК:
— холеретичний: досягається витісненням пулу токсичних гідрофобних ЖК за рахунок конкурентного захвату в клубовій кишці; індукцією бікарбонатного холерезу, що приводить до посилення виведення гідрофобних ЖК у кишечник; стимуляцією екзоцитозу в гепатоцитах шляхом активації Са2+-залежної α-протеїнкінази, що веде до зменшення концентрації гідрофобних ЖК;
— літолітичний: зменшення вмісту холестерину в жовчі із зниженням її літогенності; стимуляція виходу холестерину з конкрементів у жовч; модуляція структури і складу змішаних міцел у жовчі з великим вмістом фосфоліпідів; зменшення кишкової абсорбції холестерином; зниження синтезу холестерину в печінці; збільшення постпрандіальної скоротливості жовчного міхура;
— антиапоптичний: зниження концентрації іонізованого кальцію в клітинах; активація рецепторів епідермального фактора росту, що запобігає вивільненню мітохондріального цитохрому С з блокадою активації каспаз і апоптозу гепатоцитів і холангіоцитів; iнгібування пошкодження клітин, що викликається токсичними жовчними кислотами/алкоголем/вірусами; перешкоджання збільшенню експресії фактора некрозу пухлини α; регуляція проникності мітохондріальної мембрани; інгібування перекисного окиснення ліпідів і стимуляція антиоксидантної активності; зміна метаболізму простагландинів і жирних кислот; пряме зв’язування УДХК з глюкокортикоїдними рецепторами й транслокація зазначеного комплексу в ядро клітини;
— протизапальний: помірно пригнічує експресію HLA-антигенів I класу на гепатоцитах і продукцію прозапальних цитокінів, фагоцитоз, реакції перекисного окиснення. УДХК покращує показники клітинного імунітету в м’язовій оболонці жовчного міхура у пацієнтів із жовчнокам’яною хворобою. Інгібування активації NF-kB УДХК зумовлює пригнічення синтезу ключових прозапальних цитокінів;
— імуномодулюючий: виявляється в зниженні експресії молекул HLA I класу на гепатоцитах і HLA II класу на холангіоцитах, а також в зменшенні продукції Тh1- і Th2-цитокінів (фактор некрозу пухлини, γ-інтерферон, інтерлейкіни-1, -2, -4 і -6) і синтезу імуноглобулінів;
— цитопротективний: утворення подвійних молекул, що вбудовуються в клітинну мембрану, з підвищенням стійкості до токсичного впливу; зменшення концентрації токсичних ЖК; утворення змішаних міцел з токсичними ЖК (ХДХК, ЛХК, ДХК);
— антифібротичний: зменшення вивільнення мітохондріального цитохрому С, лужної фосфатази й лактатдегідрогенази; інгібування проліферативної активності фібробластів, зменшення функціональної активності зірчастих клітин, безпосереднє пригнічення перисинусоїдального колагеноутворення;
— гіпохолестеринемічний: полягає в зменшенні всмоктування холестерину в кишечнику, зниженні його синтезу в печінці й екскреції в жовч.
Хоча основні ефекти УДХК відомі й обґрунтовуються численними, у тому числі експериментальними, дослідженнями [4–8], механізми її дії досі вивчаються, особливо на субклітинному рівні. У цьому аспекті привертає увагу теорія біліарної гідрокарбонатної «парасольки».
Згідно з цією теорією холангіоцити захищають свою апікальну поверхню від неполярних гідрофобних мономерів ЖК, солі яких індукують їх апоптоз [9].
Головною у цьому процесі є секреція HCO3 у кількостях досить високих, щоб сформувати «парасольку» HCO3 на зовнішній поверхні апікальної мембрани. Тобто біліарна «парасолька» забезпечує захисний бар’єр холангіоцитів проти ЖК і запобігає накопиченню токсичних ЖК у клітинах.
Порушення нормальної експресії специфічних поверхневих рецепторів холангіоцитів (TRG5, P2Y), що беруть участь в утворенні HCO3, може послабити біліарну «парасольку» й сприяти розвитку фіброзуючого або склерозуючого холангіту [10].
Доведено, що терапевтичні агенти, такі як УДХК або нор-УДХК, стабілізують біліарну «парасольку» HCO3. Крім того, показано, що біліарна «парасолька» має здатність посилювати потік жовчі, що знижує токсичність за рахунок зменшення часу проходження жовчі [8, 9].
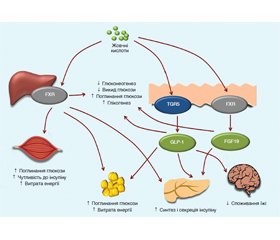
Останніми роками увагу дослідників привертають гіпохолестеринемічний і гіполіпідемічний ефекти УДХК. Відомо, що ЖК є сигнальними молекулами, що здатні активувати спеціальні рецептори, які впливають на метаболізм ЖК і ліпідів [11, 12]. Найбільш вивченими є фарнезоїдний Х-рецептор (FXR) (бере участь у регуляції біосинтезу й транспорту ЖК) і мембранний рецептор Такеда-G-білка 5 (TGR5), що зумовлює появу системних сигнальних ефектів за межами ентерогепатичних тканин.
FXR — ядерний рецептор, ендогенним лігандом якого є ЖК. Зв’язуючись з ЖК у цитоплазмі, FXR транспортується в ядро, де активує експресію безлічі генів. Так, активація FXR позитивно впливає на гомеостаз ліпідів, ЖК і глюкози, приводить до зниження рівня запалення в пошкодженій печінці й прискорює її регенерацію [13, 14].
G-білковий рецептор TGR5 був описаний через три роки після відкриття FXR, він також активується за допомогою ЖК. У людини ген TGR5 локалізується на хромосомі 2q35. Рецептор включає сім трансмембранних спіралей, три позаклітинні петлі, які сприяють зв’язуванню ліганда, і три внутрішньоклітинні петлі, які беруть участь в опосередкованій передачі сигналу всередину клітини за течією сигнальних молекул [15]. Був доведений широкий розподіл рецепторів у тканинах тварин і людини, у тому числі у вісцеральних органах, головному й спинному мозку, клітинах ендокринних залоз, адипоцитах, а також імунних органах, таких як селезінка й лімфатичні вузли [16, 17].
Так, активація FXR і TGR5 під дією ЖК призводить до інгібування глюконеогенезу й сприяє синтезу глікогену в печінці, глюкозоопосередкованому вивільненню інсуліну в підшлунковій залозі, збільшенню витрати енергії, особливо в скелетній мускулатурі й коричневій жировій тканині. У головному мозку під дією ЖК TGR5-опосередкованого сигнального шляху з’являється відчуття ситості (рис. 3).
Основна робота з вивчення ролі FXR у цих процесах була проведена на мишачих моделях.
В експерименті на мишах доведено, що стимуляція FXR зменшує тригліцеридемію і рівень тригліцеридів у печінці за допомогою зниження експресії ліпогенних генів і їх регуляторів, включаючи стерол-регулюючий білок-1c (SREBP1c), синтазу жирних кислот (FASN), і навпаки, дефіцит FXR у мишей призводить до значної гіпертригліцеридемії [18]. Отже, ЖК, зв’язуючись із FXR, відіграють роль метаболічних інтеграторів у контролі рівня жирів і глюкози, а також регулюють енергетичний метаболізм, модулюючи експресію генів.
Так, в експерименті цілеспрямоване руйнування TGR5 не призводить до порушення органогенезу й зниження фертильності. У той же час у печінці збільшується експресія цитохромів і білків, залучених до синтезу й транспорту ЖК, проте концентрація ЖК у крові не підвищується. З іншого боку, TGR5-негативні миші мають порушення архітектоніки епітеліоцитів кишечника, що призводить до значного збільшення кишкової проникності, пов’язаної з надлишковою клітинною експресією основних білків в епітеліальних клітинах ободової кишки [19].
Також отримані дані про гендерні відмінності, пов’язані з регулюванням метаболічних процесів через TGR5. Доведено значне підвищення маси тіла при дієті з високим вмістом жирів у TGR5-негативних особин жіночої статі [19].
Антиатеросклеротична дія активації TGR5 проявляється зменшенням розміру атеросклеротичних бляшок і зниженням активності запального процесу всередині самої атеросклеротичної бляшки. Так, більш виражений вплив на процес формування атеросклеротичних змін при активації TGR5 відзначається у TGR5-позитивних мишей, тоді як у TGR5-негативних особин цей ефект менш помітний. Крім того, в експериментальних дослідженнях на ендотеліальних клітинах активація TGR5 збільшує вироблення оксиду азоту (NO), що є однією з ключових антиатерогенних молекул [20].
Привертають увагу дані експериментальних досліджень щодо відмінностей профілю ЖК у сироватці крові у хворих з коронарним атеросклерозом і без нього. Виявлено, що при атеросклеротичному ураженні відзначається вірогідне зниження концентрації ЛХК — одного з найбільш потужних активаторів TGR5 [21]. Можливо, нестача ЛХК може зменшувати протизапальну TGR5-сигналізацію на макрофаги. Однак ця ідея вимагає подальшого вивчення.
В інших експериментальних дослідженнях показано, що стимуляція TGR5 індукує секрецію глюкагоноподібного пептиду 1 (ГПП-1) ентерохромафінними клітинами кишечника, у відповідь на що підвищується синтез інсуліну бета-клітинами підшлункової залози. Отримані результати дозволяють розглядати стимуляцію TGR5 як мішень у лікуванні цукрового діабету. Це підтверджено в клінічному дослідженні на здорових добровольцях, яким у формі ректальних клізм вводили таурохолат натрію (агоніст TGR5), що призводило до швидкого збільшення концентрації циркулюючого ГПП-1 [22].
У даний час велика кількість досліджень присвячена вивченню терапевтичних ефектів УДХК як у моно-, так і комбінованій терапії.
У клінічному дослідженні Л.А. Звенигородської і співавт. доведена необхідність одночасного застосування препаратів УДХК при призначенні статинів хворим з атерогенною дисліпідемією і вираженим цитолітичним синдромом [23]. Ця комбінація приводить до нормалізації біохімічних проб печінки і позитивної динаміки в структурі печінки. Так, за даними морфології, на початку в пацієнтів при біопсії печінки індекс гістологічної активності (ІГА) становив 8 (1-3-3-1), за висновком з дослідження біоптату мав місце хронічний портальний і лобулярний гепатит низького ступеня активності. Після лікування препаратом УДХК у дозі 1 г/добу і симвастатином 10 мг/добу упродовж 5 місяців при повторному дослідженні рівень ІГА становив 2 (0-0-1-1), а за висновком з дослідження біоптату мав місце хронічний вогнищевий портальний гепатит мінімального ступеня активності. Отже, на тлі комбінованої терапії статинами і УДХК відзначена позитивна динаміка, яка полягає в переході дисліпідемії IIb степеня у менш атерогенну — IIа ступеня. Також за даними контрольної біопсії печінки відзначені зменшення ІГА, нормалізація діаметра портальних трактів, зменшення їх фіброзу й інфільтрації лімфоцитами, відсутність перипортальних некрозів, гіперплазії ретикуло-ендотеліальної системи, зменшення ознак холестазу.
В іспанському дослідженні R. Caberas Gelabert показано, що при призначенні комбінованої терапії симвастатином (20 мг/добу) і УДХК (300 мг/добу) протягом 4 міс. порівняно з монотерапією симвастатином (40 мг/добу) було досягнуто більш виражене зниження рівня ліпопротеїдів низької щільності (р = 0, 0034). Аналогічний результат був отриманий в цьому ж дослідженні у групі хворих, які приймали аторвастатин (20 мг/добу) і УДХК (300 мг/добу) 4 міс., порівняно з монотерапією аторвастатином в дозі 40 мг/добу (р = 0,0037). Це дає змогу дійти висновку, що ефективність комбінації УДХК і малих доз статинів вища, ніж при використанні їх подвійної дози [5].
Французькими вченими також вивчалися гіполіпідемічні властивості УДХК у пацієнтів із синдромом короткого кишечника, які перебували на парентеральному харчуванні й отримували УДХК (20 мг/кг/добу) протягом 4 місяців [24]. Доведено, що синдром короткого кишечника асоційований з вираженою дисліпідемією (обумовленою зниженням концентрації ЖК/мальабсорбцією) і патологією печінки, індукованою недостатністю кишечника. Проаналізувавши отримані результати, автори дійшли висновку, що прийом УДХК сприяв вірогідному (р < 0,05) зниженню синтезу холестерину, зменшенню фракційної швидкості синтезу холестерину й тригліцеридів, що дало змогу рекомендувати призначати УДХК пацієнтам із синдромом короткого кишечника для корекції дисліпідемії [24].
Вивчення специфічних властивостей ЖК, їх внутрішньої активності й селективності щодо певних рецепторів спонукало до розробки нових модуляторів цих рецепторів з покращеними фармакокінетичними й фармакодинамічними профілями. Це привело до синтезу декількох напівсинтетичних похідних ЖК.
Особливий інтерес становлять нові препарати, які перебувають у III фазі клінічних досліджень.
Обетихолева кислота — напівсинтетичне похідне ХДХК, функціонує як агоніст фарнезоїдного Х-рецептора. Зареєстрована в США і схвалена Європейським медичним агентством для лікування первинного біліарного холангіту в дорослих пацієнтів у комбінації з УДХК у тих випадках, коли є адекватна відповідь на монотерапію УДХК [8, 25]. Монотерапія обетихолевою кислотою призначається, коли пацієнти не можуть отримувати лікування УДХК. На сьогодні даний препарат вивчається в клінічному дослідженні III фази під назвою REGENERATE, тривалість дослідження — 6 років.
Ще один препарат, який перебуває в III фазі клінічних досліджень, це елафібранор. Він служить подвійним (α-, δ-) агоністом PPAR-рецепторів. Ефективність і безпеку елафібранору вивчали в подвійному сліпому рандомізованому плацебо-контрольованому міжнародному дослідженні IIb фази GOLDEN-505. Елафібранор вірогідно знижував рівні загального холестерину, ліпопротеїдів низької щільності, підвищував концентрацію ліпопротеїдів високої щільності, сприяв нормалізації глюкози в осіб із цукровим діабетом. Отримані дані і далі вивчаються в дослідженні III фази під назвою RESOLVE-IT [25].
Новий актуальний напрямок — дослідження нейропротективних властивостей УДХК. В експерименті УДХК істотно покращує функції і морфологію мітохондрій, на що вказує підвищення АТФ, падіння рівня фактора некрозу пухлини, зниження активності каспаз 8, 9 і 3, позитивно впливає на функціонування дофамінергічних нейронів, покращуючи вироблення дофаміну в смугастому тілі, у зв’язку з антиапоптичною і протизапальною дією знижує нейротоксичність. Вищеназване може бути перспективним для лікування хвороби Паркінсона, Хантінгтона та інших нейродегенеративних захворювань [26].
Іншою цікавою властивістю УДХК, що вивчається в аспекті нейродегенеративних захворювань, є здатність впливати на утворення/перетворення пріонів. Пріони — особливий клас інфекційних агентів, білки з аномальною тривимірною структурою. Використовуючи функції живих клітин, вони здатні згортати в аномальні структури нормально укладені білки. При цьому запускається ланцюгова реакція, що призводить до утворення амілоїдів. Захворювання, що викликаються пріонами (куру, хвороба Крейтцфельдта — Якоба), у даний час вважаються невиліковними, оскільки пріони мають надзвичайно високу стабільність. На моделях культур клітин мозку мишей, гостро й хронічно інфікованих пріонами, вдалося показати, що в присутності УДХК істотно знижується перетворення пріонних білків в аномальні. УДХК забезпечувала зменшення астроцитозу й вірогідно збільшувала виживання пріон-інфікованих мишей. Отже, УДХК може вважаться перспективним препаратом для лікування пріонних захворювань, діючи як на конверсію пріонних білків, так і нейропротективно [27].
Плейотропні ефекти УДХК у довгостроковій перспективі приводять до уповільнення прогресування захворювання, істотного збільшення тривалості життя, покращання суб’єктивного статусу і якості життя. А з такою кількістю ефектів пов’язана різноманітність нозологічних форм, при яких дана речовина може успішно використовуватися.
Оптимальним лікарським препаратом урсодезоксихолевої кислоти є Урсофальк. Урсофальк виробляється в Німеччині з 1979 р. на заводі Losan Pharma з якісної субстанції та із застосуванням найсучасніших технологій. Це дозволяє забезпечити більш високу стабільність діючої речовини порівняно з іншими препаратами УДХК. Відповідно більш висока стабільність діючої речовини забезпечує більш високу клінічну ефективність препарату Урсофальк, надійний і тривалий клінічний ефект. Практично всі дослідження з клінічної ефективності УДХК проводилися із застосуванням оригінального німецького препарату Урсофальк починаючи з 1979 року. На сьогодні опубліковано більше ніж 4 тисячі наукових робіт з Урсофальком. Це підтверджує високу якість препарату, і саме Урсофальк застосовується в більшості країн Євросоюзу.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Інформація про фінансування. Під час написання даної роботи не було якогось фінансування.
Внесок авторів: Степанов Ю.М. — концепція і дизайн дослідження; Саленко А.В. — аналіз літературних джерел, огляд літератури, редагування статті.
Отримано/Received 10.05.2021
Рецензовано/Revised 17.05.2021
Прийнято до друку/Accepted 25.05.2021

/66.jpg)
/67.jpg)
/68.jpg)