Журнал "Гастроэнтерология" Том 55, №2, 2021
Вернуться к номеру
Маркери прогресування фіброзних змін печінки в пацієнтів із хронічним токсичним гепатитом медикаментозного генезу
Авторы: Діденко В.І., Татарчук О.М., Петішко О.П., Коненко І.С., Меланіч С.Л.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
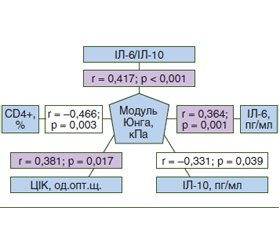
Актуальність. Останнім часом внаслідок зростаючої експансії фармацевтичного ринку спостерігається чітка тенденція до збільшення кількості випадків захворюваності на хронічний токсичний гепатит медикаментозного генезу (ТГМ). Появу фіброзу вважають найважливішою гістологічною зміною, що визначає подальший перебіг захворювання. Тому актуальним питанням у клінічній практиці залишається пошук неінвазивних або малоінвазивних маркерів оцінки фіброзних змін печінки. Мета дослідження: визначити діагностичну цінність імунологічних показників для стратифікації вираженості фіброзу печінки в пацієнтів із ТГМ. Матеріали та методи. У дослідження включені пацієнти з ТГМ (n = 41), які були розподілені на три групи: І групу становили 12 хворих без фіброзу печінки (F0), ІІ групу — 22 хворі з помірним фіброзом (F1–F2), ІІІ групу — 7 пацієнтів із вираженим фіброзом печінки (F3–F4). Зсувнохвильову еластографію (SWE) проводили на апараті Soneus P7 (Україна, Швейцарія). Усім хворим здійснено біохімічне дослідження крові з визначенням аланінамінотрансферази (АЛТ), аспартатамінотрансферази (АСТ). Оцінювали субпопуляційний склад лімфоцитів, циркулюючі імунні комплекси (ЦІК), рівень інтерлейкінів (ІЛ-6, ІЛ-10) та фактора некрозу пухлини α. Результати. Прогресування фіброзу печінки супроводжується зростанням цитолітичного синдрому: у хворих із вираженим фіброзом спостерігається збільшення вмісту АЛТ у 3,3 раза (р < 0,05) порівняно з контролем та у 2,1 раза (р > 0,05) порівняно з рівнем у хворих із помірним фіброзом. Рівень АСТ вірогідно вище в 4,6 раза (р = 0,023) у пацієнтів із вираженим фіброзом, ніж у хворих із помірним фіброзом. При прогресуванні фіброзу печінки спостерігаються вірогідне зниження клітинного імунітету, збільшення рівня ЦІК та прозапальних цитокінів з одночасним зменшенням вмісту протизапальних цитокінів, що підтверджується кореляційними зв’язками показника жорсткості печінки, за даними SWE, із рівнем Т-хелперів (r = –0,466; р = 0,03), IЛ-6 (r = 0,364; р = 0,01), ІЛ-10 (r = –0,331; р = 0,039) та ЦІК (r = 0,381; р = 0,017). Висновки. Маркерами діагностики вираженого фіброзу печінки у хворих на ТГМ є такі показники, як коефіцієнт співвідношення ІЛ-6/ІЛ-10 вище 0,83 (чутливість — 81,8 %, специфічність — 78,9 %), рівень ЦІК понад 4,3 од.опт.щ. (чутливість — 77,3 %, специфічність — 72,2 %), коефіцієнт співвідношення Т-хелпери/Т-супресори нижче або дорівнює 1,6 (чутливість — 72,7 %, специфічність — 57,9 %).
Background. In recent years, as a result of the growing expansion of the pharmaceutical market, there has been a clear trend towards an increase in the incidence of chronic toxic drug-induced hepatitis of drug genesis (TDIH). The appearance of fibrosis is considered the most important histological change that determines the further course of the disease. Therefore, the search for non-invasive or minimally invasive markers for assessing fibrotic changes in the liver remains an urgent issue in clinical practice. The purpose was to determine the diagnostic value of immunological parameters for stratification of the severity of liver fibrosis in patients with TDIH. Materials and methods. The study included 41 patients with TDIH, who were divided into three groups: group I consisted of 12 people without liver fibrosis (F0), group II — 22 patients with moderate fibrosis (F1-F2), group III — 7 individuals with severe liver fibrosis (F3-F4). Shear wave elastography was performed using a Soneus P7 system (Ukraine-Switzerland). All patients underwent a biochemical blood test with the determination of alanine aminotransferase (ALT), aspartate aminotransferase (AST). The subpopulation composition of lymphocytes, circulating immune complexes (CIC), the level of interleukins (IL-6, IL-10) and tumor necrosis factor α were assessed. Results. The progression of liver fibrosis is accompanied by an increase in cytolytic syndrome: patients with severe fibrosis have a 3.3-fold increase in the ALT (p < 0.05) compared to the controls and a 2.1-fold (p < 0.05) compared to that in patients with moderate fibrosis. The AST level is significantly higher — by 4.6 times (p = 0.023) in patients with severe fibrosis than in those with moderate fibrosis. With the progression of liver fibrosis, there is a significant decrease in cellular immunity, an increase in the level of CIC and pro-inflammatory cytokines with a simultaneous decrease in the content of anti-inflammatory cytokines, which is confirmed by correlations between the liver stiffness index according to shear wave elastography data and the level of T-helpers (r = –0.466; p = 0.03), IL-6 (r = 0.364; p = 0.01), IL-10 (r = –0.331; p = 0.039) and CIC (r = 0.381; p = 0.017). Conclusions. Markers of the diagnosis of severe liver fibrosis in patients with TDIH are indicators such as the ratio of IL-6/IL-10 higher than 0.83 (sensitivity 81.8 %, specificity 78.9 %), CIC level more than 4.3 optical density units (sensitivity 77.3 %, specificity 72.2 %), the ratio of T-helpers/T-suppressors is less than or equal to 1.6 (sensitivity 72.7 %, specificity 57.9 %).
хронічний токсичний гепатит медикаментозного генезу; фіброз печінки; діагностичні маркери
chronic toxic drug-induced hepatitis; liver fibrosis; diagnostic markers
Вступ
Матеріали та методи
Результати
/43.jpg)
Обговорення
Висновки
- Sandhu N., Navarro V. Drug-induced liver injury in GI practice. Hepatol. Commun. 2020. Vol. 4(5). P. 631-645.
- Danan G., Teschke R. RUCAM in drug and herb induced liver injury: the update. Int. J. Mol. Sci. 2016. № 17. P. 14.
- Hastings K.L. et al. Beyond metabolism: role of the immune system in hepatic toxicity. Int. J. Toxicol. 2020. Vol. 39(2). P. 151-164.
- Ibrahim E.A., Moawed F.S.M., Moustafa E.M. Suppression of inflammatory cascades via novel cinnamic acid nanoparticles in acute hepatitis rat model. Arch. Biochem. Biophys. 2020. № 696. 108658.
- Maiuri A.R. et al. Synergistic cytotoxicity from drugs and cytokines in vitro as an approach to classify drugs according to their potential to cause idiosyncratic hepatotoxicity: a proof-of-concept study. J. Pharmacol. Exp. Ther. 2017. Vol. 362(3). P. 459-473.
- Mannaa F.A., Abdel-Wahhab K.G. Physiological potential of cytokines and liver damages. Hepatoma Res. 2016. № 2. P. 131-143.
- Caballería L. et al. High prevalence of liver fibrosis among European adults with unknown liver disease: a population-based study. Clin. Gastroenterol. Hepatol. 2018. Vol. 16(7). P. 1138-1145.e5.
- Діденко В.І., Кленіна І.А., Татарчук О.М., Петішко О.П. Зв’язок імунологічних та біохімічних показників у хворих на хронічні дифузні захворювання печінки залежно від етіологічних факторів розвитку стеатозу і фіброзу печінки. Гастроентерологія. 2019. T. 53. № 2. С. 115-122.
- Niederreiter L., Til H. Cytokines and fatty liver diseases. Liver Research. 2018. Vol. 2(1). P. 14-20.
- Srivastava A. et al. Prospective evaluation of a primary care referral pathway for patients with non-alcoholic fatty liver disease. J. Hepatol. 2019. Vol. 71(2). P. 371-378.
- Діденко В.І., Татарчук О.М., Меланіч С.Л., Петішко О.П. Особливості показників функціонального стану печінки, імунної ланки, цитокінової регуляції та вуглеводного обміну у хворих на хронічні дифузні захворювання печінки токсичного генезу. Гастроентерологія. 2020. Т. 54. № 2. С. 88-95.
- European association for the study of the liver. EASL clinical practice guidelines: drug-induced liver injury. J. Hepatol. 2019. № 70. P. 1222-1261.
- Діденко В.І. та ін. Діагностичні маркери прогресування фіброзних змін печінки у хворих на хронічні дифузні захворювання алкогольного генезу. Вісник медичних і біологічних досліджень. 2020. № 3(5). С. 47-52.
- Ивашкин В.Т. и др. Лекарственные поражения печени (клинические рекомендации для врачей). Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2019. Т. 29. № 1. С. 101-131.
- Thiele M. et al. Transient and 2-dimensional shear-wave elastography provide comparable assessment of alcoholic liver fibrosis and cirrhosis. Gastroenterology. 2016. Vol. 150. № 1. P. 123-133.
- Boutari C., Perakakis N., Mantzoros C.S. Association of adipokines with development and progression of nonalcoholic fatty liver disease. Endocrinol. Metab. 2018. Vol. 33(1). P. 33-43.

/41.jpg)
/41_2.jpg)
/42.jpg)
/42_2.jpg)
/43_2.jpg)