Журнал "Гастроэнтерология" Том 55, №2, 2021
Вернуться к номеру
Гастроінтестинальні порушення в пацієнтів, які перехворіли на COVID-19: як діагностувати й лікувати в умовах пандем
Авторы: Палій І.Г.(1), Заїка С.В.(1), Чернова І.В.(1), Євтодій І.М.(2), Палій Д.В.(1)
(1) — Вінницький національний медичний університет імені М.І. Пирогова, м. Вінниця, Україна
(2) — КНП «Хмільницький ЦПМСД», м. Хмільник, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
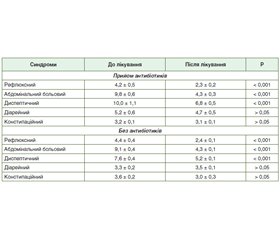
Актуальність. Пандемія, викликана коронавірусним захворюванням 2019 року (COVID-19), — тема, що зараз перебуває в центрі уваги світової спільноти. Використання значною кількістю пацієнтів в умовах пандемії COVID-19 нестероїдних протизапальних препаратів (НПЗП) у комбінації з новими пероральними антикоагулянтами (дабігатран, ривароксабан, апіксабан тощо) та ацетилсаліциловою кислотою (АСК) ставить питання про безпеку щодо впливу кожного з цих препаратів на ризик виникнення ускладнень з боку шлунково-кишкового тракту. Мета роботи: за допомогою опитувальника GSRS (Gastrointestinal Symptom Rating Scale) вивчити наявність гастроінтестинальних розладів у реконвалесцентів після COVID-19 та оцінити ефективність езомепразолу щодо корекції таких порушень. Матеріали та методи. Нами були проанкетовані 92 особи (48 чоловіків і 44 жінки), які є реконвалесцентами після COVID-19. Середній вік пацієнтів становив (49,2 ± 2,0) року. Для проведення опитування хворих, які перенесли COVID-19, нами була розроблена анкета, у якій зазначались паспортні дані пацієнта, вік, стать. Крім того, пацієнти зазначали, яким методом був діагностований COVID-19, які фармакопрепарати вони приймали під час лікування і чи була в них потреба в кисневій терапії. Надалі реконвалесценти після COVID-19 відповідали на запитання GSRS. За результатами опитувальника GSRS хворим призначався езомепразол (Езонекса) у дозі 20 мг 1 раз на добу за 30 хв до їди на 30 днів. Під час контрольного опитування на 30 добу прийому езомепразолу пацієнти повторно відповідали на запитання GSRS. Результати. Езомепразол у дозі 20 мг 1 раз на добу виявився однаково ефективним (р > 0,05) відносно динаміки вираженості синдромів як у хворих, які приймали парацетамол + 1 НПЗП, так і у хворих, які отримували парацетамол і 2 НПЗП. Зокрема, у пацієнтів, які отримували парацетамол + 1 НПЗП, на тлі прийому езомепразолу вираженість рефлюксного, абдомінального больового, диспептичного, діарейного і констипаційного синдрому становила (2,4 ± 0,1) бала, (4,3 ± 0,2) бала, (5,8 ± 0,3) бала, (4,1 ± 0,3) бала, (3,1 ± 0,1) бала, а у хворих, які приймали парацетамол + 2 НПЗП, — (2,1 ± 0,2) бала, (4,5 ± 0,4) бала, (6,7 ± 0,7) бала, (4,4 ± 0,7) бала, (3,0 ± 0,1) бала відповідно. Висновки. Езомепразол (Езонекса) ефективно зменшує (р < 0,001) вираженість рефлюксного, абдомінального больового й диспептичного синдромів у реконвалесцентів після COVID-19. Застосування езомепразолу (Езонекса) демонструє однакову ефективність (р > 0,05) як у чоловіків, так і в жінок при прийомі пацієнтами як АСК, так і ривароксабану і при лікуванні як парацетамолом + 1 НПЗП, так і парацетомолом + 2 НПЗП.
Background. The pandemic caused by the coronavirus disease 2019 (COVID-19) is a topic that is currently in the spotlight of the world community. The use of non-steroidal anti-inflammatory drugs (NSAIDs) in combination with new oral anticoagulants (dabigatran, rivaroxaban, apixaban, etc.) and acetylsalicylic acid by the significant number of patients during the pandemic, caused by COVID-19, raises the question about the safety of the influence of each drug on the occurrence of gastrointestinal complications. The development of algorithms to prevent damage to the gastrointestinal mucosa on the background of these drugs is becoming a priority. The purpose was to examine the presence of gastrointestinal disorders using the Gastrointestinal Symptom Rating Scale (GSRS) in convalescents after COVID-19 and to evaluate the effectiveness of esomeprazole for correction of these disorders. Materials and methods. We surveyed 92 (48 men and 44 women) convalescents after COVID-19. The mean age of individuals was (49.2 ± 2.0) years. To conduct a survey of patients who had COVID-19, we developed a questionnaire which included patient’s passport data, age, gender. In addition, patients reported how COVID-19 was diagnosed, what drugs they were taking during treatment, and whether they needed oxygen therapy. Subsequently, convalescents after COVID-19 answered questions from the GSRS. Information was collected and the questionnaire was completed by telephone survey. Depending on the data of GSRS, esomeprazole (Ezonexa) was prescribed to patients at a dose of 20 mg 1 time per day, 30 minutes before meals, for 30 days. During the follow-up survey on day 30 of esomeprazole intake, patients re-answered the GSRS questions. Results. Thirty days after starting esomeprazole intake at a dose of 20 mg 1 time per day, 92 convalescents after COVID-19 showed a significant reduction (p < 0.001) in the manifestations of reflux, abdominal pain and dyspeptic syndromes compared to the results before treatment ((2.3 ± 0.1), (4.3 ± 0.2), (5.7 ± 0.3) versus (4.3 ± 0.3), (9.3 ± 0.4), (8.6 ± 0.6), respectively). Esomeprazole was equally effective (p > 0.05) in influencing the severity of reflux, abdominal pain, dyspeptic, diarrheal and constipation syndromes in both men and women: (2.3 ± 0.1), (4.3 ± 0.2), (5.7 ± 0.3), (3.9 ± 0.3), (3.0 ± 0.1) versus (2.4 ± 0.1), (4.2 ± 0.2), (6.0 ± 0.4), (4.0 ± 0.4), (3.1 ± 0.1), respectively. Esomeprazole was also equally effective (p > 0.05) in the impact on the severity of reflux, abdominal pain, dyspeptic, diarrheal and constipation syndromes among patients receiving acetylsalicylic acid and those treated with rivaroxaban: (2.5 ± 0.2), (4.2 ± 0.2), (5.6 ± 0.2), (3.9 ± 0.4), (3.1 ± 0.1) versus (2.2 ± 0.1), (4.4 ± 0.3), (6.4 ± 0.6), (4.2 ± 0.4), (3.0 ± 0.1), respectively. Esomeprazole at a dose of 20 mg 1 time per day was equally effective (p > 0.05) in relation to the dynamics of the severity of syndromes in patients receiving paracetamol and one NSAID and in those receiving paracetamol and 2 NSAIDs. In particular, in people receiving paracetamol and one NSAID, on the background of esomeprazole administration, the severity of reflux, abdominal pain, dyspeptic, diarrheal and constipation syndromes were (2.4 ± 0.1), (4.3 ± 0.2), (5.8 ± 0.3), (4.1 ± 0.3), (3.1 ± 0.1) and in patients taking paracetamol and 2 NSAIDs — (2.1 ± 0.2), (4.5 ± 0.4), (6.7 ± 0.7), (4.4 ± 0.7), (3.0 ± 0.1), respectively. Conclusions. Esomeprazole (Ezonexa) effectively reduces (p < 0.001) the severity of reflux, abdominal pain and dyspeptic syndromes in convalescents after COVID-19. The use of Esomeprazole (Ezonexa) demonstrates the same efficacy (p > 0.05) in men and women when receiving both ASA and rivaroxaban and during the treatment with both paracetamol and one NSAID and paracetamol and 2 NSAIDs.
COVID-19; GSRS; нестероїдні протизапальні препарати; ривароксабан; ацетилсаліцилова кислота; езомепразол (Езонекса)
COVID-19; Gastrointestinal Symptom Rating Scale; non-steroidal anti-inflammatory drugs; rivaroxaban; acetylsalicylic acid; esomeprazole (Ezonexa)
Вступ
Матеріали та методи
Результати та обговорення
Висновки
- Каратеев А.Е., Насонов Е.Л., Лила А.М. Вызывают ли нестероидные противовоспалительные препараты специфические осложнения при коронавирусной инфекции COVID-19? Научно-практическая ревматология. 2020. № 58(3). С. 340-343. https://doi.org/10.14412/1995-4484-2020-340-343.
- Melville N.A., Nainggolan L. Are Warnings Against NSAIDs in COVID-19 Warranted? Medscape. 2020. March 17. https://www.medscape.com/viewarticle/926940.
- Палій І.Г., Заїка С.В., Янковецька А.Г. Ураження шлунково-кишкового тракту у хворих із патологією серцево-судинної системи, які приймають ацетилсаліцилову кислоту: синдромальна діагностика та можливі шляхи корекції. Сучасна гастроентерологія. 2018. № 1(99). С. 29-38.
- Бенца Т.М. Поражение пищеварительной системы нестероидными противовоспалительными препаратами. Раціональна фармакотерапія. 2007. № 4(5). https://rpht.com.ua/ru/archive/2007/4%285%29/article-67/porazhenie-pishchevaritelnoy-sistemy-nesteroidnymi-protivovospalitelnymi-preparatami.
- Lanas A. A review of the gastrointestinal safety data — a gastroenterologist’s perspective. Rheumatology (Oxford). 2010. № 49. Suppl. 2. Р. ii3-10. PMID: 20407138. doi: 10.1093/rheumatology/keq058.
- Ивашкин В.Т., Шептулин А.А., Маев И.В. и др. Клинические рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению эрозивно-язвенных поражений желудка и двенадцатиперстной кишки, вызванных нестероидными противовоспалительными препаратами. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2014. № 6. С. 89-94.
- Насонов Е.Л., Каратеев А.Е. Поражения желудка, связанные с приемом нестероидных противовоспалительных препаратов: часть 1. Клин. мед. 2000. № 3. С. 4-10.
- Rodriguez L., Hernandez-Diaz S. Risk of uncomplicated peptic ulcer users of aspirin and nonaspirin nonsteroidal anti-inflammatory drugs. Am. J. Epidemiol. 2004. № 159(1). P. 23-31. doi: 10.1093/aje/kwh005. PMID: 14693656.
- Peters R., Mehta S., Fox K. et al. Effects of aspirin dose when used alone or in combination with clopidogrel in patients with acute coronary syndromes: observations from the Clopidogrel in Unstable angina to prevent Recurrent Events (CURE) study. Circulation. 2003. № 108(14). P. 682-1687. doi:10.1161/01.CIR.0000091201.39590.CB.
- Hallas J., Dall M., Andries A. et al. Use of single and combined antithrombotic therapy and risk of serious upper gastrointestinal bleeding: population based case-control study. BMJ. 2006. № 333. P. 726. doi:10.1136/bmj.38947.697558.AE.
- Delaney J.A., Opatrny L., Brophy J.M., Suissa S. Drug drug interactions between antithrombotic medications and the risk of gastrointestinal bleeding. CMAJ. 2007. № 177. P. 347-351. doi: 10.1503/cmaj.070186.
- Eikelboom J.W., Wallentin L., Connolly S.J. et al. Risk of bleeding with 2 doses of dabigatran compared with warfarin in older and younger patients with atrial fibrillation: an analysis of the randomized evaluation of long-term anticoagulant therapy (RE-LY) trial. Circulation. 2011. № 23(21). P. 2363-2372. PMID: 21576658. DOI: 10.1161/CIRCULATIONAHA.110.004747.
- Schulman S., Kearon C., Kakkar A.K. et al. Dabigatran versus warfarin in the treatment of acute venous thromboembolism. N. Engl. J. Med. 2009. № 361(24). P. 2342-2352. DOI: 10.1056/NEJMoa0906598.
- Patel M.R., Mahaffey K.W., Garg J. et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N. Engl. J. Med. 2011. № 365(10). P. 883-891. DOI: 10.1056/NEJMoa1009638.
- Giugliano R.P., Ruff C.T., Braunwald Е. et al. Edoxaban versus warfarin in patients with atrial fibrillation. N. Engl. J. Med. 2013. № 369(22). P. 2093-2104. DOI: 10.1056/NEJMoa1310907.
- Granger C.B., Alexander J.H., McMurray J.J. et al. Apixaban versus warfarin in patients with atrial fibrillation. N. Engl. J. Med. 2011. № 365(11). P. 981-992. DOI: 10.1056/NEJMoa1107039.
- Miller C.S., Dorreen A., Martel M. et al. Risk of Gastrointestinal Bleeding in Patients Taking Non-Vitamin K Antagonist Oral Anticoagulants: A Systematic Review and Meta-analysis. Clin. Gastroenterol. Hepatol. 2017. № 15(11). P. 1674-1683. DOI: 10.1016/j.cgh.2017.04.031.
- Карасева Г.А. НПВП-индуцированная гастропатия: от понимания механизмов развития к разработке стратегии профилактики и лечения. Медицинские новости. 2012. № 8. С. 21-26.
- Zhou J., Wang X., Lee S. et al. Proton pump inhibitor or famotidine use and severe COVID-19 disease: a propensity score-matched territory-wide study. Gut. 2020. Dec 4. https://gut.bmj.com/content/early/2020/12/08/gutjnl-2020-323668. doi: 10.1136/gutjnl-2020-323668. PMID: 33277346.
- Almario C.V., Chey W.D., Spiegel B.M.R. Increased Risk of COVID-19 Among Users of Proton Pump Inhibitors. Am. J. Gastroenterol. 2020. № 115(10). P. 1707-1715. doi: 10.14309/ajg.0000000000000798. PMID: 32852340.
- Гриневич В.Б., Губонина И.В., Дощицин В.Л. и др. Особенности ведения коморбидных пациентов в период пандемии новой коронавирусной инфекции (COVID-19): Национальный Консенсус 2020. Кардиоваскулярная терапия и профилактика. 2020. № 19(4). С. 2630. https://doi.org/10.15829/1728-8800-2020-2630.
- Драпкина О.М., Маев И.В., Бакулин И.Г. и др. Болезни органов пищеварения в условиях пандемии новой коронавирусной инфекции (COVID-19): Консенсус экспертов Межрегиональной общественной организации «Общество гастроэнтерологов и гепатологов «Северо-Запад», Российского общества профилактики неинфекционных заболеваний и Профильной комиссии по терапии и общей врачебной практике Минздрава России: Временные методические рекомендации. Профилактическая медицина. 2020. Т. 23. № 3 (Приложение). С. 120-152.
- Новик А.А., Ионова Т.И. Руководство по исследованию качества жизни в медицине. 2-е издание; под. ред. акад. РАМН Ю.Л. Шевченко. М.: ОЛМА Медиа Групп, 2007. 320 с.
- Redkin A.N., Chukardin A.V., Brykalina J.V., Fontes-Carvalho R. Validation questionnaire GSRS for studying quality of a life at the patients who have transferred abdominal surgical interventions. Rev. Port. Cardiol. 2010. Vol. 29(10). P. 1555-1567.
- Колде Я.К. Практикум по теории вероятностей и математической статистике. М.: Медицина, 1991. 157 с.

/31.jpg)
/32.jpg)
/33.jpg)
/34.jpg)
/35.jpg)
/36.jpg)