Вступ
Системний червоний вовчак (СЧВ) — хронічне автоімунне захворювання, що характеризується запаленням і пошкодженням багатьох систем органів. Залучення серця при СЧВ — одне з багатьох можливих проявів цього поліморфного захворювання і спостерігається у більше ніж 50 % таких пацієнтів, зачіпаючи всі структурні компоненти серця [1].
Серцево-судинні хвороби — основна причина захворюваності та смертності пацієнтів із СЧВ. Найпоширенішими є ішемічна хвороба серця (12,0–90,0 %), ураження міокарда (40,0–60,0 %) і перикарда (25,0–50,0 %), серцева недостатність (5,0–31,0 %), вади клапанів серця (13,0–65,0 %) і порушення провідності (3,0–16,0 %) [1]. За оцінками, 50 % пацієнтів із СЧВ мають серцеві аномалії, в основному безсимптомні, що виявляються при обстеженні за допомогою високочутливих методів візуалізації [2]. Автоімунна активність СЧВ може викликати запальне ураження епікарда, ендокарда або перикарда (найчастіше) зі спектром клінічних проявів від безсимптомних до появи гострої лівошлуночкової недостатності, що вимагає гемодинамічної підтримки. Виявлення субклінічного ураження серця важливо для зупинки циклу пошкодження міокарда і запобігання прогресуванню серцевих захворювань [3].
Незважаючи на цю важливість, у класифікаційних критеріях СЧВ SLICC і ACR/EULAR не подані «кардіологічні» критерії, що підкреслює необхідність клінічної настороженості лікаря.
Крім того, в реальній клінічній практиці ураження серця стає на другий план після ураження нирок, суглобів і шкіри. Це багато в чому обумовлено тим, що саме ураження нирок з огляду на його високу частоту здебільшого визначає прогноз і тяжкість захворювання.
У нашій роботі ми ділимся своїм клінічним спостереженням дебюту СЧВ з ураження клапанів, випадком пізньої діагностики та нозологічної верифікації вовчакового ендокардиту (ендокардиту Лібмана — Сакса, ЕЛС).
Клінічний випадок
Пацієнтка, 29 років, звернулася до ревматолога в жовтні 2019 року зі скаргами на болі у великих суглобах, епізоди підвищення температури до 37,2 °С, стомлюваність, слабкість. З анамнезу відомо, що вважає себе хворою з травня 2019 р., коли через тиждень після перенесеної ангіни з’явилися епізоди підвищення температури до 38,4 °С, болі у великих суглобах з наявністю ранкової скутості понад 30 хвилин, з приводу чого самостійно приймала парацетамол із короткочасним позитивним ефектом, за медичною допомогою не зверталася. Однак продовжувала наростати слабкість, і в червні пацієнтка самостійно провела серію загальних аналізів крові, в яких виявлено значне збільшення швидкості осідання еритроцитів (ШОЕ) — 60–69–61 мм/год і анемію з концентрацією гемоглобіну (Hb) — 90–81–79 г/л. Була госпіталізована в терапевтичне відділення з діагнозом «лихоманка неясного генезу», було призначено антибактеріальне лікування (левофлоксацин і меронем). Ефекту від лікування не було, зберігалися всі вищевказані симптоми, і пацієнтці в межах діагностичного пошуку була проведена стернальна пункція для виключення системного захворювання крові. Патологічних змін виявлено не було. У липні 2019 р. у хворої розвивається епізод парестезії правої верхньої кінцівки та порушення мовлення, проводиться комп’ютерна томографія (КТ) голови — патології не виявлено. КТ органів грудної, черевної порожнин та малого таза — лімфаденопатія, гепатоспленомегалія, гідроперикард і кардіомегалія.
Визначення нозологічної приналежності вищевказаних змін на той момент не проводиться, але пацієнтці призначається 32 мг метилпреднізолону (МПЗ) з позитивним ефектом у вигляді нормалізації температури, значного зменшення болю і скутості в суглобах, поліпшення загального самопочуття. Слід зазначити, що з анамнезу було відомо, що у віці одного року у пацієнтки виявлено вроджену ваду серця — підклапанний аортальний стеноз, який суб’єктивно пацієнтку не турбував, якості життя порушено не було і за медичною допомогою пацієнтка не зверталася. Вагітностей і пологів не було. З огляду на наявність гідроперикарда і кардіомегалії для уточнення діагнозу у вересні 2019 р. пацієнтка госпіталізована в кардіологічне відділення, де при проведенні ехокардіографічного дослідження (ЕхоКГ) виявлено вегетації на аортальному клапані. Був запідозрений інфекційний ендокардит, і 11.09.2019 р. хвора переведена в Національний інститут серцево-судинної хірургії ім. М.М. Амосова, де їй виконано протезування аортального клапана з імплантацією штучного протеза ON X 23 і висіченням субаортальної діафрагми. Привернув увагу патогістологічний висновок дослідження операційного матеріалу про відсутність інфекційних змін клапанів серця, у зв’язку з чим постало питання про генез ендокардиту.
01.10.2019 р. пацієнтка була переведена на реабілітаційне лікування в кардіологічне відділення 8-ї міської лікарні м. Харкова з діагнозом «оперована вроджена вада серця: субаортальний стеноз, комбінований аортальний порок з переважанням недостатності IV ст., протезування аортального клапана (13.09.2019 р.), хронічний неуточнений ексудативний міоперикардит, двобічний плеврит, тяжкий перебіг, суправентрикулярна шлуночкова екстрасистолія СН IIА зі збереженою фракцією викиду лівого шлуночка III функціонального класу за NYHA». На момент переведення хвора продовжувала прийом МПЗ 24 мг на добу. З огляду на тривалість перебування на лікарняному листі та необхідність вирішення експертних питань вона була спрямована на лікарсько-контрольну комісію в обласну клінічну лікарню, де проконсультована ревматологом.
При огляді: стан задовільний, свідомість ясна. Активна. Помірного харчування: індекс маси тіла = = 24,0 кг/м2. Шкірні покриви звичайного забарвлення. Периферійні лімфовузли доступні пальпації, не збільшені. Аускультація легень — над усією поверхнею перкуторно визначається ясний легеневий звук, аускультативно — везикулярне дихання, хрипи не вислуховуються. Частота дихання — 18 на хвилину. Аускультація серця — «мелодія протезованого клапана», діяльність ритмічна, короткий систолічний шум у всій передсерцевій ділянці. Артеріальний тиск на правій і лівій руках — 115/70 мм рт.ст., пульс — 72 удари на хвилину, задовільних властивостей, ритмічний. Язик вологий, чистий. Живіт при пальпації м’який, безболісний. Печінка, селезінка не збільшені. Фізіологічні відправлення без особливостей. Набряків на нижніх кінцівках немає.
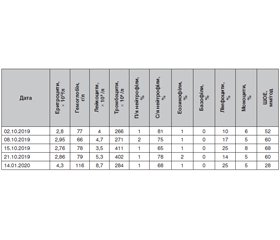
Дані лабораторних досліджень у динаміці наведено в табл. 1–3.
Хворій тричі було проведено дослідження на антинуклеарні антитіла (АНА) методом непрямої імунофлюоресценції Hep-2, результат — 1 : 160, виявлено двічі позитивні антитіла до двоспіральної ДНК (дсДНК) — 14 МО/мл, позитивні антитіла до хроматину й антитіла до рибосомального протеїну, антифосфоліпідних антитіл не виявлено. Пацієнтку обстежено на гепатити В і С — результат негативний. Добова протеїнурія — 0,5 г/л.
Проаналізувавши цю інформацію, дебют захворювання з підвищення температури, наявність анемічного синдрому, епізоду парестезії і порушення мовлення, суглобового синдрому, полісерозиту, ендокардиту неінфекційного генезу (згідно з висновком кардіохірургів), відсутність ефекту від антибактеріальної терапії, але водночас наявність драматичної позитивної відповіді на терапію глюкокортикоїдами, наявність вхідного критерію для діагнозу СЧВ — позитивних АНА, у хворої було запідозрено СЧВ.
Використовуючи класифікаційні критерії для діагностики СЧВ EULAR/ACR 2019 [4], ми набрали у цієї пацієнтки 22 бали (лихоманка вище 38 °С — 2 бали, артрит — 6 балів, серозит — 5 балів, лейкопенія — 3 бали, позитивні антитіла до дсДНК — 6 балів), для встановлення діагнозу СЧВ необхідно набрати 10 і більше балів.
Отже, на підставі скарг, анамнезу, огляду, поданих лабораторних та інструментальних методів дослідження цієї пацієнтки було встановлено такий діагноз: cистемний червоний вовчак, хронічний перебіг, середнього ступеня активності (10 балів за шкалою SLEDAI), комбінований аортальний порок змішаного генезу, стан після протезування аортального клапана (13.09.2019 р.), перикардит, плеврит, поліартралгії, поліміалгії, хронічна хвороба нирок II стадії (швидкість клубочкової фільтрації — 69 мл/хв/1,73 м2), люпус-нефрит, сечовий синдром, наявність імунологічних феноменів (позитивні AНA, антитіла до дсДНК, антитіла до хроматину, антитіла до рибосомального протеїну).
Рекомендовано пройти лабораторне дообстеження для виключення гемолітичної анемії (проба Кумбса), дослідження білірубіну, лактатдегідрогенази (пацієнтка утрималася з фінансових міркувань).
Вибираючи терапію цій пацієнтці, ми керувалися рекомендаціями EULAR 2019 р. щодо лікування пацієнтів із СЧВ [5]. Як базисний препарат був призначений гідроксихлорохін 200 мг 1 раз/день, продовження прийому МПЗ 24 мг/день з поступовим зниженням дози під контролем активності процесу, прийом препаратів кальцію і вітаміну D, бісфосфонатів і варфарину 2,5 мг/день під контролем міжнародного нормалізованого відношення.
Обговорення
Ендокардит Лібмана — Сакса був уперше описаний у чотирьох пацієнтів в 1924 році Емануелем Лібманом і Бенджаміном Саксом (Нью-Йорк, США). ЕЛС, також званий як небактеріальний тромботичний ендокардит (НБТЕ) або токсичний ендокардит, включає широкий спектр патологічних змін на клапанах, починаючи від дуже дрібних частинок, видимих тільки під мікроскопом, до великих вегетацій на раніше нормальних клапанах серця (найчастіше аортальному і мітральному). Цей термін описує стерильні вегетації на серцевих клапанах без будь-яких ознак інфекції. Первісний розвиток ЕЛС пов’язаний із пошкодженням ендотелію в умовах гіперкоагуляції [6].
Найчастіше ЕЛС трапляється при злоякісних новоутвореннях: поширеність становить 1,25 % у цій групі пацієнтів порівняно з 0,25 % в загальній популяції [7]. Найбільша асоціація виявлена для солідних пухлин, таких як аденокарцинома підшлункової залози, товстої кишки, яєчників, легенів, жовчних шляхів і простати. Для солідних пухлин показник поширеності становить 2,7 % порівняно з 0,47 % при інших злоякісних новоутвореннях [8].
Поширеність НБТЕ так само висока при СЧВ, і якщо за життя НБТЕ виявляється у 6–11 % пацієнтів із СЧВ, то аналіз даних, отриманих при патологоанатомічних розтинах, показав наявність НБТЕ в 50 % випадків СЧВ [9]. Існує значна кореляція між частотою ЕЛС і тривалістю та тяжкістю СЧВ. У пацієнтів із СЧВ спостерігаються прояви основного захворювання, такі як конституціональні симптоми (лихоманка), малярний/дискоїдний висип, артрит/артралгії, виразки в роті, серозит (плеврит, перикардит), ниркові порушення (дифузний гломерулонефрит, вогнищевий сегментарний гломерулонефрит), нейропсихіатричні, гематологічні прояви (панцитопенія) й аномальні імунологічні маркери (ANA, Anti-dsDNA, Anti-Smith)). Для встановлення діагнозу клініцист може використовувати ЕхоКГ, критерії SLICC (не менше чотирьох критеріїв, із них принаймні один клінічний і один імунологічний) або критерії EULAR/ACR (10 балів і вище з однією клінічною ознакою). Є кореляція між ЕЛС і підвищеним ризиком емболічного цереброваскулярного захворювання у пацієнтів із СЧВ.
Так само НБТЕ є частим проявом антифосфоліпідного синдрому (АФС), первинного (ідіопатичного) або вторинного (СЧВ-асоційованого), поширеність НБТЕ при цій патології становить 33 % порівняно з 4 % в контрольній групі [10]. АФС проявляється рецидивуючими викиднями, абортами та/або венозним/артеріальним тромбозом за наявності вовчакового антикоагулянту та/або IgG або IgM до кардіоліпіну та/або бета-2-глікопротеїну. Пацієнти з СЧВ із позитивними антифосфоліпідними антитілами (аФЛ-АТ) мають більш високу поширеність цього захворювання, ніж без них [11]. Метааналіз 23 первинних ехокардіографічних досліджень, в яких брали участь 1656 пацієнтів із СЧВ (668 з і 988 без аФЛ-АТ), і 508 випадків пороків клапанів серця виявив більше ніж 3-кратне значне підвищення ризику ураження клапанів і 3,5-кратне підвищення ризику НБТЕ серед тих, у кого виявлені аФЛ-АТ, порівняно з тими, у кого їх не було. Найвищий ризик виявлений у позитивних щодо вовчакового антикоагулянту пацієнтів (відносний ризик (ВР) — 5,9; 95% довірчий інтервал (ДІ) — 2,9–11,8) [12]. Інший метааналіз 21 дослідження за участю 2163 пацієнтів із СЧВ, з яких 23,3 % мали клапанні ураження, також повідомив про статистичну значущість між позитивністю щодо аФЛ-АТ і ураженнями клапанів (ВР — 1,6; 95% ДІ — 1,1–2,2) [13]. Ураження мітрального клапана були найчастішими, мітральна регургітація становила 19,7 % уражень. Іншими поширеними ураженнями були пролапс мітрального клапана (9,3 % пацієнтів) і трикуспідальна регургітація (10,9 % пацієнтів) [14].
Патогенез розвитку НБТЕ досі не до кінця зрозумілий. Виявлено, що це захворювання пов’язане з пошкодженням ендотелію циркулюючими цитокінами, такими як TNF (фактор некрозу пухлини) або інтерлейкіну, в пацієнтів у стані гіперкоагуляції, що призводить до відкладення тромбоцитів і запальних молекул в уражених клапанах. Вегетації складаються в основному з імунних комплексів, мононуклеарних клітин, фібрину і тромбоцитів, частіше мають розмір від маленького до середнього (< 10 мм), але іноді можуть бути великими (> 10 мм) [6].
Перебіг НБТЕ часто безсимптомний, і цей стан нерідко є випадковою знахідкою при обстеженні або при розтині. Вегетації частіше локалізовані на клапанах лівих відділів серця (мітральний і рідше аортальний), але можуть бути вражені й інші клапани. Найхарактерніші клінічні прояви обумовлені емболією. Цереброваскулярна емболія може проявлятися ознаками і симптомами інсульту, транзиторної ішемічної атаки, нейрокогнітивної дисфункції і вогнищевих уражень головного мозку [14]. Системна тромбоемболія може маніфестувати емболією периферичних артерій або мезентеріальною ішемією, що виявляється у вигляді сильних болів у животі.
Перед діагностикою ЕЛС слід виключити різні захворювання або патології, що, як відомо, викликають появу вегетацій на серцевих клапанів, до них належать: інфекційний ендокардит, ревматичний порок клапанів, міксома передсердь, дегенеративна хвороба клапанів, синдром холестеринової емболії, фіброеластома. Лабораторні дослідження повинні включати загальний аналіз крові, повну метаболічну панель і посів крові для виключення інфекційного ендокардиту. Обстеження на СЧВ і АФС необхідно, якщо у пацієнта ще не встановлений діагноз.
Хоча трансторакальне ехокардіографічне обстеження у безсимптомних пацієнтів із СЧВ не гарантує виявлення пороку клапана серця, однак у пацієнтів із СЧВ, особливо при високому титрі аФЛ-АТ, повинен бути високий індекс підозри. У таких пацієнтів може бути корисною трансстравохідна ехокардіографія, зокрема, якщо виявлений шум. Аускультація серця повинна виконуватися при регулярних відвідинах із подальшим ЕхоКГ-дослідженням у пацієнтів із шумами [15].
Ведення пацієнтів із НБТЕ зазвичай включає антикоагулянтну терапію та лікування основного захворювання [16]. На відміну від пацієнтів з інфекційним ендокардитом і пацієнтів з гострим ішемічним інсультом пацієнти з НБТЕ і ознаками системної емболії або без них (включаючи ураження центральної нервової системи) повинні отримувати антикоагулянти за відсутності протипоказань [17]. Такий підхід ґрунтується на клінічному досвіді та ретроспективних дослідженнях, а також на відомій високій частоті рецидивуючих і великих емболій у цій популяції пацієнтів [16, 18]. Однак, як і при ішемічному інсульті, є ризик антикоагуляції — геморагічної конверсії емболічних подій. У пацієнтів із НБТЕ перед антикоагулянтною терапією слід проводити комп’ютерну томографію головного мозку, щоб виключити внутрішньочерепний крововилив.
Операція із заміни або відновлення клапана може знадобитися для деяких пацієнтів, у яких розвивається тяжка регургітація на мітральному або аортальному клапані, або у випадках симптоматичних структурних уражень. Показання до операції (видалення вегетації або заміна клапана) такі самі, як і для інфекційного ендокардиту (наприклад, серцева недостатність, гострий розрив клапана); зазначено, що запобігання повторної емболізації є найчастішою причиною хірургічного втручання [13]. На відміну від інфекційного ендокардиту, при якому важливо повне видалення інфікованої тканини, в деяких випадках НБТЕ можливе збереження клапана. Через великий ризик рецидиву в більшості досліджень повідомляється про післяопераційну тривалу антикоагуляцію, коли це можливо, особливо у пацієнтів із системною причиною емболізації (наприклад, АФС) [13]. При розгляді питання про операцію слід зіставити переваги та ризики в контексті очікуваної тривалості життя від основного захворювання.
Лікування пацієнтів із СЧВ і НБТЕ зазвичай включає антикоагулянтну терапію та лікування основного захворювання. Глюкокортикоїдна та/або цитостатична терапія, а також антикоагулянтна терапія, мабуть, не зменшують розмір клапанних уражень, хоча проспективних досліджень не проводилося. Менш ясно, чи слід рекомендувати антикоагулянтну терапію пацієнтам із вегетаціями, асоційованими з аФЛ-АТ [19]. Невідомо, чи покращується НБТЕ при лікуванні раку; вважається, що зв’язок з наслідками основного захворювання відсутний. Отже антикоагулянтну терапію, ймовірно, слід продовжувати незалежно від відповіді на терапію основного захворювання.
Хоча багато пацієнтів можуть отримувати емпіричні антибіотики під час обстеження, але їх прийом не потрібно продовжувати, якщо тільки не буде діагностований або запідозрений інфекційний ендокардит за відсутності позитивних посівів крові.
За клінічними спостереженнями, прогноз ЕЛС вважається несприятливим. У пацієнтів можуть розвиватися повторювані тромбоемболічні події, когнітивні порушення і смерть.
Крім того, відзначений сильний зв’язок між НБТЕ і прогресуючим злоякісним новоутворенням. Також у пацієнтів із СЧВ одне шестирічне поздовжнє поперечне дослідження показало погані результати через повторний інсульт (25 %), когнітивну дисфункцію (24 %) і смерть (9 %) [6]. Довгостроковий результат для більшості пацієнтів із НБТЕ, асоційованим зі злоякісними новоутвореннями, поганий, оскільки він зазвичай пов’язаний із дисемінованими та невиліковними злоякісними пухлинами.
Висновки
Ураження ендокарда при СЧВ є досить рідкісним, але водночас складним для правильної інтерпретації нозологічної приналежності. Це пов’язано, з одного боку, з нетиповістю цього ураження в ме-жах СЧВ, коли пацієнти звертаються до кардіологів, терапевтів, кардіохірургів, отримуючи тільки симптоматичну, як у даному випадку, допомогу. З іншого боку, використовуючи нові класифікаційні критерії СЧВ, можна з великою часткою визначеності верифікувати цю патологію і почати адекватну базисну терапію, здатну привести до стійкої клініко-лабораторної ремісії і попередити залучення в процес інших органів і систем.
Особливостями нашого випадку є:
1. Дебют захворювання після ангіни із залученням серця у вигляді ендокардиту з розвитком вегетацій на тлі вродженої вади серця.
2. Тривалий період діагностичної невизначеності за відсутністю нозологічної верифікації клінічних проявів, який призвів до розвитку ендокардиту та необхідності хірургічної корекції з протезуванням аортального клапана.
3. Ми набули досвіду практичного застосування нових класифікаційних критеріїв EULAR/ACR 2019 р.
з використанням AНА у вигляді вхідного критерію й інтерпретацією розрізнених симптомів у межі певного діагнозу — СЧВ.
4. Стійка позитивна динаміка на тлі патогенетичної терапії у вигляді нормалізації загальноконституційних симптомів, регресії гідроперикарду і гідротораксу (за даними УЗД у динаміці), нормалізації показників крові (зниження ШОЕ, підвищення рівня еритроцитів і гемоглобіну, зниження креатиніну) і загального аналізу сечі (наростання відносної щільності, зниження рівня протеїнурії).
Обговорення подібних рідкісних клінічних випадків необхідно для підвищення інформованості лікарів і спільного мультидисциплінарного ведення подібних хворих ревматологами, кардіологами, кардіохірургами, неврологами, терапевтами та іншими фахівцями.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 16.03.2021
Рецензовано/Revised 01.04.2021
Прийнято до друку/Accepted 10.04.2021
Список литературы
1. Patino Giraldo S., González Naranjo L.A., Vasquez Duque G.M., Restrepo Escobar M. Heart disease characteristics in patients with systemic lupus erythematosus. Iatreia. 2013. Vol. 26. № 4. P. 447-56.
2. Ishimori M.L., Martin R., Berman D.S. et al. Myocardial ischemia in the absence of obstructive coronary artery disease in systemic lupus erythematosus. JACC Cardiovasc Imaging. 2011. Vol. 4. № 1. P. 27-3. https://doi.org/10.1016/j.jcmg.2010.09.019.
3. Clarke A.E., Urowitz M.B., Monga N., Hanly J.G. Costs associated with severe and non-severe SLE in Canada. Arthritis Care Res (Hoboken). 2014. Vol. 67. № 3. P. 431-6. doi: 10.1002/acr.22452.
4. Aringer M., Costenbader K.H., Daikh D.I. et al. 2019 EULAR/ACR Classification Criteria for Systemic Lupus Erythematosus. Arthritis Rheumatol. 2019. Vol. 71. № 9. P. 1400-1412. doi: 10.1002/art.40930.
5. Fanouriakis A., Kostopoulou M., Alunno A. et al. 2019 update of the EULAR recommendations for the management of systemic lupus erythematosus. Annals of the Rheumatic Dise-ases. 2019. Vol. 78. № 6. P. 736-745. doi: 10.1136/annrheumdis-2019-215089.
6. Yoo B.W., Lee S.W., Song J.J. et al. Clinical characteristics and long-term outcomes of Libman-Sacks endocarditis in patients with systemic lupus erythematosus. Lupus. 2020. Vol. 29. № 9. P. 1115-1120. doi: 10.1177/0961203320930097.
7. Kousa O., Baskaran J., Ahmad A. et al. A Transesophageal Echocardiogram Finding: From Infection to Malignancy. Cureus. 2020. Vol. 12. № 2. P. 6886. doi: 10.7759/cureus.6886.
8. Ibrahim A.M., Siddique M.S. StatPearls [Internet]. StatPearls Publishing; Treasure Island (FL). Sep 10, 2020. Libman Sacks Endocarditis.
9. Ginanjar E., Yulianto Y. Autoimmune Disease with Cardiac Valves Involvement: Libman-Sacks Endocarditis. Acta Med. Indones. 2017. Vol. 49. № 2. P. 148-150.
10. Lenz C.J., Mankad R., Klarich K. et al. Antiphospholipid syndrome and the relationship between laboratory assay positivity and prevalence of non-bacterial thrombotic endocarditis: A retrospective cohort study. J. Thromb. Haemost. 2020. Vol. 18. № 6. P. 1408-1414. doi: 10.1111/jth. 14798.
11. Ruiz D., Oates J.C., Kamen D.L. Antiphospholipid Antibodies and Heart Valve Disease in Systemic Lupus Erythematosus. Am. J. Med. Sci. 2018. Vol. 355. № 3. P. 293. doi: 10.1016/j.amjms.2017.07.007.
12. Zuily S., Regnault V., Selton-Suty C. et al. Increased risk for heart valve disease associated with antiphospholipid antibodies in patients with systemic lupus erythematosus: meta-analysis of echocardiographic studies. Circulation. 2011. Vol. 124. № 2. P. 215. doi.org/10.1161/CIRCULATIONAHA.111.028522.
13. Hussain K., Gauto-Mariotti E., Cattoni H.M. et al. Meta-analysis and Systematic Review of Valvular Heart Disease in Systemic Lupus Erythematosus and Its Association With Antiphospholipid Antibodies. J. Clin. Rheumatol. 2020. doi: 10.1097/RHU.0000000000001464. Online ahead of print.
14. Roldan C.A., Sibbitt W.L., Qualls C.R. et al. Libman-Sacks endocarditis and embolic cerebrovascular disease. JACC Cardiovasc Imaging. 2013. Vol. 6. № 9. P. 973-83. doi: 10.1016/j.jcmg.2013.04.012.
15. Roldan C.A., Qualls C.R., Sopko K.S., Sibbitt W.L. Transthoracic versus transesophageal echocardiography for detection of Libman-Sacks endocarditis: a randomized controlled study. J. Rheumatol. 2008. Vol. 35. № 2. P. 224. Epub 2007 Dec 15.
16. Whitlock R.P., Sun J.C., Fremes S.E. et al. American College of Chest Physicians. Antithrombotic and thrombolytic therapy for valvular disease: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed. American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012. Vol. 141. № 2. P. 576S. doi: 10.1378/chest.11-2305.
17. Sonsöz M.R., Tekin R.D., Gül A. et al. Treatment of Libman-Sacks endocarditis by combination of warfarin and immunosuppressive therapy. Turk. Kardiyol. Dern. Ars. 2019. Vol. 47. № 8. P. 687-690. doi: 10.5543/tkda.2019.29213.
18. Fujimoto D., Mochizuki Y., Nakagiri K. et al. Unusual rapid progression of non-bacterial thrombotic endocarditis in a patient with bladder cancer despite undergoing intensification treatment with rivaroxaban for acute venous thromboembolism. Eur. Heart J. 2018. Vol. 39. № 43. P. 3907. doi: 10.1093/eurheartj/ ehy569.
19. Головач І.Ю., Єгудіна Є.Д. Кардіоваскулярні маніфестації у пацієнтів з антифосфоліпідним синдромом: питання діагностики та менеджменту. Артериальная гипертензия. 2019. № 5–6. C. 67-68. doi: 10.22141/2224-1485.5-6.66-67.2019.186046.

/10.jpg)