Вступ
З розвитком медицини лікування злоякісних пухлин стає більш персоніфікованим і спрямованим на продовження тривалості та якості життя пацієнта.
Найдавнішим та основним методом лікування раку молочної залози (РМЗ) є хірургічний, але перші спроби відзначалися великою травматизацією для пацієнта. З часом лікарі почали вивчати канцерогенез більш детально, що вносило свої корективи в методи лікування та їх об’єми. Одним із перших, хто точно описав різні пухлини молочної залози та техніку їх видалення, є С. Galenus [1]. Надалі успішну роботу з лікування РМЗ продовжив французький хірург J.L. Petit. Він вважав, що потрібно видаляти молочну залозу, регіонарні лімфатичні вузли та грудний м’яз. Надалі свій внесок у боротьбу з РМЗ зробив американський хірург W.S. Halsted, який технічно вдосконалив операцію та назвав її «радикальна мастектомія» [2]. Операція включала моноблочне видалення молочної залози разом з грудними м’язами і жировою клітковиною пахвинної ділянки з лімфатичними вузлами, перерізався грудний нерв і торакодорзальний судинно-нервовий пучок. Припускалося, що чим більший радикалізм операції, тим кращий ефект лікування. Через це розробили методику «надрадикальних операцій», в яких видаляли загруднинні лімфатичні вузли одним блоком з реберними хрящами і міжреберними м’язами, надключичними лімфатичними вузлами, круглий і зубчастий м’язи. Ця операція мала низку дефектів: деформацію грудної клітки, порушення функції руки, виникнення плекситів і формування «крилоподібної лопатки», що погіршували якість життя [3].
Такої практики радикалізму хірурги притримувалися до 50-х років ХХ ст. В 1943 році вийшла стаття, де було виділено низку факторів, що погіршували прогноз при хірургічному лікуванні та сприяли виникненню рецидивів [4]. На основі цих даних почали застосовувати такі методи лікування, як хіміотерапія, променева та гормональна терапії [5]. В 1948 році D. Pates і W. Dyson запропонували зменшити об’єм мастектомії без видалення великого та малого грудних м’язів і дали цій операції назву «модифікована мастектомія за Пейті — Дайсоном». Вона мала менше післяопераційних ускладнень, ніж мастектомія за Холстедом, і не погіршувала ефект у лікуванні [6].
Наступні менш травматичні мастектомії були започатковані в 1963 році R.R. Madden. Видалялась грудна залоза разом з лімфатичними вузлами I та ІІ рівня, а ІІІ рівень видаляли лише при ураженні його метастазами. Було доведено, що не обов’язково видаляти грудний нерв при радикальній мастектомії, збереження якого зменшує післяопераційні ускладнення [7].
Проаналізувавши попередні методи лікування, дослідники встановили, що хворі помирають частіше не від рецидивів (15 %), а від віддалених метастазів (80–85 %) [8].
У наш час хірургічний метод застосовується в комбінації зі спеціальним медикаментозним лікуванням та променевою терапією, а тактику лікування обирають консиліумом. На вибір схеми лікування впливають молекулярні та біологічні властивості пухлини, розмір, локалізація та ступінь поширеності пухлинного процесу в організмі.
З часом онкохірурги почали розвивати напрямок органозберігаючих операцій на молочній залозі [9]. Вперше спробували провести органозберігаючу операцію у Німеччині. Надалі дослідники займалися вивченням ризиків виникнення рецидивів та виживаності пацієнтів після органозберігаючих операцій. З 1970 року і донині практикують органозберігаючу операцію при раку молочної залози, в об’єм якої входить видалення сектора молочної залози з пухлиною з реґіонарною лімфаденектомією, за умови досягнення негативних країв резекції. До органозберігаючих операцій відносяться: лампектомія з регіонарною лімфаденектомією та онкопластичні втручання. Найбільш поширеною операцією є лампектомія з регіонарною лімфаденектомією. У 2006 році було доведено, що результати загальної виживаності при мастектомії або органозберігаючій операції у комбінації з післяопераційною променевою терапією не відрізняються. В обох випадках загальна виживаність і виникнення рецидивів не перевищують 10 % [10]. Також перевагою є естетичний ефект та якість життя. Об’єм оперативного втручання залежить від поширеності пухлини і співвідношення розміру пухлини й об’єму молочної залози.
Обов’язковою умовою виконання органозберігаючої операції є дослідження країв резекції та досягнення «чистоти» країв. Оцінка «чистоти» країв резекції проводиться інтраопераційно, при виявленні елементів пухлини рекомендується повторне видалення тканин для досягнення «чистоти» країв резекції, за неможливості виконання мастектомії, з метою забезпечення локального контролю над хворобою [12, 13].
Інтраопераційне дослідження країв резекції допомагає зменшити відсоток місцевих рецидивів раку молочної залози. Було доведено, що в разі позитивного краю резекції ризик місцевого рецидиву збільшується в 2 рази [14].
Із вдосконаленням органозберігаючих операцій з’явилася можливість інтраопераційної оцінки стану лімфатичних вузлів. Для вирішення питання щодо зменшення об’єму лімфодисекції досліджується сигнальний лімфатичний вузол, який є першим на шляху відтоку лімфи від первинного вогнища. Ідентифікують сигнальний лімфовузол шляхом введення в оточуючі пухлину тканини спеціального барвника, за допомогою якого лімфовузол зафарбовується і його чітко видно при проведенні операції. До того ж використовують радіоактивний препарат, накопичення якого в лімфовузлах визначається ручним гамма-детектором. Також відомо застосування метиленового синього, гематоксиліну та еозину. У разі відсутності метастазів у сигнальному лімфовузлі ймовірність їх наявності в інших лімфовузлах низька, що дає можливість не виконувати подальшу лімфодисекцію [15].
З початком 2000-х років активно стала впроваджуватися неоад’ювантна поліхіміотерапія (НПХТ). Це лікування проводять перед хірургічним лікуванням для зменшення розмірів пухлини, що збільшує ймовірність органозберігаючих операцій та підвищує абластичність операції і резектабельність пухлини [16]. Також було доведено, що НПХТ дозволяє перевести неоперабельні пухлини в операбельний стан майже у 90 % хворих, забезпечити виражений клінічний ефект у 60–90 % і повну патоморфологічну регресію у 12–30 % хворих. Тактику лікування обирають залежно від молекулярного підтипу пухлини, стану лімфатичних вузлів та віку пацієнта, використовуючи комбінації препаратів. Після чого оцінюють чутливість пухлини до терапії і коригують ад’ювантну терапію. НПХТ значно збільшує безрецидивний період і загальну виживаність у хворих з місцево-поширеним раком молочної залози [17].
Відповідь на НПХТ є важливим прогностичним маркером в лікуванні пацієнток з раком молочної залози. Найбільш бажаною метою НПХТ є повна патоморфологічна регресія, що вимагає введення такої додаткової опції, як маркування пухлини до початку лікування, для уникнення проблеми візуалізації місця первинної пухлини. Неможливість візуалізації пухлини або її первинного місця розташування призводить до збільшення ризику нерадикального лікування. Для цього використовують рентгеноконтрастне маркування країв пухлин, що дозволяє візуалізовувати та адекватно планувати хірургічні втручання у пацієнтів, які отримують хіміотерапію [18]. Існують варіанти розмітки пухлини: татуаж, металічні маркери, радіоізотопи. Маркування ложа пухлин можливе як до початку лікування, так і під час оперативного втручання. Маркування під час операції доречно використовувати для того, щоб точно підвести дозу іонізуючого випромінювання до мішені, це значно зменшує променеве навантаження на здорові навколишні тканини.
У даний час доступна велика кількість маркерів для розмічення пухлин молочної залози. Мітки різної форми та складу, які підбирають під особливості та можливості пацієнта, розміру та об’єму залози (рис. 1).
Види міток для маркування пухлин:
1. Металічні біологічні інертні (титан та його сплави, тантал, нержавіюча сталь, золото, платина та сплави на основі кобальту).
2. Полісинтетичні біологічні інертні (гідрогелеві капсули).
3. Радіоактивні (ROLL). Комбіновані радіоактивні.
4. Комбіновані (гідрогелеві з металічним маркером).
Металічні маркери довговічні, їх виготовляють з рентгеноконтрастних матеріалів, які відповідають усім нормам гігієни, міцності та якості. Не використовують кліпси чи сплави з феромагнітних матеріалів, адже при проходженні магнітно-резонансної томографії (МРТ) можливе їх переміщення під впливом потужного магнітного поля, що може призвести до зміщення кліпси та травмування органа [19].
Маркери доступні в двох варіантах: одиночна кліпса (без оболонки), малого розміру і більш зручна у введенні або кліпси з біологічно поглинаючим покриттям, які розроблені для поліпшення візуалізації ультразвуком, поліпшення гемостазу і зменшення можливості зміщення кліпси. Зазвичай мітки мають циліндричну або сферичну форму в розгорнутому вигляді, тобто виглядають як закручений дріт для легкої фіксації у пухлині та найближчих тканинах. Довжина маркерів може бути різна, від 3 до 10 мм, а діаметр від 0,3 до 2,0 мм. Встановлення маркерів можливо проводити під контролем ультразвукового дослідження (УЗД), мамографії, сонографії чи МРТ молочних залоз. Необхідні функції для мітки включають в себе довгострокову видимість на УЗД, точну видимість на МРТ, простоту розгортання та стійкість до зміщення. Хоча розміщення кліпси є технічно нескладною і безпечною процедурою при візуально-контрольованій біопсії, після установки маркера можуть виникати ускладнення у вигляді зміщення та екструзії кліпси, невдалого встановлення й алергічної реакції, гематом після втручання [20, 21].
Використовуватись маркери можуть як у жінок, так і чоловіків з різним розміром та об’ємом залози, також немає жодних вікових обмежень.
Існує безліч варіантів техніки маркування пухлин перед НПХТ для візуалізації необхідної зони резекції. Зазвичай використовують спеціальний інструмент, що містить пункційну голку, внутрішньотканинний маркер, мандрен у формі гачка із заокругленням на кінці. Положення маркера відносно краю пухлини контролюється одним із методів візуалізації [22]. Технічним результатом способу є забезпечення можливості розмітки пухлини для подальшої візуалізації [23]. У практиці використовуються маркери, що встановлюються шляхом одного проколу м’яких тканин. Результатом такого методу є забезпечення можливості мультитаргетної розмітки як одного пухлинного вузла (інтратуморальний — трьома маркерами всередині пухлини; перитуморальний — за контуром пухлини та на межі зі здоровими тканинами), так і декількох. Таке маркування забезпечує мінімальне ушкодження та травматизацію молочної залози і збільшення абластики процедури. Проте існують методи встановлення відразу декількох маркерів по краях пухлини, причому потрібно робити декілька проколів. Це призводить до додаткової травматизації молочної залози, знижує абластику, тому цей метод не став загальновживаним у лікуванні даної патології.
Маркер не привносить ніяких незручних відчуттів для пацієнта, він не пальпується, за винятком випадків, коли він знаходиться близько до шкірних покривів. Відчуття дискомфорту чи больові відчуття можливі через біопсію, при якій встановлюється мітка, адже можливе утворення гематоми або набряку тканин.
Застосування методів маркування
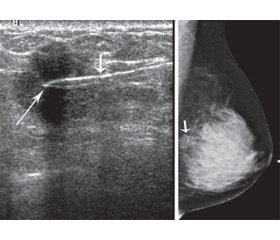
У 2000 році було проведено дослідження M.P. Braeuning із співавт., в якому вивчалися потенційні маркери для мамографії [23]. Дослідники відзначили чотири краї навколо ложа пухлини (медіальні, латеральні, каудальні, краніальні) за допомогою рентгеноконтрастних маркерів, якими у даному дослідженні були емболізаційні спіралі з платини. При встановленні спіралей трансдермально за допомогою спеціальної голки їх розмістили приблизно на 2 мм від видимого краю пухлини. Ця процедура підвищувала точність візуалізації і контролю первинної пухлини (рис. 2–4).
/69.jpg)
J. Nguyen et al. проаналізували дослідження, які проводилися у 410 пацієнтів, в яких було виконано маркування пухлини після НПХТ за допомогою рентгеноконтрастної кліпси (рис. 5) [24]. Практично можливим і клінічно корисним розміщення кліпс для передопераційної локалізації виявилося приблизно у 50 % хворих, в інших не було технічної можливості установити мітку через наявні мікрокальцинати та особливості пацієнтів. Рекомендації щодо розміщення міток:
— для пацієнтів з пухлиною менше ніж 2 см встановлення кліпс відбувалося до початку хіміотерапії;
— для пацієнтів з пухлинами розміром більше ніж 2 см рекомендували розміщення міток, коли розмір пухлини зменшиться на 50 %.
Дослідження показало, що таке маркування злоякісних новоутворень молочної залози у пацієнтів, які отримували НПХТ, забезпечувало кращий місцевий контроль незалежно від стадії та інших клініко-патологічних результатів. Автори дійшли висновку, що розміщення кліпс-маркерів має бути невід’ємною частиною підходу у лікуванні.
З 1996 по 1998 р. N. Dash та співавт. проводили дослідження впливу кліпси для тканинних маркерів у пацієнтів, які почали отримувати НПХТ з приводу раку молочної залози. Пухлини маркували за допомогою рентгеноконтрастної кліпси, яку встановлювали в ложе пухлини (рис. 6, 7). Під час досліду операція з встановлення кліпси проходила швидко й успішно для 50 %, а іншим 50 % пацієнтів за різних обставин не було встановлено міток. Маркування ложа пухлини таким методом було ефективним, адже у половини пацієнтів, в яких була встановлена кліпса, спостерігалась повна регресія пухлини. При інструментальних методах дослідження пухлинна маса не візуалізувалась, лише маркер [26].
У 2016–2017 рр. R. Shahzad і співавт. у Пакистані провели експеримент — маркування пухлин із застосуванням металічних кліпс зі сплавів кобальту у пацієнтів з РМЗ перед НПХТ. Дослідники використовували голку для люмбальної пункції та металічну кліпсу, яку розташовували по краях пухлини. Метод був використаний у 30 жінок віком від 21 до 60 років. Після НПХТ проведено органозберігаючі операції 28 пацієнткам (87,5 %). У всіх цих випадках метод не мав ніяких ускладнень зі встановленням кліпси та останні чітко візуалізувалися на мамографії. Ця процедура була економічно вигідною та простою у виконанні, свою функцію для візуалізації виконувала коректно [27].
А. Rülan і співавт. у 2018 році вперше був проведений дослід використання нової ультразвукової системи кліпс-маркерів для локалізації пухлини як у молочних залозах, так і у лімфатичних вузлах за допомогою кліпси Tumark Vision (рис. 8–12) [28]. Мітка виготовлена з 48 одиночних нітинолових дротів, біосумісного металевого сплаву, які скорочуються. Система має вигляд дротяної сітки та фіксується 2 нікотиловими ковпачками, що призводить до гіперехогенної відповіді маркерного матеріалу.
За рахунок округлої форми кожного дроту виникає відбиття звукових хвиль. Мітка залишатиметься стабільною у тканині протягом декількох місяців. Конфігурація 48 одинарних дротів у сферичній формі дозволяє виконати 3D-моделювання. Це робить мітку добре помітною під різними кутами та у різних положеннях. Матеріал має дуже пружні характеристики, тому після випуску з канюлі мітки вона миттєво розгортується до сферичної форми навіть у досить твердих тканинах [30].
Під час досліду всім пацієнтам без виключення було встановлено мітки. У жодного пацієнта не було виявлено зміщення маркера [31]. Експеримент вважається вдалим і найбільш показовим за роки розвитку маркування пухлин молочної залози. Вважається, що за допомогою таких 3D-моделювань може знадобитися менше інструментальних обстежень, таких як передопераційне МРТ або мамографія. Також покращує візуалізацію пухлини, що збільшує ефективність робочого процесу при резекції та зменшить витрати на рентгенологію.
Висновки
На сьогодні пріоритетним напрямком при хірургічному лікуванні РМЗ є органозберігаюче лікування, адже зменшується травматичність втручань і значно покращується якість життя пацієнтів в подальшому.
Органозберігаюче лікування часто передбачає проведення НПХТ, мета якої зменшити пухлину у розмірі, знищити мікрометастази та збільшити загальну і безрецидивну виживаність пацієнтів. Після проведення курсів НПХТ виникає проблема візуалізації первинної пухлини, тому для цього використовують маркування країв пухлин, що дозволяє візуалізувати та адекватно планувати хірургічні втручання у пацієнтів.
Встановлення міток підвищує точність візуалізації розміру та локалізації первинної пухлини молочної залози. Мітки виготовляють з інертних рентгеноконтрастних металів, які мінімізують ризик ускладнень. Також вони допомагають покращити місцевий контроль пухлини під час лікування незалежно від стадії захворювання.
Маркування пухлини у пацієнтів, яким планується неоад’ювантне лікування, має стати стандартною процедурою.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 01.03.2021
Рецензовано/Revised 10.03.2021
Прийнято до друку/Accepted 18.03.2021
/68.jpg)
/70.jpg)

/69.jpg)
/71.jpg)
/72.jpg)