Резюме
Актуальність. Визначення факторів ризику та проведення попередньої оцінки загального серцево-судинного ризику (ССР) у пацієнтів з артеріальною гіпертензією (АГ) — найважливіше завдання в клінічній практиці. У більшості пацієнтів, окрім підвищеного артеріального тиску (АТ), відмічаються інші фактори ССР, які підсилюють один одного, що призводить до збільшення загального ССР. Одним із факторів ССР є підвищена жорсткість артерій. Визначення жорсткості артерій проводять за допомогою методу визначення швидкості поширення пульсової хвилі (ШППХ). Другим незалежним фактором ризику серцево-судинних захворювань є підвищений вміст загального гомоцистеїну (ГЦ) в крові. Мета: оцінити зв’язок гіпергомоцистеїнемії (ГГц) з жорсткістю судин у пацієнтів із АГ. Матеріали та методи. Наше дослідження було виконано в рамках дослідження ХІПСТЕР в Україні. У дослідження було включено 40 пацієнтів з I і II ступенем АГ (середній рівень офісного систолічного (САТ)/діастолічного АТ — 155,88/92,60 ± 1,63/1,43 мм рт.ст.), частота серцевих скорочень — 71,40 ± 1,29 уд/хв. Середній вік хворих становив 55,85 ± 2,09 року (26–74). Пацієнтів із рівнем ГЦ ≥ 10 мкмоль/л визначали як пацієнтів з ГГц (Н-тип АГ). Жорсткість судин визначали за ШППХ. Результати. Нами виявлено, що на початку дослідження 75 % (30 пацієнтів з м’якою та помірною АГ) мали Н-тип АГ з підвищеним рівнем ГЦ. Пацієнти з Н-типом АГ (ГГц) і АГ без ГГц не відрізнялися за віком, тривалістю АГ. При цьому пацієнти з Н-типом АГ мали більші масу тіла, індекс маси тіла (ІМТ). Офісний САТ у пацієнтів з Н-типом АГ на початку і через 6 місяців лікування був вищим порівняно з пацієнтами без ГГц (156,45 ± 1,04 мм рт.ст. проти 152,55 ± 1,41 мм рт.ст. на початку (р < 0,05) і 130,65 ± 0,96 мм рт.ст. проти 126,97 ± 1,08 мм рт.ст. через 6 місяців (р < 0,05)). ІМТ на початку дослідження з Н-типом АГ — 30,72 ± 0,39 кг/м2 проти 28,34 ± 0,69 кг/м2 без ГГц (р < 0,05). Пацієнти з Н-типом АГ гірше досягали цільових рівнів АТ на тлі лікування, і в них були високі показники артеріального тиску на початку. Пацієнти з Н-типом АГ порівняно з пацієнтами без ГГц мали більш виражений ступінь інсулінорезистентності (за рівнем індексу НОМА), меншу швидкість клубочкової фільтрації як на початку, так і в кінці лікування. За даними добового моніторування АТ до початку лікування пацієнти з Н-типом АГ порівняно з пацієнтами з АГ без ГГц мали достовірно більш високий рівень САТ. Після регресійного аналізу рівень гомоцистеїну асоціювався зі ШППХ по артеріях еластичного типу (ШППХел) незалежно від ступеня зниження АТ (ШППХел (6 місяців), м/с, β = 0,307, Р = 0,001). Висновки. Чоловіча стать, індекс маси тіла, швидкість клубочкової фільтрації, рівень глюкози крові, рівень офісного і центрального артеріального тиску асоціювалися з підвищеним рівнем гомоцистеїну в сироватці.
Актуальность. Определение факторов риска и проведение предварительной оценки общего сердечно-сосудистого риска (ССР) у пациентов с артериальной гипертензией (АГ) — самая важная задача в клинической практике. У большинства пациентов, помимо повышенного артериального давления (АД), отмечаются и другие факторы ССР, усиливающие друг друга, что приводит к увеличению общего ССР. Одним из факторов ССР является жесткость артерий. Определение жесткости артерий проводят с помощью метода определения скорости распространения пульсовой волны (СРПВ). Вторым независимым фактором риска развития сердечно-сосудистых заболеваний является повышенный уровень гомоцистеина (ГЦ) в крови. Цель: оценить связь гипергомоцистеинемии (ГГц) с жесткостью сосудов у пациентов с АГ. Материалы и методы. Наше исследование было выполнено в рамках исследования ХИПСТЕР в Украине. В исследование было включено 40 пациентов с I и II степенью АГ (средний уровень офисного систолического (САД)/диастолического АД — 155,88/92,60 ± 1,63/1,43 мм рт.ст.), частота сердечных сокращений — 71,40 ± 1,29 уд/мин. Средний возраст больных составил 55,85 ± 2,09 года (26–74). Пациентов с уровнем ГЦ ≥ 10 мкмоль/л определяли как пациентов с ГГц (Н-тип АГ). Жесткость сосудов определяли по СРПВ. Результаты. Нами выявлено, что в начале исследования 75 % (30 пациентов с мягкой и умеренной АГ) имели Н-тип АГ с повышенным уровнем ГЦ. Пациенты с Н-типом АГ (ГГц) и АГ без ГГц не отличались по возрасту, длительности АГ. При этом пациенты с Н-типом АГ имели большие массу тела, индекс массы тела (ИМТ). Офисное САД у пациентов с Н-типом АГ в начале и через 6 месяцев лечения было выше по сравнению с пациентами без ГГц (156,45 ± 1,04 мм рт.ст. против 152,55 ± 1,41 мм рт.ст. в начале (р < 0,05) и 130,65 ± 0,96 мм рт.ст. против 126,97 ± 1,08 мм рт.ст. через 6 месяцев (р < 0,05)). ИМТ в начале исследования с Н-типом АГ — 30,72 ± 0,39 кг/м2 против 28,34 ± 0,69 кг/м2 без ГГц (р < 0,05). Пациенты с Н-типом АГ хуже достигали целевых уровней АД на фоне лечения, и у них изначально были высокие показатели АД. Пациенты с Н-типом АГ по сравнению с пациентами без ГГц имели более выраженную степень инсулинорезистентности (по уровню индекса НОМА), меньшую скорость клубочковой фильтрации как в начале, так и в конце лечения. По данным суточного мониторирования АД до начала лечения пациенты с Н-типом АГ по сравнению с пациентами с АГ без ГГц имели достоверно более высокий уровень САД. После регрессионного анализа уровень гомоцистеина ассоциировался со СРПВ по артериям эластичного типа (СРПВэл) независимо от степени снижения АД (СРПВэл (6 месяцев), м/с, β = 0,307, Р = 0,001). Выводы. Мужской пол, индекс массы тела, скорость клубочковой фильтрации, уровень глюкозы крови, уровень офисного и центрального артериального давления ассоциировались с повышением уровня гомоцистеина крови у пациентов с артериальной гипертензией.
Background. Identification of risk factors and preliminary assessment of overall cardiovascular risk in patients with hypertension is the most important task in clinical practice. Most patients, in addition to high blood pressure (BP), have other cardiovascular risk factors that aggravate each other, leading to an increase in overall cardiovascular risk. One of the cardiovascular risk factors is an increased arterial stiffness. Arterial stiffness is evaluated using pulse wave velocity (PWV). The other independent risk factor for cardiovascular diseases is elevated level of total homocysteine in the blood. The purpose was to evaluate the relationship between hyperhomocysteinemia (HHc) and vascular stiffness in patients with hypertension. Materials and methods. Our research was carried out as a part of the ХІПСТЕР trial in Ukraine. The study included 40 patients with hypertension stage 1 and 2 (average office systolic (SBP)/diasto-lic blood pressure (DBP) was 155.88/92.60 ± 1.63/1.43 mmHg, heart rate — 71.40 ± 1.29 bpm). The average age of the patients was 55.85 ± 2.09 (26–74) years. Individuals with homocysteine levels ≥ 10 μmol/l were referred to as those with HHc
(H-type hypertension). Arterial stiffness was determined by PWV. Results. We found that at the beginning of the study, 75 %
of patients (30 individuals with mild and moderate hypertension) had H-type hypertension with an increased level of homocysteine. Patients with H-type hypertension (HHc) and hypertension without HHc did not differ in terms of age, duration of hypertension. At the same time, patients with H-type hypertension had higher body weight and body mass index. Office SBP in patients with H-type hypertension at baseline and after 6 months of treatment was higher compared to patients without HHc (156.45 ± 1.04 mmHg and 152.55 ±1.41 mmHg (p < 0.05) at baseline vs 130.65 ± 0.96 mmHg and 126.97 ± 1.08 mmHg (p < 0.05) in 6 months). At the beginning of the study, body mass index was 30.72 ± 0.39 kg/m2 in patients with H-type hypertension vs 28.34 ± 0.69 kg/m2 in those without HHc (p < 0.05). Patients with H-type hypertension less often achieved target blood pressure levels during treatment and initially had higher blood pressure values. Individuals with H-type hypertension compared to patients without HHc had a more severe insulin resistance (according to the homeostatic model assessment), lower glomerular filtration rate, both at baseline and by the end of treatment. According to ambulatory blood pressure monitoring data, before the start of treatment, patients with H-type hypertension compared to those with hypertension without HHc had a significantly higher SBP level. After regression analysis, homocysteine level was associated with PWVel, regardless of the degree of BP reduction (PWVel (6 months), m/s, b = 0.307, P = 0.001). Conclusions. Male gender, body mass index, glomerular filtration rate, blood glucose, office and central blood pressure were associated with elevated serum homocysteine levels.
Вступ
Визначення факторів ризику та проведення попередньої оцінки загального серцево-судинного ризику (ССР) у пацієнтів з артеріальною гіпертензією (АГ) — найважливіше завдання в клінічній практиці. Стратифікація ризику для оцінки прогнозу в пацієнтів з АГ відображена в рекомендаціях EHS/ESC. У більшості пацієнтів, окрім підвищеного артеріального тиску (АТ), відмічаються інші фактори ССР, які підсилюють один одного, що призводить до збільшення загального ССР.
Одним із факторів ССР є підвищена жорсткість артерій [1]. Визначення жорсткості артерій проводять за допомогою методу визначення швидкості поширення пульсової хвилі (ШППХ), що доведено попередніми дослідженнями та внесено до європейських рекомендацій з АГ [2, 3]. Другим незалежним фактором ризику серцево-судинних захворювань (ССЗ) є підвищений вміст загального гомоцистеїну (ГЦ) в плазмі крові [4]. У літературі опубліковано багато суперечливих даних щодо оцінювання зв’язку між ГЦ та ШППХ.
Останнім часом усе більше з’являється інформації щодо АГ Н-типу, а саме у дослідженнях виявили зв’язок АГ Н-типу і розвитку повторних ішемічних порушень мозкового кровообігу. Відомо, що в Україні найбільша смертність від серцево-судинних подій, пов’язаних саме з порушенням мозкового кровообігу. Цей зв’язок асоціюють з біохімічними показниками крові та розвитком ішемічного інсульту. На сьогодні є значна кількість клінічних досліджень для оцінки зв’язку між ГЦ та ШППХ, але ці попередні дослідження дали суперечливі результати [5–7]. Китайські науковці довели, що 75 % пацієнтів із АГ мали підвищений рівень гомоцистеїну в сироватці крові [8].
Механізми взаємодії між АТ і рівнем ГЦ при ССЗ залишаються незрозумілими, але пацієнти з АГ і гіпергомоцистеїнемією (ГГц) частіше мали ССЗ та цереброваскулярні захворювання. Мало хто з дослідників вивчав взаємозв’язок між цільовим рівнем АТ, рівнем ГЦ та ШППХ.
Метою нашого дослідження було оцінити зв’язок гіпергомоцистеїнемії з жорсткістю судин у пацієнтів із артеріальною гіпертензією.
Матеріали та методи
Наше дослідження було виконане в рамках багатоцентрового дослідження ХІПСТЕР в Україні (відкрите клінічне дослідження антигіпертензивної ефективності генеричного препарату телмісартан або комбінації з амлодипіном чи гідрохлортіазидом у ТЕРапії пацієнтів із м’якою та помірною артеріальною гіпертензією) [9, 10].
У дослідження було включено 40 пацієнтів із I та II ступенем АГ (середній рівень офісного систолічного (САТ)/діастолічного АТ (ДАТ) — 155,88/92,60 ± 1,63/1,43 мм рт.ст.), частота серцевих скорочень (ЧСС) — 71,40 ± 1,29 уд/хв. Середній вік хворих становив 55,85 ± 2,09 року (26–74).
Критерії включення у дослідження:
— чоловіки та жінки віком від 18 до 75 років;
— I та II ступінь АГ згідно з класифікацією
ESH/ESC 2018 року за умови, що в кінці семиденного періоду відміни всіх антигіпертензивних препаратів середні значення АТ, виміряного в першій половині дня в положенні сидячи, — офісний САТ ≥ 140 мм рт.ст., але < 180 мм рт.ст., ДАТ ≥ 90 мм рт.ст., але < 110 мм рт.ст.;
— відсутність критеріїв виключення.
Критерії виключення: ангіоневротичний набряк в анамнезі, гіперкаліємія (> 5,5 ммоль/л) або гіпокаліємія (< 3,5 ммоль/л), гостра серцева недостатність, порушення серцевого ритму (хронічна фібриляція передсердь, часта екстрасистолічна аритмія, пароксизмальні шлуночкові або надшлуночкові тахікардії, персистуюча синусова тахікардія (ЧСС більше 100 уд/хв), атріовентрикулярна блокада ІІ та ІІІ ступеня, синусова брадикардія або синдром слабкості синусового вузла, наявність вад серця, вагітність або лактація, злоякісний перебіг артеріальної гіпертензії, вторинна АГ, виражена артеріальна гіпотензія (САТ < 90 мм рт.ст.), бронхіальна астма, декомпенсовані захворювання печінки (рівень АСТ або АЛТ вище верхньої межі норми у 3 рази), гостра або хронічна ниркова недостатність (розрахункова швидкість клубочкової фільтрації (ШКФ) за формулою CKD-EPI < 30 мл/хв/1,72 м2), серцева недостатність II і вище функціонального класу (згідно з Нью-Йоркською класифікацією), цукровий діабет, інфаркт міокарда в анамнезі строком менше ніж 6 місяців до моменту включення у дослідження, гостре порушення мозкового кровообігу в анамнезі, наявність стенокардії напруження ІІІ–IV функціонального класу (згідно з Канадською класифікацією) або вазоспастичної стенокардії, інфекційні та онкологічні захворювання, морбідне ожиріння (індекс маси тіла (ІМТ) > 40 кг/м2), виражені захворювання периферичних судин, синдром Рейно, стан після хірургічного втручання (менше одного місяця), прийом стероїдних та нестероїдних протизапальних засобів, контрацептивів, значні психічні розлади, неможливість відмінити попередню антигіпертензивну терапію, участь в іншому дослідженні.
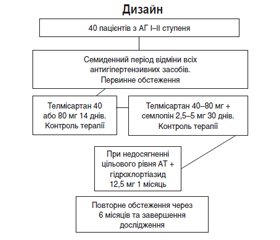
Після семиденного періоду відміни всіх медикаментозних засобів пацієнти проходили початкове обстеження та розподіл методом сліпих конвертів на групи призначеної антигіпертензивної терапії. У кінці періоду відміни оцінювали повторно критерії включення у дослідження. Якщо пацієнт відповідав критеріям включення і не мав критеріїв виключення, то пацієнта включали у дослідження. Дизайн дослідження наведено на рис. 1.
Усім пацієнтам на початку дослідження та через 6 місяців у кінці періоду лікування проводили наведені нижче клінічні, лабораторні та функціонально-діагностичні обстеження: фізикальне обстеження, вимірювання маси тіла та зросту, розрахунок ІМТ. ІМТ визначали за формулою: ІМТ = маса тіла/(зріст)2, кг/м2.
Вимірювання офісного САТ та ДАТ проводили на початку дослідження, після семиденної (у разі необхідності) відміни всіх антигіпертензивних препаратів та в кінці лікування. Вимірювання АТ проводили в кабінеті лікаря в положенні сидячи тричі з інтервалом 1–2 хвилини за допомогою апарата Omron HEM 705IT (OmronHealth Care). ЧСС визначали після другого вимірювання. Застосована методика добового моніторування артеріального тиску (ДМАТ). ДМАТ проводили за допомогою апаратів АВРМ-04М (фірма «Медітек», Угорщина) або BP-Lab, (BPLab GmbH, Германія). При цьому вивчали такі показники: середньодобовий, денний, нічний систолічний АТ, середньодобовий, денний, нічний діастолічний АТ, ЧСС. При аналізі ДМАТ для САТ і ДАТ за допомогою програмного забезпечення вираховували добовий індекс — процент зниження нічного АТ порівняно із денним. Крім того, розраховували індекс часу, що характеризує часове перевантаження тиском протягом доби та визначається як відсоток вимірів АТ, що перевищує 140/90 мм рт.ст. вдень і 120/80 мм рт.ст. вночі. Також визначали індекс навантаження тиском, що є площею між кривою підвищеного АТ та лінією межі норми, а також індекс варіабельності, який обчислювали як стандартне відхилення величини АТ. Моніторування проводили в наступному режимі: у денний час — кожні 15 хвилин, вночі (з 22.00 до 6.00) — кожні 30 хвилин. Хворі вели звичайний спосіб життя, виконуючи побутові фізичні і психоемоційні навантаження, та заповнювали щоденник.
Біохімічні аналізи виконувалися в сертифікованій в Україні лабораторії «Сінево». Забір венозної крові відбувався натще у пацієнтів після 8–10 годин голоду. Кров центрифугували. Визначали рівень гомоцистеїну, креатиніну, електролитів (калію та натрію), глюкози, загального холестерину (ХС), тригліцеридів, ХС ліпопротеїдів високої щільності, за стандартною методикою розраховували вміст ХС ліпопротеїдів низької щільності, ХС ліпопротеїдів дуже низької щільності у сироватці крові. Кліренс креатиніну, що відображає ШКФ, визначали розрахунково за формулою CKD-EPI, затвердженою рекомендаціями Kidney Disease Improving Global Outcomes (KDIGO) 2012 [11].
Рівень гомоцистеїну у сироватці крові визначали за допомогою високоефективної рідинної хроматографії. Пацієнтів із збільшенням рівня гомоцистеїну (ГЦ ≥ 10 мкмоль/л) визначали як пацієнтів із гіпергомоцистеїнемією (Н-тип АГ). Це обмеження було обрано на рівні 10 мкмоль/л відповідно до попередніх досліджень [4, 6]. Осіб, які не мали високого артеріального тиску та високого рівня гомоцистеїну, визначали як групу контролю. Рівень С-реактивного протеїну (CРП) у сироватці крові визначали за допомогою імуноферментного аналізу високої чутливості для кількісного визначення в сироватці крові. Великою кількістю досліджень було встановлено підвищення рівня СРП при артеріальній гіпертензії, інсулінорезистентності та цукровому діабеті 2-го типу, інфаркті міокарда, серцевій недостатності, ішемічному інсульті [8, 25].
Швидкість поширення пульсової хвилі та центральний АТ визначалися на апараті «Sphygmocor-PVx» (AtCor Medical Pty Ltd., Австралія), з’єднаного з персональним комп’ю-тером, що дозволяє проводити аналіз форми пульсової хвилі та визначати ШППХ по артеріях еластичного типу (ШППХел) та ШППХ по артеріях м’язового типу (ШППХм). Окрім ШППХ, визначали також центральний АТ за допомогою програмного забезпечення приладу на основі артеріального тиску на плечовій артерії та форми отриманої пульсової хвилі у висхідній аорті. ШППХ є вищою при більшій жорсткості стінки артерій, більшій їх товщині, менших густині крові та радіусі артерій. Для визначення ШППХ пульсова хвиля реєструється на проксимальній (спільна сонна) та дистальній (стегнова та променева) артеріях. За допомогою сантиметрової стрічки через поверхню тіла вимірюють відстань між місцями реєстрації пульсової хвилі (d), а прилад визначає час спізнення (t) появи пульсової хвилі в дистальній точці. Час спізнення визначається при синхронізації з електрокардіограмою. ШППХ розраховується за формулою: ШППХ = Δd/Δt.
ШППХ на сегменті «спільна сонна — стегнова артерія» відображає швидкість поширення пульсової хвилі по артеріях еластичного типу, на сегменті «спільна сонна — променева артерія» — по артеріях м’язового типу.
Таким чином, використання методики апланаційної тонометрії дозволяє оцінити ураження судин та інших органів-мішеней як в осіб із загальної популяції, так і, зокрема, у хворих з АГ.
Найбільшими прогностичними факторами контролю за ефективністю антигіпертензивної терапії на сьогодні вважаються показники центрального пульсового АТ (цПАТ) і центрального систолічного АТ (цСАТ). Як показали клінічні дослідження, саме цСАТ та цПАТ більшою мірою визначають прогноз, ніж АТ, виміряний на плечовій артерії.
Ехокардіографію (ЕхоКГ) виконували за допомогою ультразвукового діагностичного апарата «Imagic Agile» (Kontron Medical, Франція) у М- та В-режимі за стандартним протоколом. Визначались: розмір аорти, лівого передсердя, кінцево-діастолічний розмір та кінцево-систолічний розмір лівого шлуночка (ЛШ), кінцево-систолічний і кінцево-діастолічний об’єми ЛШ та фракція викиду ЛШ. Маса міокарда лівого шлуночка розраховувалась за формулою Американського товариства ехокардіографії (American Society of Echocardiography), використання якої рекомендовано Європейським товариством гіпертензії (European Society of Hypertension) та Європейським товариством кардіологів (European Society of Cardiology).
Ефективність лікування оцінювали шляхом порівняння динаміки клініко-лабораторних та функціонально-діагностичних показників у хворих на початку та в кінці лікування. Первинною кінцевою точкою було зниження та досягнення цільового рівня АТ (офісного < 140/90 мм рт.ст., при добовому моніторуванні < 130/80 мм рт.ст.). Вторинною кінцевою точкою були: вплив терапії на рівень глюкози крові та ступінь інсулінорезистентності, рівень цСАТ та ШППХ, виявлення пацієнтів із АГ та гіпергомоцистеїнемією, переносимість і розвиток побічних ефектів.
Статистичну обробку результатів проводили після створення баз даних у системах Microsoft Excel. На основі отриманих показників було створено базу даних у системі програми IBM SPSS Statistics 21. Статистичну обробку результатів здійснювали за допомогою програмного забезпечення IBM Statistics SPSS 21. Оскільки вибірка підлягала нормальному розподілу, для аналізу даних використовувались стандартні методи описової статистики з розрахунком таких показників: М — середня арифметична величина, m — похибка стандартного відхилення від середньої арифметичної величини, мода, медіана, розмах вибірки, максимальне та мінімальне значення величини, р — коефіцієнт достовірності. Достовірною вважали відмінність р < 0,05. Достовірність результатів визначали за допомогою парного двовибіркового тесту з використанням t-критерію Стьюдента для середніх величин, кореляційний аналіз для незалежних варіант, парний факторний кореляційний аналіз з розрахунком r — коефіцієнта кореляції за Спірменом та багатофакторний регресійний аналіз, критерій χ2 (хі-квадрат). Достовірною вважали кореляцію між двома варіантами при значенні р < 0,05.
Результати
Середній вік включених у дослідження хворих становив 55,85 ± 2,09 року. Середня маса тіла — 87,30 ± 2,77 кг. Середній ІМТ — 29,41 ± 0,63 кг/м2.
Середні цифри офісного САТ та ДАТ на початку дослідження становили 155,88 ± 1,63 мм рт.ст. та 92,60 ± 1,43 мм рт.ст. відповідно. Середня офісна ЧСС — 71,40 ± 1,29 уд/хв. Середні рівні АТ при амбулаторному моніторуванні становили для САТ — 139,37 ± 1,49 мм рт.ст., для ДАТ — 82,47 ± 1,84 мм рт.ст. Середня добова ЧСС — 71,38 ± 1,32 уд/хв. При аналізі структури призначення терапії на початку 95 % приймали монотерапію у вигляді телмісартану 40 або 80 мг один раз на добу, згідно з дизайном дослідження (рис. 1). Через 24 тижні тільки 35 % пацієнтів залишилися на монотерапії (тобто у них на фоні монотерапії було досягнення цільового рівня АТ). Інші 65 % хворих приймали подвійну комбіновану терапію телмісартаном 40–80 мг із амлодипіном 2,5–5 мг або потрійну комбіновану терапію — з додаванням гідрохлортіазиду (ГХТ) 12,5 мг один раз на добу (необхідність у подвійній або потрійній комбінації залежно від ступеня підвищення АТ для досягнення цільового рівня АТ визначав лікар). Основні результати дослідження ХІПСТЕР були нами опубліковані раніше [9, 10].
На фоні монотерапії телмісартаном або подвійної (телмісартан/амлодипін) чи потрійної комбінації (телмісартан/амлодипін/ГХТ) зниження офісного АТ на етапах 14 днів, 4 тижнів, 8 тижнів та 24 тижнів становило –14,0/7,7 мм рт.ст., –22,0/10,7 мм рт.ст., –25,5/13,5 мм рт.ст., –26,8/12,3 мм рт.ст. відповідно (р < 0,05 порівняно із початковими значеннями для всіх указаних показників відповідно). Зниження артеріального тиску при добовому моніторуванні на фоні лікування із використанням монотерапії телмісартаном або подвійної (телмісартан/амлодипін) чи потрійної комбінації (телмісартан/амлодипін/ГХТ) через 24 тижні становило за весь період — 15,7/9,3 мм рт.ст., за денний період — 15,3/9,2 мм рт.ст., за нічний період — 15,4/8,7 мм рт.ст. (р < 0,05 порівняно із початковими значеннями для всіх указаних показників відповідно). ЧСС в кабінеті лікаря та середня за добу достовірно не змінилася.
Досягнення цільового рівня АТ при офісному вимірюванні становило в цілому по групі 80 %. При цьому при монотерапії телмісартаном цільовий рівень АТ при офісному вимірюванні було досягнуто в усіх 100 % пацієнтів, при комбінованій терапії — тільки у 72 % пацієнтів. При добовому моніторуванні досягнення цільового АТ в цілому по групі становило 90 %, при монотерапії телмісартаном — 93 %, а при комбінованій терапії — 80 %. Такі дані були отримані відповідно до дизайну дослідження, оскільки якщо було досягнуто цільовий рівень АТ на фоні монотерапії, то пацієнт залишався на монотерапії. Подвійна та потрійна комбінації додавались у пацієнтів, у яких не вдавалося досягти цільового рівня АТ на монотерапії. Як відомо із досліджень літератури, тільки 30 % пацієнтів із АГ потребують монотерапії, усім іншим 70 % для досягнення цільового рівня АТ необхідна комбінована подвійна або потрійна антигіпертензивна терапія, що і спостерігалось у нашому дослідженні.
Нами виявлено, що на початку дослідження 75 % (30 пацієнтів з м’якою та помірною АГ) мали підвищений рівень гомоцистеїну крові (ГЦ ≥ 10 мкмоль/л), так званий Н-тип АГ.
Ми порівняли початкові та кінцеві клінічні та лабораторні характеристики пацієнтів із нормальним рівнем гомоцистеїну та з гіпергомоцистеїнемією. Для більшої достовірності даних результатів наші показники були стандартизовані за початковим рівнем НОМА. Результати наведені в табл. 1.
/12.jpg)
Як видно з табл. 1, пацієнти з Н-типом АГ та АГ без гіпергомоцистеїнемії не відрізнялися за віком, тривалістю АГ. При цьому пацієнти з АГ та гіпергомоцистеїнемією мали достовірно вищі показники САТ при офісному вимірюванні на початку дослідження, більші масу тіла, ІМТ. Так, офісний САТ у пацієнтів із ГГц на початку дослідження був 156,45 ± 1,04 мм рт.ст. проти 152,55 ± 1,41 мм рт.ст. у пацієнтів без ГГц (р < 0,05). У кінці дослідження через 6 місяців лікування офісний САТ також був достовірно вищий у пацієнтів із ГГц та становив 130,65 ± 0,96 мм рт.ст. проти 126,97 ± 1,08 мм рт.ст. порівняно з пацієнтами без ГГц (р < 0,05). ІМТ — 30,72 ± 0,39 кг/м2 проти 28,34 ± 0,69 кг/м2 відповідно. Таким чином, можна сказати, що пацієнти з ГГц гірше досягали цільових рівнів АТ на фоні лікування, у них початково були вищі показники АТ. За оцінкою серцево-судинного ризику за шкалою SCORE також пацієнти Н-типу АГ мали вищі показники як на початку дослідження, так і в кінці дослідження, навіть при достовірному зниженні АТ та досягненні цільових рівнів АТ у більшості пацієнтів. Пацієнти з Н-типом АГ порівняно із пацієнтами без гіпергомоцистеїнемії мали більш виражений ступінь інсулінорезистентності (за рівнем індексу НОМА) як на початку, так і в кінці лікування. Зміни цього показника відбувалися як за рахунок підвищення рівня інсуліну, так і вмісту глюкози у сироватці крові. Рівень креатиніну також був вищим у пацієнтів з Н-типом АГ як на початку дослідження, так і після 6 місяців лікування, та, відповідно, менший рівень розрахункової ШКФ, хоча її величини в обох групах знаходилися у межах нормальних значень. Ми не відмітили достовірної різниці за рівнем СРП на початку дослідження між пацієнтами з ГГц та без ГГц (2,56 ± 0,32 г/л проти 2,02 ± 0,15 г/л відповідно). Наші пацієнти були без супутньої патології, цукрового діабету, серцевої недостатності, тому, на нашу думку, мали невисокі показники СРП як на початку, так і в кінці лікування та не відрізнялися між групами.
Ми порівняли дані добового моніторування АТ у групах пацієнтів із підвищеним та нормальним рівнем гомоцистеїну до та через 6 місяців лікування. Дані наведені в табл. 2.
За даними добового моніторування до початку лікування пацієнти з Н-типом АГ мали достовірно вищий рівень САТ як за весь час моніторування, так і за денний та нічний періоди порівняно із групою хворих на АГ без гіпергомоцистеїнемії.
Ми провели кореляційний аналіз зв’язку вмісту гомоцистеїну у сироватці із клінічними та біохімічними показниками на початку та в кінці лікування. Дані наведені в табл. 3.
Як видно з табл. 3, вміст гомоцистеїну в загальній групі хворих на АГ до лікування корелював із чоловічою статтю, ІМТ, офісним САТ, ДАТ, ШППХ, цСАТ, рівнем глюкози, креатиніну, ШКФ крові, розмірами МШП та ЗСЛШ. Рівень гомоцистеїну до лікування був вищим у чоловіків, у пацієнтів із вищим ІМТ та вищим рівнем офісного АТ. У пацієнтів із меншою ЧСС до та після лікування був вищий рівень гомоцистеїну. Чим вищий був рівень гомоцистеїну, тим вищим були ШППХ по артеріях еластичного та м’язового типів як до, так і після лікування. Чим вищий був рівень гомоцистеїну, тим меншою була ШКФ як до, так і після лікування. Чим вищим був рівень гомоцистеїну після лікування, тим вищим був рівень цСАТ після лікування.
При проведенні регресійного аналізу рівень гомоцистеїну у сироватці крові асоціювався з ШППХ незалежно від зниження АТ на фоні терапії. Таким чином, можна сказати, що рівень гомоцистеїну в нашому дослідженні виявився фактором, пов’язаним із жорткістю судин, незалежно від рівня зниження АТ на фоні лікування. Дані наведені в табл. 4.
Обговорення
У нашому дослідженні ми виявили, що серед хворих із АГ 75 % пацієнтів мають гіпергомоцистеїнемію, так званий Н-тип АГ. Така поширеність гіпергомоцистеїнемії в популяції пацієнтів із підвищеним рівнем АТ збігається із результатами китайських вчених, за даними яких 75 % хворих на АГ мали гіпергомоцистеїнемію [8].
Попередні дослідження показали, що АГ та гіпергомоцистеїнемія є двома найважливішими факторами ризику інсульту [11, 12] та пов’язані із розвитком повторних ішемічних інсультів [13–15]. У дослідженні RESQUE Study автори виявили, що АГ мала кореляційний зв’язок із розвитком повторних ішемічних інсультів, але не було підтверджено зв’язку між гіпергомоцистеїнемією та розвитком повторних ішемічних інсультів, хоча середній рівень гомоцистеїну у пацієнтів після перенесеного ішемічного інсульту був вищим за норму (10 мкмоль/л) [16].
Останніми роками H-тип АГ став гарячою темою досліджень у світі. Так, Graham et al. встановили, що гіпергомоцистеїнемія та АГ мали синергічну дію у виникненні серцево-судинних і цереброваскулярних захворювань, а частота серцево-судинних подій у пацієнтів із Н-типом АГ була приблизно у 5 разів більша, ніж у пацієнтів із високим артеріальним тиском без підвищеного рівня гомоцистеїну [17].
F. Zhou et al. виявили синергічний ефект АГ та гіпергомоцистеїнемії при повторному інсульті у людей похилого віку [18]. У цьому дослідженні було встановлено, що Н-тип АГ був незалежним фактором ризику для розвитку повторних порушень мозкового кровообігу, що було пов’язано головним чином із суттєвим впливом АГ на виникнення повторного ішемічного порушення мозкового кровообігу.
У китайському дослідженні оцінювали зв’язок між рівнем ГЦ, стадіями АГ та ШППХ у сільській популяції. Основні результати дослідження показали, що концентрація ГЦ була незалежною та суттєво пов’язаною з ШППХ в осіб з високим нормальним АТ та АГ 1-го ступеня [19].
А. Towfighi зі співавт. [20] визначали, чи впливає підвищений рівень гомоцистеїну на розвиток інсульту після поправки на широкий спектр відповідних коваріатів та чи підсилюють певні судинні фактори ризику вплив високого гомоцистеїну на розвиток інсульту. Незалежний та інтерактивний вплив підвищеного рівня гомоцистеїну на ймовірність розвитку інсульту оцінювали в National Health and Nutrition Examination Survey у США, проведеному з 1999 по 2004 рік (n = 12 683). Автори виявили, що у тих пацієнтів, у кого був підвищений рівень гомоцистеїну, частіше спостерігався інсульт порівняно з тими, у кого не було підвищеного гомоцистеїну. Особи з поєднанням підвищеного рівня гомоцистеїну та АГ мали значно більшу ймовірність перенести інсульт порівняно з особами без будь-якого захворювання. Асоціація гіпергомоцистеїнемії з розвитком інсульту була найсильнішою у молодих людей і лінійно знижувалась із збільшенням віку. Автори роблять висновок, що підвищений рівень гомоцистеїну самостійно збільшує ризики розвитку інсульту. Більш молоді особи та особи з АГ можуть отримати особливу користь від зниження рівня гомоцистеїну.
Jia Zhang зі співавт. [21] досліджували зв’язок між АГ H-типу та поширеністю безсимптомного стенозу екстракраніальних артерій. У дослідження було включено 2330 пацієнтів. На початку 608 пацієнтів страждали від АГ Н-типу. Протягом двох років спостереження у 10,73 % пацієнтів виявився безсимптомний стеноз екстракраніальних судин. Автори виявили, що гіпертензія H-типу є незалежним фактором ризику безсимптомного стенозу екстракраніальних артерій. Автори виявили, що ізольована АГ, ізольована гіпергомоцистеїнемія та АГ H-типу були пов’язані з частотою безсимптомних стенозів екстракраніальних судин, особливо АГ H-типу.
Geng Qian зі співавт. [22] вивчали зв’язок між рівнем загального гомоцистеїну в плазмі, артеріального тиску та ШППХ. ШППХ достовірно та незалежно корелювала з гіпергомоцистеїнемією в усій досліджуваній сукупності. Більше того, ШППХ продемонструвала значне збільшення із збільшенням рівня гомоцистеїну у плазмі крові у пацієнтів із високим нормальним АТ та АГ 1-го ступеня (р < 0,05). Гіпергомоцистеїнемія незалежно корелювала з ШППХ у суб’єктів з високим нормальним АТ та АГ 1-го ступеня. Автори роблять висновок, що високий нормальний АТ та АГ 1-го ступеня можуть погіршити вплив гіпергомоцистеїнемії на жорсткість артерій.
Lulu Chen зі співавт. [23] вивчали взаємозв’язок гомоцистеїнемії із ШППХ та показали, що концентрація гомоцистеїну у сироватці крові позитивно асоціювалася із ШППХ та підвищеною жорсткістю артерій. Ці результати дозволяють припустити, що серцево-судинні ефекти гомоцистеїну можуть частково опосередковуватися через жорсткість артерій.
Артеріальна жорсткість і гомоцистеїн є потужними предикторами серцево-судинних захворювань, особливо у людей старшого віку. Song Zhang зі співавт. [24] у своєму дослідженні вивчали зв’язок гомоцистеїну з артеріальною жорсткістю у людей похилого віку, що живуть у китайській громаді. Автори порівнювали рівень гомоцистеїну в сироватці крові з показниками жорсткості артерій (ШППХел та ШППХм) у 780 учасників (46,3 % чоловіків, середній вік — 71,9 року (65–96)) від двох громад Пекіна, Китай. Автори виявили, що у людей похилого віку в Китаї рівень гомоцистеїну в сироватці крові асоціювався із змінами жорсткості аорти.
У нашому дослідженні ми вперше в Україні дослідили рівень гомоцистеїну у пацієнтів із АГ та його динаміку на фоні як монотерапії, так і застосування подвійних та потрійних комбінацій АГ-препаратів. Виявили, що підвищений рівень гомоцистеїну спостерігається у 75 % пацієнтів із м’якою та помірною АГ. Вперше виявили асоціативні зв’язки вмісту гомоцистеїну із чоловічою статтю, ІМТ, ШКФ як на початку, так і через 6 місяців лікування, рівнем глюкози у сироватці крові, рівнем офісного та центрального АТ. Пацієнти з гіпергомоцистеїнемією мали достовірно вищий рівень НОМА, показник інсулінорезистентності. Можливо, такий зв’язок обумовлений тим, що пацієнти з Н-типом АГ мали вищий ІМТ. Вперше в Україні виявили тісний зв’язок гомоцистеїну з жорсткістю судинної стінки на фоні лікування в динаміці, причому асоціація була незалежною від зниження АТ на фоні терапії. Такий зв’язок може пояснити патогенетичний механізм, чому гомоцистеїн розглядається в літературі як незалежний фактор ризику розвитку повторних ішемічних інсультів у пацієнтів із АГ: його вплив асоційований із збільшенням жорсткості артерій.
Обмеження дослідження. Наше пілотне дослідження було одноцентровим і включало невелику кількість пацієнтів.
Висновки
1. Пацієнти з Н-типом АГ до початку лікування порівняно з групою пацієнтів з АГ без гіпергомоцистеїнемії мали вищий рівень САТ за 24 години, денний і нічний періоди за даними добового моніторування.
2. У 75 % пацієнтів з артеріальною гіпертензією була виявлена гіпергомоцистеїнемія.
3. Незалежно від рівня зниження артеріального тиску після лікування рівень гомоцистеїну в сироватці крові асоціювався із жорсткістю судин.
4. Такі фактори, як чоловіча стать, індекс маси тіла, швидкість клубочкової фільтрації, рівень глюкози крові, рівень офісного і центрального артеріального тиску, асоціювалися з підвищеним рівнем гомоцистеїну в сироватці.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Список литературы
1. Yingchoncharoen T., Limpijankit T., Jongjirasiri S., Laothamatas J., Yamwong S., Sritara P. Arterial stiffness contributes to coronary artery disease risk prediction beyond the traditional risk score (RAMA-EGAT score). Heart Asia. 2012. 4(1). 77-82. https://doi.org/10.1136/heartasia-2011-010079.
2. 2013 ESH/ESC Guidelines for the management of arterial hypertension. European Heart Journal. 2013. 34(28). 2159-2219. https://doi.org/10.1093/eurheartj/eht151.
3. Franklin S.S., Larson M.G., Khan S.A., Wong N.D., Leip E.P., Kannel W.B., Levy D. Does the Relation of Blood Pressure to Coronary Heart Disease Risk Change With Aging? Circulation. 2001. 103(9). 1245-1249. https://doi.org/10.1161/01.cir.103.9.1245.
4. Wald D.S. Homocysteine and cardiovascular dise-ase: evidence on causality from a meta-analysis. BMJ. 2002. 325(7374). 1202-1206. https://doi.org/10.1136/bmj.325.7374.1202.
5. De Bree A., Mennen L.I., Zureik M., Ducros V., Guilland J.-C., Nicolas J.-P., Emery-Fillon N., Blacher J., Hercberg S., Galan P. Homocysteine is not associated with arterial thickness and stiffness in healthy middle-aged French volunteers. International Journal of Cardiology. 2006. 113(3). 332-340. https://doi.org/10.1016/j.ijcard.2005.11.045.
6. Vyssoulis G., Karpanou E., Kyvelou S.-M., Adamopoulos D., Gialernios T., Gymnopoulou E., Cokkinos D., Stefanadis C. Associations between plasma homocysteine levels, aortic stiffness and wave reflection in patients with arterial hypertension, isolated office hypertension and normotensive controls. Journal of Human Hypertension. 2009. 24(3). 183-189. https://doi.org/10.1038/jhh.2009.50.
7. Xiao W., Bai Y., Ye P., Luo L., Liu D., Wu H., Bai J. Plasma Homocysteine Is Associated with Aortic Arterial Stiffness but not Wave Reflection in Chinese Hypertensive Subjects. PLoS ONE. 2014. 9(1). e85938. https://doi.org/10.1371/journal.pone.0085938.
8. Zhang Q., Qiu D.-X., Fu R.-L., Xu T.-F., Jing M.-J., Zhang H.-S., Geng H.-H., Zheng L.-C., Wang P.-X. H-Type Hypertension and C Reactive Protein in Recurrence of Ischemic Stroke. International Journal of Environmental Research and Public Health. 2016. 13(5). 477. https://doi.org/10.3390/ijerph13050477.
9. Sirenko Yu.M., Rekovets O.L., Svischenko E.P., Ena L.M., Torbas E.A., Kushnir S.M., Gulkevych O.V., Mudruk I.V. Open clinical study of antihypertensive efficacy of generic drug telmisartan (hypotel) or a combination with S-amlodipine (Semlopin) or hydrochlorothiazide in the therapy of patients with mild to moderate arterial hypertension (ah) (results of the hipster. Hypertension. 2017. 0(1.51). 11-23. https://doi.org/10.22141/2224-1485.1.51.2017.96247.
10. Sirenko Yu.M., Rekovets O.L., Svischenko E.P., Ena L.M., Torbas E.A., Kushnir S.M., Gulkevych O.V., Mudruk I.V. Metabolic effects of the generic drug telmisartan (HYPotel) or its combination with S-amlodipine (Samlopin) or hydrochlorothiazide in the ThERapy of patients with mild to moderate arterial hypertension (results of the HYPSTER-AH study). Hypertension. 2017. 0(2.52). 69-83. https://doi.org/10.22141/2224-1485.2.52.2017.101296.
11. Sen U., Mishra P.K., Tyagi N., Tyagi S.C. Homocysteine to Hydrogen Sulfide or Hypertension. Cell Biochemistry and Biophysics. 2010. 57(2–3). 49-58. https://doi.org/10.1007/s12013-010-9079-y.
12. Zhang W., Sun K., Chen J., Liao Y., Qin Q., Ma A., Wang D., Zhu Z., Wang Y., Hui R. High plasma homocysteine levels contribute to the risk of stroke recurrence and all-cause mortality in a large prospective stroke population. Clinical Science. 2009. 118(3). 187-194. https://doi.org/10.1042/cs20090142.
13. Xu G., Liu X., Wu W., Zhang R., Yin Q. Recurrence after Ischemic Stroke in Chinese Patients: Impact of Uncontrolled Modifiable Risk Factors. Cerebrovascular Diseases. 2006. 23(2–3). 117-120. https://doi.org/10.1159/000097047.
14. Aiyagari V., Badruddin A. Management of hypertension in acute stroke. Expert Review of Cardiovascular Therapy. 2009. 7(6). 637-646. https://doi.org/10.1586/erc.09.45.
15. Saposnik G., Ray J.G., Sheridan P., McQueen M., Lonn E. Homocysteine-Lowering Therapy and Stroke Risk, Severity, and Disability. Stroke. 2009. 40(4). 1365-1372. https://doi.org/10.1161/strokeaha.108.529503.
16. Leoo T., Lindgren A., Petersson J., von Arbin M. Risk Factors and Treatment at Recurrent Stroke Onset: Results from the Recurrent Stroke Quality and Epidemiology (RESQUE) Study. Cerebrovascular Diseases. 2008. 25(3). 254-260. https://doi.org/10.1159/000113864.
17. Graham I.M., Daly L.E., Refsum H.M., Robinson K., Brattström L.E., Ueland P.M., Palma-Reis R.J., Boers G.H., Sheahan R.G., Israelsson B., Uiterwaal C.S., Meleady R., McMaster D., Verhoef P., Witteman J., Rubba P., Bellet H., Wautrecht J.C., de Valk H.W., Sales Lúis A.C. Plasma homocysteine as a risk factor for vascular disease. The European Concerted Action Project. JAMA. 1997. 277(22). 1775-1781. https://doi.org/10.1001/jama.1997.03540460039030.
18. Zhou F., Hou D., Wang Y., Yu D. Evaluation of H-type hypertension prevalence and its influence on the risk of increased carotid intima-media thickness among a high-risk stroke population in Hainan Province, China. Medicine. 2020. 99(35). e21953. https://doi.org/10.1097/md.0000000000021953.
19. Qin X., Huo Y. H-Type hypertension, stroke and diabetes in China: Opportunities for primary prevention. Journal of Diabetes. 2015. 8(1). 38-40. https://doi.org/10.1111/1753-0407.12333.
20. Towfighi A., Markovic D., Ovbiagele B. Pronounced association of elevated serum homocysteine with stroke in subgroups of individuals: A nationwide study. Journal of the Neurological Sciences. 2010. 298(1–2). 153-157. https://doi.org/10.1016/j.jns.2010.07.013.
21. Zhang J., Liu Y., Wang A., Wang D., Jiang R., Jia J., Chen S., Zhao X. Association between H-type Hypertension and Asymptomatic Extracranial Artery Stenosis. Scientific Reports. 2018. 8(1). https://doi.org/10.1038/s41598-018-19740-0.
22. Qian G., Zeng L.-H., Liu Y.-Q., Cao F., Chen Y.-D., Zheng M.-L., Yang X.-C., Xu X.-P., Huo Y. Associations between plasma total homocysteine, blood pressure stages and pulse wave velocity in Chinese rural community population. Blood Pressure. 2015. 24(6). 340-346. https://doi.org/10.3109/08037051.2014.997089.
23. Chen L., Wang B., Wang J., Ban Q., Wu H., Song Y., Zhang J., Cao J., Zhou Z., Liu L., Cao T., Gao L., Guo H., Zhang T., Tang G., Huang X., Zhang Y., Li J., Huo Y., Cheng X. Association between serum total homocysteine and arterial stiffness in adults: a community-based study. The Journal of Clinical Hypertension. 2018. 20(4). 686-693. https://doi.org/10.1111/jch.13246.
24. Zhang S., Bai Y.-Y., Luo L.-M., Xiao W.-K., Wu H.-M., Ye P. Association between serum homocysteine and arterial stiffness in elderly: a community-based study. J. Geriatr. Cardiol. 2014 Mar. 11(1). 32-8. https://doi.org/10.3969/j.issn.1671-5411.2014.01.007.
25. Wang K., Wang Y., Chu C., Hu J., Zheng W., Yan Y., Ma Q., Gao K., Yuan Y., Mu J. Joint Association of Serum Homocysteine and High-Sensitivity C-Reactive Protein with Arterial Stiffness in Chinese Population: A 12-Year Longitudinal Study. Cardiology. 2019. 144(1–2). 27-35. https://doi.org/10.1159/000501742.
/10.jpg)

/12.jpg)
/13.jpg)
/14.jpg)
/15.jpg)