Журнал «Здоровье ребенка» Том 15, №8, 2020
Вернуться к номеру
Значення Т-клітин вродженої імунної системи в розвитку метазапалення жирової тканини при ожирінні
Авторы: Абатуров О.Є., Нікуліна А.O.
ДЗ «Дніпропетровська медична академія Міністерства охорони здоров’я України», м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
Даний огляд наукової літератури присвячений участі αβТ- і γδТ-клітин вродженої імунної системи в підтримці протизапального середовища при фізіологічному стані жирової тканини та їх ролі в розвитку метазапалення при ожирінні. Надлишкова маса тіла, обумовлена збільшенням жирової тканини, асоційована з розвитком метаболічних порушень, які не тільки істотно знижують якість життя, але й несуть ризик несприятливих серцево-судинних подій. Відповідно до сучасних уявлень, індуктором метаболічних порушень є низькорівневе запалення, індуковане дисфункцією адипоцитів в умовах ожиріння. Метаболічно активні клітини, такі як адипоцити, при ожирінні секретують численні протизапальні цитокіни і хемокіни, які рекрутують у жирову тканину різні імуноцити або активують клітини імунної системи, у тому числі й Т-клітини вродженої імунної системи. При ожирінні інваріантні Т-клітини, асоційовані зі слизовими оболонками (MAIT-клітини) жирової тканини, експресують надмірно активований фенотип і характеризуються несприйнятливістю до сигналів TCR-асоційованого шляху, значно збільшуючись у дітей з ожирінням порівняно з рівнем у дітей, які мають фізіологічну масу тіла. Подані дані про значення інваріантних натуральних кілерних клітин (iNKT), які адмініструють функціонування Treg-клітин та макрофагів у жировій тканині, з активацією яких пов’язана загибель адипоцитів, стимуляція адипогенезу, що сприяє інсулінзалежному поглинанню глюкози адипоцитами, тоді як їх зменшення, що спостерігається при ожирінні, сприяє розвитку метазапалення. Варіантні NKT-клітини (vNKT) збуджують плазмоцитоїдні дендритні клітини і викликають толерогенний ефект на конвенціональні дендритні клітини. Наведено дані, що зниження представництва γδT-клітин у жировій тканині при ожирінні обумовлює інтенсивність метазапалення та інсулінорезистентності в експериментальних тварин, які отримували дієту з високим вмістом жиру. Медикаментозне управління активністю MAIT-, NKT- та γδТ-клітинами в недалекому майбутньому може стати одним із можливих шляхів пригнічення активності індукованого ожирінням метазапалення і профілактувати розвиток метаболічних порушень.
Данный обзор научной литературы посвящен значению αβТ- и γδТ-клеток врожденной иммунной системы в поддержании противовоспалительной среды при физиологическом состоянии жировой ткани и их роли в развитии метавоспаления при ожирении. Избыточная масса тела, обусловленная увеличением жировой ткани, ассоциирована с развитием метаболических нарушений, которые не только существенно снижают качество жизни, но и несут риск неблагоприятных сердечно-сосудистых событий. Согласно современным представлениям, индуктором метаболических нарушений является низкоуровневое воспаление, индуцированное дисфункцией адипоцитов в условиях ожирения. Метаболически активные клетки, такие как адипоциты, при ожирении секретируют многочисленные противовоспалительные цитокины и хемокины, которые рекрутируют в жировую ткань различные иммуноциты или активируют клетки иммунной системы, в том числе и Т-клетки врожденной иммунной системы. При ожирении инвариантные Т-клетки, ассоциированные со слизистыми оболочками (MAIT-клетки) жировой ткани, экспрессируют чрезмерно активированный фенотип и характеризуются невосприимчивостью к сигналам TCR-ассоциированного пути, значительно увеличиваясь у детей с ожирением по сравнению с уровнем у детей с физиологической массой тела. Представлены данные о значении инвариантных натуральных киллерных клеток (iNKT), которые администрируют функционирование Treg-клеток и макрофагов в жировой ткани, с активацией которых связана гибель адипоцитов, стимуляция адипогенеза, что способствует инсулинзависимому поглощению глюкозы адипоцитами, тогда как их уменьшение, которое наблюдается при ожирении, способствует развитию метавоспалению. Вариантные NKT-клетки (vNKT) возбуждают плазмоцитоидные дендритные клетки и вызывают толерогенный эффект на конвенциональные дендритные клетки. Приведены данные, что снижение представительства γδT-клеток в жировой ткани при ожирении обусловливает интенсивность метавоспаления и инсулинорезистентности у экспериментальных животных, получавших диету с высоким содержанием жира. Медикаментозное управление активностью MAIT-, NKT- и γδТ-клетками в недалеком будущем может стать одним из возможных путей подавления активности индуцированного ожирением метавоспаления и профилактировать развитие метаболических нарушений.
This review of the scientific literature deals with the participation of αβT and γδT cells of the innate immune system in maintaining an anti-inflammatory environment in the physiological state of adipose tissue and their role in the development of meta-inflammation in obesity. Overweight due to an increase in adipose tissue is associated with the development of metabolic disorders, which not only significantly reduce the quality of life, but also have the risk of adverse cardiovascular events. According to modern concepts, the trigger of metabolic disorders is low-grade inflammation induced by adipocyte dysfunction in obesity. Metabolically active cells such as adipocytes in obesity secrete numerous anti-inflammatory cytokines and chemokines, which recruit various immune cells into adipose tissue or activate cells of the immune system, including T cells of the innate immune system. In obesity, mucosal-associated invariant T (MAIT) cells of adipose tissue express an overactivated phenotype and are characterized by unresponsiveness to signals of the TCR-associated pathway, significantly increasing in obese children than in children with physiological body weight. The data are presented on the importance of invariant natural killer T (iNKT) cells, which critically administer the functioning of Treg cells and macrophages in adipose tissue, activation of which causes not only the death of adipocytes, but also stimulates adipogenesis that promotes insulin-dependent glucose uptake by adipocytes, and, in turn, a decrease in the number of iNKT cells, which observed in obesity, leads to the development of meta-inflammation. Variable NKT cells excite plasmacytoid dendritic cells and induce a tolerogenic effect on conventional dendritic cells. The data are given that a decrease in the representation of γδT cells in adipose tissue in obesity determines the intensity of meta-inflammation and insulin resistance in experimental animals receiving a high-fat diet. In the near future, drug control of the activity of MAIT, NKT, and γδT cells may become one of the possible ways to suppress the activity of obesity-induced meta-inflammation and prevent the development of metabolic disorders.
ожиріння; метазапалення; вроджена імунна система; Т-клітини; огляд
ожирение; метавоспаление; врожденная иммунная система; Т-клетки; обзор
obesity; meta-inflammation; innate immune system; T cells; review
Вступ
1. Загальні уявлення про популяцію T-лімфоцитів
2. Роль αβТ-клітин вродженої імунної системи в розвитку метазапалення
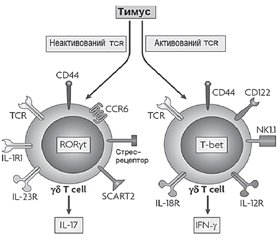
3. Роль γδT-клітин вродженої імунної системи в розвитку метазапалення
Висновок
- Абатуров О.Є. Метаболічний синдром у дітей (лекція). Таврійський медико-біологічний вісник. 2007. Т. 10. С. 57-65.
- Абатуров О.Є. Особливості метаболічного синдрому у дітей. Дитячий лікар. 2011 № 4(11) С. 54 -61.
- Бокова Т.А. Неалкогольна жирова хвороба печінки у дітей з ожирінням і метаболічним синдромом. Лечащий врач. 2019. № 1. С. 28.
- Вейцман И.А., Кузьмина А.Д., Андриенко А.В., Белов М.А. Ожирение: перспективные патогенетические направления лечения ожирения (обзор литературы) Современная наука: актуальные проблемы теории и практики. Серия: Естественные и технические науки. 2020. № 1. С. 168-171.
- Agrawal M., Kern P.A., Nikolajczyk B.S. The Immune System in Obesity: Developing Paradigms Amidst Inconvenient Truths. Curr. Diab. Rep. 2017. 17(10). 87. Published 2017, Aug 15. doi: 10.1007/s11892-017-0917-9.
- Attaf M., Legut M., Cole D.K., Sewell A.K. The T cell antigen receptor: the Swiss army knife of the immune system. Clin. Exp. Immunol. 2015. 181(1). 1-18. doi: 10.1111/cei.12622.
- Bertrand L., Lehuen A. MAIT cells in metabolic diseases. Mol. Metab. 2019. 27S(Suppl). Р. 114-121. doi: 10.1016/j.molmet.2019.06.025.
- Born W.K., Kemal Aydintug M., O’Brien R.L. Diversity of γδ T-cell antigens. Cell. Mol. Immunol. 2013. 10(1). 13-20. doi: 10.1038/cmi.2012.45.
- Brennan P.J., Brigl M., Brenner M.B. Invariant natural killer T cells: an innate activation scheme linked to diverse effector functions. Nat. Rev. Immunol. 2013. 13(2). 101-117. doi: 10.1038/nri3369.
- Carolan E., Tobin L.M., Mangan B.A. et al. Altered distribution and increased IL-17 production by mucosal-associated invariant T cells in adult and childhood obesity. J. Immunol. 2015. 194(12). 5775-5780. doi: 10.4049/jimmunol.1402945.
- Chandra S., Kronenberg M. Activation and Function of iNKT and MAIT Cells. Adv. Immunol. 2015. 127. 145-201. doi: 10.1016/bs.ai.2015.03.003.
- Choe S.S., Huh J.Y., Hwang I.J., Kim J.I., Kim J.B. Adipose Tissue Remodeling: Its Role in Energy Metabolism and Metabolic Disorders. Front. Endocrinol. (Lausanne). 2016. 7. 30. Published 2016, Apr 13. doi: 10.3389/fendo.2016.00030.
- Contreras A.V., Wiest D.L. Recent advances in understanding the development and function of γδ T cells. F1000Res. 2020. 9. F1000 Faculty Rev-306. Published 2020, Apr 29. doi: 10.12688/f1000research.22161.1.
- Costanzo A.E., Taylor K.R., Dutt S., Han P.P., Fujioka K., Jameson J.M. Obesity impairs γδ T cell homeostasis and antiviral function in humans. PLoS One. 2015. 10(3). e0120918. Published 2015, Mar 18. doi: 10.1371/journal.pone.0120918.
- Crosby C.M., Kronenberg M. Invariant natural killer T cells: front line fighters in the war against pathogenic microbes. Immunogenetics. 2016. 68(8). 639-648. doi: 10.1007/s00251-016-0933-y.
- Cua D.J., Tato C.M. Innate IL-17-producing cells: the sentinels of the immune system [published correction appears in Nat. Rev. Immunol. 2010 Aug. 10(8). 611] [published correction appears in Nat. Rev. Immunol. 2010 Jul. 10(7). following 489]. Nat. Rev. Immunol. 2010. 10(7). 479-489. doi: 10.1038/nri2800.
- Dasgupta S., Kumar V. Type II NKT cells: a distinct CD1d-restricted immune regulatory NKT cell subset. Immunogenetics. 2016. 68(8). 665-676. doi: 10.1007/s00251-016-0930-1.
- Davey M.S., Willcox C.R., Baker A.T., Hunter S., Willcox B.E. Recasting Human Vδ1 Lymphocytes in an Adaptive Role. Trends Immunol. 2018. 39(6). 446-459. doi: 10.1016/j.it.2018.03.003.
- Del Cornò M., D’Archivio M., Conti L. et al. Visceral fat adipocytes from obese and colorectal cancer subjects exhibit distinct secretory and ω6 polyunsaturated fatty acid profiles and deliver immunosuppressive signals to innate immunity cells. Oncotarget. 2016. 7(39). 63093-63105.
- Dhodapkar M.V., Kumar V. Type II NKT Cells and Their Emerging Role in Health and Disease. J. Immunol. 2017. 198(3). 1015-1021. doi: 10.4049/jimmunol.1601399.
- Fay N.S., Larson E.C., Jameson J.M. Chronic Inflammation and γδT Cells. Front. Immunol. 2016. 7. 210. Published 2016, May 27. doi: 10.3389/fimmu.2016.00210.
- Franciszkiewicz K., Salou M., Legoux F. et al. MHC class I-related molecule, MR1, and mucosal-associated invariant T cells. Immunol. Rev. 2016. 272(1). 120-138. doi: 10.1111/imr.12423.
- Garner L.C., Klenerman P., Provine N.M. Insights Into Mucosal-Associated Invariant T Cell Biology From Studies of Invariant Natural Killer T Cells. Front. Immunol. 2018. 9. 1478. Published 2018, Jun 28. doi: 10.3389/fimmu.2018.01478.
- Gibbons D., Fleming P., Virasami A. et al. Interleukin-8 (CXCL8) production is a signatory T cell effector function of human newborn infants. Nat. Med. 2014. 20(10). 1206-1210. doi: 10.1038/nm.3670.
- Godfrey D.I., Koay H.F., McCluskey J., Gherardin N.A. The biology and functional importance of MAIT cells. Nat. Immunol. 2019. 20(9). 1110-1128. doi: 10.1038/s41590-019-0444-8.
- Hams E., Locksley R.M., McKenzie A.N., Fallon P.G. Cutting edge: IL-25 elicits innate lymphoid type 2 and type II NKT cells that regulate obesity in mice. J. Immunol. 2013. 191(11). 5349-5353. doi: 10.4049/jimmunol.1301176.
- Huh J.Y., Park J., Kim J.I., Park Y.J., Lee Y.K., Kim J.B. Deletion of CD1d in Adipocytes Aggravates Adipose Tissue Inflammation and Insulin Resistance in Obesity. Diabetes. 2017. 66(4). 835-847. doi: 10.2337/db16-1122.
- Huh J.Y., Park Y.J., Kim J.B. Adipocyte CD1d determines adipose inflammation and insulin resistance in obesity. Adipocyte. 2018. 7(2). 129-136. doi: 10.1080/21623945.2018.
- Ivanov S., Paget C., Trottein F. Role of non-conventional T lymphocytes in respiratory infections: the case of the pneumococcus. PLoS Pathog. 2014. 10(10). e1004300. Published 2014, Oct 9. doi: 10.1371/journal.ppat.1004300.
- Johnson M.D., Witherden D.A., Havran W.L. The Role of Tissue-resident T Cells in Stress Surveillance and Tissue Maintenance. Cells. 2020. 9(3). 686. Published 2020, Mar 11. doi: 10.3390/cells9030686.
- Keller A.N., Corbett A.J., Wubben J.M., McCluskey J., Rossjohn J. MAIT cells and MR1-antigen recognition. Curr. Opin. Immunol. 2017. 46. 66-74. doi: 10.1016/j.coi.2017.04.002.
- Kohlgruber A.C., Donado C.A., LaMarche N.M. et al. Activation strategies for invariant natural killer T cells. Immunogenetics. 2016. 68(8). 649-663. doi: 10.1007/s00251-016-0944-8.
- Kohlgruber A.C., Gal-Oz S.T., LaMarche N.M. et al. γδT cells producing interleukin-17A regulate adipose regulatory T cell homeostasis and thermogenesis [published correction appears in Nat. Immunol. 2019 Mar. 20(3). 373]. Nat. Immunol. 2018. 19(5). 464-474. doi: 10.1038/s41590-018-0094-2.
- LaMarche N.M., Kohlgruber A.C., Brenner M.B. Innate T Cells Govern Adipose Tissue Biology. J. Immunol. 2018. 201(7). 1827-1834. doi: 10.4049/jimmunol.1800556.
- Le Menn G., Sibille B., Murdaca J. et al. Decrease in αβ/γδ T-cell ratio is accompanied by a reduction in high-fat diet-induced weight gain, insulin resistance, and inflammation. FASEB J. 2019. 33(2). 2553-2562. doi: 10.1096/fj.201800696RR.
- Lee H.W., Chung Y.S., Kim T.J. Heterogeneity of Human γδ T Cells and Their Role in Cancer Immunity. Immune Netw. 2020. 20(1). e5. Published 2020, Feb 14. doi: 10.4110/in.2020.20.e5.
- Li Y., Woods K., Parry-Strong A. et al. Distinct Dysfunctional States of Circulating Innate-Like T Cells in Metabolic Disease. Front. Immunol. 2020. 11. 448. Published 2020, Mar 13. doi: 10.3389/fimmu.2020.00448.
- Liu R., Nikolajczyk B.S. Tissue Immune Cells Fuel Obesity-Associated Inflammation in Adipose Tissue and Beyond. Front. Immunol. 2019. 10. 1587. Published 2019, Jul 17. doi: 10.3389/fimmu.2019.01587.
- Luck H., Tsai S., Chung J. et al. Regulation of obesity-related insulin resistance with gut anti-inflammatory agents. Cell. Metab. 2015. 21(4). 527-542.doi: 10.1016/j.cmet.2015.03.001.
- Lynch L., Hogan A.E., Duquette D. et al. iNKT Cells Induce FGF21 for Thermogenesis and Are Required for Maximal Weight Loss in GLP1 Therapy. Cell. Metab. 2016. 24(3). 510-519. doi: 10.1016/j.cmet.2016.08.003.
- Lynch L., Michelet X., Zhang S. et al. Regulatory iNKT cells lack expression of the transcription factor PLZF and control the homeostasis of T(reg) cells and macrophages in adipose tissue. Nat. Immunol. 2015. 16(1). 85-95. doi: 10.1038/ni.3047.
- Lynch L., Nowak M., Varghese B. et al. Adipose tissue invariant NKT cells protect against diet-induced obesity and metabolic disorder through regulatory cytokine production. Immunity. 2012. 37(3). 574-587. doi: 10.1016/j.immuni.2012.06.016.
- Mamedov M.R., Scholzen A., Nair R.V. et al. A Macrophage Colony-Stimulating-Factor-Producing γδ T Cell Subset Prevents Malarial Parasitemic Recurrence. Immunity. 2018. 48(2). 350-363. e7. doi: 10.1016/j.immuni.2018.01.009.
- Mathews J.A., Williams A.S., Brand J.D. et al. γδ T cells are required for pulmonary IL-17A expression after ozone exposure in mice: role of TNFα. PLoS One. 2014. 9(5). e97707. Published 2014, May 13. doi: 10.1371/journal.pone.0097707.
- Monteiro-Sepulveda M., Touch S., Mendes-Sá C. et al. Jejunal T cell inflammation in human obesity correlates with decreased enterocyte insulin signaling. Cell. Metab. 2015. 22(1). 113-124. doi: 10.1016/j.cmet.2015.05.020.
- Morita C.T., Mariuzza R.A., Brenner M.B. Antigen recognition by human gamma delta T cells: pattern recognition by the adaptive immune system. Springer Semin. Immunopathol. 2000. 22(3). 191-217. doi: 10.1007/s002810000042.
- O’Brien A., Loftus R.M., Pisarska M.M. et al. Obesity Reduces mTORC1 Activity in Mucosal-Associated Invariant T Cells, Driving Defective Metabolic and Functional Responses. J. Immunol. 2019. 202(12). 3404-3411. doi: 10.4049/jimmunol.1801600.
- Park J., Huh J.Y., Oh J. et al. Activation of invariant natural killer T cells stimulates adipose tissue remodeling via adipocyte death and birth in obesity. Genes. Dev. 2019. 33(23–24). 1657-1672. doi: 10.1101/gad.329557.119.
- Parkinson R.M., Collins S.L., Horton M.R. et al. Egr3 induces a Th17 response by promoting the development of γδ T cells. PLoS One. 2014. 9(1). e87265. Published 2014, Jan 24. doi: 10.1371/journal.pone.0087265.
- Paul S., Singh A.K., Shilpi, Lal G. Phenotypic and functional plasticity of gamma-delta (γδ) T cells in inflammation and tolerance. Int. Rev. Immunol. 2014. 33(6). 537-558. doi: 10.3109/08830185.2013.863306.
- Peters C., Kabelitz D., Wesch D. Regulatory functions of γδ T cells. Cell. Mol. Life Sci. 2018. 75(12). 2125-2135. doi: 10.1007/s00018-018-2788-x.
- Pisarska M., Dunne M.R., O'Shea D. et al. Interleukin-17 producing mucosal associated invariant T cells — emerging players in chronic inflammatory diseases? [published online ahead of print, 2020, Jul 3]. Eur. J. Immunol. 2020. doi:10.1002/eji.202048645.
- Qin G., Liu Y., Zheng J. et al. Type 1 responses of human Vγ9Vδ2 T cells to influenza A viruses. J. Virol. 2011. 85(19). 10109-10116. doi: 10.1128/JVI.05341-11.
- Rahimpour A., Koay H.F., Enders A. et al. Identification of phenotypically and functionally heterogeneous mouse mucosal-associated invariant T cells using MR1 tetramers. J. Exp. Med. 2015. 212(7). 1095-1108. doi: 10.1084/jem.20142110.
- Rampoldi F., Ullrich L., Prinz I. Revisiting the Interaction of γδ T-Cells and B-Cells. Cells. 2020. 9(3). 743. Published 2020, Mar 18. doi: 10.3390/cells9030743.
- Salio M., Silk J.D., Jones E.Y. et al. Biology of CD1- and MR1-restricted T cells. Annu. Rev. Immunol. 2014. 32. 323-366. doi: 10.1146/annurev-immunol-032713-120243.
- Satoh M., Andoh Y., Clingan C.S. et al. Type II NKT cells stimulate diet-induced obesity by mediating adipose tissue inflammation, steatohepatitis and insulin resistance. PLoS One. 2012. 7(2). e30568. doi: 10.1371/journal.pone.0030568.
- Satoh M., Iwabuchi K. Role of Natural Killer T Cells in the Development of Obesity and Insulin Resistance: Insights From Recent Progress. Front. Immunol. 2018. 9. 1314. Published 2018, Jun 11. doi: 10.3389/fimmu.2018.01314.
- Shiromizu C.M., Jancic C.C. γδ T Lymphocytes: An Effector Cell in Autoimmunity and Infection. Front Immunol. 2018. 9. 2389. Published 2018, Oct 16. doi: 10.3389/fimmu.2018.02389.
- Silva-Santos B., Serre K, Norell H. γδ T cells in cancer. Nat. Rev. Immunol. 2015. 15(11). 683-691. doi: 10.1038/nri3904.
- Singh A.K., Rhost S., Löfbom L., Cardell S.L. Defining a novel subset of CD1d-dependent type II natural killer T cells using natural killer cell-associated markers. Scand. J. Immunol. 2019. 90(3). e12794. doi: 10.1111/sji.12794.
- Singh A.K., Tripathi P., Cardell S.L. Type II NKT Cells: An Elusive Population With Immunoregulatory Properties. Front. Immunol. 2018. 9. 1969. Published 2018, Aug 28. doi: 10.3389/fimmu.2018.01969.
- Subramanian S., Goodspeed L., Wang S. et al. Deficiency of Invariant Natural Killer T Cells Does Not Protect Against Obesity but Exacerbates Atherosclerosis in Ldlr–/– Mice. Int. J. Mol. Sci. 2018. 19(2). 510. Published 2018, Feb 8. doi: 10.3390/ijms19020510.
- Tatituri R.V., Watts G.F., Bhowruth V. et al. Recognition of microbial and mammalian phospholipid antigens by NKT cells with diverse TCRs. Proc. Natl Acad. Sci. USA. 2013. 110(5). 1827-1832. doi: 10.1073/pnas.1220601110.
- Taylor K.R., Mills R.E., Costanzo A.E. et al. Gammadelta T cells are reduced and rendered unresponsive by hyperglycemia and chronic TNFalpha in mouse models of obesity and metabolic disease. PLoS One. 2010. 5(7). e11422. Published 2010, Jul 2. doi: 10.1371/journal.pone.0011422.
- Tezze C., Romanello V., Sandri M. FGF21 as Modulator of Metabolism in Health and Disease. Front. Physiol. 2019. 10. 419. Published 2019, Apr 17. doi: 10.3389/fphys.2019.00419.
- Toubal A., Nel I., Lotersztajn S. et al. Mucosal-associated invariant T cells and disease. Nat. Rev. Immunol. 2019. 19(10). 643-657. doi: 10.1038/s41577-019-0191-y.
- Touch S., Assmann K.E., Aron-Wisnewsky J. et al. Mucosa–l-associated invariant T (MAIT) cells are depleted and prone to apoptosis in cardiometabolic disorders [published online ahead of print, 2018, Apr 27]. FASEB J. 2018. fj201800052RR. doi: 10.1096/fj.201800052RR.
- Touch S., Clément K., André S. T Cell Populations and Functions Are Altered in Human Obesity and Type 2 Diabetes. Curr. Diab. Rep. 2017. 17(9). 81. doi: 10.1007/s11892-017-0900-5.
- Tyler C.J., Doherty D.G., Moser B. et al. Human Vγ9/Vδ2 T cells: Innate adaptors of the immune system. Cell Immunol. 2015. 296(1). 10-21. doi: 10.1016/j.cellimm.2015.01.008.
- Uhlen M., Karlsson M.J., Zhong W. et al. A genome-wide transcriptomic analysis of protein-coding genes in human blood cells. Science. 2019. 366(6472). eaax9198. doi: 10.1126/science.aax9198.
- van Eijkeren R.J., Krabbe O., Boes M. et al. Endogenous lipid antigens for invariant natural killer T cells hold the reins in adipose tissue homeostasis. Immunology. 2018. 153(2). 179-189. doi: 10.1111/imm.12839.
- Wang Y., Sedimbi S., Löfbom L. et al. Unique invariant natural killer T cells promote intestinal polyps by suppressing TH1 immunity and promoting regulatory T cells. Mucosal. Immunol. 2018. 11(1). 131-143. doi: 10.1038/mi.2017.34.
- Wensveen F.M., Valentić S., Šestan M. et al. The “Big Bang” in obese fat: Events initiating obesity-induced adipose tissue inflammation. Eur. J. Immunol. 2015. 45(9). 2446-2456. doi: 10.1002/eji.201545502.
- Xu W., Lau Z.W.X., Fulop T. et al. The Aging of γδ T Cells. Cells. 2020. 9(5). 1181. Published 2020, May 9. doi: 10.3390/cells9051181.
- Zhang H., Xue R., Zhu S. et al. M2-specific reduction of CD1d switches NKT cell-mediated immune responses and triggers metaflammation in adipose tissue. Cell. Mol. Immunol. 2018. 15(5). 506-517. doi: 10.1038/cmi.2017.11.

/84.jpg)
/85.jpg)
/86.jpg)
/87.jpg)
/89.jpg)
/90.jpg)
/91.jpg)