Уявлення про сповільнений фізичний розвиток дітей змінювались упродовж останніх століть щодо визначення, методів оцінки, надання допомоги й оцінювання довгострокових результатів. Цей феномен був уперше описаний як «припинення росту й розвитку» у 1897 р., після чого в англомовній літературі був відомий як «неспроможність росту й розвитку» (failure to thrive), а також як «сповільнення темпів росту або збільшення маси тіла» (growth faltering). Водночас порушення фізичного розвитку традиційно розглядались як наслідок і вияв недостатнього харчування. Інші терміни, що використовувались у цьому контексті, — «кахексія», «дистрофія», «гіпотрофія», «білково-енергетична недостатність», «маразм» і «квашіоркор» (переважно в країнах, що розвиваються). У вітчизняній літературі історично використовується термін «гіпотрофія», її відносять до хронічних розладів харчування. Чинний вітчизняний протокол (2005 р.) також використовує термін «гіпотрофія», класифікуючи її тяжкість відповідно до рекомендацій початку другої половини минулого століття [1], хоча Наказ МОЗ України № 149 від 20.03.2008 «Про затвердження Клінічного протоколу медичного догляду за здоровою дитиною віком до 3 років» використовує сучасну термінологію і рекомендує використовувати міжнародні стандарти фізичного розвитку дітей раннього віку [2].
Сповільнений фізичний розвиток дітей і на сьогодні залишається важливою проблемою у всіх регіонах світу, яку розглядають у комплексі із сучасною епідемією ожиріння в дітей. Так, у 2014 р. у світі 42 мільйони дітей віком до п’яти років мали надмірну масу тіла або страждали від ожиріння; але в 156 мільйонів виявлялась затримка росту (недостатня довжина тіла/зріст для віку), а 50 мільйонів мали «виснаження» (замала маса для довжини тіла/зросту) [3]. У деяких випадках неправильне харчування й сповільнення росту можуть бути менш помітними. ВООЗ описує це як «подвійний тягар неправильного харчування, коли діти недоїдають, але мають надмірну масу тіла або страждають від ожиріння відповідно до нормативних кривих росту» [3].
Однак сповільнений фізичний розвиток дітей раннього віку, пов’язаний з недостатнім харчуванням, є окремим викликом, оскільки визначає істотно вищий ризик стійких когнітивних і поведінкових порушень, які можуть зберігатись до досягнення дорослого віку [4–6]. Ця проблема добре відома й вивчена в передчасно народжених немовлят, високі харчові потреби яких поєднуються з обмеженими можливостями їх забезпечення, що спричиняє значну частоту затримки постнатального фізичного розвитку й негативні довгострокові наслідки [7]. Дослідження із залученням доношених дітей ще декілька десятиліть тому також продемонстрували, що недостатнє харчування протягом першого року життя пов’язане з перманентними змінами росту й функції мозку. Зокрема, зменшуються розміри мозку й кількість нейронів, потоншується кора головного мозку, погіршується мієлінізація і змінюється морфологія дендритних відростків. Усі ці порушення асоціювались із гіршими довгостроковими результатами неврологічного розвитку [8–10].
На сьогодні існують вагомі докази того, що порушення росту плода, сповільнене збільшення маси тіла протягом перших 2 років життя і/або низький індекс маси тіла (ІМТ) у віці 2 роки підвищують ризик захворюваності в дорослому віці, включно з артеріальною гіпертензією, ішемічною хворобою серця, інсультами, порушеннями регуляції обміну вуглеводів і жирів, патологією кісткової системи тощо [11–16].
Результати масштабних міжнародних досліджень також пояснюють більшість випадків смерті дітей у перші 5 років життя недостатнім харчуванням зі значно підвищеним відносним ризиком смерті в тяжких випадках [17].
Існують різні дані про поширеність сповільненого фізичного розвитку, зокрема, ця проблема може виявлятися в 5–10 % немовлят, які звертаються до закладів первинної медичної допомоги, і 3–5 % немовлят в умовах стаціонару [18]. Хоча відповідно до інших даних недостатність харчування, пов’язану з наявною хворобою, виявляють у 15–30 % госпіталізованих дітей [19]. У датській когорті новонароджених залежно від використовуваних критеріїв сповільнений фізичний розвиток діагностували в межах 1,3–22 % немовлят [20]. Вважається, що дійсна поширеність сповільненого фізичного розвитку може коливатися від 6 до 50 %, оскільки не існує єдиного визначення й критеріїв діагностики недостатнього харчування в дітей раннього віку [21].
У розвинених країнах недостатнє харчування переважно пов’язане із захворюваннями, хронічними патологічними станами, травмами, опіками або хірургічними втручаннями. Десятки захворювань з різною етіологією можуть спричинювати недостатність харчування й сповільнювати фізичний розвиток у дітей [22]. Це відбувається внаслідок втрати поживних речовин, підвищених витрат енергії, недостатнього споживання нутрієнтів або порушеного їх засвоєння. Зазначені механізми часто характеризують такі гострі стани, як травми, опіки й інфекції, а також хронічні захворювання — хронічні хвороби легень, муковісцидоз, бульозний епідермоліз, хвороби нирок, злоякісні новоутворення, природжені хвороби серця, а також патологію травного каналу, нервово-м’язові захворювання тощо. На додаток до антропометричних змін, що типово виявляють у дітей з гострою недостатністю харчування, для хронічного харчового дефіциту типовою є затримка росту (зменшення швидкості росту) [23].
Підходи до визначення, діагностики, класифікації і лікування недостатності харчування в дітей у світі були переглянуті після затвердження ВООЗ у 2006 р. нових стандартів фізичного розвитку дітей [21, 23–26].
Визначення недостатнього харчування й сповільненого фізичного розвитку в дітей
У 1999 р. ВООЗ визначила тяжку недостатність харчування в дітей як масу тіла щодо довжини/зросту на рівні нижче за 3 стандартні відхилення (SD) від середнього показника (на підставі рекомендацій Національного центру статистки охорони здоров’я [NCHS]) і/або наявність набряків [27]. У 2005 р. експерти рекомендували додати величину окружності середньої ділянки плеча (ОСДП) менше за 110 мм (у дітей віком від 6 до 60 місяців) як незалежний діагностичний критерій [28]. У 2009 р. ВООЗ і ЮНІСЕФ опублікували спільні рекомендації щодо визначення тяжкої гострої недостатності харчування на підставі нових стандартів фізичного розвитку дітей раннього віку ВООЗ, які залишаються актуальними до сьогодні (табл. 1) [21]. Це визначення відрізняє виснажених дітей або дітей з набряками від тих, хто має переважно затримку росту, оскільки низькорослі діти (хоча вони й мають дефіцит маси) не є пріоритетом невідкладної допомоги, тому що дефіцит довжини й маси тіла в них не можна скоригувати в короткостроковій перспективі.
Отже, для визначення й документування недостатності харчування в дітей у сучасних умовах рекомендується використовувати інформацію про зниження або негативні значення z-індексів, що доступні в додатках до Наказу МОЗ України № 149 від 20.03.2008 [2] і на відповідних електронних ресурсах (табл. 2) [26].
/57.jpg)
Американське товариство парентерального й ентерального харчування (ASPEN) визначає недостатність харчування у дітей як «дисбаланс між потребою в поживних речовинах і їх споживанням, що призводить до накопичувального дефіциту енергії, білка або мікроелементів і може негативно впливати на ріст, розвиток та інші відповідні результати» [23]. Водночас експерти ASPEN пропонують розглядати визначення недостатності харчування в дітей у 5 доменах (рис. 1), підкреслюючи, що відсутність єдиних визначення і термінології, неоднорідність методів оцінювання адекватності харчування й недостатня увага до питань харчування в комплексі лікувально-діагностичних заходів є однією з причин недооцінки поширеності цієї проблеми і її впливу на ефективність медичної допомоги загалом [23]. Традиційні терміни, такі як «білково-енергетичне недоїдання», «маразм» і «квашіоркор», описують наслідки недостатнього харчування, проте не враховують різноманітність етіологічних чинників і динамічних взаємодій, що мають значення для порушень харчового статусу в дітей [23].
/58.jpg)
Водночас настанова Британського національного інституту здоров’я і клінічної досконалості (NICE) 2017 р. визначає сповільнений фізичний розвиток як зменшення маси тіла на 1 або більше відповідний міжцентильний проміжок на стандартних перцентильних кривих маси тіла (UK-WHO), якщо маса тіла при народженні була нижчою за 9-й перцентиль; на 2 або більше проміжки, якщо показник маси при народженні був між 9-м і 91-м перцентилями, і на 3 або більше проміжки, якщо маса при народженні була вище від 91-го перцентиля. Ознакою сповільненого фізичного розвитку також вважається фактична маса тіла нижче за 2-й перцентиль за віком незалежно від маси тіла при народженні [29].
Крім того, для визначення сповільненого фізичного розвитку використовують такі критерії: 1) зменшення маси тіла на 2 перцентильних проміжки без інших додаткових умов; 2) показник фактичної маси тіла для віку нижче за 3-й перцентиль або 3) показник фактичної маси тіла щодо довжини тіла/зросту на 2 стандартних відхилення (2 z-індекси) нижче від середнього (50 %) для віку й статі [22].
Класифікація недостатнього харчування в дітей
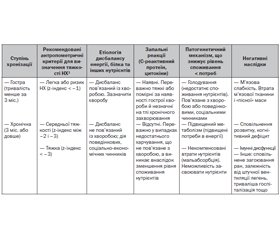
Недостатність харчування в дітей може бути гострою або хронічною, а також пов’язаною або не пов’язаною з хворобами (рис. 1). Традиційно також недостатність харчування класифікують за тяжкістю (табл. 3–5). Повну сучасну класифікацію порушень харчового статусу немовлят і дітей за ВООЗ (2017) наведено в табл. 6 [30].
Історично тяжкість недостатності харчування в дітей класифікували за відсотком від ідеальної (50-й перцентиль) маси тіла для віку/довжини тіла. Відповідний розподіл уперше описали Gomez і співавт., продемонструвавши кореляцію між ступенем недоїдання та смертю [31]. І класифікація за Gomez, і пізніше запропоновані критерії Waterlow [32] розрізняли легку, помірну й тяжку недостатність харчування як 76–90 %, 61–75 % і < 60 % відповідно [31] або як 80–89 %, 70–79 % і < 70 % [32] від ідеальної маси тіла. Саме критерії Waterlow (1972) використовувались у вітчизняній класифікації ступенів тяжкості гіпотрофії.
Легка недостатність харчування, як правило, є наслідком гострої події, що виникла або внаслідок економічних обставин, або через гостру хворобу і виявляється втратою маси тіла або зниженням темпів її збільшення. Помірна недостатність харчування виникає внаслідок тривалого недоїдання, що призводить до зменшення нижче від норми маси тіла для довжини тіла/зросту або ІМТ для віку. Тяжка недостатність харчування виникає внаслідок тривалого недоїдання і найчастіше кількісно визначається зниженням темпів лінійного росту, що призводить до його затримки (табл. 3) [26].
Під час первинного огляду дитина може мати лише одну ознаку, що свідчить про недостатнє харчування (табл. 4). Однак, як зазначалось вище, відповідно до рекомендацій ВООЗ тяжку гостру недостатність харчування, що вимагає невідкладних утручань, практично визначають на підставі дефіциту маси тіла щодо довжини тіла (зросту) та інших критеріїв, наведених у табл. 1 [21].
Якщо додатково доступні дані анамнезу захворювання, а отже, наявні декілька ознак недостатнього харчування, можуть бути корисними критерії, наведені в табл. 5 [26].
Діагностика недостатнього харчування в дітей
Для своєчасного виявлення недостатнього харчування в дітей рекомендується використовувати декілька індикаторів [26].
Рівень споживання нутрієнтів
Слід регулярно визначати рівень споживання білка/енергії в усіх дітей, особливо в тих, які мають підвищений ризик недостатнього харчування або отримують харчову корекцію з приводу наявного дефіциту. Точність в оцінці харчових потреб і рівня споживання нутрієнтів є вирішальною для встановлення величини, тривалості й тяжкості харчового дефіциту. Водночас точне індивідуальне визначення енергетичних потреб є проблематичним. Важливим є те, що відповідні харчові потреби хворих, а також окремих популяцій дітей (насамперед передчасно народжених) відрізняються від традиційних вікових норм [35].
Потреби в енергії. У клінічній практиці неможливо визначити, чи споживання енергії, наприклад, на 10–20 % перевищує потреби, чи є нижчим за реальні потреби [36]. На потреби в енергії впливають генетичні чинники, харчовий статус, наявні захворювання, витрати енергії, вік і стать. Потреби в енергії в здорових дітей залежать: 1) від рівня основного обміну; 2) наявності харчового термогенезу; 3) рівня фізичної активності; 4) потреб росту. Отже, щоб визначити сумарний показник фізіологічної потреби в енергії, потрібно врахувати ці чотири складові. Показник фізіологічної потреби можна розрахувати, помноживши енергію основного обміну на коефіцієнт фізичної активності дитини й додавши енергію, що витрачається на травлення (харчовий термогенез) і потреби росту.
Переважній більшості дітей основний обмін виміряти неможливо, тому замість цього показника оцінюють витрати енергії в стані спокою, які не відрізняються від витрат на основний обмін більше ніж на 10 % [36]. У разі недоступності методу непрямої калориметрії для розрахунку витрат енергії в стані спокою на сьогодні рекомендується використовувати рівняння Schofield для маси тіла [36], однак для дітей з тяжкою недостатністю харчування доцільно застосовувати точніший варіант цього рівняння (2), який містить також довжину тіла/зріст (табл. 7) [26, 36].
Харчовий термогенез визначає приблизно 10 % добової потреби в енергії в дітей, які харчуються ентеральним шляхом (приблизно 20 ккал/кг/добу) [36]. Відповідно в пацієнтів на повному або переважно парентеральному харчуванні таких витрат не буде, загальні потреби в енергії будуть приблизно на 10 % меншими.
Рівень фізичної активності є невисоким у хворих або ослаблених дітей. Відповідні коефіцієнти, на які множать показник витрат у стані спокою, становлять: 1,0 — для сну; 1,2 — для лежання з неспанням; 1,5 — для низького, 1,7 — для помірного і 2 — для високого рівня активності здорових дітей [36]. Для дітей перших 3 років життя коефіцієнт фізичної активності переважно дорівнює 1 [26].
Потреби росту становлять приблизно 175 ккал/добу у віці 0–3 міс., 60 ккал/добу — у 4–6 міс. і 20 ккал/добу — у віці від 6 до 12 міс. На цьому низькому рівні вони залишаються упродовж дитинства, зростаючи до 30 ккал/добу лише в підлітковому віці [36].
Усі зазначені вище складові входять у нормативні вікові фізіологічні норми споживання енергії [35].
Однак потреби в енергії хворої дитини додатково можуть змінюватись під дією стресу, пов’язаного з певним станом або хворобою. Більше енергії потребують діти, які перенесли хірургічне втручання (коефіцієнт відносно потреб у стані спокою — 1,05–1,5), хворі на сепсис (1,2–1,6), травмовані (1,1–1,8), з опіками (1,5–2,5), а також із затримкою фізичного розвитку (1,5–2,0). Це означає, що показник, розрахований за рівнянням Schofield, потрібно помножити на цей коефіцієнт [26].
Можливості наздоганяючого росту у випадку затримки фізичного розвитку дитини залежать від структури тканинного дефіциту (нежирова й жирова маса) і швидкості, з якою можливе відновлення. З урахуванням значення Atwater щодо енергетичної цінності нутрієнтів для відкладення 1 г жиру потрібно 9 ккал, а для 1 г білка — 4 ккал. Якщо вважати, що нежирова тканина містить 25 % білка, то для утворення 1 г такої тканини потрібна 1 ккал (25 % від 4 ккал). Отже, якби бажаний наздоганяючий ріст забезпечував формування 40 % жиру й 60 % нежирової маси, то відповідна енергетична цінність збільшення маси тіла на 1 г становила б 4,2 ккал [(0,4 • 9) + (0,6 • 1) = 4,2]. Якщо бажані темпи збільшення маси становлять 20 г/кг/добу, це визначатиме потребу споживання додаткових 84 ккал/кг/добу (4,2 • 20 = 84) на додаток до інших потреб [37].
Потреби в білках. Для більшості здорових дітей споживання білка на рівні 1,5 г/кг/добу є безпечним [37]. Однак нормативні вікові фізіологічні норми споживання білка відповідно до міжнародних рекомендацій є нижчими, коливаючись від 1,14 г/кг у віці одного року до 0,9 г/кг/добу в три роки [35]. Але ці норми не забезпечуватимуть потреб дітей з дефіцитом нежирової маси або в стані метаболічного стресу.
Аналогічний до описаного вище підхід для розрахунків енергії з урахуванням структури й величини тканинного дефіциту можна використати для визначення додаткових потреб у білках, необхідних для відновлення нежирової маси тіла. Дефіцит білка в організмі можна оцінити на підставі підрахованого дефіциту нежирової маси, оскільки остання містить 20–25 % білка. Для корекції цього дефіциту слід враховувати відсоток засвоєння білка в організмі дитини. Метаболічна ефективність харчового білка становить близько 70 %; отже, щоб забезпечити утворення 1 г нової нежирової тканини (що дорівнює 0,25 г білка), слід вжити 0,36 г білка (0,25/0,7 = 0,36). У дитини з бажаними темпами збільшення маси тіла на рівні 10 г/кг/добу (60 % нежирової і 40 % жирової тканини) за добу має утворюватися 6 г нежирової тканини на 1 кг маси тіла (10 • 0,6 = 6). Це вимагало би додаткового споживання 2,2 г білка/кг/добу (6 • 0,36 = 2,2) [37].
Потреба в білках у дітей зі сповільненим ростом унаслідок недостатності харчування має становити 9–11,5 % від загальної потреби в енергії залежно від прогнозованих темпів росту й дорівнює приблизно 3–5 г/кг/добу [38].
Хвора, травмована або прооперована дитина також має вищі потреби в білках, оскільки метаболічний стрес підсилює катаболізм і втрати нежирової маси. Відповідні загальні потреби в білках у дитини з таких груп ризику перших 2 років життя оцінюються на рівні 2–3 г/кг/добу, а в дитини віком 2–13 років — 1,5–2 г/кг/добу [26, 39].
Загальні підвищені потреби в енергії і білках у дитини зі сповільненим фізичним розвитком можна також розрахувати, використовуючи замість фактичної належну масу. Оптимальними будуть розрахунки з використанням середньої маси й віку, що відповідають довжині тіла (зросту). Так, замість належної маси за віком доцільно використати масу, яка відповідає –(50-й перцентиль) довжині тіла або «скоригованому» віку, визначеному за довжиною тіла.
Як вже зазначалось, потребу в білках можна також оцінити, враховуючи, що їх споживання має відповідати 9–11,5 % розрахованих потреб в енергії.
Потреби дітей з природженими вадами серця (ПВС). Щоб мінімізувати негативні наслідки прогресуючого зменшення споживання енергії і збільшення відповідних потреб, доцільно забезпечити наздоганяючий ріст немовлят зі сповільненим фізичним розвитком. Було підраховано, що для нормального росту таких дітей потрібне споживання енергії на рівні 150 ккал/кг/добу, або 140 % від середньої розрахункової потреби. Потреби немовлят із ПВС у білках також підвищені й можуть коливатися від 3,0 до 4,5 г/кг/добу. Більшість таких дітей здатні толерувати споживання рідини в межах 145–165 мл/кг/добу, не виявляючи ознак серцевої декомпенсації [22].
Потреби немовлят із хронічною легеневою хворобою. Адекватна харчова підтримка має вирішальне значення в лікуванні немовлят з бронхолегеневою дисплазією (БЛД). Орієнтовна потреба в енергії в таких дітей вища, ніж у здорових немовлят, і досягає 120–150 ккал/кг/добу. Рекомендований рівень споживання білка для немовлят з БЛД також підвищений і становить від 2,5 до 3,5 г/кг/добу. Крім того, лікування немовлят з БЛД може вимагати обмеження рідини [40].
Потреби немовлят з муковісцидозом (МВ). Визначення індивідуальних енергетичних потреб пацієнтів з муковісцидозом є непростим, оскільки, хоча загалом такі потреби підвищені, необхідно враховувати вік, клінічний і харчовий статус на момент встановлення діагнозу. Рекомендації, що містяться в різних клінічних настановах, визначають від 110 до 200 % показників для здорових дітей. Для досягнення рекомендованого рівня забезпечення енергією пацієнтам із МВ часто потрібно підвищити споживання жиру (35–40 % енергії). Більшість немовлят з недостатністю функції підшлункової залози будуть нормально рости й розвиватися за умови щоденного споживання 100–130 ккал/кг/добу у поєднанні з ферментною терапією. Якщо збільшення маси залишається недостатнім, потреби в енергії можуть сягати 150–200 ккал/кг/добу [22], а для забезпечення належного ендогенного синтезу може бути потрібним споживання до 5 г/кг/добу білка [37].
Параметри фізичного розвитку
Фізичний розвиток є основним показником харчового статусу дитини. Антропометричні показники слід визначати через регулярні інтервали протягом усього дитинства й підліткового віку, а також після госпіталізації з будь-якого приводу. У дітей, молодших за 36 міс., потрібно оцінити довжину, масу тіла й окружність голови щодо віку, а також масу щодо довжини тіла. У більш старших дітей визначають зріст, масу тіла й ІМТ щодо віку. Результати антропометричних вимірювань типово подають на стандартних перцентильних кривих порівняно з популяційними даними. Однак перцентилі завжди є позитивними й не виявляють фактичного ступеня відхилення від популяційних норм. Саме тому сучасні рекомендації визначають потребу використовувати криві росту, які дозволяють оцінити ступінь відхилення антропометричних показників від популяційних норм у стандартизованих одиницях (стандартні відхилення, або z-індекси).
Z-індекс (або стандартне відхилення) є статистичним показником, що характеризує співвідношення результату вимірювання з популяційною нормою, визначаючи істотність позитивного або негативного відхилення цього результату від середнього показника. Як і у випадку перцентильних кривих, якщо лінія росту перетинає криву z-індексу (насамперед якщо лінія росту йде донизу), це свідчить про можливий ризик недостатності харчування. Антропометричні показники дітей з нормальним ростом і розвитком знаходяться в зоні між z-індексами –1 й 1. Використання z-індексів для визначення й класифікації недостатності харчування й сповільнення темпів росту описано вище.
Раннім індикатором недостатнього харчування дітей раннього віку є сповільнення нормальних темпів збільшення антропометричних показників. Під час початкового об’єктивного обстеження довжина тіла або зріст відображають попередній харчовий статус дитини в довгостроковій ретроспективі. За відсутності інших даних для діагностики недостатності харчування в дітей можна використати негативні z-індекси. Якщо доступні дані про динаміку антропометричного показника, слід враховувати зниження z-індексів. Важливо також звертати увагу на показники щомісячного (щоденного) збільшення маси тіла, оскільки саме вони найсильніше пов’язані з віддаленими негативними наслідками [26].
Оцінювання харчового статусу дитини обов’язково передбачає визначення окружності середньої ділянки плеча. Як уже зазначалось вище, цей показник може бути незалежним антропометричним індикатором недостатнього харчування в дитини віком 6–59 міс.
Харчовий скринінг
Використання спеціальних інструментів для своєчасного виявлення дітей із групи ризику щодо виникнення недостатності харчування підвищує ефективність діагностики, профілактики й лікувальних втручань [41].
Скринінгове оцінювання харчового статусу й фізичного розвитку (STRONGkids):
1. Суб’єктивна клінічна оцінка (1 бал).
Чи харчовий статус пацієнта порушений за даними суб’єктивного клінічного оцінювання (зменшення підшкірного жиру і/або м’язової маси і/або «запалий» вигляд обличчя)?
2. Хвороба високого ризику (2 бали).
Чи наявна хвороба з ризиком недостатнього харчування або очікується значне хірургічне втручання?
3. Споживання нутрієнтів і втрати (1 бал).
Чи є що-небудь з наведеного нижче?
— Значна діарея (≥ 5 разів на день) і/або блювання (> 3 рази на день) протягом останніх кількох днів.
— Менше кількісне споживання їжі протягом останніх кількох днів перед госпіталізацією (не враховуючи голодування перед певною процедурою або операцією).
— Попередньо рекомендовані харчові втручання.
— Неможливість споживати достатню кількість їжі через біль.
4. Втрата або недостатнє збільшення маси тіла? (1 бал).
Чи спостерігається втрата або недостатнє збільшення маси тіла (немовлята) протягом останніх кількох тижнів/місяців?
4–5 балів — високий ризик (додаткові консультації і харчові втручання); 1–3 бали — помірний ризик (додаткові визначення маси тіла; повторне оцінювання через тиждень); 0 — низький ризик (додаткові втручання не потрібні).
Перелік захворювань високого ризику щодо недостатності харчування:
— незрілість/недоношеність (скоригований вік 6 міс.);
— бронхолегенева дисплазія (максимальний вік 2 роки);
— природжені вади серця;
— синдром короткого кишечника;
— целіакія;
— муковісцидоз;
— запальна хвороба кишечника;
— хронічні хвороби печінки;
— хронічні хвороби нирок;
— панкреатит;
— нервово-м’язова хвороба;
— хвороба метаболізму;
— тяжка травма;
— очікувана серйозна операція;
— неповносправність, розумова відсталість;
— інша хвороба (визначена лікарем);
— опіки;
— нервова анорексія;
— злоякісне захворювання;
— тяжке інфекційне захворювання (СНІД).
Харчові втручання в дітей з ризиком недостатнього харчування і/або сповільненим фізичним розвитком
Для досягнення кращих клінічних результатів і в дітей, які мають ризик недостатнього харчування, і в пацієнтів, у яких діагностований сповільнений фізичний розвиток, слід використовувати додаткові харчові втручання. Це сприяє скороченню терміну перебування дитини в лікарні й зменшенню частоти інфекційних та інших ускладнень, а також забезпечує кращі ріст і розвиток у довгостроковій перспективі. Тактика й зміст лікувальних заходів залежать від тяжкості, особливостей (є лише дефіцит маси або довжини тіла для віку, або є виснаження, або виснаження в поєднанні із затримкою росту) і причини (органічної або неорганічної) недостатнього харчування [41].
Декілька чинників можуть перешкоджати адекватному харчуванню тяжкохворих немовлят і дітей раннього віку, зокрема це обмеження рідини, часті переривання ентеральних годувань для процедур і відносна непереносимість продуктів харчування. Тому реальне ентеральне споживання їжі часто відрізняється від кількості, призначеної лікарем, що часто супроводжується дефіцитом білків та енергії.
Одним з найважливіших завдань харчової підтримки тяжкохворих дітей є запобігання підвищеному розщепленню білка і втратам нежирової маси тіла, пов’язаним із критичними захворюваннями, з одночасним сприянням синтезу нових тканин. Це також означає профілактику недостатнього харчування або перегодовування і, зрештою, покращання клінічних результатів для встановлення нормального росту й розвитку. Сучасні підходи до вирішення цього завдання передбачають профілактичне й лікувальне використання спеціальних продуктів харчування з високим вмістом білків та енергії, що дозволяє досягти потрібного рівня харчового забезпечення тяжкохворих немовлят на ранній фазі захворювання.
Ефективність застосування спеціальних продуктів харчування
Немовлят з підвищеними харчовими потребами і/або недостатнім споживанням нутрієнтів переважно рекомендується годувати молочною сумішшю з підвищеним вмістом енергії і поживних речовин [41, 42].
Для вирішення цього завдання традиційно практикувалось використання концентрованих порошкових сумішей для немовлят, а також збагачення стандартних сумішей порошками полімерів глюкози й жировими емульсіями. Однак підвищення концентрації суміші змінює її фізичні властивості й підвищує ризик бактеріальної контамінації, тоді як використання добавок збільшує ризик помилок під час приготування й підвищує осмоляльність суміші. Останній ефект може знижувати толерантність до ентерального харчування й підсилювати шлунково-стравохідний рефлюкс у деяких немовлят. Крім того, такі продукти, як правило, містять більше енергії, однак залишаються дефіцитними щодо білків і мікронутрієнтів, які є важливими для профілактики й лікування харчового дефіциту. Саме тому останніми роками надають перевагу спеціальним збагаченим сумішам промислового виробництва з підвищеним вмістом енергії і поживних речовин [42]. Такі харчові продукти характеризуються оптимальним співвідношенням між білками й калоріями, більш концентрованим профілем мікронутрієнтів, а також нижчою осмоляльністю і, відповідно, меншим навантаженням на нирки. Застосування готової до використання спеціальної суміші мінімізує інфекційний ризик, можливість помилок під час приготування, а також є зручним і практичним [42].
Нещодавно в Україні стали доступними високоякісні продукти цього типу. Для дітей раннього віку призначені суміші Infatrini й Infatrini Peptisorb (Nutricia, Нідерланди). Вони можуть використовуватись як єдиний повноцінний продукт харчування й забезпечують підвищені харчові потреби немовлят і дітей раннього віку від нуля до 18 міс. (або до досягнення маси тіла 9 кг). Характеризуються високим вмістом енергії (≈100 ккал/100 мл) і білка (2,6 г/100 мл), а також низькою осмоляльністю (360 мОсм/кг). Суміш Infatrini містить довголанцюгові поліненасичені жирні кислоти, нуклеотиди й олігосахариди (ГОС/ФОС). Суміш Infatrini Peptisorb відрізняється значним гідролізом білка, підвищеним вмістом середньоланцюгових тригліцеридів (52 % жирів) і зниженим вмістом лактози (< 0,10 г/100 мл). Вона не містить нуклеотидів та олігосахаридів і насамперед призначена для дітей зі сповільненим ростом унаслідок мальабсорбції.
У дітей із групи ризику щодо виникнення недостатності харчування віком від одного до шести років для харчової корекції можна використати суміш Nutrini, яка в 100 мл містить 2,5 г негідролізованого білка і 100 ккал.
Виконані клінічні дослідження засвідчили, що суміші Infatrini добре толерувались немовлятами зі сповільненим фізичним розвитком, а також дітьми раннього віку, які потребували лікування у відділеннях інтенсивної терапії. Використання цих спеціальних харчових продуктів забезпечувало вищий рівень споживання енергії і нутрієнтів, а також швидше досягнення позитивного балансу азоту, що виражалось у кращих показниках фізичного розвитку [43–50].
У першому дослідженні (2006 р.) Evans і співавт. продемонстрували толерантність до початкового годування нерозведеною сумішшю Infatrini в дітей із затримкою росту, хоча зробили висновок, що немовлятам у періоді стабілізації краще поступово збільшувати концентрацію продукту [43].
У дослідженні Clarke і співавт. [44] 60 немовлят зі сповільненим фізичним розвитком унаслідок серцевих захворювань (n = 28), муковісцидозу (n = 7) та інших органічних причин було рандомізовано для годування Infatrini або ізокалорійним продуктом (стандартна суміш, збагачена полімером глюкози й жировою емульсією) протягом 6 тижнів. У дослідження включали немовлят, якщо їх маса тіла була нижчою за 3-й перцентиль або якщо збільшення маси становило менше за 50 % від очікуваного протягом однотижневого періоду. У групі, яка отримувала Infatrini, споживання білка й мікроелементів було значно вищим, ніж у немовлят, які отримували контрольну суміш. В обох групах усі пацієнти продемонстрували наздоганяючий ріст. Однак у хлопчиків, які отримували Infatrini, темпи збільшення маси й лінійного росту були значно вищими. Дослідники дійшли висновку, що практика підвищення енергетичної цінності звичайної суміші для немовлят з порушеним фізичним розвитком не є оптимальною і її не слід застосовувати. Низьке співвідношення білка/енергії в збагачених таким чином сумішах призводить до дефіциту білка, і це може бути пов’язано з порушеннями росту, насамперед лінійного [44].
Van Waardenburg і співавт. [45] виконали подвійне сліпе рандомізоване контрольоване дослідження, порівнюючи харчові ефекти Infatrini та стандартної суміші в тяжкохворих немовлят. Двадцять дітей віком від 4 тиж. до 12 міс., які потребували штучної вентиляції легень із приводу тяжкої респіраторно-синцитіальної інфекції, були рандомізовані й перебували під спостереженням протягом 5 днів. Порівняно з контролем у групі Infatrini споживання енергії, білка й жиру було значно вищим на 3, 4 і 5-й дні, а споживання вуглеводів — на 4-й і 5-й дні. Було зроблено висновок, що раннє призначення спеціальної суміші з високим вмістом білка й енергії критично хворим немовлятам добре переноситься, сприяє швидшому досягненню більш адекватного рівня споживання нутрієнтів, покращує баланс енергії й азоту, а також анаболізм білка. Ці висновки були підтверджені в декількох сучасних дослідженнях в умовах педіатричних відділень інтенсивної терапії з використанням не лише суміші Infatrini, але й Infatrini Peptisorb. Більше того, використання спеціальної суміші покращувало показники фізичного розвитку тяжко хворих немовлят [46–50].
Загальні підходи до лікування дітей з недостатністю харчування
У випадках недостатності харчування легкого ступеня вже на етапі встановлення її етіології, пов’язаної з наявністю хвороби, потрібно відразу підвищити рівень забезпечення дитини нутрієнтами з урахуванням додаткових потреб, описаних вище. Водночас батьків усіх немовлят і дітей віком до 5 років, які звертаються до закладів первинної медичної допомоги, рекомендується рутинно консультувати з питань оптимального харчування, у тому числі із заохоченням до виключно грудного вигодовування і його підтримкою протягом перших 6 міс. життя і продовженням грудного вигодовування до віку 24 міс. [30]. Додаткові обстеження й призначення спеціальних продуктів харчування можуть здійснюватися в амбулаторних умовах з ретельним спостереженням за станом дитини в динаміці. Якщо фізичний розвиток дитини не покращиться після 2–3 місяців амбулаторного лікування, доцільно розглянути потребу госпіталізації для подальших інструментальних і лабораторних обстежень, додаткових спрямованих харчових втручань та оцінювання ефективності взаємодії батьків і дитини під час годування. Додаткові показання до госпіталізації включають помірну або тяжку недостатність харчування, оскільки можливість виникнення так званого синдрому відновленого харчування (refeeding syndrome) вимагає ретельного контролю. Харчові потреби дітей з помірною недостатністю харчування є більшими порівняно зі здоровими дітьми відповідного віку, але меншими від потреб дітей з тяжкою недостатністю харчування у фазі підсиленого харчування. Лікування помірної гострої недостатності харчування в дітей віком 6–59 місяців повинно включати такі важливі заходи, як пропаганда й підтримка грудного вигодовування, навчання й консультування з питань харчування батьків, а також інші заходи, що дозволяють виявити основні причини недоїдання й запобігти їм. Щоб задовольнити додаткові потреби відновного росту й функціонального відновлення, діти віком 6–59 місяців з помірною гострою недостатністю харчування повинні отримувати продукти з підвищеною харчовою щільністю [51]. Потрібно, щоб дієта дітей з помірною недостатністю харчування забезпечувала щонайменше 30 % енергії за рахунок жирів і 10–15 % — за рахунок білків. Рівень забезпечення енергією залежить від тяжкості недостатності харчування й особливостей основного захворювання. Реакція на харчові втручання залежить від конкретного діагнозу, лікування й тяжкості недостатності харчування [52].
Для оцінювання ефективності харчових втручань важливо використовувати ті самі антропометричні показники, на підставі яких була встановлена недостатність харчування. Усі діти з недостатнім харчуванням мають отримувати належну кількість вітамінів і мікроелементів, оскільки в них, як правило, виявляється дефіцит заліза, цинку й вітаміну D, а також підвищені потреби в мікронутрієнтах під час наздоганяючого росту [52].
Харчові втручання в дітей з тяжкою гострою недостатністю харчування
Правильне харчування є ключовим компонентом комплексної стратегії медичної допомоги дітям раннього віку з тяжкою гострою недостатністю харчування (рис. 2).
Основні особливості початкового харчування, основною метою якого є запобігання виникненню синдрому відновленого харчування, такі [53]:
1) здійснюється в умовах лікарні;
2) передбачає призначення частих годувань (кожні 2–3 год) малим об’ємом (табл. 8);
3) використовувати носошлунковий зонд, якщо дитина з’їдає ≤ 80 % запропонованого об’єму протягом 2 послідовних годувань;
4) добовий об’єм — 130 мл/кг (100 мл/кг/добу за наявності значних набряків);
5) забезпечення енергією — 100 ккал/кг/добу;
6) забезпечення білками — 1–1,5 г/кг/добу;
7) якщо дитина годується груддю, продовжувати грудне вигодовування, проте забезпечити також введення потрібної кількості призначеної стартової суміші. Суміш, що використовується для початкового харчування, має містити 75 ккал/100 мл і мінімальну кількість білка (відповідно до спеціального рецепту ВООЗ — 0,9 г білка/100 мл; проте можна використовувати стандартну суміш).
Підсилене харчування, що забезпечує наздоганяючий ріст. У цій фазі госпіталізація, як правило, не потрібна. Свідченням готовності дитини до фази реабілітації є: 1) відновлення апетиту; 2) відсутність епізодів гіпоглікемії (метаболічна стабільність); а також 3) зменшення або ресолюція набряків (за їх наявності).
На початку фази відновного (підсиленого) харчування потрібно поступово, протягом 2–3 днів, перейти на суміш, що містить 100 ккал у 100 мл. Призначення спеціальних високоенергетичних сумішей, про які йшлося вище, відповідає завданням цієї фази. Якщо такі продукти недоступні, ВООЗ пропонує спеціальний рецепт такої суміші [53]. Після 3-го дня застосування суміші (100 ккал/100 мл) потрібно збільшувати об’єм кожного наступного годування на 10 мл, поки дитина не почне залишати частину призначеного об’єму. Цей момент приблизно відповідає спожитому добовому об’єму харчування 200 мл/кг.
Отже, у цій фазі потрібно часто годувати дитину, не обмежуючи кількість суміші й забезпечуючи споживання 150–200 ккал і 4–6 г білка на 1 кг/добу. Водночас у період підсиленого харчування важливо спостерігати за можливим розвитком серцевої недостатності (вияв синдрому відновленого харчування). Якщо виявляється стійке збільшення частоти серцевих скорочень (на > 25/хв) і дихання (на > 5/хв) двічі з інтервалом у 4 год, потрібно зменшити об’єм харчування до 100 мл/кг на 24 год, після чого поступово збільшувати до 115 мл/кг/добу на наступні 24 год і до 130 мл/кг/добу на подальші 48 год. Після цього збільшувати об’єм разових годувань на 10 мл, як описувалось вище.
Ефективність відновного харчування визначають за динамікою маси тіла (кожні 3 дні — г/кг/добу). Якщо збільшення маси не перевищує 5 г/кг/добу, потрібно повторно повністю оцінити стан дитини. За умови збільшення маси на 5–10 г/кг/добу — перевірити споживання потрібної кількості нутрієнтів і виключити наявність інфекції. Збільшення > 10 г/кг/добу є свідченням ефективності втручання [53].
Отже, недостатність харчування і пов’язаний з нею сповільнений фізичний розвиток у дітей є поширеною медичною проблемою, яку в розвинених країнах переважно виявляють на тлі захворювань, хронічних патологічних станів, травм, опіків, хірургічних втручань тощо. Недостатність харчування й сповільнений фізичний розвиток можуть також мати «неорганічний» генез і виникати внаслідок дії поведінкових, соціально-економічних і середовищних чинників. На сьогодні відсутні єдині загальновизнані визначення і недостатності харчування, і сповільненого фізичного розвитку в дітей, що ускладнює діагностику й вивчення епідеміології цих станів. За таких умов доцільно використовувати відповідні діагностичні критерії ВООЗ і провідних професійних організацій світу. Знання чинників ризику й передумов формування недостатності харчування, а також відповідних харчових потреб дозволяє своєчасно коригувати харчовий раціон, насамперед хворих дітей, завдяки використанню спеціальних молочних сумішей з підвищеним вмістом енергії, білка й мікронутрієнтів. Ці харчові продукти мають доведену клінічну ефективність, доступні на українському ринку й рекомендуються не лише для профілактики, але й для лікування дітей зі сповільненим фізичним розвитком.
Конфлікт інтересів. Стаття опублікована за підтримки компанії Nutricia.
Список литературы
1. Протокол лікування дітей із недостатністю харчування. Наказ МОЗ України № 9 від 10.01.2005. https://zakononline.com.ua/documents/show/128180___529931.
2. Про затвердження Клінічного протоколу медичного догляду за здоровою дитиною віком до 3 років. Наказ МОЗ України № 149 від 20.03.2008. 91 с. https://zakon.rada.gov.ua/rada/show/v0149282-08#Text.
3. Popkin B.M., Corvalan C., Grummer-Strawn L.M. Dynamics of the double burden of malnutrition and the changing nutrition reality. Lancet. 2020. 395(10217). 65-74.
4. Galler J.R., Bryce C.P., Zichlin M.L., Fitzmaurice G., Eaglesfield G.D., Waber D.P. Infant malnutrition is associated with persisting attention deficits in middle adulthood. J. Nutr. 2012. 142. 788-94.
5. Galler J.R., Bryce C.P., Zichlin M.L., Waber D.P., Exner N., Fitzmaurice G.M. et al. Malnutrition in the first year of life and personality at age 40. J. Child Psychol. Psychiatry. 2013. 54. 911-9.
6. Waber D.P., Bryce C.P., Girard J.M., Zichlin M., Fitzmaurice G.M., Galler J.R. Impaired IQ and academic skills in adults who experienced moderate to severe infantile malnutrition: a 40-year study. Nutr. Neurosci. 2014. 17. 58-64.
7. Ehrenkranz R.A. Nutrition, growth and clinical outcomes. Koletzko B., Poindexter B., Uauy R. (eds): Nutritional care of preterm infants: scientific basis and practical guidelines. World Rev. Nutr. Diet. Basel, Karger. 2014. 110. 11-26.
8. Winick M., Rosso P. The effect of severe early malnutrition on cellular growth of human brain. Pediatr. Res. 1969. 3. 181-4.
9. Stoch M.B., Smythe P.M., Moodie A.D., Bradshaw D. Psychosocial outcome and CT findings after gross undernourishment during infancy: a 20-year developmental study. Dev. Med. Child Neurol. 1982. 24. 419-36.
10. Benitez-Bribiesca L., De la Rosa-Alvarez I., Mansilla-Olivares A. Dendritic spine pathology in infants with severe protein-calorie malnutrition. Pediatrics. 1999. 104. e21.
11. Barker D.J., Forsen T., Eriksson J.G., Osmond C. Growth and living conditions in childhood and hypertension in adult life: a longitudinal study. J. Hypertens. 2002. 20. 1951-56.
12. Newsome C.A., Shiell A.W., Fall C.H., Phillips D.I., Shier R., Law C.M. Is birth weight related to later glucose and insulin metabolism? A systematic review. Diabet Med. 2003. 20. 339-48.
13. Eriksson J.G., Osmond C., Kajantie E., Forsеn T., Barker D.J. Patterns of growth among children who later develop type 2 diabetes or its risk factors. Diabetologia. 2006. 49. 2853-58.
14. Kajantie E., Barker D.J., Osmond C., Forsеn T., Eriksson J.G. Growth before 2 years of age and serum lipids 60 years later: the Helsinki Birth Cohort study. Int. J. Epidemiol. 2008. 37(2). 280-9.
15. Osmond C., Kajantie E., Forsеn T., Eriksson J.G., Barker D.J. Infant growth and stroke in adult life: the Helsinki birth cohort study. Stroke. 2007. 38. 264-70.
16. Romano T., Wark J.D., Owens J.A., Wlodek M.E. Prenatal growth restriction and postnatal growth restriction followed by accelerated growth independently program reduced bone growth and strength. Bone. 2009. 45(1). 132-41.
17. Black R.E., Allen L.H., Bhutta Z.A., Caulfield L.E., de Onis M., Ezzati M. et al. Maternal and child undernutrition: global and regional exposures and health consequences. Lancet. 2008. 371(9608). 243-60.
18. Homan G.J. Failure to thrive: a practical guide. Am. Fam. Physician. 2016. 94(4). 295-9.
19. Joosten K.F., Hulst J.M. Prevalence of malnutrition in pediatric hospital patients. Curr. Opin. Pediatr. 2008. 20. 590-596.
20. Daniel M., Kleis L., Cemeroglu A.P. Etiology of failure to thrive in infants and toddlers referred to a pediatric endocrinology outpatient clinic. Clin. Pediatr. 2008. 47(8). 762-5.
21. A Joint Statement by the World Health Organization and the United Nations Children’s Fund. WHO child growth standards and the identification of severe acute malnutrition in infants and children. Geneva, 2009. https://apps.who.int/iris/bitstream/handle/10665/44129/9789241598163_eng.pdf.
22. McAlpine J., Nielsen D.K., Lee J., Larsen B.M.K. Growth faltering: the new and the old. Clin. Pediatr. 2019. 2. 1012.
23. Mehta N.M., Corkins M.R., Lyman B., Malone A., Goday P.S., Carney L.N. et al. Defining pediatric malnutrition: a paradigm shift toward etiology-related definitions. J. Parenter. Enteral. Nutr. 2013. 37(4). 460-81.
24. WHO Multicentre Growth Reference Study Group. WHO Child Growth Standards based on length/height, weight and age. Acta Paediatr. Suppl. 2006. 450. 76-85.
25. WHO. Guideline: Updates on the management of severe acute malnutrition in infants and children. World Health Organization; Geneva 2013. 115 p. https://www.who.int/publications/i/item/9789241506328.
26. Becker P., Carney N.L., Corkins R.M., Monczka J., Smith E., Smith E.S. et al. Consensus Statement of the Academy of Nutrition and Dietetics/American Society for Parenteral and Enteral Nutrition: Indicators Recommended for the Identification and Documentation of Pediatric malnutrition (Undernutrition). J. Acad. Nutr. Diet. 2015. 114(12). 1988-2000.
27. World Health Organization. Management of severe malnutrition: a manual for physicians and other senior health workers. Geneva, 1999. http://www.who.int/nutrition/publications/en/ manage_severe_malnutrition_eng.pdf.
28. WHO/UNICEF/WFP/SCN Joint statement. Community-based management of severe acute malnutrition. Geneva, New York, Rome, 2007. http://www.who.int/child_adolescent_health/documents/pdfs/ severe_acute_malnutrition_en.pdf.
29. Faltering growth: recognition and management of faltering growth in children. NICE guideline. Published: 27 September 2017. www.nice.org.uk/guidance/ng75.
30. World Health Organization Guideline: assessing and managing children at primary health-care facilities to prevent overweight and obesity in the context of the double burden of malnutrition. Updates for the Integrated Management of Childhood Illness (IMCI). Geneva, 2017. https://www.who.int/publications/i/item/9789241550123.
31. Gomez F., Galvan R.R., Cravioto J., Frenk S. Malnutrition in infancy and childhood with special reference to kwashiorkor. Adv. Pediatr. 1955. 7. 131-69.
32. Waterlow J.C. Classification and definition of protein-calorie malnutrition. Br. Med. J. 1972. 3(5826). 566-69.
33. Guo S., Roche A.F., Foman S.J. et al. Reference data on gains in weight and length during the first two years of life. Pediatrics. 1991. 119(3). 355-62.
34. World Health Organization. Child growth standards. Weight velocity. http://www.who.int/childgrowth/standards/w_velocity/en/index.html.
35. Шадрін О.Г., Добрянський Д.О., Няньковський С.Л., Клименко В.А., Бєлоусова О.Ю., Івахненко О.С. Сучасні тенденції в харчуванні дітей раннього віку (12–36 міс.): європейський та світовий досвід. Здоров’я дитини. 2013. 2. 95-107.
36. Joosten K., Embleton N., Yan W., Senterre T.; ESPGHAN/ESPEN/ESPR/CSPEN working group on pediatric parenteral nutrition. ESPGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Energy. Clin. Nutr. 2018. 37. 2309-14.
37. Pencharz P.B. Protein and energy requirements for ‘optimal’ catch-up growth. European Journal of Clinical Nutrition. 2010. 64. S5-S7.
38. WHO/FAO/UNU expert consultation. Protein and amino acid requirements in human nutrition. Vol. 935. WHO: Geneva, 2007. 265 p.
39. Mehta N.M., Compher C.; A.S.P.E.N. Board of Directors. A.S.P.E.N. Clinical Guidelines: nutrition support of the critically ill child. J. Parenter Enteral Nutr. 2009. 33(3). 260-76.
40. Curtiss J., Zhang H., Griffiths P., Shepherd E.G., Lynch S. Nutritional management of the infant with severe bronchopulmonary dysplasia. NeoReviews 2015. 16. e674.
41. Joosten K., Meyer R. Nutritional screening and guidelines for managing the child with faltering growth. European Journal of Clinical Nutrition. 2010. 64. S22-S24.
42. Shaw V., Lawson M. Clinical paediatric dietetics, 3rd edition. London: Blackwell Science; 2007. 620 p.
43. Evans S., Twaissi H., Daly A., MacDonald A. Should high energy infant formula be given at full strength from its first day of usage? J. Hum. Nutr. Diet. 2006. 19. 191-97.
44. Clarke S.E., Evans S., MacDonald A. et al. Randomised comparison of a nutrient-dense formula with an energy-supplemented formula for infants with faltering growth. J. Hum. Nutr. Diet. July 2007. 20. 329-39.
45. van Waardenburg D.A., de Betue C.T., van Goudoever J.B., Zimmermann L.J., Joosten K.F. Critically ill infants benefit from early administration of protein and energy-enriched formula; a randomized controlled trial. Clin. Nutr. 2009. 28. 249-55.
46. de Betue C.T., van Waardenburg D.A., Deutz N.E., van EijkH.M., van Goudoever J.B., Luiking Y.C. et al. Increased protein-energy intake promotes anabolism in critically ill infants with viral bronchiolitis: a double-blind randomised controlled trial. Arch. Dis. Child. 2011. 96. 817-22.
47. Smith C., McCabe H., Macdonald S., Morrison L., Prigg R., Trace S. et al. Improved growth, tolerance and intake with an extensively hydrolysed peptide feed in infants with complex disease. Clin. Nutr. 2018. 37(3). 1005-12.
48. Scheeffer V.A., Ricachinevsky C.P., Freitas A.T., Salamon F., Rodrigues F.F.N., Brondani T.G. et al. Tolerability and effects of the use of energy-enriched infant formula after congenital heart surgery: a randomized controlled trial. J. Parenter. Enteral Nutr. 2020. 44(2). 348-354.
49. Eveleens R.D., Dungen D.K., Verbruggen S.C.A.T., Hulst J.M., Joosten K.F.M. Weight improvement with the use of protein and energy enriched nutritional formula in infants with a prolonged PICU stay. J. Hum. Nutr. Diet. 2019. 32(1). 3-10.
50. Marino L.V., Eveleens R.D., Morton K., Verbruggen S.C.A.T., Joosten K.F.M. Peptide nutrient-energy dense enteral feeding in critically ill infants: an observational study. J. Hum. Nutr. Diet. 2019. 32(3). 400-8.
51. WHO. Technical note: supplementary foods for the management of moderate acute malnutrition in infants and children 6–59 months of age. Geneva, World Health Organization, 2012. 12 p.
52. Lo L., Ballantine A. Malnutrition. Kliegman R., Geme J. Nelson Textbook of Pediatrics E-Book. 21st ed. Philadelphia: Elsevier, 2020. 343-345.
53. Pocket book of hospital care for children: guidelines for the management of common childhood illnesses. 2nd ed. WHO, 2013. P. 200-16.

/57.jpg)
/58.jpg)
/59.jpg)
/60.jpg)
/64.jpg)
/65.jpg)