Журнал «Здоровье ребенка» Том 15, №7, 2020
Вернуться к номеру
Модуляція активності β-дефензинового захисту в дітей
Авторы: Абатуров О.Є.(1), Крючко Т.О.(2), Кривуша О.Л.(1), Ткаченко О.Я.(2), Бабич В.Л.(1), Мякота К.В.(2)
(1) — ДЗ «Дніпропетровська медична академія Міністерства охорони здоров’я України», м. Дніпро, Україна
(2) — Українська медична стоматологічна академія, м. Полтава, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
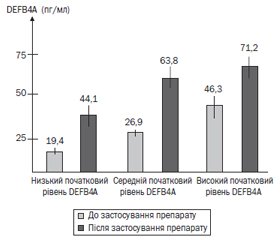
Актуальність. На сучасному етапі серед дитячого населення набуває глобального характеру недостатність вітаміну D і кальцію, а також підвищення ризику розвитку інфекційних захворювань. Мета роботи: вивчити вплив поєднаного застосування вітаміну D та препаратів кальцію на рівень DEFB4A в ротоглотковому секреті і стан здоров’я дітей раннього віку. Матеріали та методи. Нами було проведено дослідження впливу препарату Кальцикер у дітей раннього віку на рівень DEFB4A в ротоглотковому секреті, статус вітаміну D, рівень кальцію в сироватці крові. Основну групу становили 30 клінічно здорових дітей раннього віку, які протягом 2 місяців отримували препарат Кальцикер 2,5 мл 3 рази на добу. Результати. У дітей раннього віку після курсу застосування препарату Кальцикер спостерігалось вірогідне підвищення рівня кальцію в сироватці крові (t-критерій Стьюдента = 2,01; p = 0,05) та тенденція до підвищення рівня вітаміну D з 32,4 ± 1,9 нг/мл до 37,4 ± 1,7 нг/мл (t-критерій Стьюдента = 1,96; p = 0,0658). Уміст DEFB4A в ротоглотковому секреті у дітей раннього віку вірогідно збільшився з 28,9 ± 2,3 пг/мл до 58,9 ± 4,7 пг/мл (t-критерій Стьюдента = 5,73; p = 0,000001). На основі катамнестичного дослідження (через 6 місяців) встановлено, що у дітей старше одного року вірогідно знизилася кількість гострих респіраторних інфекцій (з 4,5 до 2,3 випадку на рік) та значно зменшився відсоток ускладнень на тлі захворювань дихальної системи. Висновки. Поєднання вітаміну D і кальцію карбонату має високу ефективність у процесі підтримки і відновлення необхідного рівня кальцію у дітей раннього віку і не супроводжується ризиком розвитку гіперкальціємії. Застосування препарату Кальцикер протягом 2 місяців сприяє вірогідному підвищенню концентрації DEFB4A в ротоглотковому секреті і запобіганню розвитку гострих респіраторних інфекцій.
Актуальность. На современном этапе среди детского населения приобретает глобальный характер недостаточность витамина D и кальция, а также повышение риска развития инфекционных заболеваний. Цель работы: изучить влияние сочетанного применения витамина D и препаратов кальция на уровень DEFB4A в ротоглоточном секрете и состояние здоровья детей раннего возраста. Материалы и методы. Нами было проведено исследование влияния препарата Кальцикер у детей раннего возраста на уровень DEFB4A в ротоглоточном секрете, статус витамина D, уровень кальция в сыворотке крови. Основную группу составили 30 клинически здоровых детей раннего возраста, которые в течение 2 месяцев получали препарат Кальцикер 2,5 мл 3 раза в сутки. Результаты. У детей раннего возраста после курса применения препарата Кальцикер наблюдалось достоверное повышение концентрации кальция в сыворотке крови (t-критерий Стьюдента = 2,01; p = 0,05) и тенденция к повышению уровня витамина D с 32,4 ± 1,9 нг/мл до 37,4 ± 1,7 нг/мл
(t-критерий Стьюдента = 1,96; p = 0,0658). Содержание DEFB4A в ротоглоточном секрете у детей раннего возраста достоверно увеличилось с 28,9 ± 2,3 пг/мл до 58,9 ± 4,7 пг/мл
(t-критерий Стьюдента = 5,73; p = 0,000001). На основе катамнестического исследования (через 6 месяцев) установлено, что у детей старше одного года достоверно снизилось количество острых респираторных инфекций (с 4,5 до 2,3 случая в год) и значительно уменьшился процент осложнений на фоне заболеваний дыхательной системы. Выводы. Сочетание витамина D и кальция карбоната имеет высокую эффективность в процессе поддержания и восстановления необходимого уровня кальция у детей раннего возраста и не сопровождается риском развития гиперкальциемии. Применение препарата Кальцикер в течение 2 месяцев способствует достоверному повышению концентрации DEFB4A в ротоглоточном секрете и предупреждению развития острых респираторных инфекций.
Background. At the present stage, vitamin D and calcium deficiency among children becomes global as well as the risk of infectious diseases caused by this pathology. Purpose: to study the effect of the combined use of vitamin D and calcium supplements on the level of DEFB4A in the oropharyngeal secretion and the health of young children. Materials and methods. We conducted a study of the effect of the drug Kalcyker in young children on the level of DEFB4A in the oropharyngeal secretion, the status of vitamin D, the serum level of calcium. The basic group consisted of 30 clinically healthy young children, who received Kalcyker 2.5 ml 3 times a day for 2 months. Results. After a course of Kalcyker, young children experienced a significant increase in the serum concentration of calcium (Student’s t-test = 2.01; p = 0.05) and a tendency to increase the level of vitamin D from 32.4 ± 1.9 ng/ml to 37.4 ± 1.7 ng/ml (Student’s t-test = 1.96; p = 0.0658). The content of DEFB4A in the oropharyngeal secretion in young children significantly increased from 28.9 ± 2.3 pg/ml to 58.9 ± 4.7 pg/ml (Student’s t-test = 5.73; p = 0.000001). Based on the follow-up findings (after 6 months), it was found that in children older than one year the number of acute respiratory infections decreased significantly (from 4.5 to 2.3 cases per year) and the percentage of complications due to respiratory diseases significantly reduced. Conclusions. The combination of vitamin D and calcium carbonate is highly effective in maintaining and restoring the required level of calcium in young children and is not accompanied by a risk of developing hypercalcemia. The two-month use of Kalcyker contributes to a significant increase in the concentration of defensin DEFB4A in the oropharyngeal secretion and prevents the development of acute respiratory infections.
вітамін D; кальцій; β-дефензини; діти
витамин D; кальций; β-дефензины; дети
vitamin D; calcium; β-defensin; children
Вступ
Матеріали та методи
Результати
/17.jpg)
Обговорення
Висновки
- Абатуров А.Е., Борисова Т.П., Кривуша Е.Л. Лечение и профилактика недостаточности и дефицита витамина D у детей и подростков. Здоровье ребенка. 2015. № 3(62). С. 73-78.
- Абатуров А.Е., Герасименко О.Н., Высочина И.Л., Завгородняя Н.Ю. Дефензины и дефензин-зависимые заболевания. Одесса: Изд-во ВМВ, 2011. 265 с.
- Абатуров А.Е., Завгородняя Н.Ю. Витамин-D-зависимая продукция антимикробных пептидов. Здоровье ребенка. 2012. № 1(36). С. 112-144.
- Абатуров А.Е., Крючко Т.А., Кривуша Е.Л., Ткаченко О.Я. Нутритивная и медикаментозная коррекция дефицита кальция и витамина D у детей. Здоровье ребенка. 2018. № 7(13). С. 92-101. DOI: 10.22141/2224-0551.13.7.2018.148922.
- Квашніна Л.В. Особливості кальцієвого гомеостазу в дітей шкільного віку. Здоровье ребенка. 2018. Т. 13. № 1.
- Поворознюк В.В., Балацкая Н.И., Григорьева Н.В. Коррекция дефицита витамина D высокими дозами холекальциферола. Боль. Суставы. Позвоночник. 2016. № 3(23). C. 32-41. doi: 10.22141/2224-1507.3.23.2016.85004.
- Bartley J. Vitamin D, innate immunity and upper respiratory tract infection. J. Laryngol. Otol. 2010 May. Vol. 124(5). Р. 465-9. doi: 10.1017/S0022215109992684. Epub 2010 Jan 13. PMID: 20067648.
- Bartley J. Vitamin D: emerging roles in infection and immunity. Expert Rev. Anti-Infect. Ther. 2010 Dec. Vol. 8(12). Р. 1359-69. doi: 10.1586/eri.10.102. PMID: 21133662.
- Blyth G.A.D., Connors L., Fodor C., Cobo E.R. The Network of Colonic Host Defense Peptides as an Innate Immune Defense Against Enteropathogenic Bacteria. Front. Immunol. 2020 May 20. Vol. 11. Р. 965. doi: 10.3389/fimmu.2020.00965. PMID: 32508838; PMCID: PMC7251035.
- Bouillon R., Marcocci C., Carmeliet G., Bikle D., White J.H., Dawson-Hughes B., Lips P., Munns C.F., Lazaretti-Castro M., Giustina A., Bilezikian J. Skeletal and Extraskeletal Actions of Vitamin D: Current Evidence and Outstanding Questions. Endocr. Rev. 2019 Aug 1. Vol. 40(4). Р. 1109-1151. doi: 10.1210/er.2018-00126. PMID: 30321335; PMCID: PMC6626501.
- Brice D.C., Diamond G. Antiviral Activities of Human Host Defense Peptides. Curr. Med. Chem. 2020. Vol. 27(9). Р. 1420-1443. doi: 10.2174/0929867326666190805151654. PMID: 31385762.
- Carpagnano G.E., Di Lecce V., Quaranta V.N., Zito A., Buonamico E., Capozza E., Palumbo A., Di Gioia G., Valerio V.N., Resta O. Vitamin D deficiency as a predictor of poor prognosis in patients with acute respiratory failure due to COVID-19. J. Endocrinol. Invest. 2020 Aug 9. Р. 1-7. doi: 10.1007/s40618-020-01370-x. Epub ahead of print. PMID: 32772324; PMCID: PMC7415009.
- Cediel G., Pacheco-Acosta J., CastiUo-Durdn C. Vitamin D deficiency in pediatric clinical practice. Arch. Argent. Pediatr. 2018 Feb 1. Vol. 116(1). Р. e75-e81. English, Spanish. doi: 10.5546/aap.2018.eng.e75. PMID: 29333826.
- Chang S.W., Lee H.C. Vitamin D and health — The missing vitamin in humans. Pediatr. Neonatol. 2019 Jun. Vol. 60(3). Р. 237-244. doi: 10.1016/j.pedneo.2019.04.007. Epub 2019 Apr 17. PMID: 31101452.
- Charoenngam N., Holick M.F. Immunologic Effects of Vitamin D on Human Health and Disease. Nutrients. 2020 Jul 15. Vol. 12(7). Р. 2097. doi: 10.3390/nu12072097. PMID: 32679784; PMCID: PMC7400911.
- Donnarumma G., Paoletti I., Fusco A., Perfetto B., Buommino E., de Gregorio V., Baroni A. β-Defensins: Work in Progress. Adv. Exp. Med. Biol. 2016. № 901. Р. 59-76. doi: 10.1007/5584_2015_5016. PMID: 26864271.
- Elsori D.H., Hammoud M.S. Vitamin D deficiency in mothers, neonates and children. J. Steroid Biochem. Mol. Biol. 2018 Jan. № 175. Р. 195-199. doi: 10.1016/j.jsbmb.2017.01.023. Epub 2017 Feb 5. PMID: 28179126.
- Esfandiyari R., Halabian R., Behzadi E., Sedighian H., Jafari R., Imani Fooladi A.A. Performance evaluation of antimicrobial peptide ll-37 and hepcidin and β-defensin-2 secreted by mesenchymal stem cells. Heliyon. 2019 Oct 23. Vol. 5(10). Р. e02652. doi: 10.1016/j.heliyon.2019.e02652. PMID: 31687504; PMCID: PMC6820248.
- Fan J., Luo Y., Qin Y., Wu C., Han X., Ouyang H., Zhang L., Cai P., Li N. The expression of β-Defensin-2, IL-22, IL-22R1 and IL-10R2 in rat model of Klebsiella pneumonia and their correlation with histological grades. Exp. Lung Res. 2020 May-Jun. Vol. 46(5). Р. 109-116. doi: 10.1080/01902148.2020.1725690.
- Heaney R.P. Vitamin D and calcium interactions: functional outcomes. Am. J. Clin. Nutr. 2008 Aug. Vol. 88(2). Р. 541S-544S. doi: 10.1093/ajcn/88.2.541S. PMID: 18689398.
- Holick M.F. The vitamin D deficiency pandemic: Approaches for diagnosis, treatment and prevention. Rev. Endocr. Metab. Disord. 2017 Jun. Vol. 18(2). Р. 153-165. doi: 10.1007/s11154-017-9424-1. PMID: 28516265.
- Holly M.K., Diaz K., Smith J.G. Defensins in Viral Infection and Pathogenesis. Annu. Rev. Virol. 2017 Sep 29. Vol. 4(1). Р. 369-391. doi: 10.1146/annurev-virology-101416-041734. Epub 2017 Jul 17. PMID: 28715972.
- Leiva-Juárez M.M., Kolls J.K., Evans S.E. Lung epithelial cells: therapeutically inducible effectors of antimicrobial defense. Mucosal. Immunol. 2018 Jan. Vol. 11(1). Р. 21-34. doi: 10.1038/mi.2017.71. Epub 2017 Aug 16. PMID: 28812547; PMCID: PMC5738267.
- Maes K., Serré J., Mathyssen C., Janssens W., Gayan-Ramirez G. Targeting Vitamin D Deficiency to Limit Exacerbations in Respiratory Diseases: Utopia or Strategy With Potential? Calcif. Tissue Int. 2020 Jan. Vol. 106(1). Р. 76-87. doi: 10.1007/s00223-019-00591-4. Epub 2019 Jul 26. PMID: 31350569.
- Mailhot G., White J.H. Vitamin D and Immunity in Infants and Children. Nutrients. 2020 Apr 27. Vol. 12(5). Р. 1233. doi: 10.3390/nu12051233. PMID: 32349265; PMCID: PMC7282029.
- Meade K.G., O’Farrelly C. β-Defensins: Farming the Microbiome for Homeostasis and Health. Front. Immunol. 2019 Jan 25. № 9. Р. 3072. doi: 10.3389/fimmu.2018.03072. PMID: 30761155; PMCID: PMC6362941.
- Otte J.M., Werner I., Brand S., Chromik A.M., Schmitz F., Kleine M., Schmidt W.E. Human beta defensin 2 promotes intestinal wound healing in vitro. J. Cell. Biochem. 2008 Aug 15. Vol. 104(6). Р. 2286-97. doi: 10.1002/jcb.21787. PMID: 18449938.
- Panfili F.M., Roversi M., D’Argenio P., Rossi P., Cappa M., Fintini D. Possible role of vitamin D in Covid-19 infection in pediatric population. J. Endocrinol. Invest. 2020 Jun 15. Р. 1-9. doi: 10.1007/s40618-020-01327-0. Epub ahead of print. PMID: 32557271; PMCID: PMC7299247.
- Pazgier M., Hoover D.M., Yang D., Lu W., Lubkowski J. Human beta-defensins. Cell. Mol. Life Sci. 2006 Jun. Vol. 63(11). Р. 1294-313. doi: 10.1007/s00018-005-5540-2. PMID: 16710608.
- Sharma L., Feng J., Britto C.J., Dela Cruz C.S. Mechanisms of Epithelial Immunity Evasion by Respiratory Bacterial Pathogens. Front. Immunol. 2020 Feb 11. № 11. Р. 91. doi: 10.3389/fimmu.2020.00091. PMID: 32117248; PMCID: PMC7027138.
- Van Cleemput J., Poelaert K.C.K., Laval K., Vanderheijden N., Dhaenens M., Daled S., Boyen F., Pasmans F., Nauwynck H.J. An Alphaherpesvirus Exploits Antimicrobial β-Defensins To Initiate Respiratory Tract Infection. J. Virol. 2020 Mar 31. Vol. 94(8). Р. e01676-19. doi: 10.1128/JVI.01676-19. PMID: 31996426; PMCID: PMC7108845.
- White J.H. Vitamin D signaling, infectious diseases, and regulation of innate immunity. Infect. Immun. 2008 Sep. Vol. 76(9). Р. 3837-43. doi: 10.1128/IAI.00353-08. Epub 2008 May 27. PMID: 18505808; PMCID: PMC2519414.
- Xu D., Lu W. Defensins: A Double-Edged Sword in Host Immunity. Front. Immunol. 2020 May 7. № 11. Р. 764. doi: 10.3389/fimmu.2020.00764. PMID: 32457744; PMCID: PMC7224315.
- Yang X., Cheng Y.T., Tan M.F., Zhang H.W., Liu W.Q., Zou G., Zhang L.S., Zhang C.Y., Deng S.M., Yu L., Hu X.Y., Li L., Zhou R. Overexpression of Porcine Beta-Defensin 2 Enhances Resistance to Actinobacillus pleuropneumoniae Infection in Pigs. Infect. Immun. 2015 Jul. Vol. 83(7). Р. 2836-43. doi: 10.1128/IAI.03101-14. Epub 2015 Apr 27. PMID: 25916992; PMCID: PMC4468565.
- Zemb P., Bergman P., Camargo C.A. Jr, Cavalier E., Cormier C., Courbebaisse M., Hollis B., Joulia F., Minisola S., Pilz S., Pludowski P., Schmitt F., Zdrenghea M., Souberbielle J.C. Vitamin D deficiency and the COVID-19 pandemic. J. Glob. Antimicrob. Resist. 2020 Sep. № 22. Р. 133-134. doi: 10.1016/j.jgar.2020.05.006. Epub 2020 May 29. PMID: 32474141; PMCID: PMC7256612.
- Zhang K., Zhang H., Gao C., Chen R., Li C. Antimicrobial Mechanism of pBD2 against Staphylococcus aureus. Molecules. 2020 Jul 31. Vol. 25(15). Р. 3513. doi: 10.3390/molecules25153513. PMID: 32752087; PMCID: PMC7435708.
- Zhang X., Liu Z., Xia L., Gao J., Xu F., Chen H., Du Y., Wang W. Clinical features of vitamin D deficiency in children: A retrospective analysis. J Steroid Biochem. Mol. Biol. 2020 Feb. № 196. Р. 105491. doi: 10.1016/j.jsbmb.2019.105491. Epub 2019 Oct 3. PMID: 31586638.
- Zisi D., Challa A., Makis A. The association between vitamin D status and infectious diseases of the respiratory system in infancy and childhood. Hormones (Athens). 2019 Dec. Vol. 18(4). Р. 353-363. doi: 10.1007/s42000-019-00155-z. Epub 2019 Nov 25. PMID: 31768940; PMCID: PMC7092025.

/16.jpg)
/17_2.jpg)