Цукровий діабет (ЦД) — це група метаболічних (обмінних) захворювань, що характеризуються хронічною гіперглікемією, яка є результатом порушення секреції інсуліну, дії інсуліну або обох цих факторів [1, 2].
На сьогодні прийнята етіологічна класифікація ЦД, що була розроблена Всесвітньою організацією охорони здоров’я (ВООЗ) у 1999 р. і доповнена з урахуванням результатів останніх досліджень Американською діабетичною асоціацією у 2014 р. [3, 4].
Згідно з вказаною класифікацією виділяють такі класи (типи) ЦД:
1. ЦД 1-го типу (імуноопосередкований та ідіопатичний).
2. ЦД 2-го типу (з переважною інсулінорезистентністю та відносною інсуліновою недостатністю або з переважним порушенням секреції інсуліну з інсулінорезистентністю).
3. Інші специфічні типи ЦД:
3.1. Генетичні дефекти функції β-клітин підшлункової залози.
3.2. Генетичні дефекти дії інсуліну.
3.3. Захворювання екзокринної частини підшлункової залози.
3.4. Ендокринопатії.
3.5. ЦД, індукований лікарськими препаратами або хімічними речовинами.
3.6. Інфекції.
3.7. Незвичайні форми імунологічно опосередкованого ЦД.
3.8. Інші генетичні синдроми, що інколи поєднуються з ЦД.
4. Гестаційний ЦД.
Кількість хворих на ЦД по всьому світу неухильно збільшується, досягаючи 10 % населення в таких країнах, як Китай та Індія, які активно переймають західний стиль життя. При цьому в 90–95 % випадків діагностується ЦД 2-го типу, що розвивається в більш дорослого населення, часто на фоні серцево-судинних захворювань (ССЗ), обтяжуючи перебіг останніх. Більше 60 млн європейців хворіють на ЦД 2-го типу [5]. В Україні зареєстровано близько 1 млн хворих на ЦД 2-го типу, але якщо врахувати, що на кожен зареєстрований випадок діабету доводиться два-три випадки недіагностованого захворювання, то вже зараз можна говорити про більше ніж 2–2,5 млн хворих [6, 7]. Прогнозується, що до 2045 року у світі буде більше ніж 600 млн хворих на ЦД 2-го типу та така ж кількість осіб із пре-діабетом [8].
ЦД 2-го типу характеризується насамперед хронічною гіперглікемією, що є одним із провідних факторів патогенезу пошкодження, дисфункції та недостатності різних органів, особливо очей, нирок, нервів, серця і кровоносних судин. Вказані ураження органів при ЦД призводять до розвитку дуже тяжких і надзвичайно поширених ускладнень даного захворювання [1, 9, 10].
До основних ускладнень ЦД 2-го типу відносять мікросудинні ускладнення (генералізована та локальна мікроангіопатія, у тому числі нижніх кінцівок із формуванням діабетичної стопи; ретинопатія; нефропатія; нейропатія; діабетична кардіоміопатія) та макросудинні ускладнення, до яких відносять прискорений розвиток атеросклерозу (здебільшого генералізованого) із формуванням ішемічної хвороби серця (ІХС), у тому числі її найбільш тяжкої форми — інфаркту міокарда (ІМ), атеросклеротичних уражень периферичних артерій (нижніх кінцівок, прецеребральних, у тому числі сонних, та церебральних) [1, 5, 8, 11–13]. Саме ці ускладнення є основною причиною інвалідизації і смертності хворих на ЦД 2-го типу [1, 14].
Важливість розгляду проблеми коморбідності в пацієнтів із ЦД 2-го типу обумовлена дуже великою поширеністю діабету та надзвичайно частим його поєднаним перебігом із такими ССЗ, як артеріальна гіпертензія (АГ), ІХС, серцева недостатність (СН), аритмії, захворювання периферичних артерій, а також ретельно описаним на сьогодні фактом взаємообтяжуючого впливу мікро- та макросудинних уражень на прогноз цих категорій «коморбідних» хворих [5, 8, 13, 15].
Нижче наводяться підсумовані основні положення сучасних рекомендацій з обстеження, стратифікації кардіоваскулярного ризику, профілактики основних ССЗ та їх лікування в разі коморбідного перебігу у хворих на ЦД 2-го типу, які базуються на останніх документах європейських та американських експертів у галузі діабетології та кардіології [5, 8, 11–13, 16–20].
Визначення ЦД
Європейським товариством кардіологів спільно з Європейською асоціацією з вивчення діабету (2019 р.) [5] на підставі Рекомендацій ВООЗ 2006/2011 [2, 21] пропонується постановка діагнозу ЦД та інших категорій гіперглікемії на підставі рівня глікозильованого гемоглобіну (HbA1c) або рівня глюкози плазми крові натще, а також на підставі рівня глюкози плазми крові через 2 години після прийому 75 г глюкози, якщо ще є сумніви (табл. 1). Для підтвердження діагнозу рекомендовано повторне тестування [2, 5].
Клінічно значущими можуть бути такі симптоми гіперглікемії: спрага, головні болі, труднощі при концентрації уваги, неясність зору, часте сечовиділення, апатія, втрата ваги. Для постановки діагнозу не можна використовувати як вимірювальний прилад портативні глюкометри та тест-смужки. Хворим із встановленим ССЗ рекомендовано вимірювання HbA1c та/або глюкози натще; тест толерантності до глюкози може бути виконаним, якщо дані глікемії натще і HbA1c є непереконливими [5].
Стратифікація кардіоваскулярного ризику в пацієнтів із ЦД
— Дуже високий ризик (10-річний ризик кардіоваскулярної смерті > 10 %) — пацієнти з ЦД та встановленим ССЗ, або ураженнями інших органів-мішеней (протеїнурія, хронічна ниркова недостатність зі швидкістю клубочкової фільтрації < 30 мл/хв/1,73 м2, гіпертрофія лівого шлуночка (ГЛШ) або ретинопатія), або 3 чи більше головними факторами ризику (вік, АГ, дисліпідемія, паління, ожиріння) [17], або раннім ЦД 1-го типу з довгою тривалістю (> 20 років).
— Високий ризик (10-річний ризик кардіоваскулярної смерті — 5–10 %) — пацієнти із ЦД тривалістю ≥ 10 років без ураження органів-мішеней із будь-яким додатковим фактором ризику.
— Помірний ризик — молоді пацієнти (для ЦД 1-го типу — у віці ≤ 35 років, для ЦД 2-го типу — у віці ≤ 50 років) із тривалістю ЦД ≤ 10 років без інших факторів ризику.
Експертами окремо відмічається, що за наявності ЦД жіноча стать не є захисним фактором передчасного ССЗ, як це спостерігається в загальній популяції [1, 5].
Клінічна оцінка кардіоваскулярних уражень
Для оцінки кардіоваскулярного ризику у хворих на ЦД рекомендоване комплексне клінічне обстеження пацієнта з визначенням таких основних показників:
1. Біомаркери — С-реактивний протеїн, фібриноген, високочутливий тропонін Т, NT-proBNP, альбумінурія*.
2. Електрокардіографія*.
3. Неінвазивні візуалізуючі методи — ехокардіографія* (для виявлення ГЛШ*, діастолічної дисфункції, погіршення деформації лівого шлуночка, збільшення розміру лівого передсердя), МРТ серця (для виявлення дифузного міокардіального фіброзу), КТ-коронарографія, ультразвукове дослідження каротидних артерій*, оцінка кальцифікації коронарних артерій, стрес-ехокардіографія, стрейн-ехокардіографія.
Показники кардіоваскулярних уражень, що відмічені зірочкою (*), можуть бути визначені на первинному етапі надання медичної допомоги: рутинна оцінка мікроальбумінурії показана для виявлення пацієнтів із ризиком розвитку ниркової дисфункції або високим ризиком ССЗ; ЕКГ у спокої показана хворим на ЦД із АГ або з підозрою на ССЗ; ехокардіографія, як вказано вище, показана для раннього виявлення ГЛШ — прогностично несприятливого маркера розвитку кардіоваскулярних ускладнень, ІХС та аритмій.
Інші показники необхідно визначати на етапах вторинної та третинної медичної допомоги: оцінка каротидного та/або феморального атеросклерозу за допомогою артеріальної ультрасонографії має розглядатися як модифікатор ризику у безсимптомних пацієнтів із ЦД; КТ-коронарографія або функціональна візуалізація (радіонуклідна перфузійна візуалізація міокарда, стрес-кардіо-МРТ або навантажувальна або фармакологічна стрес-ехокардіографія) можуть розглядатися в безсимптомних пацієнтів із ЦД для скринінгу ІХС; виявлення атеросклеротичної бляшки сонних або стегнових артерій за допомогою КТ або МРТ може розглядатися як модифікатор ризику у пацієнтів із ЦД із середнім та високим ступенем ризику; кісточково-плечовий індекс може розглядатися як модифікатор ризику при оцінці кардіоваскулярного ризику. Рутинне дослідження циркулюючих біомаркерів не рекомендується для стратифікації кардіоваскулярного ризику [5].
Треба зауважити, що для оцінки кардіоваскулярного ризику в пацієнтів із ЦД не рекомендовано використання шкал ризику, що розроблені для загальної популяції.
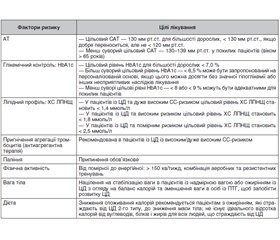
Для профілактики ССЗ у хворих на ЦД рекомендуються такі заходи [1, 5, 8]:
А. Нормалізація способу життя пацієнта (основа профілактики).
Б. Рекомендації з глікемічного контролю.
В. Рекомендації з контролю АГ.
Г. Рекомендації з лікування дисліпідемії.
Д. Рекомендації з антитромбоцитарної терапії.
Є. Мультифакторіальний підхід до профілактики ССЗ.
А. Нормалізація способу життя пацієнта з ЦД 2-го типу (рекомендації підсумовані в табл. 2)
Б. Рекомендації з глікемічного контролю (підсумовані в табл. 3)
При контролі рівня глюкози треба орієнтуватися на майже нормальний рівень HbA1c (< 7,0 % або < 53 ммоль/моль), що зменшує частоту мікросудинних ускладнень у пацієнтів із ЦД [8, 21].
Більш жорсткий контроль глюкози, що розпочатий на початку перебігу ЦД у молодих осіб, призводить до зниження кардіоваскулярних подій протягом 20 років. Менш жорсткі цільові рівні глюкози крові слід розглядати в пацієнтів літнього віку на персональній основі та в пацієнтів із вираженими супутніми захворюваннями або з розвиненим ССЗ [1, 8].
Висвітлюючи проблему глікемічного контролю хворих на діабет, треба вказати, що на сьогодні сформувався новий підхід до фармакотерапії гіперглікемії у хворих на ЦД 2-го типу. Підставою для перегляду фармакотерапії ЦД 2-го типу стали результати цілої низки досліджень, в яких вивчалась кардіоваскулярна безпека глюкозознижуючих препаратів.
У цих дослідженнях було показано, що глюкозознижуючі препарати таких груп, як інгібітори натрій-глюкозного котранспортеру 2 (ІНГКТ-2) (емпагліфлозин, канагліфлозин і дапагліфлозин) та агоністи рецепторів глюкагоноподібного пептиду 1 (АР-ГПП-1) (ліраглутид, семаглутид і дулаглутид), покращують прогноз ССЗ, а також зменшують ризик розвитку СН і прогресування патології нирок у пацієнтів із встановленим діагнозом ССЗ або хронічною хворобою нирок [5, 8, 22–24].
У зв’язку з цим саме вказані препарати рекомендовані як препарати першої лінії для досягнення глікемічного контролю у хворих на ЦД 2-го типу, що перебігає в поєднанні із ССЗ, ураженням нирок, та у хворих високого/дуже високого ризику кардіо-васкулярних ускладнень для профілактики ССЗ. Метформін може розглядатися як препарат вибору при ЦД 2-го типу з надмірною вагою, але переважно у хворих без ССЗ та з помірним кардіоваскулярним ризиком.
В. Рекомендації з контролю АГ (підсумовані в табл. 4)
ЦД 2-го типу і АГ — дві взаємопов’язані патології, які мають взаємопідсилюючу негативну дію щодо розвитку уражень відразу кількох органів-мішеней: серця, нирок, судин центральної нервової системи і сітківок [1, 8, 14, 20, 25]. При цьому АГ зустрічається в 70 % хворих на ЦД 2-го типу, що у 2 рази більше, ніж у загальній популяції.
У пацієнтів із ЦД 2-го типу виділяють такі основні варіанти АГ:
— Первинна АГ (гіпертонічна хвороба) — 30–35 %.
— Ізольована систолічна АГ — 40–45 %.
— Вторинна ренопаренхіматозна АГ на тлі діабетичної нефропатії — 15–20 %.
— Реноваскулярна АГ — 5–10 %.
— Вторинна АГ за наявності поєднаної ендокринної патології — 1–3 %.
На думку більшості дослідників, корекція АГ у хворих із ЦД 2-го типу є завданням не менш важливим, ніж компенсація метаболічних порушень, яка повинна проводитися одночасно з нею [1, 15, 20].
Цільовий артеріальний тиск (АТ) повинен бути орієнтований на систолічний АТ до 130 мм рт.ст. у пацієнтів із ЦД та < 130 мм рт.ст., якщо добре переноситься, але не < 120 мм рт.ст. В осіб похилого віку (віком > 65 років) цільовий систолічний АТ у межах 130–139 мм рт.ст. Цільовий діастолічний АТ повинен бути < 80 мм рт.ст., але не < 70 мм рт.ст. [5, 20]. Показано, що оптимальний контроль АТ зменшує ризик мікро- та макроваскулярних ускладнень, як було продемонстровано в багатьох дослідженнях, у тому числі в цілій низці досліджень, які були проведені в нашому інституті [1, 10, 25–27].
Препаратами першого вибору у хворих на ЦД 2-го типу з АГ є блокатори ренін-ангіотензин-альдостеронової системи (РААС): інгібітори ангіотензинперетворюючого ферменту (ІАПФ) або блокатори рецепторів ангіотензину ІІ (БРА ІІ) (у пацієнтів, які не переносять ІАПФ). Контроль АТ часто вимагає багатокомпонентного підходу із використанням блокатора РААС та блокатора кальцієвих каналів або діуретика. Комбінація ІАПФ та БРА не рекомендована [5, 20]. При предіабеті ризик виникнення нового випадку ЦД нижче при використанні блокаторів РААС, ніж при використанні бета-блокаторів та діуретиків [20].
Треба зауважити, що для досягнення та утримання цільових рівнів АТ пацієнтам із ЦД 2-го типу з АГ рекомендується самоконтроль АТ за допомогою його домашнього моніторування [15, 20].
Г. Рекомендації з лікування дисліпідемії (підсумовані в табл. 5)
У хворих на ЦД 2-го типу дуже часто спостерігається поєднане підвищення рівнів холестерину та тригліцеридів у крові. Лікування гіперхолестеринемії є одним із головних засобів зниження кардіоваскулярного ризику у хворих як на ЦД 2-го типу, так і на ЦД 1-го типу [5, 13, 17].
Доведено, що статини ефективно запобігають серцево-судинним (СС) подіям та знижують кардіоваскулярну смертність у хворих на ЦД 2-го типу, і їх використання пов’язане з обмеженою кількістю побічних явищ. Інтенсивне лікування статинами слід застосовувати індивідуально, насамперед у хворих дуже високого СС-ризику. Сьогодні статини залишаються найсучаснішою терапією для зниження ліпідів у пацієнтів із ЦД [13, 17, 28]. При недостатній ефективності статинів або в разі підтвердженої непереносимості статинів рекомендовано застосовувати езетиміб або інгібітори пропротеїнової конвертази субтилізину/кексину типу 9 (PCSK9) разом зі статинами або окремо, що сприяє додатковому зниженню холестерину ліпопротеїдів низької щільності в пацієнтів із ЦД і, таким чином, знижує СС-ризик та смертність [13, 28, 29].
Д. Рекомендації з антитромбоцитарної терапії (підсумовані в табл. 6)
Принципи застосування антитромбоцитарної терапії у хворих із симптомними ССЗ без ЦД 2-го типу поширюються і на хворих із діабетом [5, 13, 19]. Відмічається, що в пацієнтів із ЦД 2-го типу та помірним СС-ризиком аспірин для первинної профілактики не рекомендується. У той же час у пацієнтів із ЦД 2-го типу з високим/дуже високим ризиком аспірин може розглядатися як первинна профілактика СС-подій.
Є. Мультифакторіальний підхід до профілактики ССЗ у хворих на ЦД 2-го типу (підсумований в табл. 7)
Концепція мультифакторіального підходу до профілактики ССЗ у хворих на ЦД 2-го типу за допомогою корекції основних факторів ризику і досягнення їх оптимальних параметрів є дуже перспективною й ефективною. Так, показано, що одночасне зниження HbA1c, систолічного АТ та ліпідів зменшує ризик СС-події на 75 % [1, 5, 29]. Але в реальній практиці мультифакторіальна профілактика використовується вкрай недостатньо.
У наступному номері журналу буде опублікована частина 2 даної статті, в якій будуть наведені: алгоритми лікування хворих на ЦД 2-го типу, рекомендації з лікування хворих на ЦД 2-го типу із ССЗ: із хронічним коронарним синдромом та гострим коронарним синдромом, СН, аритміями, захворюваннями аорти та периферичних артерій.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Список литературы
1. Diabetes in cardiovascular disease: to Braunwald’s heart sisease. Ed. by Darren K. McGuire, Nikolaus Marx. Elsevier, 2015. 398.
2. World Health Organization. Definition and diagnosis of diabetes mellitus and intermediate and hyperglycaemia. Report of a WHO/IDF consultation. http://www.who.int/diabetes/publications/diagnosis_diabetes2006/en/ (June 14 2019).
3. Diagnosis and Classification of Diabetes Mellitus. American Diabetes Association. Position Statement. Diabetes Care. 2014. 37(1). 81-90.
4. Definition, diagnosis and classification of diabetes mellitus and its complications: Report of WHO Consulation. Part 1: Diagnosis and classification of diabetes mellitus (WHO/NCD/NCS/99.2). intermediate and hyperglycaemia. World Health Organization, 1999.
5. Cosentino F., Grant P.J., Aboyans V. et al. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD. Eur. Heart J. 2020, Jan 7. 41(2). 255-323. doi: 10.1093/eurheartj/ehz486.
6. Довідник основних показників діяльності ендокринологічної служби України за 2016 рік. Ендокринолог. 2017. 22. № 1 (додаток 1). 40 с.
7. Маньковский Б.Н. Распространенность невыявленного сахарного диабета 2 типа и предиабета в Украине: результаты эпидемиологического исследования «ДИАПАЗОН». ДОМС, 2014. 5. 70-75.
8. Davies M.J., D’Alessio D.A., Fradkin J., Kernan W.N., Mathieu C., Mingrone G., Rossing P., Tsapas A., Wexler D.J., Buse J.B. Management of Hyperglycemia in Type 2 Diabetes, 2018. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2018 Dec. 41(12). 2669-2701. doi: 10.2337/dci18-0033.
9. Аметов А.С. Сахарный диабет 2 типа. Проблемы и решения. 2-е изд., перераб. и доп. М.: ГЭОТАР-Медиа, 2014. 1032 с.
10. Shahim B., De Bacquer D., De Backer G. et al. The prognostic value of fasting plasma glucose, two-hour postload glucose, and HbA1c in patients with coronary artery disease: a report from EUROASPIRE IV: a survey from the European Society of Cardiology. Diabetes Care. 2017. 40. 1233-1240.
11. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. European Heart Journal. 2016. 37. 2129-2200. doi: 10.1093/eurheartj/ehw128.
12. Hinchliffe R.J., Brownrigg J.R., Andros G. et al. International Working Group on the Diabetic Foot. Effectiveness of revascularization of the ulcerated foot in patients with diabetes and peripheral artery disease: a systematic review. Diabetes Metab. Res. Rev. 2016. 32. 136-144.
13. Knuuti J., Wijns W., Saraste A. et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur. Heart J. 2019. doi: 10.1093/eurheartj/ehz425.
14. International Diabetes Federation. IDF Diabetes Atlas. 8th ed. http://diabetesatlas.org/resources/2017-atlas.html (June 14 2019).
15. Коваль С.М., Снігурська І.О., Пенькова М.Ю., Мисниченко О.В., Літвінова О.М., Юшко К.О. Сучасні підходи до медикаментозного контролю артеріальної гіпертензії у хворих на цукровий діабет. Раціональна фармакотерапія. 2018. 2(47). 24-33.
16. Kirchhof P., Benussi S., Kotecha D. et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur. Heart J. 2016. 37. 2893-2962.
17. Piepoli M.F., Hoes A.W., Agewall S. et al. ESC Scientific Document Group. 2016 European Guidelines on cardiovascular disease prevention in clinical practice: The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts) Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR). Eur. Heart J. 2016. 37. 2315-2381.
18. Priori S.G., Blomstrom-Lundqvist C., Mazzanti A. et al; ESC Scientific Document Group. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC). Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC). Eur. Heart J. 2015. 36. 2793-2867.
19. Valgimigli M., Bueno H., Byrne R.A. et al. ESC National Cardiac Societies. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS: The Task Force for dual antiplatelet therapy in coronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio-Thoracic Surgery (EACTS). Eur. Heart J. 2018. 39. 213-260.
20. Williams B., Mancia G., Spiering W. et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur. Heart J. 2018, Sep 1. 39(33). 3021-3104. doi: 10.1093/eurheartj/ehy339.
21. World Health Organization. Use of Ggycated haemoglobin (HbA1c) in the diagnosis of diabetes mellitus: abbreviated report of a WHO consultation. http://www.who.int/diabetes/publications/report-hba1c_2011.pdf (June 14 2019).
22. Koval S., Starchenko T., Iushko K. Clinical benefits of using dapagliflozin as part of the combination therapy in patients with arterial hypertension and type 2 diabetes. Journal of Hypertension. 2017. 35(e-Suppl. 2). 239.
23. Zelniker T.A., Wiviott S.D., Raz I. et al. Comparison of the effects of glucagon-like peptide receptor agonists and sodium-glucose cotransporter 2 inhibitors for prevention of major adverse cardiovascular and renal outcomes in type 2 diabetes mellitus. Circulation. 2019. 139. 2022-2031.
24. Zelniker T.A., Wiviott S.D., Raz I. et al. SGLT2 inhibitors for primary and secondary prevention of cardiovascular and renal outcomes in type 2 diabetes: a systematic review and meta-analysis of cardiovascular outcome trials. Lancet. 2019. 393. 31-39.
25. Коваль С.М., Снігурська І.О., Пенькова М.Ю., Літвінова О.М., Божко В.В., Юшко К.О. Артеріальна гіпертензія та цукровий діабет: питання оптимізації контролю артеріального тиску. Артериальная гипертензия. 2018. 2(58). 9-18.
26. Коваль С.М., Старченко Т.Г., Юшко К.О., Мисниченко О.В. та ін. Динаміка ремоделювання лівого шлуночка у хворих на артеріальну гіпертензію в поєднанні з цукровим діабетом 2-го типу та ожирінням під впливом однорічної комбінованої терапії. Артериальная гипертензия. 2019. 3-4(65–66). 53-59.
27. Koval S.M., Yushko K.O., Snihurska I.O. et al. Relations of angiotensin- (1-7) with hemodynamic and cardiac structural and functional parameters in patients with hypertension and type 2 diabetes. Arterial Hypertens. 2019. Vol. 23. № 3. Р. 183-189. DOI: 10.5603/AH.a2019.0012.
28. Catapano A.L., Graham I., De Backer G. et al. ESC Scientific Document Group. 2016 ESC/EAS Guidelines for the ma-nagement of dyslipidaemias. Eur. Heart J. 2016. 37. 2999-3058.
29. Diagnosis and Classification of Diabetes Mellitus. American Diabetes Association. Position Statement. Diabetes Care. 2014. 37(1). 81-90.

/18.jpg)
/20.jpg)
/21.jpg)
/22.jpg)
/23.jpg)