Розвиток рухових флуктуацій є ключовим обмеженням для тривалого лікування хвороби Паркінсона (ХП) за допомогою леводопи. Після розвитку рухових ускладнень деякі пацієнти можуть мати декілька епізодів «виключення» на день, а при прогресуванні захворювання кумулятивний щоденний час епізодів «виключення» може становити < 50 % від часу неспання пацієнта [1–3]. Тривалість від прийому леводопи до періоду «включення» часто може бути головною складовою загального добового часу періоду «виключення» [4–6]. Затримки періоду «включення» відображають затримку абсорбції леводопи й подальшу затримку проходження гематоенцефалічного бар’єра. Це може бути наслідком затримки спорожнення шлунка (гастропарезу), наявності інтестинального пептиду, який конкурує з леводопою при абсорбції, надмірного розвитку мікрофлори і/або фармакодинамічних ефектів [6–8]. Тривала ранкова акінезія, під час якої пацієнти залишаються в стані «виключення» перед терапевтичною відповіддю на першу ранкову дозу леводопи, є звичайним клінічним проявом у пацієнтів із затримкою періоду «включення». Оскільки інтестинальний пептид зазвичай не присутній при пробудженні, цілком імовірно, що тривала ранкова акінезія відображає затримку спорожнення шлунка або неправильно визначені фармакодинамічні фактори.
Звичайна пероральна допоміжна терапія до леводопи, що включає пероральні агоністи дофаміну, інгібітори моноаміноксидази (МАО) та інгібітори катехол-О-метилтрансферази (КОМТ), часто використовується для зменшення симптомів «виснаження» після закінчення ефекту дози. Однак, хоча ці методи лікування і скорочують загальний щоденний час періоду «виключення», у більшості пацієнтів період «виключення» залишається довготривалим, що може відображати затримку настання «включення», відсутність відповіді на дозу й субоптимальну відповідь «включення». Жодна така пероральна терапія не дає ефективного скорочення часу до появи ефекту леводопи [4–9]. Агоніст дофаміну, апоморфін, може бути введений у вигляді швидкої підшкірної ін’єкції, і, таким чином, на початок його дії не впливає ні гастропарез, ні порушення кишкової абсорбції. Кілька рандомізованих контрольованих досліджень продемонстрували, що в більшості пацієнтів із руховими флуктуаціями підшкірна ін’єкція апоморфіну забезпечує швидкий і надійний леводопаподібний ефект «включення» протягом 8–15 хвилин [10–12].
Метою цього дослідження було оцінити ефект підшкірної ін’єкції апоморфіну в пацієнтів із ХП із тривалою ранковою акінезією, пов’язаною із затримкою або нестабільним початком дії після першої ранкової дози леводопи.
Матеріали та методи
Це багатоцентрове відкрите дослідження фази IV підшкірних ін’єкцій апоморфіну в пацієнтів із ХП із ранковою акінезією, що виникає внаслідок затримки або нестабільного початку дії після перорального введення леводопи. Дослідження проводилось за підтримки US WorldMeds LLC у період із грудня 2012 року по квітень 2014 року на базі 12 дослідницьких центрів США. Воно проводилося відповідно до настанов належної клінічної практики; зведення федеральних правил США (CFR), що стосуються захисту людських істот (частина 50 CFR США 21); Нюрнберзького кодексу й Гельсінської декларації. Дослідження було схвалене всіма експертними радами установ-учасників, і всі пацієнти надали письмову інформовану згоду на участь. Дослідження зареєстровано на ClinicalTrials.gov (NCT01770145).
Популяція дослідження
У це дослідження були включені дорослі пацієнти з ХП (> 18 років), які в даний час отримують терапію леводопою і в яких спостерігається ранкова акінезія. Пацієнти, які задовольняли критеріям, повинні були мати стадії від І до ІІІ за модифікованою шкалою Хен — Яра протягом періоду «включення» й отримувати оптимізовану терапію леводопою в постійній підтримуючій дозі протягом принаймні 4 тижнів. Ранкова акінезія була визначена як мінімальний час до «включення», який повідомлявся учасником дослідження, протягом 45 хвилин або більше після отримання звичайної першої добової дози леводопи протягом мінімум 3 днів під час початкового 1-тижневого періоду згідно з щоденником. Пацієнти, які задовольняли критеріям, повинні були вміти адекватно диференціювати й описувати зміни в станах «включення» та «виключення». Ключові критерії виключення включали: використання антагоністів 5-HT3, використання лікарських засобів для лікування гастропарезу (еритроміцин, цизаприд, метоклопрамід), історію поганого дотримання режиму лікування і/або подальшого спостереження, а також будь-які серйозні медичні чи психіатричні стани, які, на думку дослідників, зроблять участь у дослідженні небезпечною або ускладнять дотримання режиму лікування.
Дизайн дослідження
Скринінгове вікно < 5 днів було дозволене, щоб дослідники мали достатньо часу для визначення критеріїв включення (візит 1). Під час цього візиту були оцінені рухові функції за уніфікованою шкалою оцінки симптомів хвороби Паркінсона (UPDRS), коли пацієнти перебували в стані «найкращого включення». Після того як вони були включені в дослідження, пацієнти закінчили початковий 7-денний період, протягом якого, прийнявши звичайну першу дозу леводопи, вони записували в щоденник, який було надано, інформацію щодо свого рухового стану (тобто «включення» або «виключення») кожні 5 хвилин, поки не було досягнуто «включення» або поки не минув період 60 хвилин (тобто мала місце відсутність відповіді на дозу). Цей запис про щоденний час до настання періоду «включення» після регулярного запланованого прийому ранкової дози леводопи потім переглянули, щоб визначити, чи були дотримані критерії включення для ранкової акінезії. Якщо так, то наприкінці початкового періоду всі пацієнти починали протиблювальну терапію триметобензамідом (3 дні) і поверталися до клініки для титрування дози апоморфіну до визначення оптимальної дози (візит 2; протягом максимального періоду в 11 днів). Під час титрування збільшення дози було дозволене під час наступного спостережуваного в суб’єкта періоду «виключення», але не раніше ніж через 2 години після попередньої дози апоморфіну. Для оптимізації дози було дозволено максимум 3 візити до клініки (протягом 11 днів). Оптимальні дози були визначені в протоколі як доза апоморфіну, що досягає > 90 % від «найкращого включення» пацієнта (як було зафіксовано під час скринінгового візиту) протягом 15 хвилин після підшкірної ін’єкції апоморфіну і без нестерпних побічних ефектів. У США апоморфін доступний лише в концентрації 10 мг/мл, і розводити його не можна. Тому дозу 2 мг завжди вводять в об’ємі 0,2 мл, 3 мг — як 0,3 мл тощо.
Перед початковою ін’єкцією апоморфіну результати обстеження рухових функцій за UPDRS реєстрували в стані «виключення». Під час титрування доза апоморфіну поступово збільшувалася з кроком < 2 мг від початкової дози 2 мг (0,2 мл), поки кожен окремий учасник не досяг оптимальної дози, але не перевищувала 6 мг (0,6 мл). Після визначення оптимальної дози пацієнти переходили до 7-денного періоду лікування, протягом якого їхня ранкова доза леводопи була замінена підшкірною ін’єкцією апоморфіну в той самий звичайний час, з подальшим записом рухових станів «включення» й «виключення» у щоденник з інтервалами в 5 хвилин. Усі інші лікарські засоби для лікування ХП (засоби, дози й терміни) залишалися незмінними під час дослідження. Після закінчення дослідження (протягом 2 днів після періоду лікування апоморфіном) пацієнти поверталися в клініку для остаточних оцінок (візит 3).
Оцінки
Використовуючи щоденник, пацієнти самостійно записували час до настання періоду «включення», відзначаючи «так» або «ні» кожні 5 хвилин до настання «включення» протягом перших 60 хвилин, після кожної ранкової дози леводопи протягом 7 днів початкової фази лікування леводопою і наступних ін’єкцій апоморфіну у фазу лікування протягом 7 днів. «Включення» було визначене як момент, коли пацієнт вперше відчув, що лікарський засіб працює; усі пацієнти проходили навчання щодо ведення щоденника й інтерпретації ними станів «включення» і «виключення», погоджуючи дані з дослідником протягом періоду скринінгу.
Дослідники й суб’єкти давали загальну клінічну оцінку тяжкості захворювання (CGI-S) і загальну оцінку тяжкості захворювання пацієнтом (PGI-S) відповідно та EuroQol (EQ-5D) (стосовно ранкової акінезії протягом попередніх 7 днів) перед отриманням першої дози апоморфіну під час візиту 2 і візиту 3. Стадію за модифікованою шкалою Хен — Яра й рухові функції за UPDRS версії 3.1 оцінювали під час візиту 1 у стані «найкращого включення», під час візиту 2 у стані «виключення» до першої ін’єкції апоморфіну й через 15 хвилин після кожної дози апоморфіну (для виявлення оптимальної дози стану «включення»). Безпеку й переносимість оцінювали методом звітування про небажані явища (НЯ), вимірювання життєвих показників, неврологічних обстежень і фізикальних оглядів.
Статистичний аналіз
Аналізи ефективності проводили для популяції повного аналізу (ППА), визначеної як усі пацієнти, що були включені в дослідження, які зробили записи до щоденника протягом > 5 із 7 днів періоду лікування апоморфіном. Результати початкового періоду й результати безпеки оцінювали серед популяції для оцінки безпеки, яка включала всіх пацієнтів, які приймали щонайменше 1 дозу досліджуваного препарату.
Первинним кінцевим результатом для ефективності була зміна від початкового рівня в середньому добовому часі до настання періоду «включення» для леводопи відповідно до щоденника учасника. Для цілей аналізу відсутність відповіді на дозу була практично визначена як ненастання періоду «включення» протягом 60 хвилин відповідно до домашнього щоденника, а ці дані для відсутності відповіді на дозу були замінені на 100 хвилин. Ключовими вторинними результатами для ефективності були зміни показників CGI-S, PGI-S, EQ-5D-3L і візуальної аналогової шкали EQ-5D-3L (VAS) порівняно з початковими. Зміни стадії за модифікованою шкалою Хен — Яра й показників рухових функцій за UPDRS між станом «виключення» перед прийняттям апоморфіну та станом «включення» після прийняття апоморфіну (лише для оптимальної дози апоморфіну) також аналізували як вторинні змінні. Усі ефекти лікування були проаналізовані за допомогою t-критерію Стьюдента.
Результати
Розподіл учасників клінічного дослідження
До популяції для оцінки безпеки входили 127 зарахованих пацієнтів, і 97 пацієнтів завершили дослідження (рис. 1). ППА налічувала 88 (69 %) пацієнтів; 3 пацієнти не заповнили в щоденнику 5 із 7 необхідних днів протягом початкової фази лікування леводопою або апоморфіном, а 6 пацієнтів пізніше були вилучені з аналізу, оскільки вони не відповідали початковим критеріям включення щодо часу до настання періоду «включення» > 45 хвилин протягом 3 із 7 днів періоду лікування леводопою.
Початкові характеристики й оптимальні рівні дозування апоморфіну
Демографічна характеристика суб’єктів і початкові характеристики популяції для оцінки безпеки подані в табл. 1. Популяція ППА складалася переважно з осіб європеоїдної раси, середній (± стандартне відхилення (СВ)) вік 65,20 ± 9,72 року. Майже в половини (45,6 %) пацієнтів ХП була діагностована протягом < 10 років, середня ± СВ добова доза леводопи становила 965 ± 990 мг, і більшість пацієнтів отримували пероральні допоміжні лікарські засоби (агоністи дофаміну, інгібітори КОМТ і МАО-Б) (табл. 1). Оптимальний рівень дози апоморфіну був визначений як 2 мг у 25 пацієнтів (28,4 % ППА), 3 мг — у 12 пацієнтів (13,6 %), 4 мг — у 35 пацієнтів (39,8 %), 5 мг — у 12 пацієнтів (13,6 %) і 6 мг — у 4 пацієнтів (4,5 %). Середня доза апоморфіну в ППА становила 3,5 мг.
Оцінки ефективності
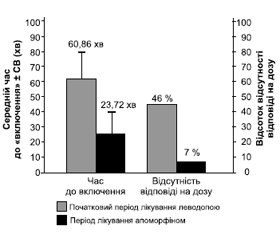
Пацієнти з ранковою акінезією, пов’язаною із затримкою початку дії пероральної терапії леводопи, мали швидке настання періоду «включення» після введення апоморфіну. Середнє значення часу до настання періоду «включення» ± СВ зменшилось з 60,86 ± 18,11 хвилини на початковому етапі при терапії леводопою до 23,72 ± 14,55 хвилини наприкінці періоду лікування апоморфіном (зменшення на 37,14 ± 20,51 хвилини; P < 0,0001 порівняно з початковим рівнем) (рис. 2).
Час до настання періоду «включення» був високостабільним у фазі ін’єкції апоморфіну. Майже всі учасники (84 із 88; 95,5%) відмічали зменшення часу до настання періоду «включення». Хоча повідомлялося про випадки відсутності відповіді на дозу (прагматично визначену як час до настання періоду «включення» > 60 хвилин) для 144 із 310 (46 %) записів у щоденниках протягом початкового тижня лікування леводопою, вони набагато рідше спостерігалися при ін’єкціях апоморфіну (20 із 307 (7 %) записів у щоденниках протягом тижня лікування апоморфіном).
Вторинні кінцеві результати, що оцінюють показники якості життя й показники за шкалами загальних оцінок (показники CGI-S, PGI-S, оцінки індексу EQ-5D-3L і показники EQ-5D VAS), підтверджували первинні результати ефективності з послідовними й статистично значущими змінами від початкового періоду лікування леводопою до періоду лікування апоморфіном (табл. 2). Об’єктивні оцінки рухової функції підтвердили, що підшкірні ін’єкції апоморфіну значно покращують рухову функцію, виходячи зі зменшення стадії за модифікованою шкалою Хен — Яра та покращення показників рухових функцій за UPDRS.
Безпека та переносимість
Під час проведення дослідження апоморфіну нові проблеми безпеки не спостерігалися. НЯ, що виникали на рівні > 5 % у популяції для оцінки безпеки, були нудота (26,8 %), запаморочення (16,5 %), позіхання (10,2 %), сонливість (7,9 %), гіпотензія (7,9 %) і блювання (7,1 %). Нудота, блювання й гіпотензія були також найбільш поширеними НЯ, які призвели до припинення лікування (табл. 3). Більшість (20 із 23) пацієнтів, які припинили лікування через НЯ, зробили це у фазі титрування дози. Більшість НЯ були легкого або помірного ступеня тяжкості. Одинадцять випадків НЯ тяжкого ступеня були зареєстровані в 6 пацієнтів: блювання (n = 2), гіпотензія (n = 2), запаморочення, холодний піт, біль у вухах, біль у щелепі, зниження рухливості, втрата свідомості й синкопе (усі n = 1). Тільки один пацієнт з-поміж них повідомив про «втрату свідомості» та «синкопе»; у цього ж пацієнта були блювання, запаморочення й гіпотензія, вказані як тяжкі (але не серйозні) НЯ. Повідомлялося, що ці НЯ з’являються через 15–20 хвилин після введення початкової дози 2 мг апоморфіну у фазі титрування, також цей пацієнт не продовжив участі в дослідженні.
/66_2.jpg)
Обговорення
Результати цього відкритого дослідження демонструють, що ін’єкція апоморфіну значно скорочувала час до «включення» в пацієнтів з пізніми стадіями ХП, які мають ранкову акінезію в результаті відстроченого початку ефекту або відсутності ефекту від ранкової дози леводопи, а також що апоморфін добре переносився більшістю пацієнтів. У цих пацієнтів спостерігався тривалий час до «включення» після ранкової дози леводопи — у середньому година. Скорочення часу до «включення» (в середньому на 37,14 хвилини) було клінічно значущим, про що свідчать істотні підвищення зроблених пацієнтами оцінок якості життя та загальних оцінок стану.
Ранкова акінезія часто згадується як одне з перших ускладнень леводопи, яке пацієнт відчуває при пробудженні [13]. Обсерваційне дослідження, проведене в Європі, показало, що при опитуванні пацієнтів із ХП щодо їхньої ранкової активності < 60 % пацієнтів повідомили про періоди «виключення» рано-вранці [14]. Однак, незважаючи на таку високу поширеність ранкової акінезії, результати цього дослідження показують, що вона часто залишається погано розпізнаною і недостатньо лікованою, незважаючи на часте застосування пероральних допоміжних препаратів. Пацієнти відчували ранкову акінезію в середньому протягом 4 років, хоча фахівці з розладів руху лікували всіх пацієнтів, і більшість отримувала допоміжну терапію агоністами дофамінових рецепторів, інгібіторами КОМТ і/або інгібіторами МАО-Б.
Після прийому першої ранкової дози леводопи протягом 7-денного початкового періоду > 40 % пацієнтів повідомляли про щонайменше одну відсутність відповіді на дозу, яка на практиці визначалася як нездатність до «включення» протягом 60 хвилин після введення дози. Це, ймовірно, відображає затримку спорожнення шлунка й надходження леводопи до проксимального відділу кишечника, де леводопа абсорбується (при пробудженні в кишечнику низька ймовірність присутності інтестинального пептиду). Також існує інформація, що при більш повільному спорожненні шлунка більша кількість леводопи може метаболізуватися в дофамін шляхом амінокислотного декарбоксилювання в слизовій оболонці шлунка [7].
Поширеність відсутності відповіді на дозу була несподівано високою, тому подальше вивчення частоти відсутності відповіді на дозу леводопи в пацієнтів із руховими флуктуаціями є виправданим. Випадки відсутності відповіді на дозу траплялися набагато рідше при лікуванні апоморфіном, а середній час до «включення» після підшкірної ін’єкції апоморфіну становив близько 24 хвилин, що вказує на те, що в основі відсутності відповіді на дозу може бути шлунково-кишкова дисфункція. Майже всі пацієнти (95,5 %) показали скорочення часу до «включення», що відображає частоту відповідей 95 % у попередніх дослідженнях [10]. Також була встановлена надійність впливу апоморфіну на рухову активність зі значним покращенням за шкалою Хен — Яра і показників рухової активності за UPDRS, паралельно до дії леводопи. Хоча це й не оцінювалося безпосередньо, покращання ранкової акінезії, мабуть, має клінічне значення для пацієнтів і дозволяє їм, наприклад, більш безпечно вставати з ліжка, виконувати свої звичайні ранкові заняття й продовжувати свій день. Дійсно, цікаво те, що пацієнти послідовно оцінювали вихідний ступінь тяжкості захворювання як «гірший» і ступінь покращання їхнього стану під час лікування як «значніший» порівняно із загальною оцінкою тяжкості захворювання, виконаною дослідником. Це свідчить про те, що пацієнти вважають ранкову акінезію більш серйозною проблемою, ніж може бути визнано на даний час у клінічній практиці.
Не було зареєстровано жодних нових НЯ під час фази титрування дози апоморфіну або на іншому етапі дослідження. Слід зазначити, що 7 із 20 пацієнтів, які припинили лікування через НЯ у фазі титрування, не могли переносити дозу 2 мг. Більше того, половина пацієнтів (n = 10), які припинили лікування через НЯ, зробили це тільки через один побічний ефект, що вказує на значущість побічного ефекту з точки зору НЯ. Побічні ефекти не були очевидні у звітах про ефективність; результати в популяції для оцінки безпеки були аналогічні тим, які спостерігалися в популяції для повного аналізу (значущість усіх результатів була на рівні 5 %). Як і слід було очікувати, найчастішими причинами припинення лікування були нудота, блювання й гіпотензія. Дослідження триметобензаміду для контролю нудоти й блювання під час початку та при продовженні лікування апоморфіном шляхом підшкірного введення показало, що в 16 % пацієнтів, які отримували триметобензамід, попередньо спостерігалися нудота та/або блювання в період титрування дози апоморфіну [15].
Обмеження цього дослідження включають відкритий дизайн і прагматичне визначення відсутності відповіді на дозу, за яким усім пацієнтам, у яких не відбулося «включення» протягом 60 хвилин, присвоювалося значення часу до «включення» 100 хвилин. Це було довільно обране значення, і, можливо, цей метод підстановки міг призвести до переоцінки середнього часу до «включення» леводопи (якщо в пацієнтів відбувалося «включення» протягом 60–100 хвилин) або, навпаки, до недооцінки (якщо в пацієнтів відбувалося «включення» через > 100 хвилин). Дослідження було розроблено для оцінки часу настання відповіді на апоморфін у пацієнтів з ранковою акінезією і не повністю відображає клінічну практику, у якій переривчасті підшкірні ін’єкції апоморфіну можуть бути додані до перорального лікування ХП протягом дня [16]. Дійсно, пацієнти з ранковою акінезією можуть отримувати користь від комбінації підшкірної ін’єкції апоморфіну (для швидкого полегшення) з пероральним прийомом леводопи (для тривалішого ефекту). Нарешті, дослідження проводилося в умовах маркування в США і тому може не повністю відображати клінічну ситуацію в інших країнах. Наприклад, у Європі ліцензовані вищі дози < 10 мг апоморфіну, а домперидон вважається кращим засобом профілактики блювання для одночасного застосування з апоморфіном, але він недоступний у Сполучених Штатах [16]. Альтернативні системи доставки леводопи або апоморфіну можуть також зменшити період до «включення» під час таких випадків, як ранкова акінезія, але вони не зареєстровані для використання в Сполучених Штатах.
Отже, було виявлено, що підшкірні ін’єкції апоморфіну забезпечують швидке й надійне «включення» для пацієнтів з ранковою акінезією, мабуть, у результаті уникнення шлунково-кишкової доставки й абсорбції. На додаток до запобігання епізодам «виключення» ін’єкції апоморфіну мають клінічне значення для зменшення перших проявів ранкової акінезії, забезпечуючи швидке й надійне «включення» при застосуванні під час пробудження.
Друкується зі скороченнями
/65_2.jpg)
/66_2.jpg)

/64.jpg)
/65.jpg)
/66.jpg)