Вступ
Згідно з даними Всесвітньої організації охорони здоров’я, недостатність вітаміну D вважається однією з надважливих проблем у всьому світі та має характер пандемії. Особливо тривожна ситуація щодо статусу вітаміну D у дітей [1–3] .
Проведене багатоцентрове дослідження із визначення забезпеченості вітаміном D дітей раннього віку в Україні дало змогу виявити наявність гіповітамінозу D у 90 % дітей віком 2–3 роки [4].
Безумовно, неможливо недооцінювати стан гіповітамінозу у дітей, проте необхідно знати про існування станів, які супроводжуються високим рівнем вітаміну D та призводять до тяжких порушень фосфорно-кальцієвого обміну з небезпечними наслідками. До них відноситься ідіопатична інфантильна гіперкальціємія.
Ідіопатична інфантильна гіперкальціємія (іdiopathic hypercalcemia infancy, OMIM 1433880, ІІГ) — рідкісне спадкове автосомно-рецесивне захворювання, пов’язане з порушенням інактивації активних метаболітів вітаміну D внаслідок інактивуючих мутацій в гені CYP24A1 [5]. Згідно з даними S. Skаlova та співавторів [6], поширеність ІІГ становить 1 на 47 000 новонароджених. Частота цього захворювання в Україні на сьогодні не визначена.
Перші випадки гіперкальціємії неясного генезу з гіперкальціурією та зниженням рівня паратгормону (ПТГ) були описані у дітей раннього віку у 50-ті роки минулого століття в деяких країнах Європи при застосуванні високих доз вітаміну D для профілактики рахіту [7–9].
У 2011 році K. Schlingman і співавтори [5] вперше показали, що причиною цього стану є інактивуючі мутації в гені CYP24A1, який кодує 24-гідроксилазу.
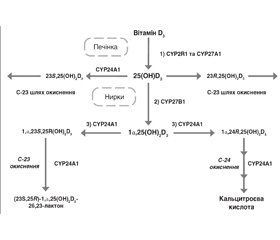
Ген CYP24A1 локалізований на хромосомі 20q13.2 і складається з 12 екзонів [10]. 24-гідроксилаза (CYP24A1) є складним мітохондріальним ензимом родини цитохромів Р450, який містить 514 амінокислот та експресований переважно в нирках, кістках, ентероцитах [11]. Завдяки CYP24A1 відбувається багатоступінчастий гідроліз 1,25-дигідроксивітаміну D3 [1,25(ОН)2D3] до кальцитроєвої кислоти та 26,23-лактонів, а також перетворення 25-гідроксивітаміну D3 [25(ОН)D3] в неактивний метаболіт 24,25-дигідроксивітамін D3 [24,25(ОН)2D3] [12–17] (рис. 1).
/72.jpg)
На даний час у пацієнтів з ІІГ виявлені різноманітні мутації: делеції, місенс-, нонсенс-, сплайсинг-мутації та інсерції-делеції зі зсувом рамки зчитування [5, 6, 18]. Більшість мутацій є гомо- або компаундгетерозиготними. У 2012 р. P. Tebben та співавтори [18] представили клінічні прояви ІІГ у гетерозиготних носіїв сплайсинг-мутації з автосомно-домінантним шляхом успадкування. У Росії у 2015 р. групою авторів (Ю.В. Тихонович, А.А. Колодкина, К.С. Куликова та ін. [19]) були описані 5 випадків ІІГ (3 дитини та 2 дорослих) з вираженою гіпекальціурією внаслідок гомо- або компаундгетерозиготних мутацій гена CYP24A1.
Актуальність даного повідомлення полягає в інформуванні медичної громадськості про те, що на тлі світової пандемії гіповітамінозу D, застосування високих доз вітаміну D з профілактичною та лікувальною метою існують генетично детерміновані випадки гіпервітамінозу D, що призводить до змін метаболізму, інтоксикації та ураження нирок з розвитком нефрокальцинозу.
Метою роботи стала необхідність привернути увагу науково-практичної медичної спільноти до рідкісних захворювань з ураженням нирок на тлі генетичних мутацій, безпосередньо ІІГ, оскільки тяжкість проявів цього захворювання варіює від безсимптомної гіперкальціємії та гіперкальційурії до тяжких випадків з летальністю в ранньому дитинстві. А також ініціювати створення реєстру рідкісних (орфанних) захворювань органів сечової системи, починаючи з дитячого віку.
Клінічний випадок
Хлопчик Я., народився у 2018 р. доношеним, гестаційний вік 39 тижнів, маса 3500 г, довжина 50 см, від ІІ бажаної вагітності, яка перебігала з токсикозом першої половини (нудота, періодичне блювання).
Матері та батькові дитини на момент народження хлопчика було 30 років, здорові, не родичі. У мами в дитинстві виявляли нефроптоз без клінічних проявів. У батька хлопчика — хронічний гастрит. У родині мами та батька по жіночій лінії зустрічались випадки кристалурії без детального обстеження, яка коригувалась дієтою та водним навантаженням.
Від І вагітності в родині є дівчинка 5 років (2013 р.н.), яка народилася доношеною, росте та розвивається згідно з віком, проте має схильність до ацетонемічних станів.
Хлопчик від народження знаходився на грудному вигодовуванні, ріс та розвивався задовільно. Спостерігався педіатром. Проводилися планові щеплення. Профілактично вітамін D в дозі 1000 МО на добу почав отримувати у віці 3 місяців, з початком осені. Маса тіла в 6 міс. становила 8600 г.
Проте на 7-му місяці життя після планового щеплення (ревакцинації, вакцина «Гексасим») протягом наступних декількох діб стан дитини значно погіршився. З’явилася різка слабкість, сонливість, зригування, м’язова гіпотонія. Батьки відмітили затримку сечі та запори. Такі зміни в стані дитини спочатку розцінювалися як патологічна реакція на щеплення. Дільничним педіатром були призначені загальні аналізи крові і сечі, були виявлені ознаки запального процесу з боку крові та лейкоцитурія. На ультразвуковому дослідженні нирок візуалізувалася велика кількість кристалів солей. Отримані результати обстежень були розцінені як прояви інфекції сечових шляхів, призначена антибактеріальна терапія. Лікування проводилося амбулаторно. Однак стан дитини залишався тяжким. Хлопчик за тиждень втратив 2 кг маси тіла. Зберігалися лейкоцитурія, гіпотонія м’язів, були втрачені психомоторні навички. Проба Сулковича виявилася позитивною +++.
У зв’язку з цим були призначені консультації нефролога, невролога, ендокринолога, гастроентеролога. Проведені електроенцефалографія, електроміографія, нейросонографія, які не виявляли органічного неврологічного захворювання. Виключали синдром м’язової атрофії, імунодефіцитний стан, непереносимість глютену. У низці аналізів крові відмічалася анемія І ст., тромбоцитоз у межах 410–460 Г/л (норма 180–400 Г/л). Проте в біохімічному аналізі крові було виявлено гіперкальціємію (4,13 ммоль/л), гіпервітаміноз D (260 нмоль/л), знижений рівень ПТГ (4,06 пг/мл).
УЗД-зміни дозволили діагностувати нефрокальциноз. Лабораторні показники наведені в табл. 1.
Тяжкий загальний стан, м’язова гіпотонія, втрата психомоторних навичок, високі рівні вітаміну D, кальцію в крові, нефрокальциноз стали приводом для генетичного обстеження.
/73.jpg)
Дитина проконсультована лікарем-генетиком ДУ «Інститут спадкової патології НАМНУ». З огляду на дифузну м’язову гіпотонію у дитини, підвищений рівень кальцію у біохімічному аналізі крові, нефрокальциноз та затримку фізичного і психомоторного розвитку запідозрено генетичну патологію, а саме порушення фосфорно-кальцієвого обміну. Проведено молекулярно-генетичне дослідження 35 генів шляхом секвенування наступного покоління (next generation sequencing, NGS). Дослідження проводилося у лабораторії Invitae, США. Від батьків отримано письмову згоду на проведення генетичного дослідження. Виявлені два патогенних варіанти — c.1186C>T (p.Arg396Trp) і c.1226T>C (p.Leu409Ser) у гені CYP24A1, які локалізовані на протилежних хромосомах. Ген CYP24A1 асоціюється з автосомно-рецесивною дитячою гіперкальціємією. Вважається, що гіперкальціємія, пов’язана з CYP24A1, є результатом чутливості до вітаміну D.
Отримані результати генетичного дослідження дали змогу верифікувати діагноз: інфантильна гіперкальціємія, автосомно-рецесивний тип успадкування. Проведене генетичне консультування сім’ї. У даному шлюбі ризик повтору даної патології при наступних вагітностях становить 25 %, згідно з автономно-рецесивним типом успадкування.
Дитині було виключено прийом вітаміну D, призначено дієту з виключенням продуктів, що містять кальцій, вітамін D, збільшений об’єм рідини, фітотерапію, антагоністи вітаміну D (вітаміни А, Е, магне В6).
Контрольні аналізи в катамнезі показали позитивну динаміку, стан хлопчика поступово покращувався. Почав набирати масу тіла, відновилися психомоторні навички. На сьогодні стан дитини відносно задовільний. Знаходиться на обліку нефролога з приводу нефрокальцинозу. З урахуванням віку дитини забір крові для визначення рівня креатиніну в динаміці є проблематичним.
Обговорення
При обговоренні наведеного клінічного випадку доцільно зупинитися на таких моментах:
1. Інфантильна гіперкальціємія — надзвичайно рідкісна патологія, яка не належить до провідних захворювань, з яких починається діагностичний пошук, але призводить до розвитку хронічної хвороби нирок у пацієнта.
2. Маніфестація ІІГ в даному випадку збіглася з проведенням профілактичного щеплення і першочергово розглядалася як реакція на щеплення, що досить часто зустрічається в загальній медичній практиці. Проте це доводить, що кожна реакція на щеплення повинна бути досліджена.
3. Лікування гострого періоду хвороби, коли були виражені ознаки інтоксикації і зневоднення, проводилося амбулаторно (доцільно було лікування в стаціонарі з адекватною регідратацією та дослідженням кальцію і фосфору в крові).
4. Процес діагностичного пошуку включав достатній обсяг консультацій необхідними вузькими спеціалістами та необхідний обсяг обстеження.
5. Визначення вітаміну D, кальцію, ПТГ, звернення до генетика проведені в останню чергу, проте саме вони дозволили верифікувати діагноз та призначити лікування.
6. Клініко-анамнестичний комплекс ІІГ у даної дитини можна оцінити як середньотяжкий, із деякими особливостями (анемія, тромбоцитоз). Клінічна картина ІІГ у даного пацієнта схожа з одним випадком, описаним у роботі російських вчених [19], проте в тієї дитини була виявлена компаунд-гетерозиготна мутація E322K/R396W гена CYP24A1.
7. ІІГ характеризується поліморфізмом генетичних мутацій, клінічних проявів, може виявлятися як у дітей, так і у дорослих людей із сечокам’яною хворобою.
Висновки
1. Безумовно, неможливо недооцінювати стан гіповітамінозу у дітей, проте необхідно пам’ятати про стани, при яких високий рівень вітаміну D призводить до тяжких порушень фосфорно-кальцієвого обміну з небезпечними наслідками.
2. Ідіопатична інфантильна гіперкальціємія, як специфічна патологія, заслуговує на високу увагу не тільки нефрологів, але й лікарів загальної практики та інших спеціальностей (ендокринологів, неврологів, радіологів тощо)
3. Доцільним є більш широке дослідження рівня кальцію, вітаміну D, особливо перед щепленнями та у дітей з клінічними проявами інфекції сечовивідних шляхів, з конкрементами в нирках, при нетиповій відповіді на терапію інфекції сечовивідних шляхів, тривалому інтоксикаційному синдромі, сечокам’яній хворобі у дітей різного віку та у дорослих [19].
4. Вчасна верифікація ідіопатичної інфантильної гіперкальціємії та правильна тактика лікування дозволяють досягнути позитивних результатів як клінічно, так і в корекції кальцієво-фосфорного обміну. Проте такі пацієнти повинні бути під медичним спостереженням пожиттєво.
Конфлікт інтересів. Автори декларують відсутність конфлікту інтересів, пов’язаних із публікацією даної статті.
Згода пацієнта. Батьки пацієнта надали згоду на публікацію медичних даних в рамках даної статті.
Список литературы
1. Диагностика, лечение и профилактика дефицита витамина D. Рекомендации Американского общества эндокринологов (2011 г.). Дитячий лікар. 2012. № 5 (18). С. 67-76.
2. Комісаренко Ю.І. Вітамін D та його роль у регуляції метаболічних розладів при цукровому діабеті. Ліки України. 2013. № 4. С. 51-54.
3. Поворознюк В.В. Состояние проблемы остеопороза и других метаболических заболеваний скелета в Украине. Новости медицины и фармации. 2014. № 3(487). С. 10-13.
4. Квашніна Л.В. Вітамін D у різні періоди дитинства: що знаємо, що треба пам’ятати і що забули. Здоров’я України. Тематичний номер. 2017, грудень. C. 29-31.
5. Schlingmann K.P., Kaufmann M., Weber S., et al. Mutations in CYP24A1 and idiopathic infantile hypercalcemia. N. Engl. J. Med. 2011. № 365(5). Р. 410-421. doi: 10.1056/nejmoa1103864
6. Skalova S., Cerna L., Bayer M., et al. Intravenous pamidronate in the treatment of severe idiopathic infantile hypercalcemia. Iran J. Kidney Dis. 2013. № 7(2). Р. 160-164.
7. Lightwood R. Idiopathic hypercalcaemia with failure to thrivenephrocalcinosis. Paper presented at: proceedings of the royal society of medicine. London; 1952.
8. Creery R.D., Neill D.W. Idiopathic hypercalcaemia in infants with failure to thrive. Lancet. 1954. № 267(6829). Р. 110-114.
9. Rhaney K., Mitchell R.G. Idiopathic hypercalcaemia of infants. Lancet. 1956. № 270(6931). Р. 1028-1032.
10. Hahn C.N., Baker E., Laslo P., et al. Localization of the human vitamin D 24-hydroxylase gene (CYP24) to chromosome 20q13.2—>q13.3. Cytogenet. Cell Genet. 1993. № 62(4). Р. 192-193.
11. Annalora A.J., Goodin D.B., Hong W.X., et al. Crystal structure of CYP24A1, a mitochondrial cytochrome P450 involved in vitamin D metabolism. J. Mol. Biol. 2010. № 396(2). Р. 441-451. doi: 10.1016/j.jmb.2009.11.057
12. Deluca H.F. Metabolism of vitamin D: current status. Am. J. Clin. Nutr. 1976. № 29(11). Р. 1258-1270.
13. Reddy G.S., Tserng K.Y. Calcitroic acid, end product of renal metabolism of 1,25-dihydroxyvitamin D3 through C-24 oxidation pathway. Biochemistry. 1989. № 28(4). Р. 1763-1769.
14. Prosser D.E., Jones G. Enzymes involved in the activation and inactivation of vitamin D. Trends Biochem. Sci. 2004. № 29(12). Р. 664-673. doi: 10.1016/j.tibs.2004.10.005
15. Sakaki T., Kagawa N., Yamamoto K., Inouye K. Metabolism of vitamin D3 by cytochromes P450. Front Biosci. 2005. № 10. Р. 119-134.
16. Jones G., Prosser D.E., Kaufmann M. 25-hydroxyvitamin D-24-hydroxylase (CYP24A1): its important role in the degradation of vitamin D. Arch Biochem Biophys. 2012. № 523(1). Р. 9-18. doi: 10.1016/j.abb.2011.11.003
17. Nesterova G., Malicdan M.C., Yasuda K., et al. 1,25-(OH)2D-24 hydroxylase (CYP24A1) deficiency as a cause of nephrolithiasis. Clin. J. Am. Soc. Nephrol. 2013. № 8(4). Р. 649-657. doi: 10.2215/cjn.05360512
18. Tebben P.J., Milliner D.S., Horst R.L., et al. Hypercalcemia, hypercalciuria, and elevated calcitriol concentrations with autosomal dominant transmission due to CYP24A1 mutations: effects of ketoconazole therapy. J. Clin. Endocrinol. Metab. 2012. № 97(3). E423-427. doi: 10.1210/jc.2011-1935
19. Тихонович Ю.В., Колодкина А.А., Куликова К.С. и др. Идиопатическая гиперкальциемия детей грудного возраста. Описание клинических случаев, обзор литературы. Проблемы эндокринологии. 2017. Т. 63. №1. С. 51-57. doi: 10.14341/probl201763151-57
20. Морозов Ю.А., Марченко Т.В., Дементьева И.И. Оценка функции почек в педиатрической практике. Український журнал нефрології та діалізу. 2013. № 4. С. 45-49.

/72.jpg)
/73.jpg)