Журнал «Здоровье ребенка» Том 15, №6, 2020
Вернуться к номеру
Неонатальний скринінг тяжких комбінованих імунодефіцитів: доцільність, можливості й перспективи
Авторы: Боярчук О.Р.
ДВНЗ «Тернопільський національний медичний університет ім. І.Я. Горбачевського МОЗ України», м. Тернопіль, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
Неонатальний скринінг виправданий для рідкісних станів, які викликають серйозні проблеми зі здоров’ям, що не визначаються стандартним клінічним обстеженням, але мають ефективні методи корекції, і для яких рання діагностика та лікування мають важливе значення для досягнення позитивного результату. Тяжкі комбіновані імунодефіцити (ТКІД) — група первинних імунодефіцитів (ПІД), що характеризуються вираженою Т- і/або В-лімфопенією. Пацієнти з ТКІД зазвичай народжуються без клінічних ознак хвороби, але вже на першому році життя, найчастіше в перші місяці, захворювання маніфестує тяжкими інфекціями. Без вчасної діагностики й адекватного лікування діти не виживають. На сьогодні розроблений і впроваджений метод виявлення ТКІД за допомогою TREC (T-cell receptor excision circle), який визначає Т-клітинну лімфопенію. Останніми роками для виявлення В-клітинної лімфопенії використовують метод KREC (кappa-deleting recombination excision circle). У статті проведено аналіз досліджень, що відображають дані як про повномасштабні популяційні програми неонатального скринінгу ТКІД, так і пілотні проєкти. На основі літературних даних визначено й інші ПІД, а також окремі стани, які перебігають з Т- і/або В-лімфопенією та які можна діагностувати за допомогою TREC/KREC методу. Розглянуто питання економічної ефективності неонатального скринінгу ТКІД, можливості його впровадження в Україні, перспективні методи ранньої діагностики ПІД. Визначено, що неонатальний скринінг ТКІД з використанням TREC чи TREC/KREC методу визначення Т- і В-лімфопенії дозволяє вчасно виявляти комбіновані первинні імунодефіцити, перш за все тяжкі, що дасть змогу вчасно проводити превентивні заходи попередження інфекцій, їх адекватне лікування та зберегти життя дітей і покращити якість їх життя. Проведення пілотного дослідження дозволить обґрунтувати клінічну та економічну доцільність впровадження повномасштабного неонатального скринінгу ТКІД в Україні.
Неонатальный скрининг оправдан для редких состояний, которые вызывают серьезные проблемы со здоровьем, не определяются стандартным клиническим обследованием, но имеют методы коррекции, и для которых ранняя диагностика и лечение имеют важное значение для достижения положительного результата. Тяжелые комбинированные иммунодефициты (ТКИД) — группа первичных иммунодефицитов (ПИД), которые характеризуются выраженной Т- и/или В-лимфопенией. Пациенты с ТКИД обычно рождаются без клинических признаков болезни, но уже на первом году жизни, чаще всего в первые месяцы, заболевание манифестирует тяжелыми инфекциями. Без своевременной диагностики и адекватного лечения дети не выживают. На сегодняшний день разработан и внедрен метод выявления ТКИД с помощью TREC (T-cell receptor excision circle), который определяет Т-клеточную лимфопению. В последние годы для выявления В-клеточной лимфопении используют метод KREC (кappa-deleting recombination excision circle). В статье проведен анализ исследований, которые отражают данные как о полномасштабных популяционных программах неонатального скрининга ТКИД, так и пилотные проекты. На основе литературных данных определены и другие ПИД, а также отдельные состояния, которые протекают с Т- и/или В-лимфопенией и которые можно диагностировать с помощью TREC/KREC метода. Рассмотрены вопросы экономической эффективности неонатального скрининга ТКИД, возможности его внедрения в Украине, перспективные методы ранней диагностики ПИД. Определено, что неонатальный скрининг ТКИД с использованием TREC или TREC/KREC метода определения Т- и В-лимфопении позволяет своевременно выявлять комбинированные первичные иммунодефициты, прежде всего тяжелые, что позволит вовремя проводить превентивные меры предупреждения инфекций, их адекватное лечение и сохранить жизни детей и улучшить качество их жизни. Проведение пилотного исследования позволит обосновать клиническую и экономическую целесообразность внедрения полномасштабного неонатального скрининга ТКИД в Украине.
Newborn screening is reasonable for rare conditions that cause serious health problems that are not defined by standard clinical examination but have effective methods of correction, and for which early diagnosis and treatment are important to achieve a positive result. Severe combined immunodeficiency (SCID) is a group of primary immunodeficiencies (PID) characterized by severe T- and/or B-lymphopenia. Patients with SCID are usually born without clinical signs of the disease, but in the first year of life, most often in the first months, the disease manifests itself in severe infections. Without timely diagnosis and adequate treatment, the disease is fatal. T-cell receptor excision circle (TREC) assay has been developed and implemented for detecting T-cell lymphopenia and screening for SCID. In recent years, the kappa-deleting recombination excision circle (KREC) assay has been used to detect B-cell lymphopenia. The article analyzes studies that reflect data on both population-based programs of newborn screening for SCID and pilot studies. Based on the literature data, other PIDs, as well as other conditions with T- and/or B-lymphopenia have been identified that can be diagnosed using the TREC/KREC assay. The issues of cost-effectiveness/benefits of newborn screening for SCID, possibilities of its implementation in Ukraine, perspective methods of early PID diagnosis were considered. It was determined that newborn screening for SCID based on TREC or TREC/KREC assay for determination of T- and B-lymphopenia allows early identification of combined primary immunodeficiencies, especially severe ones, to use protective measures to prevent infections, their adequate treatment, save children’s lives and improve their quality of life. A pilot study will justify the clinical and economic feasibility for the implementation of population-based newborn screening for SCID in Ukraine.
тяжкі комбіновані імунодефіцити; неонатальний скринінг; TREC; KREC; огляд
тяжелые комбинированные иммунодефициты; неонатальный скрининг; TREC; KREC; обзор
severe combined immunodeficiencies; newborn screening; TREC; KREC; review
Вступ
Історія неонатального скринінгу ТКІД
Результати впровадження скринінгових програм TREC/KREC
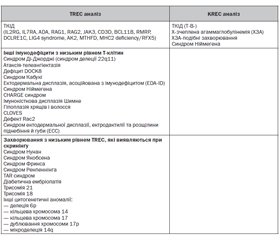
Результати скринінгових програм з використанням TREC/KREC аналізу
/94.jpg)
Економічна ефективність скринінгу методом TREC/KREC
Можливості впровадження скринінгу ТКІД в Україні
Перспективи неонатального скринінгу ПІД
Висновки
- Дитяча імунологія: підручник. Л.І. Чернишова, А.П. Волоха, Л.В. Костюченко та ін. К.: ВСВ «Медицина», 2013. 720 с.
- Picard C., Al-Herz W., Bousfiha A., Casanova J.L., Chatila T., Conley M.E. et al. Primary immunodeficiency diseases: an update on the classification from the International Union of Immunological Societies Expert Committee for primary immunodeficiency 2015. J. Clin. Immunol. 2015. Vol. 35(8). P. 696-726. doi: 10.1007/s10875-015-0201-1.
- Boyarchuk O., Volokha A., Hariyan T. et al. The impact of combining educational program with the improving of infrastructure to diagnose on early detection of primary immunodeficiencies in children. Immunol. Res. 2019. Vol. 67. № 4–5. P. 390-397. DOI: 10.1007/s12026-019-09103-w.
- King J., Hammarström L. Newborn screening for primary immunodeficiency diseases: history, current and future practice. J. Clin. Immunol. 2018. № 38. P. 56-66.
- Gennery A.R., Slatter M.A., Grandin L., Taupin P., Cant A.J., Veys P. et al. Transplantation of hematopoietic stem cells and long-term survival for primary immunodeficiencies in Europe: entering a new century, do we do better? J. Allergy Clin. Immunol. 2010. № 126. P. 602-610. doi: 10.1016/j.jaci.2010.06.015.
- Boyarchuk O., Balatska N., Chornomydz I. Evaluation of warning signs of primary immunodeficiencies. Pediatria Polska — Polish Journal of Paediatrics. 2019. Vol. 94. № 6. P. 337-341. doi: 10.5114/polp.2019.92824.
- Guthrie R. Blood screening for phenylketonuria. JAMA. 1961. № 178. P. 863. doi: 10.1001/jama.1961.03040470079019.
- Wilson J., Jungner G. The principles and practice of screening for disease. Geneva: World Health Organization, 1968.
- Puck J.M. Newborn screening for severe combined immunodeficiency and T-cell lymphopenia. Immunol. Rev. 2019. Vol. 287. № 1. P. 241-252. doi: 10.1111/imr.12729.
- Argudo-Ramírez A., Martín-Nalda A., Marín-Soria J.L. et al. First Universal Newborn Screening Program for Severe Combined Immunodeficiency in Europe. Two-Years' Experience in Catalonia (Spain). Front. Immunol. 2019. № 10. P. 2406. doi: 10.3389/fimmu.2019.02406.
- Collier F., Tang M., Ponsonby A.L., Vuillermin P. Flow cytometric assessment of cord blood as an alternative strategy for population-based screening of severe combined immunodeficiency. J. Allergy Clin. Immunol. 2013. Vol. 131(4). P. 1251-1252. doi: 10.1016/j.jaci.2012.09.039.
- Puck J.M. Laboratory technology for population-based screening for severe combined immunodeficiency in neonates: the winner is T-cell receptor excision circles. The Journal of Allergy and Clinical Immunology. 2012. Vol. 129. № 3. P. 607-616. DOI: 10.1016/j.jaci.2012.01.032.
- Verbsky J.W., Baker M.W., Grossman W.J., Hintermeyer M., Dasu T., Bonacci B. et al. Newborn screening for severe combined immunodeficiency; the Wisconsin experience (2008–2011). J. Clin. Immunol. 2012. № 32. P. 82-88. doi: 10.1007/s10875-011-9609-4.
- Douek D.C., McFarland R.D., Keiser P.H., Gage E.A., Massey J.M., Haynes B.F. et al. Changes in thymic function with age and during the treatment of HIV infection. Nature. 1998. Vol. 396. № 6712. P. 690-695. doi: 10.1038/25374.
- Chan K., Puck J.M. Development of population-based newborn screening for severe combined immunodeficiency. J. Allergy Clin. Immunol. 2005. Vol. 115. № 2. P. 391-398. doi: 10.1016/j.jaci.2004.10.012.
- Van Zelm M.C., Szczepanski T., van der Burg M., van Dongen J.J. Replication history of B lymphocytes reveals homeostatic proliferation and extensive antigen-induced B cell expansion. J. Exp. Med. 2007. Vol. 204. № 3. P. 645-655. doi: 10.1084/jem.20060964.
- Nakagawa N., Imai K., Kanegane H., Sato H., Yamada M., Kondoh K. et al. Quantification of kappa-deleting recombination excision circles in Guthrie cards for the identification of early B-cell maturation defects. J. Allergy Clin. Immunol. 2011. Vol. 128. № 1. P. 223-225. doi: 10.1016/j.jaci.2011.01.052.
- Borte S., von Döbeln U., Fasth A., Wang N., Janzi M., Winiarski J. et al. Neonatal screening for severe primary immunodeficiency diseases using high-throughput triplex real-time PCR. Blood. 2012. Vol. 119. № 11. P. 2552-2555. doi: 10.1182/blood-2011-08-371021.
- Kwan A., Abraham R.S., Currier R., Brower A., Andruszewski K., Abbott J.K. et al. Newborn screening for severe combined immunodeficiency in 11 screening programs in the United States. JAMA. 2014. Vol. 312. № 7. P. 729-738. doi: 10.1001/jama.2014.9132.
- Amatuni G.S., Currier R.J., Church J.A. et al. Newborn Screening for Severe Combined Immunodeficiency and T-cell Lymphopenia in California, 2010–2017. Pediatrics. 2019. Vol. 143. № 2. Е20182300. doi: 10.1542/peds.2018-2300.
- Rechavi E., Lev A., Saraf-Levy T., Etzioni A., Almashanu S., Somech R. Newborn screening for severe combined immunodeficiency in Israel. Int. J. Neonatal Screen. 2017. Vol. 3. № 2. P. 13. https://doi.org/10.3390/ijns3020013.
- Chien Y.-H., Yu H.-H., Lee N.-C., Ho H.-C., Kao S.-M., Lu M.-Y. et al. Newborn screening for severe combined immunodeficiency in Taiwan. Int. J. Neonatal Screen. 2017. Vol. 3. № 3. P. 16.
- Thomas C., Durand-Zaleski I., Frenkiel J. et al. Clinical and economic aspects of newborn screening for severe combined immunodeficiency: DEPISTREC study results. Clin. Immunol. 2019. № 202. P. 33-39. doi: 10.1016/j.clim.2019.03.012.
- Barbaro M., Ohlsson A., Borte S. et al. Newborn Screening for Severe Primary Immunodeficiency Diseases in Sweden-a 2-Year Pilot TREC and KREC Screening Study. J. Clin. Immunol. 2017. Vol. 37. № 1. P. 51-60. doi: 10.1007/s10875-016-0347-5.
- Zetterström R., Barbaro M., Ohlsson A., Borte S., Jonsson S., Winiarski J. et al. Newborn screening for primary immune deficiencies with a TREC/KREC/ACTB triplex assay — a three-year pilot study in Sweden. Int. J. Neonatal Screen. 2017. Vol. 3(2). P. 11.
- Blom M., Bredius R.G.B., Weijman G., Dekkers E.H.B.M., Kemper E.A., van de -Akker M.E. et al. Introducing newborn screening for severe combined immunodeficiency (SCID) in the Dutch neonatal screening program. Int. J. Neonatal Screen. 2018. № 4. P. 1-10. https://doi.org/10.3390/ijns4040040.
- Chien Y.H., Chiang S.C., Chang K.L., Yu H.H., Lee W.I., Tsai L.P. et al. Incidence of severe combined immunodeficiency through newborn screening in a Chinese population. J. Formos Med. Assoc. 2015. Vol. 114. № 1. P. 12-16. doi: 10.1016/j.jfma.2012.10.020.
- De Felipe B., Olbrich P., Lucenas J.M., Delgado-Pecellin C., Pavon-Delgado A., Marquez J. et al. Prospective neonatal screening for severe T- and B-lymphocyte deficiencies in Seville. Pediatr. Allergy Immunol. 2016. Vol. 27. № 1. P. 70-77. doi: 10.1111/pai.12501.
- Adams S.P., Rashid S., Premachandra T., Harvey K., Ifederu A., Wilson M.C. et al. Screening of neonatal UK dried blood spots using a duplex TREC screening assay. J. Clin. Immunol. 2014. № 34. P. 323-330. doi: 10.1007/s10875-014-0007-6.
- Nourizadeh M., Shakerian L., Borte S., Fazlollahi M., Badalzadeh M., Houshmand M. et al. Newborn screening using TREC/KREC assay for severe T and B cell lymphopenia in Iran. Scand. J. Immunol. 2018. № 88. Е12699. doi: 10.1111/sji.12699.
- Audrain M., Thomas C., Mirallie S., Bourgeois N., Sebille V., Rabetrano H. et al. Evaluation of the T-cell receptor excision circle assay performances for severe combined immunodeficiency neonatal screening on Guthrie cards in a French single centre study. Clin. Immunol. 2014. № 150. P. 137-139. doi: 10.1016/j.clim.2013.11.012.
- Blom M., Pico-Knijnenburg I., Sijne-van Veen M., Boelen A., Bredius R.G.M., van der Brug M., Schielen P.J.C.I. An evaluation of the TREC assay with regard to the integration of SCID screening into the Dutch newbon screening program. Clin. Immunol. 2017. № 180. P. 106-110.
- Al-Mousa H., Al-Dakheel G., Jabr A., Elbadaoui F., Abouelhoda M., Baig M. et al. High incidence of severe combined immunodeficiency disease in Saudi Arabia detected through combined T cell receptor excision circle and next generation sequencing of newborn dried blood spots. Front. Immunol. 2018. № 9. P. 782.
- Дерябина С.С., Тузанкина И.А., Власова Е.В., Болков М.А., Шершнев В.Н. Неонатальный скрининг на тяжелую комбинированную иммунную недостаточность в России: прекрасное далеко или завтрашняя реальность? Вопросы современной педиатрии. 2017. Т. 16. № 1. С. 59-66. doi: 10.15690/vsp.v16i1.1696).
- King J., Ludvigsson J., Hammarström L. Newborn screening for primary immunodeficiency diseases: the past, the present and the future. Int. J. Neonatal Screening. 2017. Vol. 3(3). P. 19. doi: 10.3390/ijns3030019.
- La Marca G., Giocaliere E., Malvagia S., Funghini S., Ombrone D., Della Bona M.L. et al. The inclusion of ADA-SCID in expanded newborn screening by tandem mass spectrometry. J. Pharm. Biomed. Anal. 2014. № 88. P. 201-206. doi: 10.1016/j.jpba.2013.08.044.
- Van der Spek J., Groenwold R.H., van der Burg M., van Montfrans J.M. TREC Based Newborn Screening for Severe Combined Immunodeficiency Disease: A Systematic Review. J. Clin. Immunol. 2015. Vol. 35. № 4. P. 416-430. doi: 10.1007/s10875-015-0152-6.
- Modell V., Knaus M., Modell F. An analysis and decision tool to measure cost benefit of newborn screening for severe combined immunodeficiency (SCID) and related T-cell lymphopenia. Immunol. Res. 2014. № 60. P. 145-152. doi: 10.1007/s12026-014-8485-4.
- Chan K., Davis J., Pai S.Y., Bonilla F.A., Puck J.M., Apkon M. A Markov model to analyze cost-effectiveness of screening for severe combined immunodeficiency (SCID). Mol. Genet. Metab. 2011. № 104. P. 383-389. doi: 10.1016/j.ymgme.2011.07.007.
- McGhee S.A., Stiehm E.R., McCabe E.R. Potential costs and benefits of newborn screening for severe combined immunodeficiency. J. Pediatr. 2005. Vol. 147(5). P. 603-608. doi: 10.1016/j.jpeds.2005.06.001.
- Ding Y., Thompson J.D., Kobrynski L., Ojodu J., Zarbalian G., Grosse S.D. Cost-Effectiveness/Cost-Benefit Analysis of Newborn Screening for Severe Combined Immune Deficiency in Washington State. J. Pediatr. 2016. Vol. 172. P. 127-135. doi: 10.1016/j.jpeds.2016.01.029.
- Van der Burg M., Mahlaoui N., Gaspar H.B., Pai S.-Y. Universal Newborn Screening for Severe Combined Immunodeficiency (SCID). Front. Pediatr. 2019. № 7. P. 373. doi: 10.3389/fped.2019.00373.
- Boyarchuk O., Dmytrash L. Clinical Manifestations in the Patients with Primary Immunodeficiencies: Data from One Regional Center. Turkish Journal of Immunology. 2019. Vol. 7(3). P. 113-119.
- Janzi M., Sjöberg R., Wan J., Fischler B., von Döbeln U., Isaac L. et al. Screening for C3 deficiency in newborns using microarrays. PLoS One. 2009. Vol. 4(4). Е5321. doi: 10.1371/journal.pone.0005321.
- Kingsmore S.F. Newborn testing and screening by whole-genome sequencing. Genet. Med. 2016. Vol. 18(3). P. 214-216. doi: 10.1038/gim.2015.172.
- Willig L.K., Petrikin J.E., Smith L.D., Saunders C.J., Thiffault I., Miller N.A. et al. Whole-genome sequencing for identification of Mendelian disorders in critically ill infants: a retrospective analysis of diagnostic and clinical findings. Lancet. Respir. Med. 2015. Vol. 3(5). P. 377-387. doi: 10.1016/S2213-2600(15)00139-3.

/92.jpg)
/93.jpg)
/94_2.jpg)