Журнал «Здоровье ребенка» Том 15, №6, 2020
Вернуться к номеру
Значення вроджених лімфоїдних клітин у розвитку метазапалення жирової тканини при ожирінні
Авторы: Абатуров О.Є., Нікуліна А.O.
ДЗ «Дніпропетровська медична академія Міністерства охорони здоров’я України», м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
У літературному огляді подані сучасні уявлення стосовно ролі вроджених лімфоїдних клітин у розвитку метазапалення жирової тканини при ожирінні, яке останнім часом набуло епідемічного характеру, особливо в підлітковій віковій групі. У статті наведені дані стосовно організації популяції вроджених лімфоїдних клітин (ILC), що за спектром своїх субпопуляцій являють собою немов вроджений клітинний аналог CD4+ T-хелперних клітин, але не експресують рецептори антигену і не здатні до клональної експансії. Подані основні типи ILC, а саме ILC1, які є аналогом Th1-клітин, ILC2 — Th2-клітин, а ILC3 — Th17- і Th22-клітин, а також їх основні функціональні властивості та структурні особливості. Розвиток ожиріння супроводжується збільшенням представництва NK-клітин, ILC1 і зниженням кількості ILC2 в епідидимальній жировій тканині. Наведені дані свідчать, що основною функцією групи ILC1 є високий рівень експресії IFN-γ і TNF-α, що відіграє визначальну роль захисту проти внутрішньоклітинних патогенів, а використання специфічних маркерів CD49a, CD127 (IL-7Rα) і Eomes дозволяє відрізнити ILC1 від NK-клітин. У той же час відносно високий вміст ILC2 у фізіологічній жировій тканині є необхідним клітинним механізмом, що підтримує протизапальний стан жирової тканини як органа з високим вмістом прозапальних молекулярних тригерів. Збільшення популяцій NK-клітин і ILC1 сприяє акумуляції та активації як M1 Mϕ, так і Th1-клітин. Зниження рівня ILC2 супроводжується зменшенням пулів M2 Mϕ та еозинофілів. Як ключовий фактор транскрипції розвитку і функціонування ILC2 виступає GATA3. Популяція ILC3 представлена клітинами, що експресують фактор транскрипції RORγt і продукують IL-22. Популяція ILC3 відіграє дуальну роль: за рахунок продукції IL-22 перешкоджає процесу запалення, а за рахунок продукції IL-17 сприяє розвитку метазапалення. Таким чином, можна вважати, що популяція вроджених лімфоїдних клітин бере участь у тонкій регуляції функціонування ефекторних клітин імунної системи. При фізіологічному стані популяції ILC підтримує «стан спокою», а при розвитку ожиріння — механізми елімінації гіпертрофованих адипоцитів.
В литературном обзоре приведены современные представления о роли врожденных лимфоидных клеток в развитии метавоспаления жировой ткани при ожирении, которое в последнее время приобрело эпидемический характер, особенно в подростковой возрастной группе. В статье представлены данные по организации популяции врожденных лимфоидных клеток (ILC), которые по спектру своих субпопуляций представляют собой как бы врожденный клеточный аналог CD4+ T-лимфоцитов клеток, но не экспрессируют рецепторы антигена и не способны к клональной экспансии. Приведены основные типы ILC, а именно ILC1, представляющие собой аналог Th1-клеток, ILC2 — Th2-клеток, а ILC3 — Th17- и Th22-клеток, а также их основные функциональные свойства и структурные особенности. Развитие ожирения сопровождается увеличением представительства NK-клеток, ILC1 и снижением количества ILC2 в епидидимальной жировой ткани. Представленные данные свидетельствуют, что основной функцией группы ILC1 является высокий уровень экспрессии IFN-γ и TNF-α, что играет определяющую роль защиты против внутриклеточных патогенов, а использование специфических маркеров CD49a, CD127 (IL-7Rα) и Eomes позволяет отличить ILC1 от NK-клеток. В то же время относительно высокое содержание ILC2 в физиологической жировой ткани является необходимым клеточным механизмом, который поддерживает противовоспалительное состояние жировой ткани как органа с высоким содержанием провоспалительных молекулярных триггеров. Увеличение популяций NK-клеток и ILC1 способствует аккумуляции и активации как M1 Mϕ, так и Th1-клеток. Снижение уровня ILC2 сопровождается уменьшением пулов M2 Mϕ и эозинофилов. В качестве ключевого фактора транскрипции развития и функционирования ILC2 выступает GATA3. Популяция ILC3 представлена клетками, экспрессирующими фактор транскрипции RORγt и продуцирующими IL-22. Популяция ILC3 играет дуальную роль: за счет продукции IL-22 препятствует процессу воспаления, а за счет продукции IL-17 способствует развитию метавоспаления. Таким образом, можно считать, что популяция врожденных лимфоидных клеток участвует в тонкой регуляции функционирования эффекторных клеток иммунной системы. При физиологическом состоянии популяции ILC поддерживает «состояние покоя», а при развитии ожирения — механизмы элиминации гипертрофированных адипоцитов.
The literature review presents modern ideas about the role of innate lymphoid cells in the development of meta-inflammation of adipose tissue in obesity, which has recently become epidemic, especially in the adolescent group. The article presents the data on the organization of the population of innate lymphoid cells (ILC), which, according to the spectrum of their subpopulations, represent, as it were, an innate cellular analogue of CD4+ T-lymphocytes cells but do not express antigen receptors and are not capable of clonal expansion. The main types of ILCs are presented, namely ILC1, which are analogous to Th1 cells, ILC2 — Th2 cells, and ILC3 — Th17 and Th22 cells, as well as their main functional properties and structural features. The development of obesity is accompanied by an increase in the representation of NK cells, ILC1, and a decrease in the amount of ILC2 in the epididymal adipose tissue. The presented data indicate that the main function of the ILC1 group is a high level of expression of IFN-γ and TNF-α, which has a defining role of protection against intracellular pathogens, and the use of specific markers CD49a, CD127 (IL-7Rα), and Eomes makes it possible to distinguish ILC1 from NK cells. At the same time, the relatively high content of ILC2 in physiological adipose tissue is a necessary cellular mechanism that maintains the anti-inflammatory state of adipose tissue as an organ with a high content of pro-inflammatory molecular triggers. An increase in the populations of NK cells and ILC1 promotes the accumulation and activation of both M1 Mϕ and Th1 cells. The decrease in the ILC2 level is accompanied by a decrease in the M2 Mϕ and eosinophil pools. GATA3 acts as a key transcription factor for the development and functioning of ILC2. The ILC3 population is represented by cells expressing the transcription factor RORγt and producing IL-22. The ILC3 population plays a dual role: due to the production of IL-22, it prevents the process of inflammation, and due to the production of IL-17, it promotes the development of meta-inflammation. Thus, it can be assumed that the population of innate lymphoid cells is involved in the fine regulation of the functioning of the effector cells of the immune system. In the physiological state of the population, the ILC maintains a “state of rest”, and in the development of obesity, the mechanisms of elimination of hypertrophied adipocytes.
ожиріння; діти; метазапалення; жирова тканина; вроджені лімфоїдні клітини; огляд
ожирение; дети; метавоспаление; жировая ткань; врожденные лимфоидные клетки; обзор
obesity; children; meta-inflammation; adipose tissue; innate lymphoid cells; review
Скорочення
Вступ
1. Коротка характеристика популяції вроджених лімфоїдних клітин
2. Роль ILC1 в розвитку метазапалення жирової тканини
3. Роль ILC2 в розвитку метазапалення жирової тканини
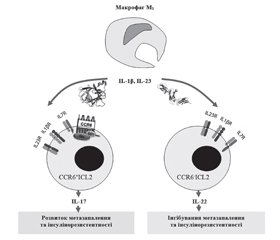
4. Роль ILC3 в розвитку метазапалення жирової тканини
Висновки
- Абатуров А.Е. Метаболический синдром у детей (лекция). Таврический медико-биологический вестник. 2007. 10. 57-65.
- Абатуров А.Е. Особенности метаболического синдрома у детей. Дитячий лікар. 2011. 4(11). 54-61.
- Al-Attar A., Presnell S.R., Clasey J.L. et al. Human Body Composition and Immunity: Visceral Adipose Tissue Produces IL-15 and Muscle Strength Inversely Correlates with NK Cell Function in Elderly Humans. Front. Immunol. 2018. 9. 440. Published 2018 Mar 6. doi: 10.3389/fimmu.2018.00440.
- Artis D., Spits H. The biology of innate lymphoid cells. Nature. 2015. 517(7534). 293-301. doi: 10.1038/nature14189.
- Bähr I., Spielmann J., Quandt D., Kielstein H. Obesity-Associated Alterations of Natural Killer Cells and Immunosurveillance of Cancer. Front. Immunol. 2020. 11. 245. Published 2020 Mar 13. doi: 10.3389/fimmu.2020.00245.
- Bénézech C., Jackson-Jones L.H. ILC2 Orchestration of Local Immune Function in Adipose Tissue. Front. Immunol. 2019. 10. 171. Published 2019 Feb 7. doi: 10.3389/fimmu.2019.00171.
- Beringer A., Miossec P. IL-17 and IL-17-producing cells and liver diseases, with focus on autoimmune liver diseases. Autoimmun. Rev. 2018. 17(12). 1176-1185. doi: 10.1016/j.autrev.2018.06.008.
- Biobaku F., Ghanim H., Batra M., Dandona P. Macronutrient-Mediated Inflammation and Oxidative Stress: Relevance to Insulin Resistance, Obesity, and Atherogenesis. J. Clin. Endocrinol. Metab. 2019. 104(12). 6118-6128. doi: 10.1210/jc.2018-01833.
- Björklund Å.K., Forkel M., Picelli S. et al. The heterogeneity of human CD127(+) innate lymphoid cells revealed by single-cell RNA sequencing. Nat. Immunol. 2016. 17(4). 451-460. doi: 10.1038/ni.3368.
- Bolus W.R., Hasty A.H. Contributions of innate type 2 inflammation to adipose function. J. Lipid Res. 2019. 60(10). 1698-1709. doi: 10.1194/jlr.R085993.
- Bonamichi B.D.S.F., Lee J. Unusual Suspects in the Development of Obesity-Induced Inflammation and Insulin Resistance: NK cells, iNKT cells, and ILCs. Diabetes Metab. J. 2017. 41(4). 229-250. doi: 10.4093/dmj.2017.41.4.229.
- Brestoff J.R., Kim B.S., Saenz S.A. et al. Group 2 innate lymphoid cells promote beiging of white adipose tissue and limit obesity. Nature. 2015. 519(7542). 242-246. doi: 10.1038/nature14115.
- Cayrol C., Girard J.P. Interleukin-33 (IL-33): A nuclear cytokine from the IL-1 family. Immunol. Rev. 2018. 281(1). 154-168. doi: 10.1111/imr.12619.
- Cella M., Fuchs A., Vermi W. et al. A human natural killer cell subset provides an innate source of IL-22 for mucosal immunity. Nature. 2009. 457(7230). 722-725. doi: 10.1038/nature07537.
- Cortez V.S., Colonna M. Diversity and function of group 1 innate lymphoid cells. Immunol. Lett. 2016. 179. 19-24. doi: 10.1016/j.imlet.2016.07.005.
- Cortez V.S., Robinette M.L., Colonna M. Innate lymphoid cells: new insights into function and development. Curr. Opin. Immunol. 2015. 32. 71-77. doi: 10.1016/j.coi.2015.01.004.
- Cua D.J., Tato C.M. Innate IL-17-producing cells: the sentinels of the immune system. Nat. Rev. Immunol. 2010. 10(7). 479-489. doi: 10.1038/nri2800.
- Dalmas E., Lehmann F.M., Dror E. et al. Interleukin-33-Activated Islet-Resident Innate Lymphoid Cells Promote Insulin Secretion through Myeloid Cell Retinoic Acid Production. Immunity. 2017. 47(5). 928-942. Е7. doi: 10.1016/j.immuni.2017.10.015.
- Eberl G., Colonna M., Di Santo J.P., McKenzie A.N. Innate lymphoid cells. Innate lymphoid cells: a new paradigm in immunology. Science. 2015. 348(6237). aaa6566. doi: 10.1126/science.aaa6566.
- Ebihara T., Taniuchi I. Transcription Factors in the Development and Function of Group 2 Innate Lymphoid Cells. Int. J. Mol. Sci. 2019. 20(6). 1377. Published 2019 Mar 19. doi: 10.3390/ijms20061377.
- Ebihara T. Dichotomous Regulation of Acquired Immunity by Innate Lymphoid Cells. Cells. 2020. 9(5). 1193. Published 2020 May 11. doi: 10.3390/cells9051193.
- Elemam N.M., Hannawi S., Maghazachi A.A. Innate Lymphoid Cells (ILCs) as Mediators of Inflammation, Release of Cytokines and Lytic Molecules. Toxins (Basel). 2017. 9(12). 398. Published 2017 Dec 10. doi: 10.3390/toxins9120398.
- Fox C.K., Gross A.C., Bomberg E.M. et al. Severe Obesity in the Pediatric Population: Current Concepts in Clinical Care. Curr. Obes. Rep. 2019. 8(3). 201-209. doi: 10.1007/s13679-019-00347-z.
- Fuchs A. ILC1s in Tissue Inflammation and Infection. Front. Immunol. 2016. 7. 104. Published 2016 Mar 22. doi: 10.3389/fimmu.2016.00104.
- Halim T.Y.F., Rana B.M.J., Walker J.A. et al. Tissue-Restricted Adaptive Type 2 Immunity Is Orchestrated by Expression of the Costimulatory Molecule OX40L on Group 2 Innate Lymphoid Cells. Immunity. 2018. 48(6). 1195-1207. Е6. doi: 10.1016/j.immuni.2018.05.003.
- Kabata H., Moro K., Koyasu S. The group 2 innate lymphoid cell (ILC2) regulatory network and its underlying mechanisms. Immunol. Rev. 2018. 286(1). 37-52. doi: 10.1111/imr.12706.
- Kim H.Y., Lee H.J., Chang Y.J. et al. Interleukin-17-producing innate lymphoid cells and the NLRP3 inflammasome facilitate obesity-associated airway hyperreactivity. Nat. Med. 2014. 20(1). 54-61. doi: 10.1038/nm.3423.
- Lee B.C., Kim M.S., Pae M. et al. Adipose Natural Killer Cells Regulate Adipose Tissue Macrophages to Promote Insulin Resistance in Obesity. Cell Metab. 2016. 23(4). 685-698. doi: 10.1016/j.cmet.2016.03.002.
- Lee M.W., Odegaard J.I., Mukundan L. et al. Activated type 2 innate lymphoid cells regulate beige fat biogenesis. Cell. 2015. 160(1–2). 74-87. doi: 10.1016/j.cell.2014.12.011.
- Lim A.I., Menegatti S., Bustamante J. et al. IL-12 drives functional plasticity of human group 2 innate lymphoid cells. J. Exp. Med. 2016. 213(4). 569-583. doi: 10.1084/jem.20151750.
- Lynch L.A., O’Connell J.M., Kwasnik A.K., Cawood T.J., O’Farrelly C., O’Shea D.B. Are natural killer cells protecting the metabolically healthy obese patient? Obesity (Silver Spring). 2009. 17(3). 601-605. doi: 10.1038/oby.2008.565.
- McNelis J.C., Olefsky J.M. Macrophages, immunity, and metabolic disease. Immunity. 2014. 41(1). 36-48. doi: 10.1016/j.immuni.2014.05.010.
- Mjösberg J., Spits H. Human innate lymphoid cells. J. Allergy Clin. Immunol. 2016. 138(5). 1265-1276. doi: 10.1016/j.jaci.2016.09.009.
- Molofsky A.B., Nussbaum J.C., Liang H.E. et al. Innate lymphoid type 2 cells sustain visceral adipose tissue eosinophils and alternatively activated macrophages. J. Exp. Med. 2013. 210(3). 535-549. doi: 10.1084/jem.20121964.
- Molofsky A.B., Van Gool F., Liang H.E. et al. Interleukin-33 and Interferon-γ Counter-Regulate Group 2 Innate Lymphoid Cell Activation during Immune Perturbation. Immunity. 2015. 43(1). 161-174. doi: 10.1016/j.immuni.2015.05.019.
- Ogden C.L., Carroll M.D., Kit B.K., Flegal K.M. Prevalence of childhood and adult obesity in the United States, 2011–2012. JAMA. 2014. 311(8). 806-814. doi: 10.1001/jama.2014.732.
- O’Rourke R.W., Meyer K.A., Neeley C.K. et al. Systemic NK cell ablation attenuates intra-abdominal adipose tissue macrophage infiltration in murine obesity. Obesity (Silver Spring). 2014. 22(10). 2109-2114. doi: 10.1002/oby.20823.
- O’Shea D., Hogan A.E. Dysregulation of Natural Killer Cells in Obesity. Cancers (Basel). 2019. 11(4). 573. Published 2019 Apr 23. doi: 10.3390/cancers11040573.
- O’Sullivan T.E., Rapp M., Fan X. et al. Adipose-Resident Group 1 Innate Lymphoid Cells Promote Obesity-Associated Insulin Resistance. Immunity. 2016. 45(2). 428-441. doi: 10.1016/j.immuni.2016.06.016.
- O’Sullivan T.E., Sun J.C., Lanier L.L. Natural Killer Cell Memory. Immunity. 2015. 43(4). 634-645. doi: 10.1016/j.immuni.2015.09.013.
- Papotto P.H., Ribot J.C., Silva-Santos B. IL-17+ γδ T cells as kick-starters of inflammation. Nat. Immunol. 2017. 18(6). 604-611. doi: 10.1038/ni.3726.
- Price A.E., Liang H.E., Sullivan B.M. et al. Systemically dispersed innate IL-13-expressing cells in type 2 immunity. Proc. Natl. Acad. Sci. USA. 2010. 107(25). 11489-11494. doi: 10.1073/pnas.1003988107.
- Rolot M., O’Sullivan T.E. Living with Yourself: Innate Lymphoid Cell Immunometabolism. Cells. 2020. 9(2). 334. Published 2020 Feb 1. doi: 10.3390/cells9020334.
- Ruiz-Sánchez B.P., Cruz-Zárate D., Estrada-García I., Wong-Baeza I. Las células linfoides innatas y su papel en la regulación de la respuesta inmune [Innate lymphoid cells and their role in immune response regulation]. Rev. Alerg. Mex. 2017. 64(3). 347-363. doi: 10.29262/ram.v64i3.284.
- Ryder J.R., Fox C.K., Kelly A.S. Treatment Options for Severe Obesity in the Pediatric Population: Current Limitations and Future Opportunities. Obesity (Silver Spring). 2018. 26(6). 951-960. doi: 10.1002/oby.22196.
- Sasaki T., Moro K., Kubota T. et al. Innate Lymphoid Cells in the Induction of Obesity. Cell Rep. 2019. 28(1). 202-217. Е7. doi: 10.1016/j.celrep.2019.06.016.
- Satoh-Takayama N. Heterogeneity and diversity of group 3 innate lymphoid cells: new cells on the block. Int. Immunol. 2016. 28(1). 29-34. doi: 10.1093/intimm/dxv054.
- Sonnenberg G.F., Hepworth M.R. Functional interactions between innate lymphoid cells and adaptive immunity. Nat. Rev. Immunol. 2019. 19(10). 599-613. doi: 10.1038/s41577-019-0194-8.
- Spits H., Artis D., Colonna M. et al. Innate lymphoid cells — a proposal for uniform nomenclature. Nat. Rev. Immunol. 2013. 13(2). 145-149. doi: 10.1038/nri3365.
- Tait Wojno E.D., Artis D. Emerging concepts and future challenges in innate lymphoid cell biology. J. Exp. Med. 2016. 213(11). 2229-2248. doi: 10.1084/jem.20160525.
- Theurich S., Tsaousidou E., Hanssen R. et al. IL-6/Stat3-Dependent Induction of a Distinct, Obesity-Associated NK Cell Subpopulation Deteriorates Energy and Glucose Homeostasis. Cell Metab. 2017. 26(1). 171-184. Е6. doi: 10.1016/j.cmet.2017.05.018.
- Valeri M., Raffatellu M. Cytokines IL-17 and IL-22 in the host response to infection. Pathog. Dis. 2016. 74(9). ftw111. doi: 10.1093/femspd/ftw111.
- Vivier E., Artis D., Colonna M. et al. Innate Lymphoid Cells: 10 Years On. Cell. 2018. 174(5). 1054-1066. doi: 10.1016/j.cell.2018.07.017.
- Wang X., Ota N., Manzanillo P. et al. Interleukin-22 alleviates metabolic disorders and restores mucosal immunity in diabetes. Nature. 2014. 514(7521). 237-241. doi: 10.1038/nature13564.
- Wasinski F., Bacurau R.F., Moraes M.R. et al. Exercise and caloric restriction alter the immune system of mice submitted to a high-fat diet. Mediators Inflamm. 2013. 2013. 395672. doi: 10.1155/2013/395672.
- Wensveen F.M., Jelenčić V., Valentić S. et al. NK cells link obesity-induced adipose stress to inflammation and insulin resistance. Nat. Immunol. 2015. 16(4). 376-385. doi: 10.1038/ni.3120.

/81.jpg)
/83.jpg)
/84.jpg)
/85.jpg)
/86_2.jpg)
/86.jpg)