Вступ
Науковою групою міжнародних експертів «Глобальна ініціатива боротьби з астмою» (Global Strategy for Asthma Management and Prevention, GINA) на підставі останніх публікацій і результатів досліджень виділено п’ять фенотипів бронхіальної астми (БА): алергічна, неалергічна, БА з пізнім дебютом, БА з фіксованою обструкцією дихальних шляхів, БА у хворих з ожирінням (Ож) [1].
Щодо ведення хворих із коморбідністю БА-Ож у матеріалах GINA-2020 зазначено, що кортикостероїди залишаються основними терапевтичними препаратами (рівень доказовості В), хоча відповідь на лікування у таких пацієнтів ослаблена. В Європі лише 15 % пацієнтів, які отримують терапію БА стероїдами, досягають належного контролю за захворюванням [2].
Науковими дослідженнями доведене зменшення ефективності базисної протиастматичної терапії при БА з Ож інгаляційними глюкокортикостероїдами (ІГКС) [3] та їх комбінацією з β2-агоністами тривалої дії (БАТД) та теофілінами [4], і його пов’язують з наявністю додаткового неатопічного системного запалення, підтримуваного активними речовинами, які виробляє жирова тканина [5].
Ож та надлишкова маса тіла (НМТ) згубно впливають на роботу легень, проте конкретні закономірності такого впливу відрізняються у дітей та дорослих. Встановлена принципова відмінність перебігу Ож у дорослих і дітей: якщо для дорослих ступінь Ож визначається гіпертрофією адипоцитів при відносно постійній їх кількості, то для дітей до 12 років адипоцити ще здатні до поділу, і збільшення обсягу жирової тканини, крім гіпертрофії, доповнюється ще і за рахунок гіперплазії адипоцитів (майже подвійне збільшення їх кількості при Ож) [6].
При Ож гіпертрофовані адипоцити синтезують і виділяють прозапальні цитокіни, серед яких лептин, який відіграє суттєву роль в проліферації і диференціації макрофагів, подальшій секреції прозапальних цитокінів. У хворих на БА у поєднанні з НМТ та Ож лептин провокує активний синтез потужних бронхоконстрикторів — цистеїнових лейкотрієнів [7]. Низкою досліджень продемонстровано, що реактивність дихальних шляхів суттєво пов’язана з експресією лептину у вісцеральному жирі, і лептин може бути важливим медіатором захворювання дихальних шляхів при Ож не тільки через підсилення запалення дихальних шляхів, але й через прямий вплив на дихальні шляхи [8]. Тому слід при оцінці ефективності терапії БА в осіб з Ож враховувати рівень сироваткового лептину.
Специфіка впливу Ож на стан дихальних шляхів у дітей полягає в тому, що дитячий організм перебуває у процесі росту і розвитку. Однією із ознак розвитку, що можуть мати вплив на погіршення контролю БА, є дисанапсис дихальних шляхів у дітей з НМТ та Ож (невідповідність росту паренхіми легень і калібру дихальних шляхів). Більше того, дослідження цих особливостей підтвердили, що дисанапсис дихальних шляхів асоціювався із зменшенням реакції на БАТД та ІГКС [9]. Для таких дітей основні показники спірометрії, що відображають стан дихальних шляхів при БА, — це нормальний або високий рівень форсованої життєвої ємності легень (ФЖЄЛ), нормальний рівень обсягу форсованого видиху за першу секунду (ОФВ1), знижений менше за 0,9 рівень індексу Тіффно (співвідношення показників ОФВ1/ФЖЄЛ) [10]. У дорослих з поєднаним перебігом БА та Ож про погіршення контролю БА свідчить стабільне зниження всіх трьох зазначених показників. Тому спірометрія не є досить чутливим інструментом для оцінки контрольованості та ефективності терапії БА для дітей з НМТ та Ож, на відміну від переконливості застосування цього методу дослідження у дорослих з подібним поєднаним перебігом захворювань [11].
Оскільки контрольованість БА у поєднанні з Ож при терапії ІГКС, комбінації ІГКС з БАТД чи ІГКС з теофілінами знижена, досягнення її потребує підвищення дози препаратів. Більшість ліків, що призначаються дітям із Ож, призводять до субтерапевтичних або надтерапевтичних концентрацій, що створює для цих дітей ризик невдалого лікування, токсичності лікарських засобів і розвитку несприятливих побічних ефектів [12]. Сам факт залежності пацієнта від препаратів невідкладної допомоги істотно знижує якість його життя. Окрім цього, терапія високими дозами ГКС (насамперед системними) може призводити до девіації запалення в бік нейтрофільного типу, бо вони здатні гальмувати апоптоз нейтрофілів [13].
Згідно з останніми переглядами міжнародних рекомендацій GINA (2015–2020), антилейкотрієнові препарати (АЛТП) розглядають як другу лінію терапії як альтернативу ІГКС при лікуванні легкої персистуючої астми і як компонент базисної протизапальної терапії (для доповнення до ІГКС) персистуючої середньотяжкої астми. В Україні дозволений до використання єдиний препарат з групи АЛТП — монтелукаст [14]. У поєднанні з ІГКС антилейкотрієновий препарат дозволяє знижувати дозу ГКС і контролювати перебіг хвороби у пацієнтів з середніми і тяжкими формами БА [15].
Вибір варіанта базисної терапії має бути обґрунтованим лікарем, забезпечуючи прагматичний ризик-орієнтований підхід до діагностики та ведення досліджуваної категорії пацієнтів (при поєднанні БА з НМТ та Ож) і зважаючи на оцінку ефективності лікування та можливих ризиків.
Аналіз існуючих досліджень показав відмінності у базисній терапії БА кроку 2 у дорослих, пов’язані з масою тіла пацієнта. Було продемонстровано позитивний клінічний ефект від застосування АЛТП порівняно з беклометазоном у лікуванні пацієнтів з БА та Ож [16]. Виявлено, що лікувальний ефект низьких доз ІГКС зменшувався при збільшенні індексу маси тіла (ІМТ), в той час як вплив АЛТП на кількість астма-контрольованих днів залишався незмінним у різних вагових категоріях пацієнтів. У пацієнтів з НМТ частіше спостерігалось зменшення відповіді на монотерапію IГКС за рівнем видихуваного оксиду азоту порівняно з пацієнтами з нормальною масою тіла, в той час як ефективність АЛТП зберігалась [17].
Результати дослідження щодо аналізу ефективності лікування БА у дорослих осіб з неконтрольованою БА середнього ступеня тяжкості, поєднаної з Ож, показали, що використання антилейкотрієнового препарату як додаткового засобу до комбінації флутиказону пропіонату і формотеролу призводить до поліпшення контролю БА, загального стану хворих, зменшення потреби в препаратах швидкої допомоги і поліпшення основних показників функції зовнішнього дихання в осіб, які мають Ож [18].
Дослідження щодо порівняння ефективності варіантів базисної медикаментозної терапії дітей з середньотяжкою БА у поєднанні з НМТ та Ож вкрай обмежені.
С. Longo еt al. (2019) був виявлений зв’язок між масою тіла і відповіддю на лікування БА у дітей, які отримували монотерапію БА в об’ємі кроку 2. Тоді як для дітей з ІМТ ≤ 80-го перцентиля низькі дози IГКС виявилися більш ефективними, ніж АЛТП, монотерапія IГКС чи монотерапія АЛТП була однаково ефективна в лікуванні дітей з ІМТ > 80-го перцентиля. Отже, АЛТП мали кращий ефект при вищих значеннях ІМТ у дітей. Дослідники пропонують розглядати АЛТП у пацієнтів з астмою та НМТ якщо не як першу лінію терапії кроку 2, то принаймні як альтернативну терапію у пацієнтів, які мають субоптимальну відповідь на ІГКС, перед переведенням їх на наступний крок (step-uр) лікування астми. Проте, враховуючи обмеження цього ретроспективного когортного дослідження, автори вказують на необхідність подальших проспективних досліджень [19].
АЛТ-препарат має імуномодулюючі та протизапальні властивості, впливаючи саме на лейкотрієновий механізм розвитку запалення, який ІГКС не можуть повністю здолати. Серед переваг застосування антилейкотрієнового препарату порівняно з ІГКС — зручність і легкість у використанні (можливість перорального прийому), що позитивно впливає на комплаєнс, а також найбільший профіль безпеки серед препаратів базисної терапії БА на сьогодні [18]. При оцінці переносимості антилейкотрієнового препарату дітьми віком 6–11 років за період активного лікування і катамнестичного спостереження відзначалась добра переносимість у 90 % дітей, задовільна — у 10 % [15].
Ми вважаємо за доцільне вивчити ефективність застосування цього засобу в комплексній терапії хворих на БА дітей з НМТ та Ож.
Метою дослідження є порівняння ефективності двох схем базисної терапії БА для дітей з НМТ та Ож — схеми використання середніх доз ІГКС та схеми використання комбінації низьких доз ІГКС з антилейкотрієновим препаратом.
Матеріали та методи
Проведено дослідження 64 хворих на БА дітей віком від 6 до 18 років, які перебували на стаціонарному лікуванні на базі алергологічного відділення Київської міської дитячої клінічної лікарні № 2. Батьками (законними представниками) дітей була підписана інформована згода на участь в дослідженні.
Діагноз верифікували згідно з Наказом МОЗ України № 868 від 08.10.2013 р. та рекомендаціями Глобальної стратегії лікування та профілактики БА GINA.
Серед обстежених дітей було 45 дітей з НМТ (ІМТ становив від 85-го до 95-го перцентиля відповідно до віку і статі) та 19 дітей з Ож (ІМТ більше 95-го перцентиля відповідно до віку і статі).
З метою порівняння ефективності двох схем базисної терапії бронхіальної астми у дітей з НМТ та Ож діти були розподілені на 2 терапевтичні групи методом випадкової вибірки. До І групи (27 дітей) увійшло 19 хлопчиків (70,4 %) та 8 дівчаток (29,6 %), до ІІ групи (37 дітей) — 30 хлопчиків (81,1 %) та 7 дівчаток (18,9 %). Різниця між групами за статтю статистично незначуща (p = 0,48). Медіана віку Ме [QI; QIII] у І групі становила 12 [9; 14,5] років, у ІІ групі — 12 [9; 15] років. Отже, за віком і статтю діти І та ІІ груп були порівнянними.
Діти І групи отримували комбінацію АЛТ-препарату з низькими дозами ІГКС протягом 3 місяців. Доза АЛТ-препарату призначалась відповідно до віку дитини. Дітям віком від 6 до 14 років призначали АЛТ-препарат у формі жувальних таблеток у дозі 5 мг (1 жувальна таблетка) на добу (на ніч, після їжі). Дітям віком від 15 років призначали АЛТ-препарат у формі таблеток, вкритих плівковою оболонкою, у дозі 10 мг (1 таблетка) на добу, незалежно від прийому їжі. Діти ІІ групи отримували середні дози ІГКС протягом 3 місяців. Усім дітям були надані рекомендації відносно модифікації способу життя — гіпокалорійна дієта та дозовані фізичні навантаження.
Контрольне обстеження дітей І та ІІ груп проводили через 3 місяці від початку призначення базисної терапії. Клінічну ефективність терапії оцінювали за такими критеріями: контроль клінічних симптомів БА, дані спірометрії, рівень лептину сироватки крові, контроль за перебігом БА за астма-контроль тестом (АСТ), показники якості життя (ЯЖ) дітей.
Згідно з рекомендаціями GINA-2020, аналіз контрольованості здійснювали за кількістю клінічних проявів захворювання впродовж останніх чотирьох тижнів, а саме: наявність денних симптомів БА (напади ядухи частіше двох разів на тиждень), нічних пробуджень через БА, потреба в бронхолітичних препаратах (частіше двох разів на тиждень, за винятком випадків застосування їх перед фізичним навантаженням), наявність будь-яких обмежень активності через БА. Якщо пацієнт відповідає негативно на всі питання, йдеться про добре контрольовану БА. При одній-двох позитивних відповідях з переліку говорять про частково контрольовану БА. За наявності трьох-чотирьох позитивних відповідей з переліку має місце неконтрольований перебіг захворювання.
Стан функції зовнішнього дихання оцінювали на підставі аналізу кривої форсованого видиху, що зареєстрована на комп’ютерному спірографі BTL-08 Spiro Pro (Велика Британія). Оцінювали форсовану життєву ємність легень та об’єм форсованого видиху за першу секунду. Оскільки зниження значення показника ОФВ1 входить до потенційно модифікованих незалежних факторів ризику розвитку загострень БА, відстежували динаміку показників ОФВ1 та ФЖЄЛ на початку терапії та через 3 місяці контролюючої терапії. Норми показників для контрольованої БА у дітей, згідно з рекомендаціями GINA-2020, для ФЖЄЛ та ОФВ1 — не менше 80 % від належного, індекс Тіффно (ОФВ1/ФЖЄЛ) — не менше за 0,9.
Суб’єктивну оцінку перебігу БА визначали шляхом анкетування за опитувальником АСТ до та після призначеного курсу терапії. Наявність не менш ніж 20 балів за опитувальником дозволяє верифікувати контрольовану БА, при сумі балів у межах 16–19 — частково контрольовану БА, наявність менше 15 балів свідчить про відсутність контролю над захворюванням.
Лептин сироватки крові визначали методом твердофазового ферментозв’язаного імуносорбентного аналізу (ELISA) з використанням реактивів «DRG Лептин ELISA» (DRG, Німеччина) на імуноферментному аналізаторі Tecan Sunrise (Австрія) та Stat Fax 1904. За відсутності загальноприйнятих норм показників лептину визначення норми базується на даних щодо цього показника у дітей з БА без ознак НМТ, а саме 8,7 нг/мл [20].
Для оцінки ЯЖ було використано спеціалізований опитувальник PAQLQ (Pediatric Asthma Quality of life Questionnaire), розроблений для дітей з БА віком від 7 до 17 років [21], що перекладений і лінгвістично підтверджений Науково-дослідним інститутом у Ліоні, Франція (MAPI Research Institute), багатьма мовами, у тому числі українською [22]. Вищий бал за опитувальником свідчить про кращий рівень ЯЖ. Для оцінки клінічної значущості при порівнянні середніх значень показників опитувальника приймалось мінімальне значення різниці 0,5 (згідно з рекомендаціями розробників РAQLQ) [23].
Отримані дані аналізували методами біостатистики та клінічної епідеміології. Для аналізу нормальності розподілу даних застосовували критерій Шапіро — Уїлка. Оскільки розподіл більшості досліджуваних ознак відрізнявся від нормального, застосовували непараметричні методи статистики. Для оцінки зв’язку між ознаками застосовувався коефіцієнт рангової кореляції Спірмена. Різницю між порівнюваними величинами вважали статистично значущою на рівні р < 0,05.
Кількісні дані наведені як медіана та квартилі [перший; третій]. Для порівняння кількісних даних двох вибірок між собою використовували непараметричний критерій Вілкоксона для пов’язаних вибірок (дані до та після лікування для кожної з терапевтичних груп) та U-критерій Манна — Уїтні для непов’язаних вибірок (порівняння ефективності двох схем лікування — дані різних терапевтичних груп).
Категорійні змінні узагальнені за частотою кожного із значень та відсотками. При порівнянні якісної змінної у двох групах використовували точний критерій Фішера для непов’язаних вибірок та критерій Макнемара для пов’язаних вибірок (з урахуванням поправки Йєйтса). Кількісна оцінка клінічного ефекту проводилась з визначенням зростання абсолютного (ЗАР) та відносного (ВР) ризику досягнення ефективного контролю БА при порівнянні результатів дослідження, отриманих у дослідній (І) та контрольній (ІІ) групах з урахуванням мінімальної кількості хворих (МКХ), яких слід пролікувати для отримання хоча б одного позитивного результату.
Статистичну обробку отриманих даних проводили за допомогою статистичного пакета IBM SPSS Statistics Base (версія 22) та програмного забезпечення EZR, версія 1.32 (графічний інтерфейс середовища R (версія 2.13.0)) [24].
Дослідження проводилось відповідно до основних положень Гельсінської декларації щодо етичних засад медичних досліджень, що стосуються людських суб’єктів [25].
Результати та обговорення
Результати аналізу клінічних симптомів БА за кількістю проявів по кожній з досліджуваних терапевтичних груп (Ме [QI; QIII]) впродовж останнього місяця до лікування та впродовж останнього місяця після лікування наведені у табл. 1.
При проведенні аналізу було виявлено, що до лікування кількісні показники клінічних симптомів (Ме [QI; QIII]) кожної з груп статистично вірогідно не відрізнялись між собою (p > 0,05), отже, групи до лікування є порівнянними за цими показниками.
Після тримісячної терапії спостерігався позитивний ефект щодо контролю клінічних симптомів в обох терапевтичних групах: значення показників знижувались під впливом терапії статистично вірогідно за критерієм Вілкоксона (p < 0,001) як за першою схемою базисної терапії, так і за другою.
Проте результат попарних порівнянь груп між собою після лікування, наведений на рис. 1, виявив статистично значущу за U-критерієм Манна — Уїтні (p < 0,05) різницю результатів позитивного впливу лікування на користь схеми базисної терапії БА з використанням комбінації низьких доз ІГКС з АЛТП щодо зменшення денних, нічних симптомів та застосування бронхолітичних препаратів за потребою.
Оцінюючи, окрім статистичного, ефект клінічний (за критеріями, визначеними рекомендаціями GINA-2020 щодо аналізу рівня контрольованості БА за клінічними симптомами), слід зазначити, що показники після лікування демонструють у І терапевтичній групі: зменшення кількості денних симптомів БА та потреби у бронхолітиках до рівня не частіше двох разів на тиждень, нічних пробуджень через БА та будь-яких обмежень активності через БА до нульового рівня (в середньому за тиждень), що свідчить про досягнення повного контролю над захворюванням. У ІІ терапевтичній групі результати після тримісячної терапії щодо денних, нічних симптомів та обмеження активності свідчать про середній рівень контролю БА.
/55.jpg)
З метою оцінки функції зовнішнього дихання (ФЗД) у динаміці всім 64 хворим була виконана спірометрія, результати її наведені у табл. 2, де n — кількість дітей у групі, в яких був присутній відповідний рівень показника, (% ± m %) — абсолютна частота присутності відповідного рівня показника у групі (%) та стандартна похибка частоти (± m %).
Слід зазначити, що основні показники до лікування по досліджуваних групах статистично вірогідно не відрізнялись за критерієм Фішера (p > 0,05), отже, групи є порівнянними за показниками легеневої функції.
Результати оцінки динаміки показників ФЗД свідчать про те, що під впливом терапії за схемою 1 кількість дітей у групі I з порушенням вентиляційної функції легень статистично вірогідно зменшилась за критерієм Макнемара (p < 0,05), що говорить про позитивну клінічну динаміку показників ФЗД у цій групі. У групі II позитивні зрушення не були статистично значущими. Проте, за результатом попарних порівнянь груп після лікування за критерієм Фішера, вірогідної різниці між показниками вентиляційної функції легень хворих обох груп не було (р > 0,05). Порівнюючи ефективність двох схем лікування за показниками функції зовнішнього дихання, слід брати до уваги дослідження щодо зниження чутливості та специфічності результатів спірометрії для оцінки легеневої функції дітей з БА та НМТ і Ож [11].
Як вже зазначалось, лептин є суттєвим для досліджуваного фенотипу БА біомаркером запалення [8], тому за доцільне вирішено було провести кореляційний аналіз зв’язку показників рівня сироваткового лептину та рівня контрольованості БА за балами АСТ до лікування для всіх 64 хворих (рис. 2). Виявлено наявність негативного середнього кореляційного зв’язку досліджуваних ознак, коефіцієнт рангової кореляції Спірмена –0,642, p < 0,05.
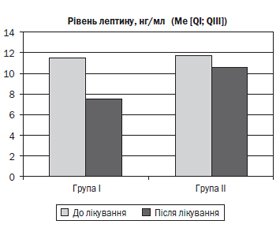
Результати аналізу оцінки динаміки рівня сироваткового лептину до та після лікування по терапевтичних групах наведені на рис. 3.
При проведенні аналізу було встановлено, що до лікування рівень лептину у групах статистично вірогідно не відрізнявся (p > 0,05), отже, групи до лікування є порівнянними за рівнем лептину.
Під впливом терапії рівень лептину (Ме [QI; QIII]) знизився статистично вірогідно за критерієм Вілкоксона (p < 0,001) як за першою схемою базисної терапії (з 11,5 [10,1; 21] нг/мл до 7,5 [5,4; 13,3] нг/мл), так і за другою (з 11,7 [7,9; 19,1] нг/мл до 10,8 [7,3; 19] нг/мл). Проте результат попарних порівнянь груп між собою за U-критерієм Манна — Уїтні після лікування виявив статистично значущу (p < 0,05) різницю результатів на користь схеми базисної терапії БА з використанням комбінації низьких доз ІГКС з АЛТП (терапевтична група І).
Таким чином, більш виражена позитивна динаміка рівня сироваткового лептину у ході лікування за схемою 1, корелюючи з підвищенням контрольованості БА, є додатковим важелем на користь більш високої клінічної ефективності саме цієї схеми терапії.
При проведенні аналізу ЯЖ пацієнтів за опитувальником PAQLQ було встановлено, що до лікування рівень середніх значень показників (Ме [QI; QIII]) за U-критерієм Манна — Уїтні по групах статистично вірогідно не відрізнявся по жодній із шкал (p > 0,05), отже, групи І та ІІ до лікування є порівнянними за рівнем ЯЖ.
Результати аналізу, наведені у табл. 3, свідчать, що після проведеної терапії за схемою 1 у дітей І групи було виявлене статистично вірогідне за критерієм Вілкоксона (p < 0,001) покращення середніх значень показників ЯЖ за всіма оціночними шкалами, поріг мінімальної клінічної значущості, рівний 0,5, перевищено за шкалами оцінки «Активність», «Симптоми» та «Загальний показник ЯЖ», тому отримані нами результати говорять про те, що покращення показників ЯЖ у цій терапевтичній групі є не тільки статистично, але і клінічно значущим. Щодо дітей ІІ групи, хоч і спостерігались деякі покращення показників ЯЖ, вони не були статистично значущі за критерієм Вілкоксона (p > 0,001).
/57_2.jpg)
Порівнюючи ефективність двох базисних схем терапії БА для дітей з НМТ та Ож, ми виявили, що використання комбінації низьких доз ІГКС з АЛТП призвело до статистично значущого за U-критерієм Манна — Уїтні (p < 0,05) покращення показників ЯЖ за всіма оціночними шкалами PAQLQ порівняно з використанням середніх доз ІГКС. Разом з цим за шкалами «Активність» і «Симптоми» відмінність була, крім статистично значущої, також і клінічно значущою (виходячи з критерію, визначеного розробниками PAQLQ [23]).
Результати аналізу суб’єктивних оцінок хворими рівня контрольованості БА за опитувальником АСТ у досліджуваних групах наведені у табл. 4, де n — кількість дітей у групі, які досягли відповідного рівня контролю БА, (% ± m %) — абсолютна частота присутності відповідного рівня контролю в групі (%) та стандартна похибка частоти (± m %).
За результатами аналізу було виявлено, що до лікування частота контрольованої БА, частково контрольованої БА та неконтрольованої БА між групами статистично вірогідно не відрізнялась (p > 0,05), отже, групи до лікування є порівнянними за рівнем контрольованості БА.
Як видно з табл. 4, схема 1 базисної терапії БА з використанням комбінації низьких доз ІГКС з АЛТП (група І) призводить до статистично вірогідного покращення контрольованості БА (за критерієм Макнемара (з урахуванням поправки Йєйтса)): частота контрольованої БА зросла від 22,2 ± 7,8 до 55,6 ± 9,6 (p = 0,008), а неконтрольованої — зменшилась від 51,9 ± 9,6 до 11,1 ± 6,1 (p = 0,003). При призначенні схеми 2 базисного лікування БА середніми дозами ІГКС (група ІІ) спостерігались позитивні зміни щодо контролю БА, проте статистично вірогідного покращення в групі не відбулося (p > 0,05 при порівнянні частот до та після лікування).
/58.jpg)
Для аналізу кількісної оцінки ефективності схеми лікування групи I порівняно із схемою лікування групи II (критичний рівень значимості 0,05) розрахована інтервальна оцінка абсолютних ризиків досягнення рівня повного контролю БА по кожній групі, яка для хворих групи I становила 55,6 % (95% ВІ 35,3 ÷ 74,5 %), а для хворих групи II — 27 % (95% ВІ 13,8 ÷ 44,1 %). Показник ЗАР –28,5 % (95% ВІ –52,1 ÷ –4,9 %) підтверджує більш значний клінічний ефект в досягненні повного контролю БА при лікуванні за схемою 1, причому на генеральній сукупності підвищення контрольованості становить не менше за 4,9 %.
Показник ВР 2,06 (95% ВІ 1,1 ÷ 3,9) вказує на збільшення при застосуванні схеми терапії 1 в середньому у 2 рази ризику досягнення повністю контрольованої БА порівняно із застосуванням схеми 2 (p = 0,037). МКХ = 4, тобто при терапії БА у дітей з НМТ за схемою з використанням комбінації низьких доз ІГКС з АЛТП у середньому в одному випадку з чотирьох ефект буде кращим, ніж за схемою терапії середніми дозами ІГКС.
Висновки
1. Використання комбінації низьких доз ІГКС та АЛТП у дітей з поєднанням БА і НМТ та Ож призводить до статистично значимого покращення: контролю БА за рахунок зменшення кількості денних, нічних симптомів та потреби в препаратах швидкої допомоги; показників функції зовнішнього дихання; показників якості життя дітей за опитувальником PAQLQ; контрольованості захворювання за результатами астма-контроль тесту; рівня прозапального адипокіну лептину в сироватці крові (а саме його зниження).
2. Порівняння ефективності вибору однієї з двох схем базисної терапії (комбінації низьких доз ІГКС та АЛТП чи підвищення доз ІГКС до середніх) для дітей з поєднанням БА і НМТ та Ож виявило статистично та клінічно значущу різницю результатів позитивного впливу лікування на користь комбінації низьких доз ІГКС та АЛТП.
3. Отримані результати дозволяють рекомендувати схему базисної терапії із застосуванням комбінації низьких доз ІГКС та АЛТП при частково контрольованій персистуючій БА у дітей з НМТ та Ож.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Список литературы
1. [GINA 2020]. GINA 2020. (online) [download: September 2020]. https://ginasthma.org/wp-content/uploads/2020/04/GINA-2020-full-report_-final-_wms.pdf.
2. Gallucci M., Carbonara P., Pacilli A.M.G, di Palmo E., Ricci G., Nava S. Use of Symptoms Scores, Spirometry, and Other Pulmonary Function Testing for Asthma Monitoring. Front. Pediatr. 2019. 7. 54. Published 2019 Mar 5. doi: 10.3389/fped.2019.00054.
3. Forno E., Celedón J.C. The effect of obesity, weight gain, and weight loss on asthma inception and control. Curr. Opin. Allergy Clin. Immunol. 2017. 17(2). 123-130. doi: 10.1097/ACI.0000000000000339.
4. McGarry M.E., Castellanos E., Thakur N. et al. Obesity and bronchodilator response in black and Hispanic children and adolescents with asthma. Chest. 2015. 147(6). 1591-1598. doi: 10.1378/chest.14-2689.
5. Vijayakanthi N., Greally J.M., Rastogi D. Pediatric Obesity-Related Asthma: The Role of Metabolic Dysregulation. Pediatrics. 2016. 137(5). Е20150812. doi: 10.1542/peds.2015-0812.
6. Landgraf K., Rockstroh D., Wagner I.V. et al. Evidence of early alterations in adipose tissue biology and function and its association with obesity-related inflammation and insulin resistance in children. Diabetes. 2015. 64(4). 1249-1261. doi: 10.2337/db14-0744.
7. Приступа Л.Н., Фадеева А.А. Исследование провоспалительного действия лептина при ассоциации бронхиальной астмы и висцерального ожирения. Курский научно-практический вестник «Человек и его здоровье». 2012. 1. 112-117.
8. Sideleva O., Suratt B.T., Black K.E., Tharp W.G., Pratley R.E., Forgione P., Dienz O., Irvin C.G., Dixon A.E. Obesity and asthma: an inflammatory disease of adipose tissue not the airway. Am. J. Respir. Crit. Care Med. 2012. 186(7). 598-605. doi: 10.1164/rccm.201203-0573OC.
9. Forno E., Weiner D.J., Mullen J. et al. Obesity and Airway Dysanapsis in Children with and without Asthma. Am. J. Respir. Crit. Care Med. 2017. 195(3). 314-323. doi: 10.1164/rccm.201605-1039OC.
10. Yao T.-C., Tsai H.-J., Chang S.-W., Chung R.-H., Hsu J.-Y., Tsai M.-H. et al. Obesity disproportionately impacts lung volumes, airflow and exhaled nitric oxide in children. PLoS ONE. 2017. 12(4). Е0174691. doi: 10.1371/journal.
11. Jones M.H., Roncada C., Fernandes M.T.C., Heinzmann-Filho J.P., Sarria Icaza E.E., Mattiello R., Pitrez P.M.C., Pinto L.A., Stein R.T. Asthma and Obesity in Children Are Independently Associated with Airway Dysanapsis. Front. Pediatr. 2017. 5. 270. doi: 10.3389/fped.2017.00270.
12. Kyler K.E., Wagner J., Hosey-Cojocari C. et al. Drug Dose Selection in Pediatric Obesity: Available Information for the Most Commonly Prescribed Drugs to Children. Pediatr. Drugs. 2019. 21. 357-369. doi: 10.1007/s40272-019-00352-8.
13. Gao H., Ying S., Dai Y. Pathological roles of neutrophil-mediated inflammation in asthma and its potential for therapy as a target. J. Immunol. Res. 2017. 6. 1-12. doi: 10.1155/2017/3743048.
14. Бенца Т.М. Роль антилейкотриеновых препаратов в лечении бронхиальной астмы. Український терапевтичний журнал. 2016. 2. 99-104.
15. Охотнікова О.М. Ефективність застосування протизапального препарату антилейкотрієнової дії — монтелукасту натрію як засобу контролюючої терапії бронхіальної астми та алергічного риніту у дітей. Здоровье ребенка. 2016. 4(72). 19-28.
16. Peters-Golden M., Swern A., Bird S.S., Hustad C.M., Grant E., Edelman J.M. Influence of body mass index on the response to asthma controller agents. Eur. Respir. J. 2006. 27(3). 495-503. doi: 10.1183/09031936.06.00077205.
17. Sutherland E.R., Goleva E., Strand M., Beuther D.A., Leung D.Y. Body mass and glucocorticoid response in asthma. Am. J. Respir. Crit. Care Med. 2008. 178(7). 682-687. doi: 10.1164/rccm.200801-076OC.
18. Просветов Ю.В., Баринов C.С., Боев С.С. Бронхиальная астма и ожирение. Новые возможности контроля бронхиальной астмы. Клінічна імунологія. Алергологія. Інфектологія. 2017. 2(99). 94-98.
19. Longo C., Bartlett G., Schuster T., Ducharme F.M., MacGibbon B., Barnett T.A. Influence of weight status in the response to Step-2 maintenance therapies in children with asthma. BMJ Open. Respir. Res. 2019. 6(1). Е000401. doi: 10.1136/bmjresp-2019-000401.
20. Abdul Wahab A., Maarafiya M.M., Soliman A., Younes N.B., Chandra P. Serum Leptin and Adiponectin Levels in Obese and Nonobese Asthmatic School Children in relation to Asthma Control. J. Allergy (Cairo). 2013. 2013. 654104. doi: 10.1155/2013/654104.
21. Juniper E.F., Guyatt G.H., Feeny D.H. et al. Measuring quality of life in children with asthma. Qual. Life Res. 1996. 5. 35-46. doi: 10.1007/bf00435967.
22. Measurement of Healh-Related Quality of Life & Asthma Control. Cultural adaptation and linguistic validation. (online) https://www.qoltech.co.uk/language_lists.html.
23. Juniper E.F., Guyatt G.H., Willan A. et al. Determining a minimal important change in a disease-specific quality of life questionnaire. J. Clin. Epidemiol. 1994. 47(1). 81-87. doi: 10.1016/0895-4356(94)90036-1.
24. Kanda Y. Investigation of the freely available easy-to-use software “EZR” for medical statistics. Bone Marrow Transplant. 2013. 48(3). 452-458. doi: 10.1038/bmt.2012.244.
25. World Medical Association. World Medical Association Declaration of Helsinki: Ethical Principles for Medical Research Involving Human Subjects. JAMA. 2013. 310(20). 2191-2194. doi: 10.1001/jama.2013.281053.
/56.jpg)
/57.jpg)

/54.jpg)
/55.jpg)
/56_2.jpg)
/57_2.jpg)
/58.jpg)