Остеоартроз: дефиниция, этиология и механизмы развития
Остеоартроз (ОА) является одной из наиболее актуальных медицинских и социальных проблем. Это обусловлено его широкой распространенностью, высоким риском развития ограничений функции опорно-двигательного аппарата, которые приводят к нарушению трудоспособности и снижению качества жизни пациентов. Согласно данным эпидемиологических исследований, клинические симптомы ОА наблюдаются более чем у 10–20 % населения земного шара [1], а рентгенологические изменения суставов — у 50 % пациентов в возрасте 55 лет и у 80 % старше 65 лет [2, 3]. По прогнозам Всемирной организации здравоохранения, ОА в ближайшие 10–15 лет станет четвертой главной причиной инвалидности у женщин и восьмой — у мужчин [4], что предопределяет необходимость профилактики и повышения эффективности лечения ОА.
Остеоартроз — гетерогенная группа заболеваний различной этиологии со сходными биологическими, морфологическими, клиническими проявлениями и исходом, в основе которых лежит поражение всех компонентов сустава, в первую очередь хряща, а также субхондральной кости, синовиальной оболочки, связок, капсулы, околосуставных мышц. В зарубежной литературе вместо термина «остеоартроз» чаще используют более адекватный термин «остеоартрит», подчеркивающий важную роль воспалительного компонента в развитии и прогрессирования заболевания [5].
Остеоартроз (остеоартрит) характеризуется биохимическими изменениями в клетках и матриксе суставов, что приводит к образованию эрозий, уменьшению толщины суставного хряща и склерозу субхондральной кости. В развитии ОА принимают участие многие факторы, включая генетическую предрасположенность, механические повреждения, возрастные, эндокринные, метаболические факторы [6, 7].
К основным причинам, способствующим развитию ОА, относятся генетические (немодифицируемые) факторы: женский пол, дефекты и мутации гена коллагена 2-го типа (COL2A1) (синдром Стиклера), этническая принадлежность, врожденные заболевания костей и суставов; потенциально модифицируемые (приобретенные): пожилой возраст, избыточная масса тела, снижение уровня эстрогенов, особенно у женщин в постменопаузе, нарушение развития костей и суставов или их приобретенные заболевания, операции на суставах, травмы суставов; факторы внешней среды: профессиональные особенности, нагрузки на суставы и занятия спортом [2, 5].
При воздействии различных этиологических факторов возникает нарушение адаптации суставного хряща к механической нагрузке, приводящее к изменению обмена и синтетической активности хондроцитов, а также физико-химическому повреждению его матрикса [8]. Изменяется качество протеогликанов основного вещества хряща, нарушается структура коллагеновой сети, наблюдается недостаточное образование или усиленный катаболизм компонентов хрящевой ткани, в результате чего развивается деструкция хряща с потерей матриксом гликозаминогликанов — хондроитинсульфата, кератансульфата и гиалуроновой кислоты [9–11].
При ОА хондроциты вместо коллагена II типа начинают синтезировать коллаген I и III типов, увеличивается содержание неколлагеновых белков, усиливаются катаболические процессы за счет роста активности кислых лизосомальных гидролаз. В очагах деструкции суставного хряща при ОА выявляется значительное повышение одной из лизосомальных протеиназ — катепсина, который расщепляет стержневой белок протеогликанов, что вызывает высвобождение и выведение из матрикса гликозаминогликанов. Считается, что именно этот механизм обеспечивает характерное для ОА обеднение хрящевой ткани протеогликанами. При ОА в хряще становится заметной активность коллагенолитических ферментов — матриксных металлопротеиназ. Повышение активности ферментов, участвующих в катаболизме хрящевого матрикса, безусловно, является одним из основных механизмов патогенеза ОА [6, 12, 13].
Нарушение функций хондроцитов не только негативно влияет на синтез компонентов матрикса хряща, но и повышает продукцию провоспалительных цитокинов (интерлейкин 1 и 6, фактор некроза опухоли α), циклооксигеназы 2. Это приводит к повреждению синовиальной оболочки с развитием реактивного синовита [14]. Провоспалительные цитокины, отвечающие за синтез матриксных металлопротеиназ, разрушающих протеогликаны и коллаген, повышают функциональную активность клеток субхондральной кости и остеокластическую резорбцию. Отсутствие амортизации при условии давления на суставную поверхность костей приводит к их уплотнению (субхондральный остеосклероз) с образованием участков ишемии, склероза, кист и компенсаторным разрастанием костной ткани, ослабляет сухожильный мышечный аппарат. При этом прогрессирование ОА приобретает необратимый характер [4, 9, 15].
Анатомо-физиологические особенности суставного хряща и метаболизм в тканях сустава
Основная функциональная роль суставного хряща заключается в обеспечении физиологических условий при движении в суставе путем уменьшения давления во время механической нагрузки за счет обратимой деформации, что осуществляется благодаря уникальному строению хрящевой ткани. По физико-химическим свойствам хрящевая ткань представляет собой гель, содержащий 70–80 % воды, 10–15 % органических веществ и 4–7 % минеральных солей.
Суставные поверхности костей, образующих суставы, покрыты гиалиновым хрящом, в структуру которого входят клетки хондроциты, погруженные в основное вещество или внеклеточный (хрящевой) матрикс [16, 17].
Матрикс состоит из волокон и основного вещества. Вид и количество волокон определяют принадлежность хряща к одной из трех разновидностей: гиалиновый, фиброзный (волокнистый) или эластичный. Суставной хрящ является гиалиновым. В гиалиновом хряще много коллагена и протеогликанов. Фиброзный хрящ располагается в местах прикрепления сухожилий к костям, а также образует часть межпозвоночного диска — кольцевую связку. Другим примером фиброзной хрящевой ткани является ткань менисков коленного сустава. Эластичный хрящ содержит эластичные волокна, из него состоят хрящевая часть ушной раковины, надгортанник, некоторые хрящи гортани [16, 18].
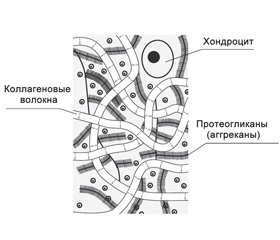
У взрослых хондроциты в гиалиновом хряще суставов не способны к делению и предназначены для поддержания целостности суставной поверхности путем баланса синтетической и катаболической активности. Хондроциты сами вырабатывают элементы внеклеточного матрикса и занимают всего 2 % от объема суставного хряща. В свою очередь, внеклеточный матрикс, который формирует большую часть хряща, состоит из двух основных элементов: коллагеновых волокон и протеогликанов (рис. 1). Если из хрящевого матрикса удалить воду, то 70 % сухого вещества будет составлять коллаген [17, 19, 20].
Молекула коллагена представляет собой левозакрученную спираль из трех α-цепей, каждая из которых содержит триаду аминокислот, в которых третья аминокислота — глицин, вторая — пролин или лизин, первая — любая другая аминокислота, кроме трех перечисленных. Синтез коллагена — сложный ферментативный процесс, который должен быть обеспечен достаточным количеством витаминов и минералов, среди которых важное место принадлежит витамину С, железу, магнию, цинку, меди [12, 18].
Молекулы суставного коллагена синтезируются в хондроцитах. Из молекул коллагена формируются коллагеновые фибриллы и волокна, образующие сеть, где более толстые волокна находятся в глубоких слоях, а более тонкие располагаются горизонтально в поверхностном слое. Это обеспечивает поддержание формы и объема суставного хряща, а также оказывает сопротивление деформирующим силам, воздействующим на него (рис. 2).
Другим немаловажным в функциональном отношении компонентом внеклеточного матрикса суставного хряща являются протеогликаны — белки, к которым присоединена одна или несколько гликозаминогликановых цепей. Высокая гидрофильность протеогликанов обеспечивает эластичность хряща. При воздействии на него сил, направленных на сжатие, вода вытесняется из сульфатированных и карбоксильных групп протеогликанов, что сближает их, а отрицательные заряды этих групп препятствуют дальнейшему сжатию. В дальнейшем при уменьшении давления на хрящ содержание воды в протеогликанах восстанавливается [21, 22].
Протеогликаны состоят из небольшой белковой части и гликозаминогликанов, содержание которых достигает 93–97 %. Основным протеогликаном суставного хряща является аггрекан, имеющий сложную структуру и состоящий из стержневого белка, связанного со множеством гликозаминогликановых цепей (главным образом это хондроитинсульфаты), а также олигосахаридов и фосфатных эфиров. Молекулы аггрекана синтезируются хондроцитами и секретируются во внеклеточный матрикс, где при помощи связующих белков из множества молекул аггрекана и нитей гиалуроновой кислоты формируются стабильные агрегаты. Они переплетены друг с другом и стянуты сетью волокон коллагена, что обеспечивает эластичность и прочность суставного хряща [5, 16, 21].
Гиалуроновая кислота по своему строению также является гликозаминогликаном. Гликозаминогликаны представляют собой длинные неразветвленные цепи гетерополисахаридов. Они построены из повторяющихся дисахаридных единиц. Одним мономером этого дисахарида является глюкуроновая кислота, вторым — производное аминосахара (глюкозамина или галактозамина) [11, 21, 23] (табл. 1).
/19_2.jpg)
При ОА отмечается уменьшение размера молекул протеогликанов, что позволяет им свободно выходить из матрикса хряща. Измененные протеогликаны способны абсорбировать, но не удерживать воду. Избыточная вода абсорбируется коллагеном [24]. Это приводит к разволокнению и расщеплению матрикса, изменению в нем процессов диффузии метаболитов, дегидратации, дезорганизации и разрыву коллагеновых волокон. При повреждении хондроцитов вырабатываются не свойственные нормальной хрящевой ткани короткий коллаген, не образующий фибрилл, и низкомолекулярные мелкие протеогликаны, не способные формировать агрегаты с гиалуроновой кислотой [9, 24], что снижает амортизационные свойства хряща [15].
Основная механическая функция протеогликана, одним из элементов которого является гиалуроновая кислота, — это удержание жидкости в хряще и противостояние силам сжатия. Гиалуроновая кислота также является важным элементом синовиальной жидкости. Гиалуроновая кислота связывает воду, в результате чего синовиальная жидкость приобретает желеобразную структуру. Это обеспечивает выполнение ею функции смазки, уменьшающей трение между суставными поверхостями. Синовиальная жидкость также играет важную роль в обменных процессах в суставном хряще. Состав синовиальной жидкости во многом определяется поступлением веществ из крови и интенсивностью всасывания из суставной полости в кровеносные и лимфатические сосуды [5, 25, 26].
Коллаген поддерживает трехмерную прочность хряща, удерживает аггреканы и противостоит силам растяжения, воздействующим на хрящ. При ОА уменьшается поступление к хондроцитам строительного материала для биосинтеза коллагена и протео-гликанов, веществ и минералов, необходимых для поддержания жизнедеятельности самих хондроцитов, что становится причиной их истощения, снижения функциональной активности и преждевременной гибели [12].
Начиная примерно с 25 лет синтез коллагена уменьшается. Также с возрастом изменяется соотношение типов коллагенов в тканях; коллаген становится более жестким, что приводит к ухудшению состояния всех тканей, содержащих коллаген, включая хрящи суставов. Таким образом, ОА представляет собой патологический процесс, в ходе которого усиливаются катаболические процессы в хряще, снижается синтетическая функция хондроцитов, в том числе за счет дефицита веществ для биосинтеза компонентов хряща, с выработкой недостаточного количества и/или с несвойственными нормальному хрящу качествами протеогликанов (мелкие, низкомолекулярные) и коллагена (короткоцепочечный). В совокупности это приводит к потере хрящевым матриксом гликозаминогликанов и коллагена, деградации хряща, вторичным изменениям в подлежащей кости и других структурных компонентах сустава. Соответственно, лечение ОА направлено на торможение катаболических процессов, например путем применения противовоспалительных препаратов, и стимуляцию анаболической активности хондроцитов.
В условиях, когда нет возможности изменить количество хондроцитов, единственным реальным путем повышения их синтетической активности является своего рода заместительная терапия, ликвидация дефицита «строительного материала» — применение веществ, являющихся субстратами для синтеза гликозаминогликанов и коллагена.
Роль коллагена в восстановлении хряща при остеоартрозе
В качестве средств, содержащих коллаген, для восстановления суставного хряща используют желатин, гидролизованный коллаген и пептиды коллагена, применение которых одобрено Управлением по санитарному надзору за продуктами и лекарствами (FDA) [12].
Коллаген — сложный белок, который содержится во многих продуктах питания. Богаты коллагеном мясные волокна, субпродукты, кожа, хрящи животных и рыб. Человеческий организм плохо усваивает целостный белок коллаген из пищи из-за большого размера его молекул. В процессе пищеварения в желудке под воздействием соляной кислоты и пепсина начинается разрушение пептидных связей в молекуле коллагена. В дальнейшем гидролиз коллагена происходит в тонкой кишке под влиянием протеолитических ферментов панкреатического сока. При этом негидролизованный коллаген распадается до уровня пептидов коллагена. Дальнейший гидролиз пептидов уже происходит под воздействием кишечных ферментов до состояния аминокислот, которые всасываются и через систему воротной вены поступают в печень и далее распространяются по всему организму [16, 18, 27] (рис. 3).
/20.jpg)
Для полноценного переваривания коллагена пищевых продуктов нужны достаточный уровень соляной кислоты и пепсина в желудке, хорошая внешнесекреторная функция поджелудочной железы и ферментная активность тонкой кишки. При различных заболеваниях желудочно-кишечного тракта, а также у детей и лиц старшего возраста коллаген переваривается плохо. Повлиять на данный процесс можно за счет включения в рацион питания коллагена в форме пептидов. Пептиды коллагена — короткие цепочки, состоящие из двух или трех аминокислот, обладающие меньшей молекулярной массой в сравнении с гидролизованным коллагеном [18, 27].
Есть данные, что короткие пептиды коллагена, состоящие из двух или трех аминокислот, а не только отдельные аминокислоты могут всасываться в кишечнике. Благодаря использованию пептидов коллагена облегчается процесс переваривания белка в желудочно-кишечном тракте, увеличивается уровень поступления аминокислот в хрящ с дальнейшим их использованием в синтезе коллагена в ходроцитах [12, 28].
Следует отметить, что в суставах, костях, коже человека нет коллагена животных или рыб, а есть собственный видоспецифический, то есть человеческий, коллаген, а прием пептидов коллагена животного происхождения служит источником дефицитных аминокислот, необходимых для синтеза собственного коллагена [18, 27, 29].
В работе Oesser et al. продемонстрировано, что при пероральном приеме гидролизированных форм коллагена его асборбция повышается до 95 %. Этот уровень отмечается уже через 6 часов после приема. При этом гидролизированная форма коллагена хорошо переносится и его прием не сопровождается побочными эффектами со стороны желудочно-кишечного тракта [30].
Эффективная и безопасная доза коллагена при ОА составляет 10 г. В исследовании, проведенном R.W. Moskowitz (2000), было показано, что ежедневный прием 10 г коллагена эффективно устраняет боль, превосходя по эффективности плацебо. При этом коллаген не вызывает побочных эффектов и хорошо переносится пациентами, страдающими ОА [28].
В проспективном рандомизированном плацебо-контролируемом двойном слепом исследовании K. Clark et al. (2008) [31] с участием 147 спортсменов с болями в суставах, вызванными физической активностью, изучалось влияние гидролизата коллагена на боль и двигательную активность. Все участники были распределены на две группы: 1-я группа (n = 73) получала 10 г гидролизата коллагена, 2-я (n = 74) — плацебо в течение 24 недель.
Результаты исследования продемонстрировали несомненное преимущество гидролизата коллагена в сравнении с плацебо в уменьшении боли в суставах по визуальной аналоговой шкале (ВАШ) как в состоянии покоя, так и при статической и динамической нагрузке. Это позволило авторам сделать вывод о необходимости назначения коллагена для поддержания здоровья суставов, а также для уменьшения боли и улучшения двигательной активности.
В работе A.E. Bello et al. (2006) [32] было установлено, что перорально принимаемый коллаген накапливается в суставном хряще и обеспечивает значимое увеличение синтеза макромолекул внеклеточного матрикса. В четырех открытых и трех двойных слепых исследованиях была показана эффективность и безопасность гидролизата коллагена в уменьшении боли и улучшении функции суставов у пациентов с остеоартрозом.
В двойном слепом плацебо-контролируемом рандомизированном клиническом исследовании, проведенном S. Kumar et al. (2015) [29] с участием 30 пациентов, страдающих остеоартрозом, также подтверждается обезболивающее и противовоспалительное действие пептидов коллагена. В группе пациентов (n = 15), принимающих пептиды коллагена в течение 13 недель, отмечалось значимое снижение боли по шкале WOMAC, ВАШ и улучшение качества жизни по шкале QOL.
Результаты данных исследований указывают на необходимость включения коллагена в стандарты лечения при патологии суставов, в частности при остеоартрозе. Положительное влияние на процессы ремоделирования хряща при остеоартрозе возможно при назначении коллагена в суточной дозе 10 г на протяжении 1–3 месяцев. Коллаген нашел применение не только у пациентов с остеоартрозом, но и при другой патологии суставов, например при ревматоидном артрите. Но механизм действия и дозировки коллагена при этой патологии отличаются от таковых при остеоартрозе. При ревматоидном артрите дозировка коллагена должна составлять 40 мг, что связано с аутоиммунным характером патологии. Низкие дозы перорального коллагена (40 мг) действуют аналогично методам десенсибилизации при лечении аллергии, вызывая развитие пищевой толерантности. Это позволяет иммунной системе становиться толерантной к собственному коллагену, что уменьшает выраженность аутоиммунного воспаления.
Выводы
Проблема остеоартроза остается одной из актуальных и нерешенных проблем современной медицины.
Это обусловлено значительной распространенностью данной патологии среди людей средней и старшей возрастных групп, невыясненностью многих аспектов патогенеза заболевания и социальными последствиями, которые возникают у пациентов: снижением качества жизни, социальной дезадаптацией, длительным нарушением трудоспособности и инвалидизацией.
При воздействии различных этиологических факторов возникает нарушение адаптации суставного хряща к механической нагрузке, приводящее к изменению обмена и синтетической активности хондроцитов, а также физико-химическому повреждению его матрикса, основными структурными элементами которого являются коллаген и протеогликаны (аггреканы).
При остеоартрозе отмечается уменьшение размера молекул протеогликанов, разволокнение и расщепление матрикса, нарушение процессов диффузии метаболитов. Также наблюдаются дегидратация, дез-организация и разрыв коллагеновых волокон. Это объясняет целесообразность применения средств, содержащих коллаген, при остеоартрозе.
Коллаген в процессе пищеварения распадается до аминокислот, которые используются для синтеза хрящевого коллагена в хондроцитах. Этот коллаген впоследствии встраивается во внеклеточный матрикс суставного хряща.
Эффективность и безопасность гидролизированного коллагена и пептидов коллагена при остеоартрозе показаны в многочисленных клинических исследованиях. Достижение позитивных изменений в структуре хряща при остеоартрозе, достижение эффективного уровня уменьшения боли, улучшение показателей физической активности и качества жизни возможны при использовании коллагена в суточной дозе 10 г на протяжении 1–3 месяцев.
Список литературы
1. Мозговая Е.Э., Зборовская И.А. Остеоартроз — самое частое заболевание суставов. Лекарственный вестник. 2012. Т. 6. № 7(47).
2. Балла Е. Остеоартроз: схема лечения шаг за шагом. http://www.medvestnik.by/ru/sovremennii_podxod/view/osteoartroz-sxema-lechenija-shag-za-shagom-17029-2017/
3. Hochberg M.C., Altman R.D., April K.T. et al. American College of Rheumatology 2012 recommendations for the use of nonpharmacologic and pharmacologic therapies in osteoarthritis of the hand, hip, and knee. Arthritis Care Res. (Hoboken). 2012. № 64. Р. 465-474.
4. Дядык А.И., Маловичко И.С., Здиховская И.И., Шпилевая Н.И. Симпозиум «Остеоартроз: вопросы патогенеза, диагностики и лечебной тактики». Новости медицины и фармации. 2012. № 1–2(399–400).
5. Казюлин А.Н. Воздействие современных хондропротекторов на различные звенья патогенеза остеоартроза. Эффективная фармокотерапия. Ревматология. Травматология. Ортопедия. 2015. № 2(21).
6. Jordan J.M., Helmick C.G., Renner J.B. et al. Prevalence of knee symptoms and radiographic and symptomatic knee osteoarthritis in African Americans and Caucasians: the Johnston County Osteoarthritis Project. J. Rheumatol. 2007. № 34. Р. 172-180.
7. Lawrence R.C., Felson D.T., Helmick C.G. et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States. Part II. Arthritis Rheum. 2008. № 58. Р. 26-35.
8. Цурко В.В., Хитров Н.А. Остеоартроз: патогенез, клиника, лечение. Лечащий врач. 2009. № 6.
9. Насонова В.А. Остеоартроз коленного сустава: причины развития, диагностика и профилактика. Consilium medicum. 2003. № 5(2). С. 87-92.
10. Боровков Н.Н. Современные подходы к комплексной терапии остеоартроза с использованием мази «Хондроксид». Нижний Новгород: Нижфарм, 2002. 25 с.
11. Singh J.A., Noorbaloochi S., MacDonald R., Maxwell L.J. Chondroitin for osteoarthritis. Cochrane Database Syst. Rev. 2015. № 1. CD005614.
12. Dybka K., Walczak P. Collagen hydrolysates as a new diet suplement. Food Chemistry and Biotechnology. 2009. Vol. 73. № 1058.
13. Wandel S., Jüni P., Tendal B. et al. Effects of glucosamine, chondroitin, or placebo in patients with osteoarthritis of hip or knee: network meta-analysis. BMJ. 2010. № 341. c4675.
14. Клиническая ревматология: Руководство для практикующих врачей. Под ред. чл.-корр. РАМН В.И. Мазурова. СПб.: Фолиант, 2001. 416 с.
15. Ребров А.П. Новые возможности лечения остеоартроза: симптоматические препараты медленного действия. Саратов, 2005. 9 с.
16. Кольман Я., Рем К.-Г. Наглядная биохимия. Пер. с англ. Т.П. Мосоловой. 6-е изд. М.: Лаборатория знаний, 2019. 509 с.
17. Руководство по гистологии. Под ред. Р.К. Данилова. СПб.: СпецЛит, 2010. Т. 1. 831 с.
18. Біологічна і біоорганічна хімія: Базовий підручник: у 2 кн. Кол. авт.; за ред. Ю.І. Губського, І.В. Ніженковської. Кн. 2. Біологічна хімія / Ю.І. Губський, І.В. Ніженковська, М.М. Корда та ін. 2-ге вид., випр. К.: ВСВ «Медицина», 2017. 544 с.
19. Ревматология: Национальное руководство. Под ред. Е.Л. Насонова, В.А. Насоновой. M.: ГЭОТАР-Медиа, 2010. 720 с.
20. Советников Н.Н., Кальсин В.А., Коноплянников М.А., Муханов В.В. Клеточные технологии и тканевая инженерия в лечении дефектов суставной поверхности. Клиническая практика. 2013. № 3. С. 52-66.
21. Родичкин П.В., Шаламанов Н.С. Клиническая фармакология хондропротекторов. Обзоры по клинической фармакологии и лекарственной терапии. 2010. Т. 10. № 3. С. 18-27.
22. Jawed H., Anjum S., Awan S.I., Simjee S.U. Anti-arthritic effect of GN1, a novel synthetic analog of glucosamine, in the collagen-induced arthritis model in rats. Inflamm. Res. 2011. № 60. Р. 1113-1120.
23. Lee Y.H., Woo J.H., Choi S.J., Ji J.D., Song G.G. Effect of glucosamine or chondroitin sulfate on the osteoarthritis progression: a meta-analysis. Rheumatol. Int. 2010. № 30. Р. 357-363.
24. Цурко В.В., Шавловская О.А. Комплексный подход в терапии остеоартроза: в фокусе цель Т. Русский медицинский журнал. 2014. № 27. С. 1989-1993.
25. Reichenbach S., Sterchi R., Scherer M. et al. Meta-analysis: chondroitin for osteoarthritis of the knee or hip. Ann. Intern. Med. 2007. № 146. Р. 580-590.
26. Towheed T.E., Maxwell L., Anastassiades T.P. et al. Glucosamine therapy for treating osteoarthritis. Cochrane Database Syst. Rev. 2005. (2). CD002946.
27. Тарасенко Л.М., Григоренко В.К., Непорада К.С. Функціональна біохімія: Підруч. для студ. 2-ге вид., доопрац. і доповн. Вінниця: Нова кн., 2007. 379 c.
28. Moskowitz R.W. Role of collagen hydrolysate in bone and joint disease. Semin. Arthritis Rheum. 2000. № 30. Р. 87-99.
29. Kumar S., Sugihara F., Suzuki K., lnoue N., Venkateswarathirukumara S. A double-blind, placebo-controlled, randomised, clinical study on the effectiveness of collagen peptide on osteoarthritis. Sci Food Agric. 2015. № 95 (4). Р. 702-707. doi: 10.1002/jsfa.6752.
30. Oesser S., Seifert J., Adam M., Babel W. Oral administration of 14C labeled collagen hydrolysate leads to an accumulation of a radioactivity in cartilage of mice (C57/BL). J. Nutr. 1999. № 129. Р. 1891-1895.
31. Clark K.L., Sebastianelli W., Flechsenhar K.R. et al. 24-week study on the use of collagen hydrolysate as a dietary supplement in athletes with activity-related joint pain. Curr. Med. Res. Opin. 2008. № 24(5). doi: 10.1185/ 030079908x291967.
32. Bello A.E., Oesser S. Collagen Hydrolysate for the Treatment of Osteoarthritis and Other Joint Disorders: A Review of the Literature. Curr. Med. Res. Opin. 2006. № 22(11). Р. 2221-32. doi: 10.1185/030079906X148373.
33. Calamia V., Ruiz-Romero C., Rocha B. et al. Pharmacoproteomic study of the effects of chondroitin and glucosamine sulfate on human articular chondrocytes. Arthritis Res. Ther. 2010. № 12. R138.
34. Sherman A.L., Ojeda-Correal G., Mena J. Use of glucosamine and chondroitin in persons with osteoarthritis. PM R. 2012. № 4. S110–S116.
/19_2.jpg)

/19.jpg)
/20.jpg)