Введение
Резкое увеличение заболеваемости и тяжести инфекции Clostridium difficile (C. difficile), отмеченное во всем мире за последние десятилетия, сделало ее глобальной проблемой здравоохранения [1–6].
Открытие антибиотиков в начале ХХ века позволило спасти миллионы человеческих жизней от целого ряда инфекционных заболеваний (дизентерии, пневмонии, раневых инфекций и др.), но применение этих препаратов привело, помимо развития устойчивости к ним бактерий, к активации микроорганизмов, которые ранее не встречались в структуре основных возбудителей. К числу таких инфекционных агентов относится C. difficile, токсины которого являются этиологическим агентом C. difficile-ассоциированного колита [3, 7, 8].
До внедрения антибиотиков это заболевание встречалось крайне редко, преимущественно у пациентов, перенесших обширные операции на желудочно-кишечном тректе. В 1893 г. американским хирургом J. Finney был описан случай тяжелой диареи, развившейся у 22-летней женщины после операции на желудке и закончившийся смертью, с наличием выявленных на аутопсии образований, сходных с «дифтеритическими мембранами». Позже такое поражение кишечника получило название «псевдомембранозный колит» [3, 7, 8]. В 1960-х годах предположили, что причиной этой патологии является Staphylococcus aureus, но применение антибиотиков в таких случаях способствовало усилению диареи и ухудшению состояния пациентов. И только во второй половине 1970-х гг. была доказана этиологическая роль C. difficile в развитии псевдомембранозного колита [8].
Clostridium difficile-ассоциированный колит (Clostridium difficile-associated colitis), или Clostridium difficile-инфекция (Clostridium difficile infection), Clostridium difficile-ассоциированная болезнь (Clostridium difficile-associated disease), Clostridium difficile-ассоциированная диарея (Clostridium difficile-associated diarrhea), — заболевание, развивающееся при нарушении кишечного микробиома с избыточной колонизацией Clostridium (Clostridioides) difficile, токсины которой вызывают воспаление, повреждение слизистой оболочки толстой кишки и диарею [1, 9–13].
Псевдомембранозный колит (ПМК) — тяжелая клиническая форма C. difficile-ассоциированного колита, как правило, вызванного токсигенной формой C. difficile, характерным признаком которого являются фибринозные наложения на слизистой оболочке толстой кишки — псевдомембраны, выявленные при эндоскопическом исследовании. ПМК является наиболее известным вариантом клостридиальной инфекции [1, 2, 12–14].
Эпидемиология
C начала XXI века в мире отмечен стремительный прогрессирующий рост числа больных с C. difficile-диареей. Однако низкая осведомленность, отсутствие стандартных протоколов диагностики позволяют предположить, что частота данной патологии еще недооценена [4, 5, 12–16, 17].
Исследователи разделяют C. difficile-инфицированность на госпитальную и внегоспитальную (когда симптомы возникают в течение первых 48 часов пребывания в стационаре или спустя 12 недель после выписки) [1, 12, 13].
C. difficile является основной причиной развития диареи у госпитализированных лиц и считается наиболее частой нозокомиальной инфекцией, которая возникает у 10–15 % госпитализированных пациентов, принимающих антибиотики [2–4, 8, 12, 13, 15]. Только в США ежегодно отмечается 3 млн случаев диареи и колита, вызванных C. difficile, что приводит к 14 000 смертей в год [12–15]. Частота клостридиальной инфекции среди госпитализированных пациентов в США за 30 лет возросла в 2 раза, а частота с первичным диагнозом клостридиальной инфекции возросла более чем в 3 раза. Также регистрируется рост и внебольничной инфицированности C. difficile [12, 13].
Заболеваемость и смертность от C. difficile-ассоциированного колита возросли в Европе, Канаде (в некоторых провинциях отмечен четырехкратный рост) и других странах. В опросе 97 больниц в 34 европейских странах заболеваемость C difficile-инфекцией у госпитализированных пациентов составляла 41 на 100 000 пациенто-дней [12, 14, 17, 18].
Увеличение заболеваемости C. difficile-инфекцией во всем мире объясняется целым рядом факторов риска, в том числе увеличением количества пожилых пациентов в популяции, устойчивостью к лечению фторхинолонами и появлением вновь открытого более вирулентного штамма С. difficile (BI/NAP1/027), который способствует развитию тяжелой диареи и сопровождается высокой летальностью [3, 4, 12–14]. Дополнительные факторы риска в отношении увеличения частоты клостридиального колита включают использование пенициллинов и клиндамицина, а также более широкое использование общего количества антибиотиков в обществе.
Этиология и патогенез
Бактерия C. difficile впервые была выделена в 1935 г. I. Hall et O’Toole из фекалий новорожденных и первоначально была идентифицирована как естественный представитель микрофлоры человека.
И только в 1970-х годах после активного внедрения антибиотиков широкого спектра действия была доказана этиологическая роль C. difficile в развитии антибиотик-ассоциированного колита, когда J. Barlett описал случай колита, развившегося после применения клиндамицина [3, 7, 18, 19]. Исследователи дали этой клостридии латинское название «difficile» («трудный») в связи со значительными трудностями, возникшими при ее изоляции [2, 3, 8, 18, 19]. Clostridium difficile (Clostridioides difficile) — крупные подвижные грамположительные анаэробные бактерии (рис. 1), которые в неблагоприятных условиях образуют субтерминальные споры (рис. 2) [1, 3, 7, 12, 13, 18–21].
/80.jpg)
C. difficile широко распространены в природе и обнаруживаются в почве, речной и морской воде, выделены из кишечника кошек, собак, свиней, лошадей, коров, верблюдов, домашних птиц. Могут выявляться в испражнениях здоровых людей различного возраста, включая новорожденных. Необходимо отметить широкое распространение носительства C. difficile среди здорового населения, что, по данным литературы, составляет от 3 до 15 % [4, 13]. Особенно высока доля носительства C. difficile (57%) у пожилых людей в домах престарелых [4, 13]. Распространение C. difficile в популяции и окружающей среде обусловлено биологическими особенностями возбудителя, защищающими его от оксидативного шока, химических и физических факторов [14].
Тем не менее эпидемиологи считают, что инфицирование людей, как правило, происходит в условиях больниц. Установлено, что культура C. difficile может высеваться с различных объектов больничной среды (пол, стены, постельные принадлежности и т.п.). Путь заражения — фекально-оральный [7, 13]. Путем передачи инфекции могут служить и продукты питания, загрязненные спорами, а также больные люди. Реже источником инфекции может быть медицинский персонал, бессимптомные носители, повторно госпитализированные пациенты [3, 5, 13].
Бактерии присутствуют в основном в вегетативной форме и очень чувствительны к атмосферному кислороду. Под воздействием значительного стресса они могут принимать форму спор и таким образом выживать в суровых условиях, таких как содержание кислоты в желудке. При такой устойчивости C. difficile могут оказаться неповрежденными в тонкой кишке [19].
Споры бактерий устойчивы к воздействию физических и химических факторов (даже при применении стерилизации — высокой температуры, ультрафиолетового излучения), могут длительно (до нескольких лет) оставаться жизнеспособными в условиях окружающей среды, в течение нескольких месяцев выживают в виде спор на аэробных поверхностях: больничных стенах, дверях, хирургических инструментах, сотовых телефонах и т.д. Более того, споры устойчивы к воздействию антибиотиков и могут длительное время сохраняться в желудочно-кишечном тракте человека и приводить к рецидиву заболевания. Созревание спор до вегетативных форм в толстой кишке происходит при воздействии солей желчных кислот и L-глицина [3, 6, 7, 12, 13, 15, 20–22].
Факторами патогенности C. difficile являются экзотоксины А (TcdA), В (TcdB) и бинарный токсин (binarytoxin) [1, 7, 8, 13, 14, 18, 23–26].
Токсин А является мощным энтеротоксином с цитотоксическим действием, что способствует повреждению эпителиоцитов, повышению сосудистой проницаемости, активации секреции жидкости в просвет кишечника и в целом нарушению барьерной функции слизистой оболочки кишечника с возникновением диареи и лихорадки.
Цитотоксин В является в 1000 раз более мощным токсином; его цитотоксический эффект вызван нарушением полимеризации внутриклеточных филаментов актина. Оба токсина в организме человека действуют локально и синергетически [14, 22].
Бинарный токсин Clostridium difficile transferase относится к семейству клостридиальных iota-like-токсинов, образует на мембране энтероцита комплекс, который проникает в цитоплазму, нарушает функционирование клетки посредством дезорганизации цитоскелета и ведет к ее гибели, а также усиливает адгезию и колонизацию C. difficile. Этот токсин продуцируют около 10 % штаммов C. difficile, которые отличаются повышенной вирулентностью и способствуют более тяжелому течению клостридиальной инфекции с частыми рецидивами, возможным смертельным исходом [23].
На основании данных центров по контролю и профилактике заболеваний в большинстве штатов США и в нескольких странах Европы был зафиксирован вирулентный штамм С. difficile (BI/NAP1/027), связанный с повышенной продукцией токсинов А и В, устойчивостью к фторхинолонам и продукцией бинарного токсина, который может синергетически увеличивать вирулентность токсинов А и В [12].
Токсины, связываясь с клеточными рецепторами, повреждают клеточные мембраны, нарушают клеточные контакты, внедряются в клетки, повреждают колоноциты, индуцируют медиаторы воспаления, вызывают дезагрегацию актина, дегрануляцию тучных клеток и хемотаксис, увеличивают проницаемость клеточного барьера с повреждением слизистой оболочки (СО) толстой кишки, что приводит к воспалению, некрозу СО, васкулитам, образованию язв [1, 2, 5, 14].
Морфологические изменения в слизистой оболочке толстой кишки обусловлены действием только токсинов. Штаммы C. difficile, не продуцирующие токсины, не являются патогенными, так как C. difficile не обладают инвазивными свойствами и, как правило, в подслизистый слой не проникают [4, 5, 12–14, 17, 24, 25, 27, 28].
При попадании токсигенных штаммов C. difficile в организм разворачивание клинической картины происходит не всегда благодаря защитным свойствам нормальной микробиоты кишечника и реализации антитело-опосредованного ответа. При нарушении баланса микрофлоры, чаще на фоне приема антибиотиков, происходит угнетение эндогенной микрофлоры и размножение C. difficilе благодаря плазмидам спорообразования. После отмены препаратов споры переходят в вегетативную форму и начинают вырабатывать токсины. В результате повреждения эндотелия, обширных воспалительных изменений в слизистой оболочке толстой кишки в ряде случаев формируются участки некроза на поверхности эпителия с образованием псевдомембран (экссудативных бляшек). В большинстве случаев при клостридиальной диарее поражение ограничено толстой кишкой [13, 18].
Рост бактерий C. difficile обычно происходит в слепой и поперечной ободочной кишке. Затем бактерии C. difficile колонизируют пищеварительный тракт, используя микрофлору кишечника [3, 29].
Выраженность, степень, протяженность морфологических изменений, выявляемых в толстой кишке, обусловливают клиническую тяжесть течения инфекционного процесса.
В последние годы C. difficile стала одним из распространенных и агрессивных внутрибольничных возбудителей. При отсутствии своевременной адекватной терапии данное заболевания приводит к развитию угрожающих жизни осложнений — токсическому мегаколону, перфорации стенки кишки, сепсису [2, 3, 8, 12, 15].
Факторы риска
Факторы риска развития C. difficile-инфекции можно разделить на три основные категории:
— факторы, нарушающие нормальный микробиом толстой кишки (антибиотики, ингибиторы протонной помпы (ИПП), другие лекарства);
— факторы хозяина (пожилой возраст, иммунный статус, сопутствующие заболевания, хирургическое лечение, прежде всего колопроктологического плана),
— факторы, увеличивающие возможность воздействия спор C. difficile (госпитализация, общественные источники, учреждения длительного ухода) [3, 5, 6, 13, 18].
Колонизации C. difficile способствует глубокое угнетение облигатной анаэробной микрофлоры кишечника, как правило, вследствие антибиотикотерапии (особенно широкого спектра действия). C. difficile-колит могут спровоцировать все группы антибиотиков. Длительное применение нескольких антибиотиков, особенно широкого спектра действия с низкой кишечной абсорбцией или высокой экскрецией желчью, вызывает изменения кишечной микрофлоры и возникновение C. difficile-инфекции [1–3, 5, 6, 12, 13, 18–20, 30]. Но при этом риск возникновения C. difficile-колита не зависит от дозы, кратности, способа введения антибиотика. Описано его возникновение после однократного применения антибиотика. Чаще всего C. difficile-инфекцию вызывают цефалоспорины (особенно третьего и четвертого поколений), фторхинолоны, пенициллины широкого спектра действия и клиндамицин, иногда — макролиды, триметоприм, сульфаниламиды, редко — аминогликозиды, тетрациклин, хлорамфениколы [2, 3, 12].
Опубликованы данные о значительной взаимосвязи между приемом препаратов, снижающих кислотность (ИПП), и развитием C. difficile-колита, риск возникновения которого возрастает при одновременном применении антибиотиков и ИПП [3, 4, 6, 18, 20, 40].
В целом к факторам риска C. difficile-колита относятся режим антибиотикотерапии, пожилой возраст пациентов (старше 65 лет), женский пол, длительная госпитализация, химио- и лучевая терапия, абдоминальные хирургические вмешательства, в том числе бариатрические операции, оперативные трансплантологические вмешательства, иммунные нарушения и иммунодефицитные состояния (ВИЧ-инфекция), фоновые заболевания (сахарный диабет, воспалительные заболевания кишечника, хронические заболевания почек), применение ИПП, НПВП, противогрибковых препаратов, антидепрессантов (миртазепин, флуоксетин), нехирургические гастроинтестинальные процедуры (постановка назогастрального зонда) [1, 3–5, 8, 12, 13, 18, 26, 30]. У пациентов с онкологической патологией частота возникновения клостридиальной диареи в 6 раз выше, чем у других госпитализированных больных [12, 18]. Пациенты с воспалительным заболеванием кишечника имеют повышенный риск развития C. difficile-инфекции, худшие результаты лечения, более высокие показатели колэктомии и рецидивов [5].
Не у всех пациентов, колонизированных C. difficile, развивается клостридиальная инфекция. Это свидетельствует о том, что в патогенезе заболевания, помимо C. difficile, важны и другие факторы, такие как иммунный ответ и баланс кишечной микробиоты [15]. Ряд недавних исследований показал, что с повышенным риском развития С. difficile-колита может быть связан полиморфизм генов (например, IL-8), что требует дальнейших исследований [12, 32].
Клиника
Клостридиальная инфекция приводит к широкому спектру клинических проявлений — от бессимптомного носительства, умеренной, неосложненной диареи до угрожающего жизни псевдомембранозного колита, токсического мегаколона и других тяжелых осложнений, вплоть до летального исхода [2, 3, 5, 12, 19, 30].
В литературе, в том числе и в нескольких руководствах, представлен ряд классификаций (градаций) клинических вариантов течения С. difficile-инфекции. Интересная, на наш взгляд, градация тяжести клинических проявлений инфекции C. difficile представлена M. Kazaniwski и соавт. (2014), которые различают носительство, C. difficile-ассоциированную диарею, C. difficile-ассоциированный колит, псевдомембранозный колит и фульминантный (молниеносный) колит, охарактеризованные ниже (табл. 1) [3, 19, 27].
В более поздних работах клинические варианты С. difficile-инфекции градируются по тяжести течения. Так, согласно руководству WSES (World Society of Emergency Surgery) по ведению C. difficile-инфекции (2019) и ряду других рекомендаций различают слабый/умеренный C. difficile-колит (mild-moderate), выраженный (тяжелый) C. difficile-колит (severe), осложненный (фульминантный, fulminant) колит и рецидивную форму клостридиальной инфекции (табл. 2) [5, 13, 14].
Представляем характеристику разных вариантов клинических проявлений заболевания.
Бессимптомная колонизация C. difficile (носительство) — это вариант клостридиальной инфекции, при котором обнаруживается C. difficile, но отсутствуют симптомы инфекции. Носительство C. difficile очень быстро распространяется в госпитальной среде, особенно среди пациентов, находящихся на лечении в отделении интенсивной терапии и хирургии: до 50 % госпитализированных больных, получающих антибиотики, становятся носителями данной инфекции без существенных клинических проявлений [13, 15, 19]. Установлено, что более высокие показатели бессимптомного носительства C. difficile наблюдаются у пациентов с воспалительными заболеваниями кишечника, что обусловлено применением различных типов иммунодепрессантов, включая стероиды, которые повышают риск развития C. difficile-инфекции [5].
Бессимптомные колонизированные лица могут быть резервуаром инфекции и передавать C. difficile другим. Показано, что носители токсигенных штаммов могут подвергаться более высокому риску развития инфекции по сравнению с неколонизированными пациентами [31]. Другие данные свидетельствуют о том, что носительство нетоксигенного C. difficile может защищать от токсигенных риботипов [5].
К типичным клиническим проявлениям клостридиальной инфекции, исключая носительство C. difficile, относятся: водянистый стул (вплоть до профузных, холероподобных испражнений), схваткообразные боли в животе, лихорадка, признаки общей интоксикации с лейкоцитозом и гипоальбуминемией (табл. 2).
C. difficile-ассоциированная диарея является ключевым, доминирующим симптомом клостридиального колита и обычно развивается через 48–72 часа после развития инфекции. Манифестация C. difficile-ассоциированного колита может развиваться и в более поздние сроки от начала или прекращения антибиотикотерапии [1–3, 12, 15].
Частота стула варьирует от 4–5 до 30 раз в сутки (в среднем 10 раз). Стул при этом жидкий, водянистый (иногда «холероподобный»), небольшого объема, часто со слизью, но, как правило, без примеси крови. У каждого пациента с диареей до 8 недель после окончания антибиотикотерапии нельзя исключать диагноз C. difficile-ассоциированного колита [2, 3].
Хотя диарея и является отличительным признаком C. difficile-инфекции, первоначально она может отсутствовать при снижении моторики толстой кишки, других предшествующих состояниях, что особенно важно учитывать у хирургических пациентов с возможной сопутствующей кишечной непроходимостью [5]. Отсутствие диареи у пациента с C. difficile-инфекцией может также сигнализировать о прогрессировании клостридиального колита и развитии фульминантного, молниеносного, варианта данного заболевания [32].
Частый жидкий стул даже при колите легкой/умеренной тяжести при отсутствии своевременного лечения может привести к изменению электролитного баланса и обезвоживанию организма, что значительно выражено при тяжелом и осложненном течении заболевания.
Диарейный синдром у больных C. difficile-ассоциированным колитом может сопровождаться абдоминальной болью различной интенсивности, чаще — спастического характера, без четкой локализации, по ходу толстого кишечника, не связанной с актом дефекации и приемом пищи. Иногда боли могут усиливаться после движения, физической нагрузки, пальпации живота [27].
Лихорадка встречается чаще при тяжелом и осложненном течении C. difficile-ассоциированного колита, но иногда может быть и первым проявлением заболевания. Чаще температура тела у пациентов коррелирует со степенью тяжести заболевания, но, по данным литературы, может достигать фебрильных цифр даже при легком течении. В последние годы отмечено повышение частоты крайне тяжелого, фульминантного течения C. difficile-ассоциированного колита с гектической лихорадкой (выше 40 °С).
При исследовании крови обнаруживают лейкоцитоз (> 15 × 109/л, иногда до 60 × 109/л), нейтрофилез, сдвиг лейкоцитарной формулы влево, токсическую зернистость нейтрофилов и увеличение СОЭ. У части пациентов могут отмечаться лейкемоидные реакции с уровнем лейкоцитов до 40 × 109/л, что характерно для фульминантного течения заболевания с развитием бактериемии. В биохимическом анализе крови возможны гипопротеинемия, гипокалиемия, гипокальциемия, гипонатриемия, повышение содержания острофазовых белков [3, 30].
Особого внимания заслуживает фульминантная (молниеносная) форма C. difficile-ассоциированного колита, которая развивается в среднем в 3 % случаев, но характеризуется развитием ряда осложнений (токсический мегаколон, перфорация, перитонит, септический шок, полиорганная недостаточность) и зачастую — смертности [3, 5, 7, 12, 15, 18, 32]. В последние годы отмечен рост этой формы, что связывают с гипервирулентным штаммом B1/NAP1/027 бактерии C. difficile.
Фульминантное течение C. difficile-ассоциированного колита представляет наибольшие трудности для диагностики и лечения в связи с сочетанным поражением толстого и тонкого кишечника. Клинические проявления включают непроизвольное напряжение мышц живота, в крови — выраженный лейкоцитоз (40 × 109/л и более) и вторичную анемию, обусловленную желудочно-кишечными кровотечениями. Диарея может значительно варьировать в зависимости от стадии заболевания: от нескольких эпизодов в день до полной обструкции и дилатации гастроинтестинального тракта. При этом могут появляться запоры, вплоть до развития кишечной непроходимости, с симптомами острого живота, фебрильной лихорадкой, явлениями перитонизма. При компьютерной томографии брюшной полости может определяться свободная жидкость и утолщение стенок толстой кишки. Характерно отсутствие эффекта или низкая эффективность медикаментозной терапии, что приводит к хирургическим вмешательствам (субтотальная/тотальная колэктомия) [5, 12, 19]. В связи с высокой смертностью, достигающей 60 %, показано срочное хирургическое вмешательство, особенно у пожилых пациентов [12, 19].
К прогностическим факторам тяжелого течения относятся: возраст старше 65 лет, лейкоцитоз более 15 × 109/л, повышение уровня креатинина сыворотки крови (более 133 мкмоль/л или в 1,5 раза от преморбидного уровня), гипоальбуминемия, сопутствующая тяжелая патология, в том числе воспалительные заболевания кишечника [6, 12, 13, 32]. Инфицирование высоковирулентным штаммом B1/NAP1/027 связано с более тяжелым течением и высокой смертностью независимо от возраста пациентов [14, 31].
Рецидив C. difficile-ассоциированного колита — это повторный эпизод развития симптомов заболевания менее чем через 8 недель после начала предыдущего эпизода при завершении начального лечения [4, 5, 13]. После первого диагноза C. difficile-инфекции у 10–30 % пациентов развивается как минимум один рецидивирующий эпизод заболевания, и риск рецидива увеличивается с каждым последующим рецидивом, что представляет собой клиническую проблему. Для пациентов с 1–2 предыдущими эпизодами риск дальнейших рецидивов составляет 40–65 %. Рецидивы связаны с нарушением иммунного ответа на C. difficile-токсины, с изменением микробиоты толстой кишки, могут быть следствием прорастания резидентных спор, остающихся в кишечнике после прекращения лечения антибиотиками, или при повторной инфекции из источника окружающей среды [3–5, 8, 13, 33–37].
К факторам риска рецидивирования заболевания относят: продолжающуюся антибактериальную терапию, возраст более 65 лет, тяжелые сопутствующие заболевания, одновременное применение антисекреторных препаратов (ИПП), наличие клостридиальной инфекции в анамнезе, тяжелое течение первого эпизода заболевания [8, 12, 13, 33–37].
По данным канадских исследователей, рецидивирующие эпизоды менее тяжелы по сравнению с начальными эпизодами (отмечено снижение доли тяжелых случаев в зависимости от количества рецидивирующих эпизодов: 47 % для начальных эпизодов, 31 % для первых рецидивов, 25 % для вторых и 17 % для третьих). По мнению E.C. Oldfield и соавт. (2014), серьезность повторных эпизодов C. difficile-инфекции не следует недооценивать: 11 % пациентов с первым рецидивом имели по крайней мере одно тяжелое осложнение, включая шок, колэктомию, мегаколон, перфорацию или смерть в течение 30 дней [30]. И в целом возникновение рецидива заболевания требует более значительных экономических затрат на лечение, чем первичное заболевание [35, 37, 43].
Осложнения
Осложнения C. difficile-ассоциированного колита: токсический мегаколон (нарастание болевого синдрома, вздутие живота, локальная болезненность живота, напряжение мышц брюшного пресса, появление свободной жидкости в брюшной полости); перфорация толстой кишки, острый перитонит, инфекционно-токсический шок с летальным исходом [7, 12].
Диагностика
Несмотря на недавние достижения, диагностика C. difficile-инфекции остается сложной, так как не существует единого метода, сочетающего высокую чувствительность и специфичность [1, 12, 15, 30]. Диагноз C. difficile-ассоциированного колита прежде всего должен быть заподозрен у любого пациента с диареей, который получал антибиотики в течение предыдущих трех месяцев, был недавно госпитализирован и/или имел диарею в течение 48 часов или более после госпитализации, при исключении других причин диареи (например, воспалительный колит, энтеральное питание) [2, 4–6, 10, 12, 14, 15].
Лабораторная диагностика
В связи с медленным ростом бактериальной культуры выделение возбудителя C. difficile при всей его важности имеет второстепенное значение. Золотым стандартом и наиболее информативным методом верификации клостридиальной инфекции является обнаружение токсинов или токсигенных штаммов в кале [2, 6, 14, 15, 38].
Современные международные рекомендации по диагностике C. difficile-инфекции предлагают использование нескольких вариантов диагностических тестов.
Иммуноферментный анализ (ИФА) для определения токсинов А/В C. difficile в кале — наиболее распространенный диагностический тест с чувствительностью 75–95 % и специфичностью 83–98 % [13, 14, 30, 38].
Исследование глутаматдегидрогеназы (ГДГ) C. difficile обладает низкой чувствительностью и специфичностью, применяется только для экспресс-диагностики; в связи с тем, что глутаматдегидрогеназа является ферментом, который продуцируют и токсигенные, и нетоксигенные штаммы бактерий, этот тест не позволяет определять наличие именно токсигенного штамма C. difficile у конкретного пациента [5, 6, 10, 12, 14, 38].
Полимеразная цепная реакция (ПЦР) — метод амплификации нуклеиновых кислот для определения токсигенного штамма C. difficile обладает высокой чувствительностью и специфичностью, но пока малодоступен в клинической практике [13, 14].
Для повышения точности лабораторных исследований не рекомендуется проводить тестирование на C. difficile у пациентов, получавших слабительные средства в течение последних 48 часов [15].
В мире разработан ряд подходов к лабораторной диагностике C. difficile-инфекции. Американское и Европейское общества микробиологов рекомендуют двухэтапный подход, включающий скрининговый тест на обнаружение ГДГ и, в случае его положительного результата, проведение тестов, подтверждающих наличие определенных токсинов (ПЦР или ИФА) [2, 4, 8, 10, 14, 15].
В случае первичного отрицательного результата не рекомендуется дальнейшее обследование пациента, так же как и проведение повторных исследований, при которых повышается вероятность получения ложноположительных результатов. Специалисты не рекомендуют проведение повторных лабораторных исследований после курса лечения, так как тесты на основе ИФА могут оставаться положительными на протяжении 30 дней [13, 30].
Следует понимать, что при развитии у пациента клинической картины C. difficile-колита лечение может быть начато до получения лабораторного подтверждения, так как отрицательные результаты тестов не исключают наличие заболевания [13].
Эндоскопия. Достаточно информативным методом диагностики C. difficile-колита является эндоскопическое исследование толстой кишки [1, 6, 12, 13, 18, 19]. При умеренном течении заболевания эндоскопические изменения могут включать такие неспецифические ранние изменения, как эритема слизистой оболочки толстой кишки, рыхлость и контактная кровоточивость. В связи с этим у пациентов, получающих антибиотики и имеющих повышенный уровень лейкоцитов, даже при отсутствии выраженной диареи, необходимо исключить клостридиальную инфекцию [12, 18, 20].
При более тяжелых формах заболевания развивается псевдомембранозный колит, который при эндоскопическом исследовании характеризуется наличием приподнятых желто-белых узелков или бляшек, образующих псевдомембраны на поверхности слизистой оболочки толстой кишки. Псевдомембраны могут быть диаметром от 2 мм до 2 см, рассеянными по областям нормальной или эритематозной слизистой оболочки; но при тяжелом течении заболевания могут выявляться сливные псевдомембраны, которые покрывают всю слизистую оболочку. Чаще процесс локализуется в прямой, сигмовидном и нисходящем отделах ободочной кишки, крайне редко возникает тотальное поражение толстой кишки, в связи с чем для диагностики ПМК может быть достаточным проведение сигмоскопии [1, 12, 13, 18, 42]. Псевдомембраны наблюдаются у 14–25 % пациентов с умеренной C. difficile-инфекцией и у 87 % пациентов с фульминантным ее течением (рис. 2, 3) [12, 13].
В то же время отсутствие мембран не исключает наличие C. difficile-инфекции, и, наоборот, выявление эндоскопических признаков ПМК является достаточным аргументом для обоснования клостридиального генеза заболевания [3]. С учетом возможности ложноотрицательного результата лабораторных исследований колоноскопия является более информативным методом исследования в сравнении с исследованием кала на токсины. Наряду с этим сообщают об отсутствии прямой корреляции между эндоскопическими проявлениями и тяжестью болезни [2, 3, 8].
При тяжелом течении заболевания, в том числе при фульминантной его форме, эндоскопическое исследование толстой кишки должно проводиться с ограничениями и осторожностью (с учетом риска перфорации) и строго по показаниям [5, 12, 42].
Согласно литературным данным, с целью диагностики C. difficile-ассоциированного колита показано проведение сигмоскопии у всех госпитализированных пациентов с диареей и негативными анализами кала на цитотоксин C. difficile и кишечные патогены [5].
Морфологические изменения
Изменения локализуются в толстой кишке, чаще в прямой, сигмовидной и нисходящей кишках, но в тяжелых случаях может быть тотальное поражение. В литературе приведена классификация морфологических изменений слизистой оболочки толстой кишки при ПМК (рис. 4) A.B. Price, D.R. Davice (1977), где авторы выделяют три типа изменений в зависимости от степени выраженности процесса [3, 12]:
— I тип: мелкие поверхностные эрозии с очаговыми наложениями фибрина с примесью слизи, полиморфно-клеточной инфильтрацией, с возможным уменьшением бокаловидных клеток; в собственной пластинке слизистой оболочки толстой кишки — отек, полнокровие, небольшие очаговые скопления полиморфно-ядерных лейкоцитов;
— II тип: множественные участки некроза поверхностного эпителия с вовлечением нескольких крипт, наличие толстого слоя фибрина (фибринозная пленка), слизи, слущенных клеток и полиморфно-ядерных лейкоцитов на поверхности, субэпителиальный отек;
— III тип: множественные участки воспаления с некрозом эпителия не только верхних слоев, но и всей толщи слизистой оболочки, вплоть до некроза; в строме густая полиморфно-клеточная инфильтрация с пропитыванием фибрина, очаги некроза, участки атрофии эпителия разной степени выраженности со снижением секреции слизи [3]. В целом бляшки при ПМК состоят из фибрина, муцина, слущенных эпителиальных клеток, разрушенных лейкоцитов и микробной флоры кишечника [3].
Американская коллегия радиологов при подозрении на осложненное течение C. difficile-ассоциированного колита рекомендует проведение компьютерной томографии брюшной полости. К наиболее характерным изменениям относятся: выраженное утолщение стенок толстой кишки, асцит, нерегулярные контуры стенок толстой кишки [5, 12].
Лечение
На сегодняшний день существует ряд международных клинических рекомендаций по лечению C. difficile-инфекции, основные положения которых приведены ниже.
Согласно рекомендациям, лечение асимптомного носительства не рекомендуется [19].
При установлении диагноза C. difficile-ассоциированного колита лечение необходимо начинать незамедлительно. Первый шаг — отмена антибиотика, вызвавшего диарею, что в ряде случаев может восстановить естественную флору кишечника и нормальное функционирование пищеварительного тракта [3, 5, 7, 10, 13, 15, 19, 20].
Лечебная тактика имеет две основные цели: санацию кишечника от C. difficile; купирование воспалительного процесса в кишечнике.
Неотъемлемой частью стандартной терапии пациентов с C. difficile-ассоциированным колитом является антибактериальная терапия, которая должна ограничить колонизацию кишечника C. difficile и оказать противовоспалительное действие. C. difficile наиболее чувствительны к ванкомицину и метронидазолу. Ванкомицин оказывает более выраженное действие на инфекцию C. difficile. Эффективным средством в лечении C. difficile-ассоциированного колита также является более новый антибиотик фидаксомицин, который может применяться вместо ванкомицина. Обязательным условием является энтеральное назначение антибиотиков, так как при парентеральном их введении в кишечнике не всегда создается достаточная их концентрация, в связи с чем может не наступить полная санация от C. difficile [2–6, 8, 12–15, 30, 39, 40].
Пациентам с легкой и среднетяжелой формой заболевания назначается метронидазол в дозе 500 мг внутрь три раза в день в течение 10 дней. При отсутствии клинического эффекта через 5–7 дней производят смену препарата на ванкомицин в дозе 125 мг 4 раза в день per os в течение 10 дней [5, 32, 39].
Пациентам с тяжелым течением C. difficile-ассоциированного колита изначально показано назначение ванкомицина в дозе 125 мг внутрь 4 раза в день вместе с метронидазолом по 500 мг 3 раза в день в течение 10 дней [5, 6, 13, 14, 32, 39].
Ухудшение состояния пациента с возникновением гипотонии, гипертермии выше 38,5 °С, при задержке стула, выраженном вздутии живота, изменении сознания, лейкоцитозе свыше 15 × 109 или лейкопении ниже 2 × 109, повышении уровня лактата в сыворотке крови выше 2,2 ммоль/л, развитии синдрома полиорганной недостаточности требует перевода в отделение интенсивной терапии для дальнейшего лечения. Наряду с инфузионной терапией назначается ванкомицин внутрь в дозе 500 мг 4 раза в день в сочетании с метронидазолом в дозе 500 мг 3 раза в день внутривенно. При невозможности введения препарата через рот ванкомицин назначается ректально. При этом препарат в дозе 500 мг разводится в 500 мл 0,9% раствора хлорида натрия и вводится в виде клизм четыре раза в день [14, 39].
В случае использования фидаксомицина (вместо ванкомицина) он назначается в дозе 200 мг 2 раза в сутки в течение 10 дней [6, 12, 15, 17].
Важным элементом лечения является инфузионная терапия, призванная устранить белково-электролитные нарушения, а также обеспечить коррекцию обезвоживания [5, 6].
Среди дополнительных средств могут быть применены сорбенты, в частности диоктаэдрический смектит, которые способны нейтрализовать активность токсинов C. difficile. Однако обязательно следует соблюдать временной интервал между применением сорбентов и антибиотиков, чтобы сорбирующее действие не помешало эффекту пероральных антибиотиков.
Также рекомендуется использование у этих пациентов пробиотиков, которые назначаются после завершения курса антибиотикотерапии с целью профилактики рецидивов C. difficile-ассоциированного колита, как правило, длительно (до 3 месяцев). С этой же целью используются пробиотики на основе бифидо- и лактофлоры (в частности, L. rhamnosus, B. longum, B. bifidum, B. infantis и другие), а также препараты на основе непатогенных дрожжей Saccharomyces boulardii [5, 6, 13, 14].
Следует избегать у больных с C. difficile-ассоциированным колитом препаратов, угнетающих моторику пищеварительного тракта (лоперамид), чтобы не спровоцировать осложнения колита [13].
Сообщают об эффективности трансплантации фекальной микрофлоры у пациентов с рецидивирующим течением клостридиального колита и неэффективной антибиотикотерапией [2, 5, 6, 12, 15, 20, 41], кроме пациентов с онкологической патологией [40].
В тяжелых случаях C. difficile-ассоциированного колита при неэффективности консервативной терапии и развитии опасных осложнений рассматривается вопрос о необходимости хирургического лечения, в частности проведения колэктомии. Показаниями к ее проведению служат перфорация кишки, развитие токсического мегаколона, илеуса, симптомов острого живота [1, 2, 5, 13, 32].
Неприятной особенностью C. difficile-ассоциированного колита является возможность развития рецидивов. При рецидивах повторяются курсы антибактериальных средств (метронидазол, ванкомицин/фидаксомицин). Важный элемент профилактики рецидивов — рациональное использование пробиотиков [13].
Прогноз
Некоторые пациенты с умеренным течением клостридиального колита могут выздороветь без специфической терапии, но длящаяся несколько недель диарея может приводить к истощению, поэтому даже при умеренном течении заболевания показано лечение [12].
Примерно у 20–27 % пациентов, пролеченных по поводу первого эпизода C. difficile-ассоциированного колита, развивается рецидив заболевания, причиной чего может быть неполная санация от спор либо повторное заражение [8, 12, 13].
Смертность от клостридиальной диареи зависит от тяжести течения, сопутствующей патологии, возраста пациентов и колеблется, по данным различных авторов, от 9,3 до 22 %. При развитии молниеносной формы C. difficile-ассоциированного колита летальность может достичь 53–60 % [8].
Профилактика
В связи со способностью C. difficile к образованию спор и биопленок, что влияет на значительное распространение данного микроорганизма, чрезвычайно важными считаются профилактические мероприятия по борьбе с клостридиальной инфекцией [14].
Исследовательская группа Европейского общества клинической микробиологии и инфекционных заболеваний (ESCMID) по C. difficile (ESGCD) недавно опубликовала ряд руководств, касающихся мер по профилактике инфекции C. difficile в условиях медицинских учреждений. По мнению комитета, для предупреждения развития C. difficile-инфекции в лечебных учреждениях необходимы оптимизация политики применения антибиотиков и строгое соблюдение принципов инфекционного контроля: использование средств индивидуальной защиты (перчатки и халаты/одноразовые фартуки) для уменьшения передачи C. difficile, использование мер предосторожности при контакте с больными, внедрение ежедневной экологической спорицидной дезинфекции и терминальной дезинфекции помещений пациентов с клостридиальной инфекцией для снижения передачи C. difficile, проведение эпиднадзора за пациентами с C. difficile-ассоциированным колитом в сочетании со своевременной обратной связью с показателями инфицирования как на уровне больницы, так и на уровне отделения, внедрение протоколов по сокращению продолжительности антибиотикотерапии, обучение работников здравоохранения профилактике C. difficile-ассоциированного колита с целью расширения их знаний и навыков по стратегиям профилактики [3–5, 8, 10, 18].
Важным моментом является, по мнению специалистов, и сокращение по возможности сроков госпитализации, особенно у лиц старше 65 лет [1, 2, 13, 18, 39].
При этом не рекомендуется проведение скрининга с целью выявления зараженных пациентов или носителей C. difficile как способа снижения риска развития клостридиального колита, а также скрининга у работников здравоохранения на наличие инфекции C. difficile в качестве рутинной контрольной меры развития клостридиального колита [5, 12].
Клинический случай
Больной Н., 78 лет, работающий пенсионер, поступил в клинику Института гастроэнтерологии НАМН Украины в январе 2019 года с жалобами на общую слабость, частый водянистый стул небольшого объема до 10 раз в сутки, спастическую боль в околопупочной области, повышение температуры тела до 39 °С, головокружение, метеоризм.
Из анамнеза известно, что пациент длительно страдает гипертонической болезнью, принимает арифон и лизиноприл. Наблюдается в течение трех лет у уролога по поводу гипертрофии предстательной железы. В течение ряда лет лечился у ревматолога по поводу подагры. Туберкулез, вирусные гепатиты, малярию, тифы, венерические заболевания и злокачественные новообразования у себя и у родственников отрицает. Наследственный и аллергологический анамнез не отягощен. Не курит, алкоголь не употребляет. Прием наркотических веществ отрицает.
Считает себя больным около двух недель, когда при амбулаторном обследовании выявили гипертрофию простаты и уролог назначил лечение азитромицином по 500 мг 1 раз в день в течение 9 дней. На фоне лечения самочувствие больного резко ухудшилось — появился частый жидкий водянистый стул до 12–15 раз в сутки, спастические боли вокруг пупка, вздутие живота, общая слабость и головокружение, повышение температуры до 38 градусов. По месту жительства проводимое лечение эффекта не имело. Поступил в клинику для уточнения диагноза и лечения.
При объективном осмотре общее состояние средней тяжести, обусловлено основным заболеванием (дегидратационный и диспептический синдром). Сознание ясное, положение в постели активное. Вес — 79 кг, рост — 170 см, индекс массы тела — 27,3. Периферические лимфоузлы не увеличены. Костно-мышечный аппарат не изменен. Активные и пассивные движения в суставах возможны в полном объеме. Щитовидная железа не увеличена. Периферических отеков нет. Дыхание через нос свободное. Грудная клетка правильной формы. Перкуторно над легкими чистый, ясный легочный звук. Аускультативно — везикулярное дыхание на всем протяжении легочных полей. Область сердца не изменена. Границы относительно сердечной тупости расширены на 1,5 см влево. Аускультативно — тоны сердца приглушены. Пульс 90 ударов в 1 минуту удовлетворительного наполнения и напряжения. Артериальное давление — 90/60 мм ртутного столба. Язык густо обложен белым налетом, суховат. Живот мягкий, при пальпации болезненный в эпигастральной области и вокруг пупка. Печень выступает из-под края реберной дуги на 2 см. Край печени закруглен. Селезенка не пальпируется. Симптомы Керра, Ортнера, Дежардена, Георгиевского отрицательные. Симптомы раздражения брюшины не вызываются. Область почек не изменена. Симптом Пастернацкого с обеих сторон отрицательный. Периферических отеков нет. Суточный диурез до 1,1 литра.
Общий анализ крови: гемоглобин — 142 г/л, эритроциты — 4,8 × 1012; цветной показатель — 0,87; тромбоциты — 263 000, лейкоциты — 30,6 × 109 (палочкоядерные нейтрофилы — 14 %), СОЭ — 25 мм в час. Таким образом, анализ крови сигнализировал о выраженном бактериальном воспалении.
Биохимический анализ крови: общий белок — 48 г/л, альбумин — 28,6 г/л, билирубин — 8,8 мкмоль/л, АЛТ — 13,6 ммоль/л, АСТ — 16,7 ммоль/л, щелочная фосфатаза — 90,3 Е/л, ГГТ — 34,4 Е/л, глюкоза — 8,5 ммоль/л, мочевина — 10,5 ммоль/л, креатинин — 149,7 мкмоль/л. Эти данные указывали на значительное снижение уровня белка, а также нарушение почечной функции.
Копроцитограмма: кал не оформлен, жидкий, оранжевого цвета, слизь +++, реакция щелочная, реакция на скрытую кровь в кале отрицательная, умеренная креаторея и амилорея, лейкоциты — свыше 100 в поле зрения, эритроциты — до 10 в поле зрения, простейшие и яйца гельминтов не обнаружены.
С учетом жалоб пациента, данных анамнеза, объективных признаков, а также лабораторных показателей наиболее вероятным диагнозом рассматривался псевдомембранозный колит.
Пациенту выполнен анализ кала на токсин А/В C. difficile: выявлено наличие токсина.
/89.jpg)
Выполнено ультразвуковое исследование: признаки стеатогепатоза, хронического холецистита, полипа желчного пузыря, хронического панкреатита, косвенные признаки патологии кишечника, нельзя исключить явления частичной кишечной непроходимости. На обзорной рентгенографии брюшной полости данные в пользу частичной кишечной непроходимости не подтвердились.
Заключение компьютерной томографии: признаки хронического колита, дивертикулеза сигмовидной кишки, незначительного асцита, гепатолиенального синдрома, застойного желчного пузыря, солитарных простых кист почек, гипертрофии предстательной железы, двустороннего гидроторакса, гидроперикарда. Задержка жидкости в полостях, вероятно, была связана с гипопротеинемией.
Через несколько дней терапии после умеренного клинического и лабораторного улучшения была выполнена видеоколоноскопия: наружный осмотр перианальной области без особенностей. Аппарат введен в купол слепой кишки. Тонус кишки повышен. Гаустрация не визуализируется. В прямой кишке слизистая очагово гиперемирована, неравномерно отечная, с очагово стертым сосудистым рисунком. В сигмовидной кишке визуализируются единичные дивертикулы средних размеров. В ободочной кишке на фоне гиперемированной слизистой визуализируются множественные беловато-желтые наложения (псевдомембраны) до 5–6–10 мм в диаметре с контактной ранимостью, большее их количество отмечается в правых отделах толстой кишки. В слепой кишке и восходящем отделе толстой кишки значительный фибринозный налет, повышенная контактная ранимость, ткань при инструментальной пальпации мягкая (взята биопсия), кровоточивость повышена.
Заключение: диффузный псевдомембранозный колит. Дивертикулез сигмовидного отдела ободочной кишки.
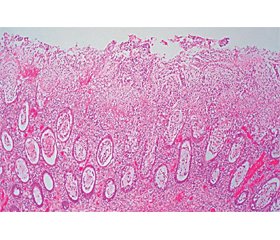
При гистологическом исследовании биоптатов (рис. 5, 6) выявлены данные в пользу псевдомембранозного колита; в некротизированной ткани небольшие донные участки крипт; бляшки образованы наложением фибрина, густо инфильтрированы полиморфноядерными нейтрофильными лейкоцитами.
Таким образом, клинико-анамнестические, лабораторные, эндоскопические и морфологические данные подтвердили наличие у пациента псевдомембранозного колита тяжелой степени.
Пациент принимал комплексную терапию, включающую антибиотики (ванкомицин и метронидазол), салофальк, пробиотики (пробиолог), спазмолитики (дуспаталин), инфузионную дезинтоксикационную терапию (реосорбилакт, трисоль, раствор Рингера, аминол), 10% раствор альбумина.
В процессе лечения самочувствие больного улучшилось. Частота стула снизилась сначала до 3–4 раз в сутки, а в последние 3 дня пребывания в клинике стул стал оформленным и осуществлялся 1 раз в день. Температура тела нормализовалась. Улучшились лабораторные показатели: через 2 недели лечения в анализе крови: лейкоциты — 12,7 × 109 (палочкоядерные лейкоциты — 9 %), общий белок — 67 г/л, альбумин — 38,4 г/л, мочевина — 4,89 ммоль/л, креатинин — 99,7 мкмоль/л; в копрограмме лейкоциты не определялись.
Пациент был выписан с улучшением на амбулаторное лечение.
Выводы
Таким образом, с учетом увеличения заболеваемости C. difficile-инфекцией (особенно среди хирургических пациентов), расширения групп риска, роста частоты тяжелых, рефрактерных к медикаментозному лечению форм заболевания, в том числе обусловленных более вирулентными штаммами, продуцирующими бинарный токсин, склонности к рецидивированию и ростом летальности, C. difficile-ассоциированный колит представляет собой актуальную проблему здравоохранения, требующую дальнейшего изучения и четкого понимания с целью своевременной диагностики, лечения и предупреждения осложнений.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов и личной финансовой заинтересованности при подготовке данной статьи.
Вклад авторов в подготовку статьи. Сбор материала, его анализ и написание текста проводились авторами совместно: Степанов Ю.М. — общее руководство проектом, литературный обзор; Симонова Е.В. — проведение литературного поиска, литературный обзор; Будзак И.Я. — проведение литературного поиска, описание клинического случая; Кононов И.Н. — описание клинического случая.
Дополнительная информация. Работа выполнена на базе ГУ «Институт гастроэнтерологии НАМН Украины» и ГУ «Днепропетровская медицинская академия МЗ Украины».
/89.jpg) Выполнено ультразвуковое исследование: признаки стеатогепатоза, хронического холецистита, полипа желчного пузыря, хронического панкреатита, косвенные признаки патологии кишечника, нельзя исключить явления частичной кишечной непроходимости. На обзорной рентгенографии брюшной полости данные в пользу частичной кишечной непроходимости не подтвердились.
Выполнено ультразвуковое исследование: признаки стеатогепатоза, хронического холецистита, полипа желчного пузыря, хронического панкреатита, косвенные признаки патологии кишечника, нельзя исключить явления частичной кишечной непроходимости. На обзорной рентгенографии брюшной полости данные в пользу частичной кишечной непроходимости не подтвердились.
/80.jpg)
/83.jpg)
/86.jpg)
/88.jpg)