Журнал "Гастроэнтерология" Том 54, №3, 2020
Вернуться к номеру
Оценка коморбидного статуса и структурных изменений щитовидной железы у больных с хроническим метапластическим атрофическим гастритом: обзор и собственные исследования
Авторы: Мосийчук Л.Н., Демешкина Л.В., Коненко И.С., Зыгало Э.В., Петишко О.П.
ГУ «Институт гастроэнтерологии НАМН Украины», г. Днепр, Украина
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
Актуальність. Коморбідна патологія залишається поширеною, але недостатньо вивченою проблемою. На сьогодні частота і характер сполученої патології у хворих на хронічний метапластичний атрофічний гастрит (ХМАГ) остаточно не з’ясовані, не визначена роль щитоподібної залози (ЩЗ) в етіопатогенезі даного захворювання. Мета: оцінити стан коморбідності у хворих на ХМАГ та вивчити частоту і характер структурних змін ЩЗ у даної категорії хворих, дослідити літературні дані з цієї проблеми. Матеріали та методи. В обстеження включений 41 хворий на ХМАГ віком (60,1 ± 2,4) року, серед них було 29 жінок і 12 чоловіків. Хворим проводилася гастроскопія (з NBI-режимом та забором біопсійного матеріалу), ультразвукове дослідження щитоподібної залози та анкетування за допомогою Сumulative Illness Rating Scale (CIRS), а також за історіями хвороби пацієнтів вивчались коморбідні захворювання шлунково-кишкового тракту (ШКТ). Результати. У 82,9 % хворих на ХМАГ виявлені ультразвукові дифузні зміни ЩЗ, причому у 48,8 % обстежених вони виявлені вперше, а у 37,8 % пацієнтів дані зміни поєднувалися з наявністю вузлів у ЩЗ. До того ж у 9,8% хворих виявлені ультразвукові ознаки автоімунного тиреоїдиту. У 97,6 % хворих на ХМАГ спостерігалася поліморбідна патологія, причому у 92,7 % хворих — з боку 3 систем та більше і тільки у 4,9 % — з боку 2 систем. Встановлено позитивний кореляційний зв’язок між віком хворих та сумарною кількістю балів, набраних за допомогою опитувальника коморбідності CIRS (r = 0,412, p = 0,04). За даними СIRS, найбільш часто у пацієнтів із ХМАГ поєднувалася патологія верхнього і нижнього відділів ШКТ (97,7 та 53,7 % відповідно), патологія м’язово-кісткового апарату та шкірних покривів (68,3 %), патологія очей, вух, горла та гортані (56,1 %), судинна патологія (56,1 %), захворювання серця (51,2 %) та ендокринно-метаболічна патологія (34,1 %). Висновки. У 82,9 % хворих на ХМАГ виявлені ультразвукові структурні зміни ЩЗ. Перспективним напрямком подальшого дослідження, на наш погляд, було б вивчення автоімунних процесів у шлунку та ЩЗ (встановлення можливих взаємозв’язків між автоімунним тиреоїдитом та автоімунним гастритом), а також особливостей перебігу даних коморбідних захворювань. Необхідно приділити увагу ХМАГ не тільки як захворюванню, що є фактором ризику розвитку раку шлунка, але й як можливому маркеру наявності супутньої патології щитоподібної залози.
Актуальность. Коморбидная патология остается распространенной, но недостаточно изученной проблемой. В настоящее время частота и характер соединенной патологии у больных с хроническим метапластическим атрофическим гастритом (ХМАГ) окончательно не выяснены, как и роль щитовидной железы (ЩЖ) в этиопатогенезе данного заболевания. Цель: оценить состояние коморбидности у больных с ХМАГ и изучить частоту и характер структурных изменений ЩЖ у данной категории больных, исследовать литературные данные по этой проблеме. Материалы и методы. В обследование включен 41 больной с ХМАГ в возрасте (60,1 ± 2,4) года, среди которых было 29 женщин и 12 мужчин. Больным проводилась гастроскопия (с NBI-режимом и забором биопсийного материала), ультразвуковое исследование ЩЖ, анкетирование с помощью Сumulative Illness Rating Scale (CIRS), а также по историям болезни изучались коморбидные заболевания желудочно-кишечного тракта (ЖКТ). Результаты. У 82,9 % больных с ХМАГ выявлены ультразвуковые диффузные изменения ЩЖ, причем у 48,8 % обследованных они выявлялись впервые, а у 37,8 % пациентов данные изменения сочетались с наличием узлов в ЩЖ. К тому же у 9,8 % больных выявлены ультразвуковые признаки аутоиммунного тиреоидита. У 97,6 % пациентов с ХМАГ наблюдалась полиморбидная патология, причем у 92,7 % больных — со стороны 3 систем и больше и только у 4,9 % — со стороны 2 систем. Установлена положительная корреляционная связь между возрастом больных и суммарным количеством баллов, набранных с помощью опросника коморбидности CIRS (r = 0,412, p = 0,04). По данным СIRS, наиболее часто у пациентов с ХМАГ сочеталась патология верхнего и нижнего отделов ЖКТ (97,7 и 53,7 % соответственно), патология костно-мышечного аппарата и кожных покровов (68,3 %), патология глаз, ушей, горла, носа и гортани (56,1 %), сосудистая патология (56,1 %), заболевания сердца (51,2 %) и эндокринно-метаболическая патология (34,1 %). Выводы. У 82,9 % больных с ХМАГ выявлены ультразвуковые структурные изменения ЩЖ. Перспективным направлением дальнейшего исследования, на наш взгляд, было бы изучение аутоиммунных процессов в желудке и ЩЖ (установление возможных взаимосвязей между аутоиммунным тиреоидитом и аутоиммунным гастритом), а также особенностей течения данных коморбидных заболеваний. Необходимо уделить внимание ХМАГ не только как заболеванию, которое является фактором риска развития рака желудка, но и как возможному маркеру наличия сопутствующей патологии щитовидной железы.
Background. Comorbidity remains a challenge for researchers. The frequency of comorbid diseases and the role of the thyroid gland (TG) in the etiopathogenesis in patients with metaplastic atrophic gastritis (MAG) are not finally determined. The purpose of the study was to assess comorbidity and thyroid structural changes in patients with MAG and to investigate the literature data on this problem. Materials and methods. The study enrolled 41 patients with MAG, among whom 29 women and 12 men. The patients’ age was (60.1 ± 2.4) years. They underwent gastroscopy with narrow-band imaging and gastric biopsy, an ultrasound examination of the thyroid gland. Comorbidity was studied using a questionnaire (Сumulative Illness Rating Scale, CIRS) and patients’ medical histories. Results. 82.9 % of patients with MAG had ultrasound diffuse thyroid changes, which are firstly revealed in 48.8 % of them; 37.8% of observed patients had ultrasound thyroid diffuse changes combined with TG nodules. Besides, 9.8 % of patients had ultrasonic signs of Hashimoto’s disease (Hashimoto’s thyroiditis). 97.6 % of patients with MAG had polymorbidity, which was observed in 3 or more systems in 92.7 % of patients and in 2 systems in 4.9 %. Positive correlation (r = 0.412, p = 0.04) between patients’ age and CIRS score was established. According to CIRS data, the pathology of the upper and lower gastrointestinal tract was observed in 97.7 and 53.7 % of patients, respectively. Patients had comorbidity of the musculoskeletal and integumentary system (68.3 %), eyes, ears, throat, nose, and larynx (56.1 %), vascular system (56.1 %), heart diseases (51.2 %), and endocrine-metabolic pathology (34.1 %). Conclusions. 82.9 % of patients with MAG had ultrasound structural changes in the thyroid gland. Further research on autoimmune processes in the stomach and thyroid gland is needed to figure out a possible relationship between Hashimoto’s disease and autoimmune metaplastic atrophic gastritis, their pathogenesis, as well as the peculiarities of the course of these comorbid diseases. It is required to pay attention to MAG not only as of the disease, which can lead to stomach cancer development but also as a possible marker for comorbid thyroid pathology.
коморбідність; поліморбідність; автоімунний метапластичний атрофічний гастрит; обумовлений зовнішніми факторами метапластичний атрофічний гастрит; щитоподібна залоза; тиреоїдит; шкала CIRS; іонізуюча радіація; йод; хвороба Хашимото; автоімунні захворювання; рак шлунка
коморбидность; полиморбидность; аутоиммунный метапластический атрофический гастрит; обусловленный внешними факторами метапластический атрофический гастрит; щитовидная железа; тиреоидит; шкала CIRS; ионизирующая радиация; йод; болезнь Хашимото; аутоиммунные заболевания; рак желудка
comorbidity; polymorbidity; autoimmune metaplastic atrophic gastritis; environmental metaplastic atrophic gastritis; thyroid gland; CIRS; ionizing radiation; iodine; risk factors; Hashimoto’s disease; autoimmune diseases; stomach cancer
Введение
Коморбидность и полиморбидность: современное состояние проблемы
/45.jpg)
Хронический атрофический гастрит: гастроэнтерологический аспект в классификации аутоиммунного полиэндокринного синдрома
Хронический атрофический гастрит: его взаимосвязи с патологией щитовидной железы, раком желудка и некоторыми факторами риска
Собственные наблюдения
Материалы и методы
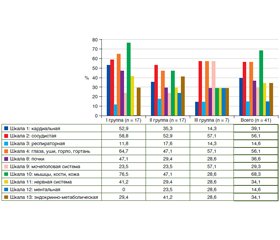
Результаты
/53_2.jpg)
Обсуждение
Выводы
- Бакулин И.Г., Сайганов С.А., Скалинская М.И., Лапинский И.В. Коморбидный пациент в гастроэнтерологии: индивидуальный подход. Рациональная фармакотерапия в кардиологии. 2018. Т. 14 № 1. С. 65-69. https://doi.org/10.20996/1819-6446-2018-14-1-65-69.
- Fortin M., Ramond A., Boyd S., Almirall J. Disease, Comorbidity, and Multimorbidity (Chapter 8, 164–193) in Aging, place, and health. Editors Satariano W.S., Maus M. 2018; published by Jones@Bartlett Learning LCC. First edition. 378 p.
- Multimorbidity: Technical Series on Safer Primary Care. Geneva: World Health Organization; 2016. Licence: CC BY-NC-SA 3.0 IGO. URL: https://apps.who.int/iris/bitstream/handle/10665/252275/9789241511650-eng.pdf?sequence = 1 (Дата обращения: 25 мая 2020 г.).
- Stirland L.E., González-Saavedra, Mullin D.S., Ritchie C.W., Muniz-Terrera G., Russ T.C. Measuring multimorbidity beyond counting diseases: systematic review of community and population studies and guide to index choice. BMJ. 2020. № 18. 368. P. 160. doi: 10.1136/bmj.m160.
- Makovski T.T., Schmitz S., Zeegers M.P., Stranges S., van den Akker M. Multimorbidity and quality of life: Systematic literature review and meta-analysis. Ageing Res. Rev. 2019. № 53. P. 100903. doi: 10.1016/j.arr.2019.04.005.
- Cassell A., Duncan E., Harshfield A., Rhodes K., Brimicombe J. The epidemiology of multimorbidity in primary care: a retrospective cohort study. British Journal of General Practice. 2018. № 68(669). Р. 245-251. doi: https://doi.org/10.3399/bjgp18X695465.
- Воронин С.В., Черкашин Д.В., Бершева И.В. Полиморбидность: определение, классификации, распространенность, методы оценки и практическое значение. Вестник Российской военно-медицинской академии. 2018. Т. 64. № 4. С. 243-249. https://doi.org/10.17816/brmma12384.
- Чукаева И.И., Самородская И.В., Ларина В.Н. Сочетанная патология: дискуссионные вопросы терминологии, учета и влияния на выбор тактики ведения пациента. Тер. архив. 2018. № 80(8). С. 125-130. doi: 10.26442/terarkh2018908125-130.
- Almirall J., Fortin M. The coexistence of terms to describe the presence of multiple concurrent diseases. J. Comorb. 2013. № 3. Р. 4-9. doi: 10.15256/joc.2013.3.22.
- Нургазизова А.К. Происхождение, развитие и современная трактовка понятий «коморбидность» и «полиморбидность». Казанский медицинский журнал. 2014. Т. 95. № 2. С. 292-296. doi: 10.17816/KMJ2084.
- Willadsen T.G., Bebe A., Køster-Rasmussen R., Jarbøl D.E., Guassora A.D., Waldorff F.B., Reventlow S., De Fine Olivarius N. The role of diseases, risk factors and symptoms in the definition of multimorbidity — a systematic review. Scand. J. Prim. Health Care. 2016. № 34(2). Р. 112-21. doi: 10.3109/02813432.2016.1153242.
- van der Akker M., Knottnerus J.A. Comorbidity or multimorbidity: what's in a name? A review of literture. Eur. J. Gen. Pract. 1996. № 2. Р. 65-70. URL: https://www.researchgate.net/publication/232032028_Comorbidity_or_multimorbiditywhat's_in_a_name_A_review_of_literature (Дата обращения: 25.05.2020).
- Лазебник Л.Б., Ефремов Л.И., Конев Ю.В. Семантические трудности при полиморбидности. Клиническая геронтология. 2015. № 3–4. С. 44-46.
- Верткин А.Л. Коморбидный пациент. Руководство для практических врачей. 2015. 160 с.
- Navickas R., Petric V.K., Feigl A.B., Seychell M. Multimorbidity: What do we know? What should we do? J. Comorb. 2016. № 6(1). Р. 4-11. doi: 10.15256/joc.2016.6.72.
- Guan W.J., Liang W.H., Zhao Y. et al. Comorbidity and its impact on 1590 patients with COVID-19 in China: a nationwide analysis. Eur. Respir. J. 2020. № 55(5) (Epub ahead of print). doi: 10.1183/13993003.00547-2020.
- Абрагамович О.О., Фаюра О.П., Абрагамович У.О. Коморбідність: сучасний погляд на проблему; клаcифікація (перше повідомлення). Львівський клінічний вісник (рубрика «Погляд у проблему»). 2015. № 4(12). С. 56-64. https://doi.org/10.25040/lkv2015.04.056.
- Fortin M., Bravo G., Hudon C., Vanasse A., Lapointe L. Prevalence of multimorbidity among adults seen in family practice. Ann. Fam. Med. 2005. № 3(3). Р. 223-8. doi: 10.1370/afm.272.
- Fortin M., Soubhi H., Hudon C., Bayliss E.A., van den Akker M. Multimorbidity’s many challenges. BMJ. 2007. № 334(7602). P. 1016-7. doi: 10.1136/bmj.39201.463819.2C.
- Воронин С.В. Распространенность и особенности полиморбидности военнослужащих различных возрастных групп по результатам их медицинского освидетельствования для определения категории годности к военной службе. Вестник Российской военно-медицинской академии. 2020. № 1(69). С. 39-44. doi: https://doi.org/10.17816/brmma25965.
- Van Weel C., Schellevis F.G. Comorbidity and guidelines: conflicting interests. Lancet. 2006. № 367(9510). P. 550-551. doi: 10.1016/S0140-6736(06)68198-1.
- Sakib M.N., Shooshtari S., St. John P. et al. The prevalence of multimorbidity and associations with lifestyle factors among middle-aged Canadians: an analysis of Canadian Longitudinal Study on Aging data. BMC Public Health. 2019. № 19. Р. 243. https://doi.org/10.1186/s12889-019-6567-x.
- Schäfer I., Hansen H., Kaduszkiewicz H., Bickel H., Fuchs A., Gensichen J., Maier W., Riedel-Heller S.G., König H.-H., Dahlhaus A., Gerhard Schön G., Weyerer S., Wiese B., van den Bussche H., Scherer M. Health behaviour, social support, socio-economic status and the 5-year progression of multimorbidity: Results from the MultiCare Cohort Study. J. Comorbidity. 2019. № 9. P. 1-11. https://doi.org/10.1177/2235042X19883560.
- Caughey G.E., Roughead E.E. Multimorbidity research challenges: Where to go from here? Journal of Comorbidity 2011. № 1. P. 8-10. doi: 10.15256/joc.2011.1.9.
- Gijsen R., Hoeymans N., Schellevis F.G., Ruwaard D., Satariano W.A., van den Bos G.A. Causes and consequences of comorbidity: a review. J. Clin. Epidemiol. 2001. № 54(7). P. 661-74. Doi: 10.1016/s0895-4356(00)00363-2.
- Журавлев Ю.И., Тхорикова В.Н. Современные проблемы измерения полиморбидности. Научные ведомости (серия «Медицина. Фармация»). 2013. Вып. 22. № 11(154). C. 214-218. URL: https://cyberleninka.ru/article/n/sovremennye-problemy-izmereniya-polimorbidnosti/viewer (Дата обращения: 25.05.2020).
- Johnston M.C., Crilly M., Black C., Prescott G.J., Mercer S.W. Defining and measuring multimorbidity: a systematic review of systematic reviews. Eur. J. Public Health. 2019. № 29(1). P. 182-189. doi: 10.1093/eurpub/cky098.
- Linn B.S., Linn M.W., Gurel L. Cumulative illness rating scale. J. Am. Geriatr. Soc. 1968. № 16(5). P. 622-6.
- Uhlig K., Leff B., Kent D., Dy S., Brunnhuber K., Burgers J.S., Greenfield S., Guyatt G., High K., Leipzig R., Mulrow C., Schmader K., Schunemann H., Walter L.C., Woodcock J., Boyd C.M. A framework for crafting clinical practice guidelines that are relevant to the care and management of people with multimorbidity. J. Gen. Intern. Med. 2014. № 29(4). Р. 670-9. doi: 10.1007/s11606-013-2659-y. Epub 2014 Jan 18.
- Lee S.P., Sung I.K., Kim J.H., Lee S.Y., Park H.S., Shim C.S. The effect of emotional stress and depression on the prevalence of digestive diseases. J. Neurogastroenterol. Motil. 2015. № 21(2). Р. 273-282. doi: 10.5056/jnm14116.
- Al Quraan A.M., Beriwal N., Sangay P., Namgyal T. The Psychotic Impact of Helicobacter pylori Gastritis and Functional Dyspepsia on Depression: A Systematic Review. Cureus. 2019. № 11(10). Е5956. doi: 10.7759/cureus.5956.
- Locatelli F., Finocchio E., Marcon A., Bono R., Cerveri I., Pirina P., Trucco G. et al. The association between gastritis/gastroesophageal reflux and rhinitis/rhinosinusitis. European Respiratory Journal. 2016. № 48(Suppl. 60). PA4255. doi: 10.1183/13993003.congress-2016.PA4255.
- Cellini M., Santaguida M.G., Virili C., Capriello S., Brusca N., Gargano L., Centanni M. Hashimoto’s Thyroiditis and Autoimmune Gastritis. Front Endocrinol. (Lausanne). 2017. № 8. Р. 92. doi: 10.3389/fendo.2017.00092.
- Neufeld M., Blizzard R.M. Polyglandular autoimmune diseases. In: Pinchera A., Doniach D., Fenzi G.F., Baschieri L., editors. Symposium on autoimmune aspects of endocrine disorders. New York: Academic Press, 1980. Р. 357-365.
- Betterle C., Zanchetta R. Update on autoimmune polyendocrine syndromes (APS). Acta Biomed. 2003. № 74(1). P. 9-33.
- Betterle C., Garelli S., Coco G., Burra P. A rare combination of type 3 autoimmune polyendocrine syndrome (APS-3) or multiple autoimmune syndrome (MAS-3). Auto Immun. Highlights. 2014. № 5(1). Р. 27-31. doi: 10.1007/s13317-013-0055-6.
- Rodriguez-Castro K.I., Franceschi M., Miraglia C., Russo M., Nouvenne A., Leandro G., Meschi T., De Angelis G.L., Di Mario F. Autoimmune diseases in autoimmune atrophic gastritis. Acta Biomed. 2018. № 89(8-S). Р. 100-103. doi: 10.23750/abm.v89i8-S.7919.
- Park J.Y., Lam-Himlin D., Vemulapalli R. Review of autoimmune metaplastic atrophic gastritis. Gastrointest Endosc. 2013. № 77(2). Р. 284-292. doi: 10.1016/j.gie.2012.09.033.
- Minalyan A., Benhammou J.N., Artashesyan A., Lewis M.S., Pisegna J.R. Autoimmune atrophic gastritis: current perspectives. Clin. Exp. Gastroenterol. 2017. № 10. Р. 19-27. Published 2017 Feb 7. doi: 10.2147/CEG.S109123.
- Pittman M.E., Voltaggio L., Bhaijee F., Robertson S.A., Montgomery E.A. Autoimmune Metaplastic Atrophic Gastritis: Recognizing Precursor Lesions for Appropriate Patient Evaluation. Am. J. Surg. Pathol. 2015. № 39(12). Р. 1611-1620. doi: 10.1097/PAS.0000000000000481.
- Zorzetto V., Maddalo G., Basso D., Farinati F. Immunotherapy for gastric premalignant lesions and cancer. Immunotherapy. 2012. № 4(6). Р. 587-599. doi: 10.2217/imt.12.50.
- Crafa P., Russo M., Miraglia C., Barchi A., Moccia F., Nouvenne A., Leandro L. et al. From Sidney to OLGA: an overview of atrophic gastritis. Acta Biomed. 2018. № 89(8–S). Р. 93-99. doi: 10.23750/abm.v89i8-S.7946.
- Jencks D.S., Adam J.D., Borum M.L., Koh J.M., Stephen S., Doman D.B. Overview of Current Concepts in Gastric Intestinal Metaplasia and Gastric Cancer. Gastroenterol. Hepatol. (N.Y.). 2018. № 14(2). Р. 92-101. https://pubmed.ncbi.nlm.nih.gov/29606921.
- Calcaterra V., Montalbano C., Miceli E., Luinetti O., Albertini R., Vinci F., Regalbuto C., Larizza D. Anti-gastric parietal cell antibodies for autoimmune gastritis screening in juvenile autoimmune thyroid disease. J. Endocrinol. Invest. 2020. № 43(1). Р. 81-86. doi: 10.1007/s40618-019-01081-y.
- Utiyama S.R.R., De Bem R.S., Skare T.L., De Carvalho G.A., Teixeira L.M., Bertolazo M., Ioshii S.O. Anti-parietal cell antibodies in patients with autoimmune thyroid diseases. J. Endocrinol. Invest. 2018. № 41(5). Р. 523-529. doi: 10.1007/s40618-017-0755-2.
- Miceli E., Vanoli A., Lenti M.V. et al. Natural history of autoimmune atrophic gastritis: a prospective, single centre, long-term experience. Aliment Pharmacol. Ther. 2019. № 50(11–12). Р. 1172-1180. doi: 10.1111/apt.15540.
- Astl J., Šterzl I. Activation of Helicobacter pylori causes either autoimmune thyroid diseases or carcinogenesis in the digestive tract. Physiol. Res. 2015. 64(Suppl. 2). S291-S301. doi: 10.33549/physiolres.933118.
- Erdoğan A., Yilmaz U. Is there a relationship between Helicobacter pylori and gastric autoimmunity? Turk. J. Gastroenterol. 2011. № 22(2). Р. 134-8. doi: 10.4318/tjg.2011.0181.
- Gao Y., Liu S. Research the relativity of Helicobacter pylori infection and autoimmune thyroiditis. Journal of Dalian Medical University. 2013. № 35(2). Р. 160-162. doi: 10.11724/jdmu.2013.02.16.
- Arslan M.S., Ekiz F., Deveci M., Sahin M., Topaloglu O., Karbek B., Tutal E., Ginis Z., Cakal E., Ozbek M., Yuksel O., Delibasi T. The relationship between cytotoxin-associated gene A positive Helicobacter pylori infection and autoimmune thyroid disease. Endocrine research. 2015. № 40(4). Р. 211-214. https://doi.org/10.3109/07435800.2015.1015727.
- Shi W.J., Liu W., Zhou X.Y., Ye F., Zhang G.X. Associations of Helicobacter pylori infection and cytotoxin-associated gene A status with autoimmune thyroid diseases: a meta-analysis. Thyroid. 2013. № 23(10). Р. 1294-1300. doi: 10.1089/thy.2012.0630.
- Sugano K., Tack J., Kuipers E.J. Kyoto global consensus report on Helicobacter pylori gastritis (Guidelines.) Gut. 2015. № 64(9). Р. 1353-1367. doi: 10.1136/gutjnl-2015-309252.
- Pimentel-Nunes P., Libânio D., Marcos-Pinto R., Areia M., Leja M., Gianluca Esposito G., Monica Garrido M. et al. Management of epithelial precancerous conditions and lesions in the stomach (MAPS II): European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacterand Microbiota Study Group (EHMSG), European Society of Pathology (ESP), and Sociedade Portuguesa de Endoscopia Digestiva (SPED). Обновленные рекомендации 2019. Endoscopy. 2019. № 51(4). Р. 365-388. http://dx.doi.org/10.1055/a-0859-1883.
- Testerman T.L., Morris J. Beyond the stomach: an updated view of Helicobacter pylori pathogenesis, diagnosis, and treatment. World J. Gastroenterol. 2014. № 20(36). Р. 12781-12808. doi: 10.3748/wjg.v20.i36.12781.
- Smyk D.S., Koutsoumpas A.L., Mytilinaiou M.G., Rigopoulou E.I., Sakkas L.I., Bogdanos D.P. Helicobacter pylori and autoimmune disease: cause or bystander. World J. Gastroenterol. 2014. № 20(3). Р. 613-629. doi: 10.3748/wjg.v20.i3.613.
- Hou Y., Sun W., Zhang C., Wang T., Guo X., Wu L., Qin L., Liu T. Meta-analysis of the correlation between Helicobacter pylori infection and autoimmune thyroid diseases. Oncotarget. 2017. № 8(70). Р. 115691-115700. doi: 10.18632/oncotarget.22929.
- Bassi V., Santinelli C., Iengo A., Romano C. Identification of a correlation between Helicobacter pylori infection and Graves’ disease. Helicobacter. 2010. № 15. Р. 558-562. doi: https://doi.org/10.1111/j.1523-5378.2010.00802.
- Bertalot G., Montresor G., Tampieri M., Spasiano A., Pedroni M., Milanesi B., Favret M., Manca N., Negrini R. Decrease in thyroid autoantibodies after eradication of Helicobacter pylori infection. Clin. Endocrinol. (Oxf.). 2004. № 61(5). Р. 650-2. doi.org/10.1111/j.1365-2265.2004.02137.x.
- Gravina A.G., Zagari R.M., De Musis C., Romano L., Loguercio C., Romano M. Helicobacter pylori and extragastric diseases: A review. World J. Gastroenterol. 2018. № 24(29). Р. 3204-3221. doi: 10.3748/wjg.v24.i29.3204.
- Papamichael K.X., Papaioannou G., Karga H., Roussos A., Mantzaris G.J. Helicobacter pylori infection and endocrine disorders: is there a link? World J. Gastroenterol. 2009. № 15(22). Р. 2701-2707. doi: 10.3748/wjg.15.2701.
- Бобирьова Л.Е., Городинська О.Ю. Тиреоїдна патологія та стан йодної забезпеченості в Полтавській області через 20 років після аварії на ЧАЕС. Світ медицини та біології. 2014. № 1(43). С. 8-14.
- Behrouzian R., Aghdami N. Urinary iodine/creatinine ratio in patients with stomach cancer in Urmia, Islamic Republic of Iran. East Mediterr Health J. 2004. № 10(6). Р. 921-4.
- Gulaboglu M., Yildiz L., Gul M., Celebi F., Peker K. Blood and urine iodine levels in patients with gastric cancer. Biol. Trace Elem. Res. 2006. № 113(3). Р. 261-71. DOI: 10.1385/BTER:113:3:261.
- Tabaeizadeh M., Haghpanah V., Keshtkar A., Semnani S., Roshandel G., Adabi K., Heshmat R., Rohani D., Kia A., Ehsan Hatami E., Jahangirrad A., Nabizadeh R., Larijani B. Goiter Frequency Is More Strongly Associated with Gastric Adenocarcinoma than Urine Iodine Level. J. Gastric. Cancer. 2013. № 13(2). Р. 106-110. doi: 10.5230/jgc.2013.13.2.106.
- Kovacheva-Slavova M.D., Angelov T.A., Valkov H.Ya., Iliev H.I., Vladimirov B.V. Current View on Autoimmune Gastritis. Chapter in book Gastritis. New approach and treatments (edited by Bruna Maria Roesler) Intech. Open: 2019. doi: 10.5772/intechopen.87006. URL: https://www.intechopen.com/books/gastritis-new-approaches-and-treatments/current-view-on-autoimmune-gastritis.
- Annibale B., Esposito G., Lahner E. A current clinical overview of atrophic gastritis. Expert Rev. Gastroenterol. Hepatol. 2020. № 14(2). Р. 93-102. doi: 10.1080/17474124.2020.1718491.
- Feldman M., Lee E.L. Gastritis. In: Feldman M., Friedman L.S., Brandt L.J., eds. Sleisenger and Fordtran’s Gastrointestinal and Liver Disease (pathophysiology/diagnosis/management): 10th ed. Philadelphia, PA: Elsevier Saunders, 2016. Сhap. 52. P. 868-883.
- Neumann W.L., Coss E., Rugge M., Genta R.M. Autoimmune atrophic gastritis — pathogenesis, pathology and management. Nat. Rev. Gastroenterol. Hepatol. 2013. № 10(9). Р. 529-541. doi: 10.1038/nrgastro.2013.101.
- Kandemir E.G., Yonem A., Narin Y. Gastric carcinoma and thyroid status. J. Int. Med. Res. 2005. № 33(2). Р. 222-227. doi: 10.1177/147323000503300210.
- Venturi S., Venturi A., Cimini D., Arduini C., Venturi M., Guidi A. A new hypothesis: iodine and gastric cancer. Eur. J. Cancer Prev. 1993. № 2(1). Р. 17-23.
- Venturi S., Donati F.M., Venturi A., Venturi M., Grossi L., Guidi A. Role of iodine in evolution and carcinogenesis of thyroid, breast and stomach. Adv. Clin. Path. 2000. № 4(1). Р. 11-17.
- Gulaboglu M., Yildiz L., Celebi F., Gul M., Peker K. Comparison of iodine contents in gastric cancer and surrounding normal tissues. Clin. Chem. Lab. Med. 2005. № 43(6). Р. 581-584. doi: 10.1515/CCLM.2005.101.
- Яшина И.Н., Иванов А.В., Харченко В.В., Литвинова Е.С. Эмбриогенез органов пищеварительной системы человека. Аномалии развития. Курск: ГБОУ ВПО КГМУ Минздравсоцразвития России, 2012. 77 с.
- Джикия Е.Л., Авилов О.Н., Киселева Я.Ю., Кулинич Т.М., Боженко В.К. Обзоры Na+/I-симпортер (NIS): структура, функции, экспрессия в норме и опухолях. URL: http://vestnik.rncrr.ru/vestnik/v18/docs/gzikia.pdf (Дата обращения: 25 мая 2020 г.).
- Altorjay A., Dohán O., Szilágyi A., Paroder M., Wapnir I.L., Carrasco N. Expression of the Na+/I-symporter (NIS) is markedly decreased or absent in gastric cancer and intestinal metaplastic mucosa of Barrett esophagus. BMC Cancer. 2007. № 7. Р. 5. doi: 10.1186/1471-2407-7-5.
- Ruf J., Carayon P. Structural and functional aspects of thyroid peroxidase. Arch. Biochem. Biophys. 2006. № 445(2). Р. 269-277. doi: 10.1016/j.abb.2005.06.023.
- Bhattacharjee M., Bhattacharjee S., Gupta A., Banerjee R.K. Critical role of an endogenous gastric peroxidase in controlling oxidative damage in H. pylori-mediated and nonmediated gastric ulcer. Free Radic. Biol. Med. 2002. № 32(8). Р. 731-743. doi: 10.1016/s0891-5849(02)00757-8.
- Tessler F.N., Middleton W.D., Grant E.G. Thyroid Imaging Reporting and Data System (TI-RADS): A User’s Guide. Radiology. 2018. № 287(1). Р. 29-36. doi: 10.1148/radiol.2017171240.
- Мамаев А.Н. Основы медицинской статистики. М.: Практическая медицина, 2011. 128 с.
- Мартиросян И.Т. Клинико-морфологическая характеристика очаговых (фокальных) изменений ткани щитовидной железы в условиях легкого йодного дефицита: Автореф. дис. … канд. мед. наук. М., 2007. 25 с.
- Корзун В.Н., Парац А.М. Шляхи мінімізації впливу радіаційних та ендемічних чинників на стан здоров'я населення. Довкілля та здоров’я. 2006. № 36(1). С. 13-17.
- Козярін І.П., Корзун В.Н. Медико-соціальні проблеми профілактики йододефіцитних захворювань. Мистецтво лікування. 2009. № 4(60). С. 39-43. http://www.health-medix.com/articles/misteztvo/2009-07-01/39-43.pdf.
- Zimmermann M.B., Boelaert K. Iodine deficiency and thyroid disorders. Lancet Diabetes Endocrinol. 2015. № 3(4). Р. 286-95. doi: 10.1016/S2213-8587(14)70225-6.
- Leung A.M., Braverman L.E. Iodine-induced thyroid dysfunction. Current opinion in endocrinology, diabetes, and obesity. 2012. № 19(5). Р. 414-9. DOI: 10.1097/MED.0b013e3283565bb2.
- Murphy R., Turek C., Arseneau L. The Role of Iodine Deficiency and Subsequent Repletion in Autoimmune Thyroid Disease and Thyroid Cancer. Journal of Restorative Medicine. 2016. № 5(1). Р. 32-38. https://doi.org/10.14200/jrm.2016.5.0102.
- Sun X., Shan Z., Teng W. Effects of Increased Iodine Intake on Thyroid Disorders. Endocrinol. Metab. (Seoul). 2014. № 29(3). Р. 240-247. doi: 10.3803/EnM.2014.29.3.240.
- Кравченко В.І. Чорнобильська аварія та йодна недостатність як фактори ризику тиреоїдної патології у населення постраждалих регіонів України. Международный эндокринологический журнал. 2016. № 2(76). С. 13-20. doi: 10.22141/2224-0721.2.74.2016.70911.
- Васько Л.М., Почерняева В.Ф., Баштан В.П. Засоби захисту організму від дії іонізувального випромінювання: навч. посіб. К.: Медицина, 2019. 112 с.
- World Uranium Mining Production (Updated August 2019). https://www.world-nuclear.org/information-library/nuclear-fuel-cycle/mining-of-uranium/world-uranium-mining-production.aspx (Дата звернення 12. 04.2020).
- Ткаченко В.І., Максимець Я.А., Видиборець Н.В., Коваленко О.Ф. Аналіз поширеності тиреоїдної патології та захворюваності на неї серед населення Київської області та України за 2007–2017 рр. Международный эндокринологический журнал. 2018. Т. 14. № 3. С. 272-277. doi: https://doi.org/10.22141/2224-0721.14.3.2018.136426.
- Прилуцкий А.С., Касярум В.П., Бахтиярова А.А., Кущ О.М., Майлян Э.А., Бужина Л.М. Частота заболеваний щитовидной железы в Донецком регионе. Международный эндокринологический журнал. 2009. № 3(21). С. 2-15. URL: http://www.mif-ua.com/archive/article/8796. 26.05.2020 (Дата обращения: 25.05.2020).
- Maser C., Toset A., Roman S. Gastrointestinal manifestations of endocrine disease. World J. Gastroenterol. 2006. № 12(20). Р. 3174-3179. doi: 10.3748/wjg.v12.i20.3174.
- Paz-Filho G., Mastronardi C.A. Interactions between the endocrine system and the gastrointestinal tract. Transl. Gastrointest. Cancer. 2015. № 4(1). Р. 1-2. doi: 10.3978/ j.issn.2224-4778.2014.09.04.
- Carballo G.A., Fighera T.M. Effect of gastrointestinal disorders in autoimmune thyroid diseases. Transl. Gastrointest. Cancer. 2015. № 4(1). Р. 76-82. doi: 10.3978/j.issn.2224-4778.2014.07.03.
- Chen S., Ying L., Kong M., Zhang Y., Li Y. The Prevalence of Helicobacter pylori Infection Decreases with Older Age in Atrophic Gastritis. Gastroenterol. Res. Pract. 2013. № 4. doi: 10.1155/2013/494783.
- Yancik R., Ershler W., Satariano W., Hazzard W., Cohen H.J., Ferrucci L. Report of the national institute on aging task force on comorbidity. J. Gerontol. A Biol. Sci. Med. Sci. 2007. № 62(3). Р. 275-280. doi: 10.1093/gerona/62.3.275.
- Marengoni A., Angleman S., Melis R. et al. Aging with multimorbidity: a systematic review of the literature. Ageing Res. Rev. 2011. № 10(4). Р. 430-439. doi: 10.1016/j.arr.2011.03.003.

/47.jpg)
/47_2.jpg)
/48.jpg)
/50.jpg)
/51.jpg)
/52.jpg)
/53.jpg)
/54.jpg)
/54_2.jpg)
/55.jpg)
/55_2.jpg)