Журнал «Здоровье ребенка» Том 15, №5, 2020
Вернуться к номеру
Нуклеазы, разрушающие внеклеточную ДНК бактериальных биопленок
Авторы: Абатуров А.Е.
ГУ «Днепропетровская медицинская академия МЗ Украины», г. Днепр, Украина
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
Позаклітинна бактеріальна ДНК (eDNA) бере активну участь у формуванні та життєдіяльності біоплівок, виступаючи як основний структурний компонент матриксу. Вивільнення eDNA в континуум біоплівки здійснюється за рахунок лізису бактеріальних клітин і активної секреції лізис-незалежним механізмом. Молекули eDNA наявні у видоспецифічних кількостях у біоплівках різних мікроорганізмів та організовані у вигляді чітких морфологічних утворень, що формують сітчасті структури або ниткоподібні мережі. Значущість eDNA у підтримці стабільності матриксу є особливо високою в ранній стадії розвитку біоплівки. У біоплівках eDNA бере участь як фактор, що сприяє адгезії бактерій, утворенню біоплівки і продукції позаклітинного матриксу; як структурний компонент у забезпеченні стабільності матриксу; як субстрат процесу перенесення генів шляхом трансформації компетентних сестринських бактерій; як нутрієнт і як протекторний фактор бактерій біоплівки. Зниження вмісту eDNA дестабілізує матрикс, що дозволяє вивільнити бактерії з біоплівок і, як наслідок, підвищити чутливість патогенів до дій антибактеріальних засобів. Розщеплення молекул eDNA ДНКазою є одним із шляхів деградації матриксу біоплівок і подолання бактеріальної антибіотикорезистентності, пов’язаної з формуванням біоплівок. Показано, що ДНКази, зокрема ДНКаза I, ДНКаза 1L2, нуклеаза NucB, досить ефективно руйнують «молоді» біоплівки різних грамнегативних і грампозитивних бактерій. Сьогодні ДНКази розглядаються як можливі моделі майбутніх антибіоплівкових лікарських засобів. З огляду на відсутність довготривалої активності й обмежену глибину проникнення при диспергуванні біоплівок даних засобів розроблений і синтезований нанотехнологічний ДНК-міметичний штучний фермент, що має високий рівень ДНКаза-подібної антибіоплівкової активності. У клінічній практиці при лікуванні інфекцій у хворих на муковісцидоз успішно використовується високоочищена людська рекомбінантна ДНКаза I — дорназа альфа.
Внеклеточная бактериальная ДНК (eDNA) принимает активное участие в формировании и жизнедеятельности биопленок, выступая в качестве основного структурного компонента матрикса. Высвобождение eDNA в континуум биопленки осуществляется за счет лизиса бактериальных клеток и активной секреции лизис-независимым механизмом. Молекулы eDNA присутствуют в видоспецифических количествах в биопленках разных микроорганизмов и организованы в виде четких морфологических образований, формирующих сетчатые структуры или нитевидные сети. Значимость eDNA в поддержании стабильности матрикса особенно высока на ранних стадиях развития биопленки. В биопленках eDNA участвует как фактор, способствующий адгезии бактерий, образованию биопленки и продукции внеклеточного матрикса; как структурный компонент в обеспечении стабильности матрикса; как субстрат процесса переноса генов посредством трансформации компетентных сестринских бактерий; как нутриент и как протекторный фактор бактерий биопленок. Снижение содержания eDNA дестабилизирует матрикс, что способствует высвобождению бактерий из биопленок и, как следствие, повышению чувствительности патогенов к действию антибактериальных средств. Расщепление молекул eDNA ДНКазой представляет собой один из путей деградации матрикса биопленок и преодоления бактериальной антибиотикорезистентности, связанной с формированием биопленок. Показано, что ДНКазы, в частности ДНКаза I, ДНКаза 1L2, нуклеаза NucB, достаточно эффективно разрушают «молодые» биопленки различных грамотрицательных и грамположительных бактерий. В настоящее время ДНКазы рассматриваются как возможные модели будущих антибиопленочных лекарственных средств. Ввиду отсутствия долгосрочной активности и ограниченной глубины проникновения при диспергировании биопленок данных препаратов разработан и синтезирован нанотехнологический ДНК-миметический искусственный фермент, который обладает высоким уровнем ДНКаза-подобной антибиопленочной активности. В клинической практике при лечении инфекций у больных с муковисцидозом успешно используется высокоочищенная человеческая рекомбинантная ДНКаза I — дорназа альфа.
Extracellular bacterial DNA (eDNA) is actively involved in the formation and vital activity of biofilms, acting as a major structural component of the matrix. The release of eDNA into the biofilm continuum is due to bacterial cell lysis and active secretion by a lysis-independent mechanism. Molecules of eDNA are present in species-specific amounts in biofilms of different microorganisms and are organized as clear morphological formations forming mesh structures or filamentous networks. The importance of eDNA in maintaining matrix stability is particularly high in the early stages of biofilm development. EDNA is involved in biofilms: as a factor contributing to bacterial adhesion, biofilm formation, and extracellular matrix production; as a structural component in ensuring matrix stability; as a substrate for the process of gene transfer through transformation of competent sister bacteria; as a nutrient and as a protective factor of bacterial biofilms. Reducing the content of eDNA destabilizes the matrix, which promotes the release of bacteria from biofilms and, as a consequence, increases the sensitivity of pathogens to the action of antibacterial agents. Cleavage of eDNA molecules by DNase is one of the ways of degradation of the biofilm matrix and overcoming bacterial antibiotic resistance associated with biofilm formation. It has been shown that DNases, in particular DNase I, DNase 1L2, NucB nuclease, effectively destroy young biofilms of different Gram-negative and Gram-positive bacteria. Currently, DNases are considered as possible models of future antibiofilm drugs. Given the lack of long-term activity and the limited depth of penetration in the dispersion of biofilms of these drugs, a nanotechnological DNA mimetic artificial enzyme was developed and synthesized, which has a high level of DNase-like antibiofilm activity. In the clinical practice, highly purified human recombinant DNase I — dornase alpha — is being successfully used in the treatment of infections in patients with cystic fibrosis.
бактеріальні біоплівки; диспергування; ДНКази
бактериальные биопленки; диспергирование; ДНКазы
bacterial biofilms; dispersion; DNases
Введение
Внеклеточная бактериальная ДНК (extracellular DNA, eDNA) функционирует в биопленках в качестве структурного компонента матрикса биопленки и участвует в бактериальной адгезии, агрегации и горизонтальном переносе генов от бактерии к бактерии [8]. Кроме фундаментальной роли в формировании биопленки бактериальная eDNA изменяет чувствительность к термическому воздействию специфических протеинов сыворотки крови человека, способствуя приобретению ими термостойкости. Протеины, которые становятся термостойкими после воздействия eDNA, получили название «Tetz-proteins». Протеины сыворотки крови человека, которые становятся термостойкими после обработки бактериальной eDNA, ассоциированы с развитием рака [39].
Учитывая, что бактериальная eDNA действует как клей, сцепляющий бактериальные клетки, ее можно рассматривать как потенциальную мишень для контроля стабильности биопленки и восприимчивости бактерий к действию антибиотиков. Дестабилизация биопленок за счет снижения концентрации eDNA наблюдается при обработке биопленок ДНКазами во время образования биопленки или после него. Элиминация eDNA снижает уровень стабильности матрикса, которая, если не в состоянии разрушить биопленку, увеличивает восприимчивость бактерий к действию антибиотиков [29].
Внеклеточная бактериальная ДНК
Внеклеточная бактериальная ДНК активно секретируется микроорганизмами и является одним из структурных компонентов внеклеточного матрикса биопленки, который играет особенно важную роль при ее формировании [9, 31].
Многочисленные микроорганизмы способны высвобождать eDNA при помощи различных механизмов (табл. 1).
В биопленках свободная eDNA, естественным образом высвобождаемая при лизисе бактериальных клеток и за счет активной секреции лизис-независимым механизмом, представлена в достаточно высоких концентрациях [28].
Полагают, что eDNA участвует в биопленках: 1) как фактор, способствующий адгезии бактерий, образованию биопленки и продукции внеклеточного матрикса; 2) как структурный компонент в обеспечении стабильности матрикса; 3) как субстрат процесса переноса генов посредством трансформации компетентных сестринских бактерий; 4) как нутриент и 5) как протекторный фактор бактерий биопленок [15].
Участие eDNA в адгезии бактерий и в формировании матрикса биопленки
Адгезия планктонных бактериальных клеток к биологической поверхности является первым этапом формирования биопленки, который состоит из двух фаз: в первой фазе адгезии основную роль в привязывании бактерий к биологической поверхности играют вандерваальсовы силы, а во второй — специфическое взаимодействие бактериальных адгезинов с их рецепторами. Внеклеточная бактериальная ДНК принимает участие в обеих фазах адгезии микроорганизмов [28]. Установлено, что eDNA адсорбируется на поверхности отдельных бактериальных клеток в структурах, образуя длинные петли, которые простираются до 300 нм от поверхности клетки. Петли eDNA, которая связана с планктонными бактериями, электростатически взаимодействуют с мембраной клеток оболочек макроорганизма и заякоривают бактерии в первой фазе их прикрепления. Как только расстояние между бактерией и мембраной клетки макроорганизма уменьшается до нескольких нанометров, вступают в действие спе–цифические взаимодействия второй фазы адгезии. Молекулы eDNA, связанные с поверхностью бактерии, могут взаимодействовать с ДНК-связывающими протеинами [1, 5, 6].
Derek E. Moormeier и соавт. [23] показали, что в процессе адгезии бактерий Staphylococcus aureus eDNA играет более значительную роль, чем компоненты микробной поверхности, распознающие адгезиновые белки адгезивной матрицы (microbial surface components recognizing adhesive matrix molecules, MSCRAMM). В частности, данные авторы продемонстрировали, что мутантные штаммы с дефицитом продукции протеинов MSCRAMM, включая фибронектин-связывающие белки A и B, экстрацеллюлярный матрикс и плазма-связывающий протеин, клэмпинг-факторы A и B, протеин A, эластин-связывающий протеин, протеины семейства Sas и белки семейства серин-аспартатных повторов, формировали биопленки, которые были неотличимы от биопленок бактерий дикого типа.
Молекулы eDNA, обладая гидрофобностью, способствуют взаимодействию бактериальных адгезинов и с их специфическими рецепторами [28].
Установлено, что eDNA представляет собой фактор, который необходим для формирования бактериальной биопленки. На этих ранних этапах формирования биопленки eDNA широко распространяется по поверхности пораженной слизистой оболочки и способствует распространению подвижных бактериальных клеток [12, 13]. Во время формирования верхней части грибовидной структуры происходит перераспределение eDNA, ее молекулы концентрируются между верхней частью «ножки» и «шляпкой». Бактериальные клетки, взаимодействуя при помощи пилей IV типа с eDNA, перемещаются к вершине биопленки, где и продуцируют сигнальные молекулы QS [30]. Alejandra L. Ibáñez de Aldecoa и соавт. [15] полагают, что eDNA является хемоаттрактантом или структурным полимером, который необходим подвижным бактериальным клеткам для их миграции к верхушке «ножки» и для формирования структуры «шляпки» биопленки.
Значение eDNA как структурного компонента биопленки
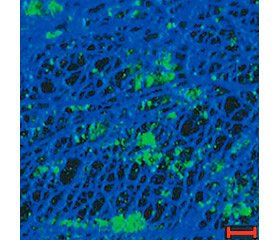
Внеклеточная бактериальная ДНК присутствует в видоспецифических количествах в биопленках различных микроорганизмов в виде четких морфологических образований, формирующих сетчатые структуры или нитевидные сети (рис. 1) [24].
Ключевая роль eDNA для структурной стабильности биопленки продемонстрирована при помощи воздействия на биопленку ДНКазы: обработка ДНКазой биопленок сопровождается деструкцией биопленки [46]. Значимость eDNA в поддержании стабильности матрикса особенно высока на ранних стадиях развития биопленки. Обработка ДНКазой приводит к быстрому диспергированию вновь образованных биопленок, но практически не влияет на стабильность зрелых биопленок [34, 35].
Внеклеточная бактериальная ДНК взаимодействует с различными компонентами матрикса, участвуя в формировании и стабилизации бактериальной биопленки (рис. 2).
Взаимодействие eDNA с полисахаридами приводит к образованию сети волокон, функционирующих как «скелет» биопленки, на котором существует бактериальная колония. Внеклеточная бактериальная ДНК обеспечивает прикрепление бактериальных клеток друг к другу даже в планктонных культурах, стабилизирует биопленку и обеспечивает устойчивость даже к таким разрушающим агентам, как детергент додецилсульфат натрия. Более того, было доказано, что eDNA может взаимодействовать с молекулами Pel, которые играют существенную роль в поддержании межклеточных взаимодействий в биопленках и способствуют резистентности к действию антибиотиков [16, 21, 33].
Роль eDNA в восстановлении повреждений ДНК и горизонтальном переносе генов
Горизонтальный перенос генов между бактериальными клетками был открыт в 1928 году. В последующем было установлено, что значительная часть большинства бактериальных геномов состоит из горизонтально приобретенных генов и что горизонтальный перенос генов (Horizontal gene transfer, HGT) является важным фактором эволюции бактерий. Пул eDNA бактериальных биопленок обеспечивает субстрат для естественной генетической трансформации, которая является единственной альтернативой мобильным генетическим элементам и бактериофаговому переносу генов. Пул eDNA функционирует как резервуар утраченных последовательностей, которые могут быть быстро восстановлены путем поглощения ДНК [22, 41].
Установлено, что биопленочные бактериальные клетки активно отдают ДНК своим прокариотическим соседям. Лизис субпопуляции клеток во время формирования биопленки, по-видимому, есть обычное явление. Внеклеточная бактериальная ДНК, высвобождаемая при бактериальном лизисе, доступна для HGT компетентным клеткам. Такой горизонтальный перенос генов облегчается биопленочным образом жизни, который характеризуется очень близким расположением друг к другу соседствующих бактерий [28].
Значение eDNA как бактериального продукта питания
Внеклеточная бактериальная ДНК для бактерий является потенциальным источником нутриентов, особенно фосфатов, и энергии [32, 47]. Бактерии могут поглощать как нуклеозиды или нуклеотиды, так и целые молекулы eDNA. Те бактерии, которые обладают способностью продуцировать внеклеточные нуклеазы, чтобы расщепить молекулу eDNA, преимущественно поглощают нуклеозиды или нуклеотиды в качестве нутриентов. Бактерии, поглощающие молекулы eDNA, используют ее и в качестве питательного вещества, и в качестве субстрата, пригодного для модификации генома [18].
Защитная роль eDNA
Внеклеточная бактериальная ДНК играет свою протекторную роль в поддержании структурной стабильности биопленки. В частности, она уменьшает способность противомикробных веществ транспортироваться через матрикс [10]. Также eDNA способна хелатировать катионы, например магния, что способствует увеличению уровня патогенности бактерий или их устойчивости к действию антибактериальных средств. Благодаря своему отрицательному заряду eDNA действует как хелатор катионных противомикробных препаратов и может выступать как система защиты от действия аминогликозидов [4].
Таким образом, eDNA можно рассматривать как потенциальную мишень для медикаментозного контроля жизнедеятельности биопленки, так как деградация молекулы eDNA и ее дестабилизация взаимодействий с другими компонентами матрицы приводит к разрушению биопленки и повышению восприимчивости бактерий к действию антибиотиков [41]. Одним из эффективных путей медикаментозного влияния на eDNA биопленки является применение дезоксирибонуклеаз [19].
Антибиопленочная активность дезоксирибонуклеаз
Продемонстрировано, что обработка дезоксирибонуклеазой I (ДНКаза I) биопленки, сформированной бактериями, в частности Pseudomonas aeruginosa, приводит к разрушению биопленки [43]. В последующем было установлено, что ДНКаза I проявляет деградирующую активность против биопленок многочисленных грамотрицательных, грамположительных бактерий и грибов (табл. 2) [17].
Эффективность антибиопленочного действия ДНКазы зависит от возраста биопленки: после определенного времени существования биопленки она приобретает устойчивость к действию ДНКаз. Переход в резистентную к действию ДНКаз форму наступает у биопленки, сформированной бактериями Staphylococcus epidermidis, через 12 часов, бактериями Pseudomonas aeruginosa — через 80 часов, бактериями Vibrio choleraе — через 72 часа [29].
ДНКаза I
ДНКаза I поджелудочной железы расщепляет молекулу eDNA, тем самым дестабилизируя архитектуру матрикса биопленки [11]. ДНКаза I разрушает биопленки, сформированные различными микроорганизмами, включая Acinetobacter baumannii, Aggregatibacter actinomycetemcomitans, Bdellovibrio bacteriovorus, Bordetella bronchiseptica, Bordetella pertussis, Campylobacter jejuni, Enterococcus faecalis, Escherichia coli, Haemophilus influenzae, Klebsiella pneumoniae, Listeria monocytogenes, Pseudomonas aeruginosa, Shewanella oneidensis, Staphylococcus aureus, Streptococcus pyogenes, Vibrio cholerae, Candida albicans и Aspergillus fumigatus [8].
Дорназа альфа
Дорназа альфа представляет собой высокоочищенную человеческую рекомбинантную ДНКазу I, которая выпускается в виде аэрозоля для лечения инфекций, вызванных бактериями Pseudomonas aeruginosa, у больных с муковисцидозом [25, 37, 42, 44, 45].
ДНКаза 1L2
Человеческая ДНКаза 1L2 (deoxyribonuclease I-like 1 and 2 genes) принадлежит к семейству ДНКаз I (EC3.1.21.1) и является специфической эндонуклеазой кератиноцитов, играющей существенную роль в деградации ДНК во время терминальной дифференцировки эпидермальных кератиноцитов. ДНКаза 1L2 обладает способностью дезагрегировать биопленки, сформированные бактериями Pseudomonas aeruginosa и Staphylococcus aureus [7, 40].
Лямбда-экзонуклеазы
Andrea Seper и соавт. [34] установили, что представители семейства лямбда-экзонуклеаз Dns (VC0470) и Xds (VC2621) бактерий Vibrio choleraе обладают способностью разрушать сформированные биопленки. Делеция Xds и Dns приводит к значительному увеличению образования биопленки. Авторы считают, что экзонуклеазы контролируют уровень eDNA в биопленке, участвуют в развитии трехмерной структуры биопленки, отделении бактерий от зрелой биопленки и использовании eDNA в качестве источника питательных веществ.
Нуклеаза NucB
Бактериальная нуклеаза NucB, продуцируемая морской бактерией Bacillus licheniformis, быстро разрушает биопленки как грамположительных, так и грамотрицательных бактерий [27]. Установлено, что нуклеаза NucB способна вызывать деградацию биопленок, сформированных бактериями Bacillus licheniformis, Bacillus subtilis, Escherichia coli, Micrococcus luteus, Streptococcus anginosus, Staphylococcus aureus, Streptococcus constellatus, Staphylococcus epidermidis, Staphylococcus lugdunesis, Streptococcus salivarius, Streptococcus intermedius [8, 36].
Нуклеаза NucM
Представитель семейства нуклеаз bba-металлического пальца нуклеаза NucM принимает участие в деградации биопленки, сформированной бактериями Moraxella catarrhalis, и увеличивает способность выживания у бактериальных клеток in vivo [38].
Нуклеаза DeoC
Нуклеаза DeoC бактерий Streptococcus mutans способствует распространению инфекционного процесса за счет диспергирования биопленки. Jia Liu и соавт. [20] предложена модель нуклеазозависимого диспергирования бактерий Streptococcus mutans. Авторы полагают, что при созревании биопленки нуклеаза DeoC выполняет деградацию молекул eDNA матрикса, способствуя высвобождению бактериальных клеток из биопленки. Диспергированные бактерии избегают гибели, опо–средованной нейтрофильными внеклеточными ловушками (neutrophil extracellular traps, NET), благодаря DeoC-опосредованной деградации NET. Впоследствии выжившие бактерии прикрепляются к новым локусам и образуют новые биопленки (рис. 3).
Стрептодорназа
Стрептодорназа (варидаза) представляет собой стрептококковую ДНКазу, которая обладает способностью разрушать биопленку, сформированную бактериями Pseudomonas aeruginosa. Полагают, что варидаза может быть использована при лечении инфекции мочевыводящих путей, вызванной бактериями Pseudomonas aeruginosa [26].
Искусственные нанотехнологические ферменты
Создан ДНК-миметический искусственный фермент (DNase-mimetic artificial enzyme, DMAE), который представляет собой синтетическую металлонуклеазу, состоящую из пассивированных кластеров золота со множественными комплексами церия (IV) на поверхности коллоидных магнитных частиц ядра/оболочки Fe3O4/SiO2. Фермент DMAE обладает высоким уровнем ДНКаза-подобной антибиопленочной активности, эксплуатационной стабильности, способности к восстановлению. Также DMAE усиливает эффективность традиционных антибиотиков при формировании бактериальной биопленки [2, 3].
Выводы
В формировании и жизнедеятельности биопленок участвует внеклеточная бактериальная ДНК, которая выступает в качестве структурного компонента матрикса, предопределяет бактериальную адгезию бактерий, участвует в горизонтальном переносе генов, защищает бактерии от экзогенных антибактериальных веществ и обеспечивает бактерии энергией. Снижение содержания eDNA дестабилизирует матрикс, что способствует высвобождению бактерий из биопленок и, как следствие, повышению чувствительности патогенов к действию антибактериальных средств. Расщепление молекул eDNA ДНКазой представляет собой один из путей деградации матрикса биопленок и преодоления бактериальной антибиотикорезистентности, связанной с формированием биопленок. Показано, что ДНКазы, в частности ДНКаза I, ДНКаза 1L2, нуклеаза NucB, достаточно эффективно разрушают «молодые» биопленки различных грамотрицательных и грамположительных бактерий. В настоящее время ДНКазы рассматриваются как возможные модели будущих антипленочных лекарственных средств. Ввиду отсутствия долгосрочной активности и ограниченной глубины проникновения при диспергировании биопленок данных препаратов разработан и синтезирован нанотехнологический ДНК-миметический искусственный фермент, который обладает высоким уровнем ДНКаза-подобной антибиопленочной активности. В клинической практике при лечении инфекций у больных с муковисцидозом успешно используется высокоочищенная человеческая рекомбинантная ДНКаза I — дорназа альфа. Альтернативой препаратам ДНКаз считают индукторы продукции бактериальных нуклеаз, использование которых может привести к снижению содержания eDNA в биопленке и ее диспергированию. Однако триггеры синтеза внеклеточных нуклеаз у различных бактерий отличаются друг от друга, что затрудняет разработку лекарственных средств, обладающих влиянием на широкий спектр бактерий.
Конфликт интересов. Автор заявляет об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
1. Arenas J., Tommassen J. Meningococcal Biofilm Formation: Let’s Stick Together. Trends Microbiol. 2017 Feb. 25(2). 113-124. doi: 10.1016/j.tim.2016.09.005.
2. Chen Z., Ji H., Liu C. et al. A Multinuclear Metal Complex Based DNase-Mimetic Artificial Enzyme: Matrix Cleavage for Combating Bacterial Biofilms. Angew Chem. Int. Ed. Engl. 2016 Aug 26. 55(36). 10732-6. doi: 10.1002/anie.201605296.
3. Chen Z., Wang Z., Ren J., Qu X. Enzyme Mimicry for Combating Bacteria and Biofilms. Acc. Chem. Res. 2018 Mar 20. 51(3). 789-799. doi: 10.1021/acs.accounts.8b00011.
4. Chiang W.C., Nilsson M., Jensen P.Ø. et al. Extracellular DNA shields against aminoglycosides in Pseudomonas aeruginosa biofilms. Antimicrob. Agents Chemother. 2013 May. 57(5). 2352-61. doi: 10.1128/AAC.00001-13.
5. Das T., Sehar S., Koop L. et al. Influence of calcium in extracellular DNA mediated bacterial aggregation and biofilm formation. PLoS One. 2014 Mar 20. 9(3). e91935. doi: 10.1371/journal.pone.0091935.
6. Das T., Sharma P.K., Busscher H.J. et al. Role of extracellular DNA in initial bacterial adhesion and surface aggregation. Appl. Environ. Microbiol. 2010 May. 76(10). 3405-8. doi: 10.1128/AEM.03119-09.
7. Eckhart L., Fischer H., Barken K.B. et al. DNase1L2 suppresses biofilm formation by Pseudomonas aeruginosa and Staphylococcus aureus. Br. J. Dermatol. 2007 Jun. 156(6). 1342-5.
8. Fleming D., Rumbaugh K.P. Approaches to Dispersing Medical Biofilms. Microorganisms. 2017 Apr 1. 5(2). pii: E15. doi: 10.3390/microorganisms5020015.
9. Flemming H.C., Wingender J., Szewzyk U. et al. Biofilms: an emergent form of bacterial life. Nat. Rev. Microbiol. 2016 Aug 11. 14(9). 563-75. doi: 10.1038/nrmicro.2016.94.
10. Flemming H.C., Wingender J. The biofilm matrix. Nat. Rev. Microbiol. 2010 Sep. 8(9). 623-33. doi: 10.1038/nrmicro2415.
11. Gbejuade H.O., Lovering A.M., Webb J.C. The role of microbial biofilms in prosthetic joint infections. Acta Orthop. 2015 Apr. 86(2). 147-58. doi: 10.3109/17453674.2014.966290.
12. Gloag E.S., Elbadawi C., Zachreson C.J. et al. Micro-Patterned Surfaces That Exploit Stigmergy to Inhibit Biofilm Expansion. Front. Microbiol. 2017 Jan 23. 7. 2157. doi: 10.3389/fmicb.2016.02157.
13. Gloag E.S., Turnbull L., Huang A. et al. Self-organization of bacterial biofilms is facilitated by extracellular DNA. Proc. Natl. Acad. Sci U S A. 2013 Jul 9. 110(28). 11541-6. doi: 10.1073/pnas.1218898110.
14. Goodman S.D., Obergfell K.P., Jurcisek J.A. et al. Biofilms can be dispersed by focusing the immune system on a common family of bacterial nucleoid-associated proteins. Mucosal. Immunol. 2011 Nov. 4(6). 625-37. doi: 10.1038/mi.2011.27.
15. Ibáñez de Aldecoa A.L., Zafra O., González-Pastor J.E. Mechanisms and Regulation of Extracellular DNA Release and Its Biological Roles in Microbial Communities. Front. Microbiol. 2017 Jul 26. 8. 1390. doi: 10.3389/fmicb.2017.01390.
16. Jennings L.K., Storek K.M., Ledvina H.E. et al. Pel is a cationic exopolysaccharide that cross-links extracellular DNA in the Pseudomonas aeruginosa biofilm matrix. Proc. Natl. Acad. Sci U S A. 2015 Sep 8. 112(36). 11353-8. doi: 10.1073/pnas.1503058112.
17. Kaplan J.B. Biofilm matrix-degrading enzymes. Methods Mol. Biol. 2014. 1147. 203-13. doi: 10.1007/978-1-4939-0467-9_14.
18. Lennon J.T. Diversity and metabolism of marine bacteria cultivated on dissolved DNA. Appl. Environ. Microbiol. 2007 May. 73(9). 2799-805. doi: 10.1128/AEM.02674-06.
19. Li X.H., Lee J.H. Antibiofilm agents: A new perspective for antimicrobial strategy. J. Microbiol. 2017 Oct. 55(10). 753-766. doi: 10.1007/s12275-017-7274-x.
20. Liu J., Sun L., Liu W. et al. A Nuclease from Streptococcus mutans Facilitates Biofilm Dispersal and Escape from Killing by Neutrophil Extracellular Traps. Front. Cell. Infect. Microbiol. 2017 Mar 28. 7. 97. doi: 10.3389/fcimb.2017.00097.
21. Marmont L.S., Whitfield G.B., Rich J.D. et al. PelA and PelB proteins form a modification and secretion complex essential for Pel polysaccharide-dependent biofilm formation in Pseudomonas aeruginosa. J. Biol. Chem. 2017 Nov 24. 292(47). 19411-19422. doi: 10.1074/jbc.M117.812842.
22. Merod R.T., Wuertz S. Extracellular polymeric substance architecture influences natural genetic transformation of Acinetobacter baylyi in biofilms. Appl. Environ. Microbiol. 2014 Dec. 80(24). 7752-7. doi: 10.1128/AEM.01984-14.
23. Moormeier D.E., Bose J.L., Horswill A.R., Bayles K.W. Temporal and stochastic control of Staphylococcus aureus biofilm development. MBio. 2014 Oct 14. 5(5). e01341-14. doi: 10.1128/mBio.01341-14.
24. Nagler M., Insam H., Pietramellara G., Ascher-Jenull J. Extracellular DNA in natural environments: features, relevance and applications. Appl. Microbiol. Biotechnol. 2018 Aug. 102(15). 6343-6356. doi: 10.1007/s00253-018-9120-4.
25. Nair A., Perry A., Perry J.D., Gould F.K., Samuel J. In vitro effects of combined iron chelation, antibiotics and matrix disruption on clinical isolates of Pseudomonas aeruginosa. J. Antimicrob. Chemother. 2019 Dec 17. pii: dkz505. doi: 10.1093/jac/dkz505.
26. Nemoto K., Hirota K., Murakami K. et al. Effect of Varidase (streptodornase) on biofilm formed by Pseudomonas aeruginosa. Chemotherapy. 2003 Jun. 49(3). 121-5. doi: 10.1159/000070617.
27. Nijland R., Hall M.J., Burgess J.G. Dispersal of biofilms by secreted, matrix degrading, bacterial DNase. PLoS One. 2010 Dec 14. 5(12). e15668. doi: 10.1371/journal.pone.0015668.
28. Okshevsky M., Meyer R.L. The role of extracellular DNA in the establishment, maintenance and perpetuation of bacterial biofilms. Crit. Rev. Microbiol. 2015. 41(3). 341-52. doi: 10.3109/1040841X.2013.841639.
29. Okshevsky M., Regina V.R., Meyer R.L. Extracellular DNA as a target for biofilm control. Curr. Opin. Biotechnol. 2015 Jun. 33. 73-80. doi: 10.1016/j.copbio.2014.12.002.
30. Piepenbrink K.H. DNA Uptake by Type IV Filaments. Front. Mol. Biosci. 2019 Feb 5. 6. 1. doi: 10.3389/fmolb.2019.00001.
31. Rose S., Bermudez L.E. Identification of Bicarbonate as a Trigger and Genes Involved with Extracellular DNA Export in Mycobacterial Biofilms. MBio. 2016 Dec 6. 7(6). pii: e01597-16. doi: 10.1128/mBio.01597-16.
32. Salter I. Seasonal variability in the persistence of dissolved environmental DNA (eDNA) in a marine system: The role of microbial nutrient limitation. PLoS One. 2018 Feb 23. 13(2). e0192409. doi: 10.1371/journal.pone.0192409.
33. Senpuku H., Mohri S., Mihara M. et al. Effects of 7S globulin 3 derived from the adzuki bean [Vigna angularis] on the CSPand eDNAdependent biofilm formation of Streptococcus mutans. Arch. Oral. Biol. 2019 Jun. 102. 256-265. doi: 10.1016/j.archoralbio.2019.04.010.
34. Seper A., Fengler V.H., Roier S. et al. Extracellular nucleases and extracellular DNA play important roles in Vibrio cholerae biofilm formation. Mol. Microbiol. 2011 Nov. 82(4). 1015-37. doi: 10.1111/j.1365-2958.2011.07867.x.
35. Sharma P., Garg N., Sharma A., Capalash N., Singh R. Nucleases of bacterial pathogens as virulence factors, therapeutic targets and diagnostic markers. Int. J. Med. Microbiol. 2019 Dec. 309(8). 151354. doi: 10.1016/j.ijmm.2019.1.
36. Shields R.C., Mokhtar N., Ford M. et al. Efficacy of a marine bacterial nuclease against biofilm forming microorganisms isolated from chronic rhinosinusitis. PLoS One. 2013. 8(2). e55339. doi: 10.1371/journal.pone.0055339.
37. Southern K.W., Clancy J.P., Ranganathan S. Aerosolized agents for airway clearance in cystic fibrosis. Pediatr. Pulmonol. 2019 Jun. 54(6). 858-864. doi: 10.1002/ppul.24306.
38. Tan A., Li W.S., Verderosa A.D. et al. Moraxella catarrhalis NucM is an entry nuclease involved in extracellular DNA and RNA degradation, cell competence and biofilm scaffolding. Sci Rep. 2019 Feb 22. 9(1). 2579. doi: 10.1038/s41598-019-39374-0.
39. Tetz V., Tetz G. Bacterial DNA induces the formation of heat-resistant disease-associated proteins in human plasma. Sci Rep. 2019 Nov 29. 9(1). 17995. doi: 10.1038/s41598-019-54618-9.
40. Ueki M., Takeshita H., Kimura-Kataoka K. et al. Identification of functional SNPs potentially served as a genetic risk factor for the pathogenesis of parakeratosis in the gene encoding human deoxyribonuclease I-like 2 (DNase 1L2) implicated in terminal differentiation of keratinocytes. Gene. 2015 Apr 25. 561(1). 15-22. doi: 10.1016/j.gene.2015.01.006.
41. Vorkapic D., Pressler K., Schild S. Multifaceted roles of extracellular DNA in bacterial physiology. Curr. Genet. 2016 Feb. 62(1). 71-9. doi: 10.1007/s00294-015-0514-x.
42. Wagener J.S., Kupfer O. Dornase alfa (Pulmozyme). Curr. Opin. Pulm. Med. 2012 Nov. 18(6). 609-14. doi: 10.1097/MCP.0b013e328358d51f.
43. Whitchurch C.B., Tolker-Nielsen T., Ragas P.C., Mattick J.S. Extracellular DNA required for bacterial biofilm formation. Science. 2002 Feb 22. 295(5559). 1487.
44. Yang C., Chilvers M., Montgomery M., Nolan S.J. Dornase alfa for cystic fibrosis. Cochrane Database Syst. Rev. 2016 Apr 4. 4. CD001127. doi: 10.1002/14651858.CD001127.pub3.
45. Yang C., Montgomery M. Dornase alfa for cystic fibrosis. Cochrane Database Syst. Rev. 2018 Sep 6. 9. CD001127. doi: 10.1002/14651858.CD001127.pub4.
46. Ye J., Shao C., Zhang X. et al. Effects of DNase I coating of titanium on bacteria adhesion and biofilm formation. Mater. Sci. Eng. C Mater. Biol. Appl. 2017 Sep 1. 78. 738-747. doi: 10.1016/j.msec.2017.04.078.
47. Zhu X., Dordet-Frisoni E., Gillard L. et al. Extracellular DNA: A Nutritional Trigger of Mycoplasma bovis Cytotoxicity. Front. Microbiol. 2019 Nov 29. 10. 2753. doi: 10.3389/fmicb.2019.02753.

/147-1.jpg)
/149-1.jpg)
/151-1.jpg)
/150-1.jpg)