Журнал «Здоровье ребенка» Том 15, №5, 2020
Вернуться к номеру
Роль основних ефекторних клітин вродженої імунної системи в розвитку метазапалення жирової тканини при ожирінні
Авторы: Абатуров О.Є., Нікуліна А.O.
ДЗ «Дніпропетровська медична академія Міністерства охорони здоров’я України», м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
У літературному огляді наведені сучасні уявлення стосовно ролі основних ефекторних клітин вродженої імунної системи (макрофагів, нейтрофілів, моноцитарних клітин) у розвитку ожиріння. Відповідно до сучасної концепції, ожиріння розглядається як захворювання, що перебігає з розвитком хронічної запальної реакції з низьким рівнем активності, яка отримала назву метазапалення. Молекулярні особливості індукованого надмірною масою тіла метазапалення викликають особливий практичний інтерес в умовах пандемії ожиріння в людській популяції. Розвиток ожиріння супроводжується підвищенням рівня вільних жирних кислот у жировій тканині. Вільні жирні кислоти, взаємодіючи з TLR4 і TLR2 адипоцитів, активують сигнальні шляхи NF-κB і MAPK8, що призводить до продукції прозапальних цитокінів та хемокінів. Запальна реакція при ожирінні в результаті надмірного накопичення жиру в адипоцитах і характеризується зміною спектра синтезованих ними продуктів: зниженням рівня секреції адипонектину, IL-10, TGF-β; посиленням синтезу резистину, лептину, CCL2, IL-6, TNF-α. Ці зміни спектра синтезованих адипокінів і цитокінів, які впливають на жирову тканину протягом відносно тривалого періоду часу, призводять до рекрутування різноманітних імуноцитів в метаболічно активні регіони жирової тканини й порушення адипогенезу. Наведені дані щодо розбіжностей патофізіологічних процесів формування метазапалення підшкірної та вісцеральної жирової тканини, що характеризується особливостями як за рівнем рекрутованих імуноцитів, так і за механізмами кліренсу запалених та гіпертрофованих адипоцитів. У підшкірній жировій тканині переважно спостерігається гіпертрофія, а у вісцеральній жировій тканині — гіпертрофія й гіперплазія адипоцитів, що значною мірою і зумовлює формування ускладненого перебігу ожиріння та інсулінорезистентності. Виділення ключових прозапальних факторів, асоційованих з ожирінням, дозволить знайти нові терапевтичні підходи до профілактики та лікування метаболічних порушень, які загрожують здоров’ю та життю хворих.
В литературном обзоре представлены современные данные о роли основных эффекторных клеток врожденной иммунной системы (макрофагов, нейтрофилов, моноцитарных клеток) в развитии ожирения. Согласно современной концепции, ожирение рассматривается как заболевание, протекающее с развитием хронической воспалительной реакции с низким уровнем активности, которая получила название метавоспаление. Молекулярные особенности индуцированного избыточной массой тела метавоспаления вызывают особый практический интерес в условиях пандемии ожирения в человеческой популяции. Развитие ожирения сопровождается повышением уровня свободных жирных кислот в жировой ткани. Свободные жирные кислоты, взаимодействуя с TLR4 и TLR2 адипоцитов, активируют сигнальные пути NF-κB и MAPK8, что приводит к продукции провоспалительных цитокинов и хемокинов. Воспалительная реакция при ожирении в результате избыточного накопления жира в адипоцитах характеризуется изменением спектра синтезируемых ими продуктов: снижением уровня секреции адипонектина, IL-10, TGF-β; усилением синтеза резистина, лептина, CCL2, IL-6, TNF-α. Данные изменения спектра синтезированных адипокинов и цитокинов, которые влияют на жировую ткань в течение относительно длительного периода времени, приводят к рекрутированию различных иммуноцитов в метаболически активные регионы жировой ткани и нарушению адипогенеза. Представлены данные о различиях патофизиологических процессов формирования метавоспаления в подкожной и висцеральной жировой ткани, характеризующегося особенностями как по уровню рекрутируемых иммуноцитов, так и по механизмам клиренса воспаленных и гипертрофированных адипоцитов. В подкожной жировой ткани преимущественно наблюдается гипертрофия, а в висцеральной жировой ткани — гипертрофия и гиперплазия адипоцитов, что в значительной мере и обусловливает формирование осложненного течения ожирения и инсулинорезистентности. Выделение ключевых провоспалительных факторов, ассоциированных с ожирением, позволит найти новые терапевтические подходы к профилактике и лечению метаболических нарушений, которые несут угрозу здоровью и жизни больных.
The literature review presents modern data on the role of the main effector cells of the innate immune system (macrophages, neutrophils, monocytic cells) in the development of obesity. According to the modern concept, obesity is considered as a disease proceeding with the development of a chronic inflammatory reaction with a low level of activity, which is called meta-inflammation. The molecular features of overweight-induced meta-inflammation are of particular practical interest in the context of an obesity pandemic in the human population. The development of obesity is accompanied by an increase in the level of free fatty acids in adipose tissue. Free fatty acids, interacting with TLR4 and TLR2 of adipocytes, activate the signaling pathways NF-κB and MAPK8, which leads to the production of pro-inflammatory cytokines and chemokines. The inflammatory response in obesity as a result of excessive accumulation of fat in adipocytes is characterized by a change in the spectrum of products synthesized by them: a decrease in the level of secretion of adiponectin, IL-10, TGF-β; increased synthesis of resistin, leptin, CCL2, IL-6, TNF-α. These changes in the spectrum of synthesized adipokines and cytokines, which affect adipose tissue over a relatively long period of time, lead to the recruitment of various immunocytes into metabolically active regions of adipose tissue and impairment of adipogenesis. The data are provided on the differences in the pathophysiological processes of the formation of meta-inflammation in the subcutaneous and visceral adipose tissues characterized by features both in the level of recruited immunocytes and in the mechanisms of clearance of inflamed and hypertrophied adipocytes. In the subcutaneous adipose tissue, hypertrophy is predominantly observed, and in the visceral adipose tissue — hypertrophy and hyperplasia of adipocytes, which to a large extent determines the formation of a complicated course of obesity and insulin resistance. Isolation of the key pro-inflammatory factors associated with obesity will make it possible to find new therapeutic approaches to the prevention and treatment of metabolic disorders that threaten the health and life of patients.
ожиріння; метазапалення; жирова тканина; вроджена імунна система; адипогенез; огляд
ожирение; метавоспаление; жировая ткань; врожденная иммунная система; адипогенез
obesity; meta-inflammation; adipose tissue; innate immune system; adipogenesis; review
Скорочення: АКМ — активовані кисеньвмісні метаболіти; ВЖТ — вісцеральна біла жирова тканина; ІМТ — індекс маси тіла; ЛПНЩ — ліпопротеїди низької щільності; ПЖТ — підшкірна біла жирова тканина; ВЖК — вільні жирні кислоти (free fatty acids); A2R — аденозиновий рецептор (adenosine receptor 2); ABCA1 — представник 1 субродини А АТФ-зв’язуючої касети (ATP binding cassette subfamily A member 1); ACOD1 — аконітат декарбоксилази 1 (aconitate decarboxylase 1); ARG1 — аргіназа 1 (arginase 1); CARKL — вуглецевоподібна кіназа (carbohydrate kinase-like); CCL2 — ліганд 2 С-С мотиву (C-C motif ligand 2) або MCP-1 моноцитарний хемоатрактантний протеїн 1 (monocyte chemoattractant protein 1); CSF-2 — колонієстимулюючий фактор 2 (colony stimulating factor 2); ECM — екстрацелюлярний матрикс (extracellular matrix); FGF — фактор зростання фібробластів (fibroblast growth factor); FTAP — протеїни, які здійснюють транспорт ВЖК (fatty acid transport proteins); GATA — GATA-зв’язуючий протеїн (GATA binding protein); GS — глутамінсинтетаза (glutamine synthetase); HFD — дієта з високим умістом жиру (high-fat diet); HIF-1a — індукований гіпоксією фактор 1-a (hypoxia-inducible factor 1-a); IDO — індоламіндіоксигеназа (indoleamine dioxygenase); IFN — інтерферон (interferon); IL — інтерлейкін (interleukin); ILC — вроджені лімфоїдні клітини (innate lymphoid cells); iNKT-клітини — інваріантні натуральні Т-клітинні кілери (invariant natural killer T cells); iNOS — індуцибельна синтаза оксиду азоту (inducible nitric oxide synthase); IRF — інтерферон-регуляторний фактор (interferon regulatory factor); IRS-1 — субстрат 1 інсулінового рецептора (insulin receptor substrate 1); KEAP1 — Kelch-подібний ECH-асоційований протеїн 1 ECH (kelch like ECH associated protein 1); KLF4 — Krüppel-подібний фактор 4 (Krüppel-like factor 4); LPS — ліпополісахарид (lipopolysaccharid); LTB4 — лейкотрієн B4 (leukotriene B4); MAPK — мітоген-активована протеїнкіназа (mitogen-activated protein kinase); MAPK8 — мітоген-активована протеїнкіназа 8 (mitogen-activated protein kinase 8); MC — тучна клітина (mast cell); MCP-6 — протеаза 6 тучних клітин (mast cell protease 6); MHC І, ІІ — головний комплекс гістосумісності І, ІІ класу (major histocompatibility complex class І, ІІ); miR — мікроРНК; MMP — матриксна металопептидаза (matrix metallopeptidase); МРО — мієлопероксидаза (myeloperoxidase); Mj — макрофаг; NFE2L2 — ядерний фактор 2, подібний еритроїдному деривату 2 (nuclear factor, erythroid 2 like 2); NF-kB — ядерний фактор каппа — енхансер легкого ланцюга активованих В-клітин (nuclear factor kappa-light-chain-enhancer of activated B cells); NOX2 — НАДФН-оксидаза-2 (NADPH-oxidase-2); PAMP — патоген-асоційовані молекулярні структури (pathogen-associated molecular patterns); PPAR — рецептор, що активується проліфератором пероксисом (peroxisome proliferator-activated receptor); PTGS2 — простагландин-ендопероксидсинтаза 2 (prostaglandin-endoperoxide synthase 2); SCF — фактор стовбурових клітин (stem cell factor); SOCS — супресор цитокінових сигнальних шляхів (suppressor of cytokine signaling); STAT — сигнальний трансдуктор та активатор транскрипції (signal transducer and activator of transcription); TGF — трансформуючий фактор росту (transforming growth factor); TLR — toll-подібний рецептор (toll like receptor); TNF — фактор некрозу пухлини (tumor necrosis factor); UCP1 — мітохондріальний роз’єднувальний протеїн 1 (uncoupling protein 1); VEGF — судинний ендотеліальний фактор росту (vascular endothelial growth factor).
Вступ
Ожиріння в дітей і дорослих індивідуумів є одним із найважливіших цивілізаційних факторів ризику розвитку інсулінорезистентності та серцево-судинних захворювань [2–4].
Відповідно до сучасної концепції, ожиріння розглядається як захворювання, що перебігає з розвитком хронічної запальної реакції з низьким рівнем активності, що отримала назву метазапалення [1, 2, 47, 91]. Запальна реакція при ожирінні спочатку виникає в результаті надмірного накопичення жиру в адипоцитах і зміни спектра продукованих ними продуктів: зниження рівня секреції адипонектину, IL-10, TGF-b; посилення синтезу резистину, лептину, CCL2, IL-6, TNF-a. Ці зміни спектра синтезованих адипокінів і цитокінів, які впливають на жирову тканину протягом відносно тривалого періоду часу, призводять до рекрутування різноманітних імуноцитів в метаболічно активні регіони жирової тканини і порушення адипогенезу [49, 94].
У даний час показано, що метаболічні порушення, індуковані ожирінням, обумовлені впливом метазапалення жирової тканини. Молекулярні особливості індукованого надмірною масою тіла метазапалення викликають особливий практичний інтерес в умовах пандемії ожиріння в людській популяції. Виділення ключових прозапальних факторів, асоційованих з ожирінням, дозволить знайти нові терапевтичні підходи до профілактики та лікування метаболічних порушень, які загрожують здоров’ю та життю хворих.
1. Участь адипоцитів у розвитку метазапалення жирової тканини
Жирова тканина являє собою особливий тип сполучної тканини, яка складається з двох основних компонентів: клітинних популяцій і спеціалізованого ECM [73]. Жирова тканина містить популяції різних типів клітин: приблизно одна третина клітин у жировій тканині — це адипоцити, а решта клітин представлена преадипоцитами, фібробластами, ендотеліальними, стромальними клітинами, макрофагами, MC, еозинофілами, NK-, ILC, iNKT-, abT-, gdT-, B-клітинами та іншими імуноцитами [72, 84]. Структура ECM організована молекулами колагену (фібрилярного I, III типів і нефібрилярного IV, VI, VIII типів), ламініну, фібронектину та протеогліканів. Сукупність клітин неадипоцитарних популяцій і ECM отримала назву стромально-судинної фракції [10, 19].
Розрізняють два основних типи жирової тканини: білу та буру жирову тканину. Біла жирова тканина акумулює енергію у вигляді ліпідних сполук, а бура жирова тканина бере участь у термогенезі, сприяючи виділенню енергії у вигляді тепла. У даний час за морфологічними і функціональними характеристиками розрізняють чотири типи жирових клітин: білі, рожеві, бурі та бежеві адипоцити (рис. 1) [58, 71].
Білий адипоцит являє собою клітину, що може акумулювати ліпіди і має прозапальний профіль секретуючих адипокінів. Рожеві адипоцити — це секретуючі молоко альвеолярні клітини, що з’являються в результаті трансдиференціювання білих адипоцитів під час вагітності та годування груддю. Ці клітини характеризуються наявністю мікроворсинок на апікальній поверхні, цитоплазматичних молоковмісних гранул і численних ліпідних крапель. Рожевий адипоцит відрізняється від білого вищою метаболічною активністю, але низькою прозапальною активністю, описується як клітина з великим потенціалом для накопичення енергії. Бурі та бежеві адипоцити беруть участь у нескорочувальному термогенезі. Вони на внутрішній мембрані мітохондрій експресують UCP1, який роз’єднує окисне фосфорилювання, зумовлюючи виділення тепла. Класичні бурі адипоцити походять від Myf-5+ клітинної лінії; а індуцибельні або бежеві адипоцити, як і білі адипоцити, — від Myf-5neg клітинної лінії. Бежевий адипоцит має найвищу метаболічну активність серед всіх чотирьох типів адипоцитів і здатність виділяти тепло завдяки великій кількості мітохондрій. Усі типи жирових клітин мають ендокринну активність: білі адипоцити продукують низку адипокінів, які впливають на харчову поведінку (лептин) і обмін речовин (наприклад, адипонектин, резистин, адипсин); бурі адипоцити секретують гормони і фактори росту (бетатрофін і FGF21); рожеві адипоцити — компоненти молока і лептин [17, 18, 22, 43, 58, 75].
У системі кровотоку ліпіди знаходяться у вигляді ліпопротеїдів, які несуть триацилгліцериди або ВЖК. Ліпопротеїнліпаза, розташована на поверхні клітинної мембрани адипоцитів, відщеплює від ліпопротеїнів ВЖК, і останні потрапляють в адипоцити за допомогою CD36 і FTAP. Усередині адипоцита ВЖК рестерифікуються в триацилгліцериди й акумулюються в ліпідних крапельках. Надлишок ліпідів стимулює збільшення кількості адипоцитів (гіперплазія жирової тканини) і сприяє збільшенню розмірів адипоцитів (гіпертрофії) [83]. Морфологічні зміни білої жирової тканини, індуковані розвитком ожиріння, супроводжуються і зміною функціональної активності адипоцитів.
Морфофункціональні реакції білої жирової тканини при розвитку ожиріння залежать від її розташування в організмі людини. У фізіологічних умовах ПЖТ характеризується великою кількістю адипоцитів, продукцією лептину при відносно низькому рівні секреції адипонектину та переважанням в ECM колагену I, II, V типів, тоді як ВЖТ відрізняється великими розмірами адипоцитів, більш високим рівнем продукції адипонектину та переважанням в ECM колагену VI типу, наявністю ламіну, фібронектину [73].
У фізіологічному стані в жировій тканині пригнічується активність прозапальних механізмів. Ключовим молекулярним протизапальним регулятором жирової тканини є IL-33, що продукується стромальними клітинами. Інтерлейкін IL-33 рекрутує в жирову тканину еозинофіли, ILC2, iNKT-клітини, Treg-клітини, інгібуючи активність запалення за рахунок підтримування протизапального фенотипу М2 у Mj [66].
Розвиток ожиріння супроводжується підвищенням рівня ВЖК у жировій тканині. Вільні жирні кислоти, взаємодіючи з TLR4 і TLR2 адипоцитів, активують сигнальні шляхи NF-kB і MAPK8, що призводить до продукції прозапальних цитокінів та хемокінів [30, 69].
Адипоцити продукують широкий спектр адипокінів, які відіграють ключову роль у регуляції метаболізму ліпідів та глюкози й індукують розвиток метазапалення (табл. 1) [13].
Порушення енергобалансу за рахунок надлишку надходження калорій супроводжується гіпертрофією адипоцитів, що призводить до виникнення ЕР-стресу і, як наслідок, до вивільнення адипокінів (лептину, резистину), прозапальних цитокінів, зокрема IL-1b, –IL-6, IL-34 і TNF-a, і хемокінів з адипоцитів. Ці адипокіни та прозапальні цитокіни підтримують активацію резидентних імунних клітин й індукують рекрутинг імуноцитів (Mj, нейтрофілів, MC) з кровоносного русла [46, 96].
Провідним морфологічним субстратом, який визначає розвиток метазапалення, є ВЖТ. Хронічне метазапалення жирової тканини асоційоване з надлишком жирової маси тіла й характеризується інфільтрацією імуноцитів, активацією прозапальних Mj та інших різноманітних імунних клітин, які продукують та секретують прозапальні цитокіни і хемокіни [12].
Зі збільшенням розмірів жирової тканини через недостатню перфузію тканин, механічний стрес або підвищене споживання кисню розвивається гіпоксія, що індукує продукцію фактора HIF-1a, який активує транскрипцію численних прозапальних генів хемокінів. Нокаут гена Hif1 запобігає розвитку метазапалення й інсулінорезистентності під впливом ожиріння. Активація HIF-1-регульованих профібротичних генів –сприяє розвитку фіброзу жирової тканини. Клінічні дослідження продемонстрували високий ступінь прямої асоціації фіброзу ВЖТ з інсулінорезистентністю [24].
2. Участь ефекторних клітин вродженої імунної системи в розвитку метазапалення жирової тканини
2.1. Роль макрофагів
Макрофаги є однією з найчисленніших імунних популяцій імуноцитів, які виявляються у жировій тканині ссавців. У жировій тканині здорової людини Mj становлять 4 % від загальної кількості імунних клітин, а при ожирінні їх частка збільшується до 12 % [35].
Розрізняють декілька фенотипів Mj, які мають різні функціональні можливості (табл. 2).
Макрофаги жирової тканини людини генеруються з моноцитів периферичної крові, які поділяються на три субпопуляції: класичні моноцити (CD14++CD16–), проміжні моноцити (CD14++CD16+) та некласичні моноцити (CD14+CD16++) [93].
Мишачі моноцити можуть бути класифіковані за експресією Ly6C, причому Ly6Chi-клітини вважаються прозапальними моноцитами. При фізіологічному стані моноцитарні Ly6Chi-клітини диференціюються в Ly6Clo-моноцити, які в жировій тканині стають резидентними Mj з фенотипом М2. При ожирінні у відповідь на прозапальні стимули, зокрема на дію моноцитарного хемоатрактанту CCL2, Ly6Chi-моноцити рекрутуються в жирову тканину, де вони диференціюються в Mj із фенотипом М1 [71].
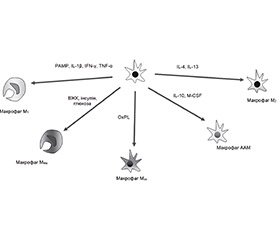
У жировій тканині розрізняють декілька типів Mj: попередники Mj — М0; рекрутовані моноцитарні Mj — «класично активовані» (активовані PAMP, Il-1b, IFN-g або TNF-a) CD11c+F4/80hiMj прозапальні — М1; метаболічно активовані ABCA1+CD36+PLIN2+Mj — MMe; активовані окисненими ліпідними продуктами CX3CR1negF4/80loTXNRD1+HO1+Mj — Mox (М3); резидентні «альтернативно активовані» протизапальні Mj — М2, подібні до альтернативно активованих Mj — AAM-подібні Mj (рис. 2). Активація фактора транскрипції NF-kB відіграє істотну роль у поляризації M1; сигнального шляху, асоційованого з PPARg, зумовлює поляризацію макрофагів у фенотип M2; пов’язаний із NOX2-сигнальним каскадом — у фенотип MMe; фактора транскрипції NFE2L2 — у фенотип Mox [70, 74].
Поляризація макрофагів була добре вивчена протягом останнього десятиліття, що призвело до відкриття кількох ключових регуляторів, які керують поляризацією макрофагів: факторів транскрипції STAT, інтерферонових регуляторних факторів, регуляторів метаболізму ліпідів, miR та довгих некодуючих РНК. Так, для Mj із фенотипом М1 характерна експресія STAT1, STAT2, IRF1, IRF5, IRF6, IRF6, а для Mj з фенотипом М2 — STAT3, STAT6, IRF3, IRF4. МікроРНК беруть участь у поляризації макрофагів. Установлено, що miR-125b, пригнічуючи експресію фактора транскрипції М2 Mj — IRF4, miR-9, пригнічуючи PPARd, сприяють поляризації М1 Mj; miR-155 інгібує STAT6, тим самим пригнічує поляризацію М2 Mj, miR-132, miR-146a і miR-223 індукують М2 Mj за рахунок пригнічення NF-kB [71].
У фізіологічних умовах у жировій тканині присутні переважно резидентні Mj із фенотипом М2. Співвідношення кількості Mj М2/М1 становить 60/40. Макрофаги М2 експресують галактозний лектин С-типу (CD301), рецептор манози (CD206), аргінази 1, IL-10, антагоніст рецептора IL-1 (IL-1Ra) і TGF-b, у зв’язку з чим мають виражену протизапальну активність [15]. Макрофаги M2 за рахунок продукції TGF-b запобігають надмірній проліферації адипоцитів. Виснаження пулу CD206+ Mj з фенотипом М2 призводить до посиленого утворення більш дрібних адипоцитів і викликає проліферацію попередників білих та бежевих адипоцитів [63]. Макрофаги M2 характеризуються високою продукцією протизапального цитокіну IL-10. Продемонстровано, що застосування екзогенного IL-10 підвищує сенситивність до дії інсуліну. Також, М2 Mj виділяють екзосоми, що містять miR-155, яка сприяє підвищенню сенситивності тканин до дії інсуліну [67].
Окиснення ЛПНЩ та ліпідів плазмолеми клітин, які зазнали апоптозу, в субендотеліальному просторі призводить до збагачення жирової тканини окисненими ліпідами. Окиснення фосфоліпідів, таких як 1-пальмітоїл-2-арахідоноїл-sn-3-гліцерофосфорилхолін, дає низку структурно певних продуктів окиснення, які викликають як прозапальні, так і протизапальні ефекти. Окиснені фосфоліпіди (OxPL), взаємодіючи з хемокіновим рецептором CCR2, специфічно рекрутують моноцити/макрофаги. Також OxPL змінюють експресію генів Mj, що призводить до розвитку унікального фенотипу макрофагів TXNRD1+HO1+Mj (Mox Mj), який обумовлений активацією фактора транскрипції NFE2L2. Макрофаги Mox мають прозапальну активність та експресують кілька прозапальних генів, включаючи PTGS2 і IL1b, хоча і значно меншою мірою, ніж M1 Mj. Цікавим є те, що укорочені OxPL пригнічують активність дихального ланцюга, тоді як повнорозмірні OxPL індукують експресію прозапальних генів в Mj. Тому при фізіологічній масі тіла OxPL жирової тканини підтримує розвиток Mox Mj, а під час розвитку ожиріння підтримується активність M1 Mj [40].
У відповідь на окиснювальний стрес фактор транскрипції NFE2L2 уникає убініквітинізації, дисоціюючи від свого негативного регулятора KEAP1, транслокується в ядро та активує гени, які беруть участь в синтезі антиоксидантних ферментів, таких як гемоксигенезу 1 (HO-1) глутаматцистеїнлігаза (GCLM), глутатіон-S-трансфераза (GST) та тіоредоксин-редуктаза 1 (TXNRD1). Активність цих генів специфічна для Mox Mj [40].
При фізіологічній масі тіла в мишей превалюючою субпопуляцією Mox є група Mj із сигнатурою F4/80loTxnrd1+HO1+, яка відноситься до M2 Mj. На тлі годування HFD і з розвитком ожиріння відбувається зменшення концентрації усічених OxPL та збільшення вмісту повнорозмірних OxPL, також відбувається зменшення представництва F4/80loTxnrd1+HO1+Mox Mj, і фенотип більшості Mox Mj набуває гібридних ознак F4/80hiCD11c+CD206+ та прозапальні властивості [76].
Ожиріння супроводжується збільшенням представництва загальної популяції Mj, їх частка в структурі похідних стромальних клітин становить від 5–10 до 40–50 %. Збільшення макрофагальної популяції в жировій тканині супроводжується порушенням балансу за рахунок збільшення М1 Mj [73]. Класичним диференціюючим маркером субпопуляцій М1 Mj і М2 Mj вважається CD11c (негативний у M2 Mj і позитивний у M1 Mj). Однак ці макрофагальні фенотипи асоційовані і з іншими клітинними маркерами: з фенотипом M1 пов’язані CD172, CD44; із фенотипом M2 — аргіназа 1, CD163, CD206, CD301. Макрофаги M2 або «альтернативно активовані» Mj характеризуються сигнатурою CD11b+CD11c–Ly6c–F4/80loCD64+CD9–CD80–CD86–CD163++CD206+CD301+ та експресують більш високі рівні мРНК генів ARG1, CHI3L3/YM1, RETNLA/FIZZ1, EGR2, FN1, MRC1/CD206, TGFb й IL10, а M1 Mj — CD11b+CD11c+Ly6c–F4/80hiCD64+CD9+CD80+CD86+CD163– та експресують мРНК генів LPL, PLIN2, CD63, ACP5, CTSS, LAMP2, LIPA, IL1RA, IL6, IL18, TNFa, NLRP3, NOS2, CCR2 й CCR7. Макрофаги M1 використовують аргінін для утворення оксиду азоту (NO) за допомогою iNOS, а Mj М2 — завдяки активності аргінази використовують аргінін у біосинтезі колагену під час ремоделювання жирової тканини. Також Mj М1 отримують енергію переважно внаслідок гліколізу, а M2 Mj — за рахунок окисного фосфорилювання. Характерною особливістю М1 Mj є їх здатність синтезувати ліпіди й генерувати прозапальні ліпідні медіатори, такі як ейкозаноїди, М2 Mj — продукувати протизапальні субстанції; а Мox Mj — поглинати окислені ліпідні молекули [14, 38, 77, 86].
У регуляції процесу поляризації Mj в жировій тканині беруть участь кілька молекулярних механізмів, пов’язаних із рецепторами PPAR і ЛПНЩ, факторами транскрипції KLF4 і IRF4. Установлено, що специфічна делеція генів PPARG або PPARd в мієлоїдних клітинах призводить до порушення поляризації M2 Mj і розвитку інсулінорезистентності. Активація рецептора ЛПНЩ, яка спостерігається при ожирінні, сприяє M1-поляризації Mj. Фактори транскрипції KLF4 і IRF4 беруть участь в M2-поляризації Mj. У мишей з ожирінням із мієлоїдно-специфічним дефіцитом експресії Klf4 або Irf4 спостерігається знижена експресія маркерів, асоційованих із M2 Mj жирової тканини [20].
Гіпертрофовані адипоцити продукують хемокін CCL2, який рекрутує Mj моноцитарного походження, що мають фенотип M1 і продукують TNF-a, IL-1b, IL-6, CXCL10, зміщуючи баланс М2/М1 в сторону М1 Mj [8]. Делеція гена Ccl2 в адипоцитах або гена Ccr2 в Mj супроводжується зменшенням накопичення Mj у жировій тканині в мишей з ожирінням, що викликано HFD [41, 87].
Продукція хемокіну CCL2 у жировій тканині активується IL-1b, TNF-a, CXCL8/IL-8, IL-4 і IL-6. Також у рекрутингу Mj в жирову тканину беруть участь: LTB4, що генерується адипоцитами, і хемокін CXCL2, що секретується Mj. Гіпертрофовані адипоцити секретують LTB4, який стимулює хемотаксис не тільки Mj, але й нейтрофілів [79]. Адипоцити також продукують фракталін (CX3CL1), який, взаємодіючи зі специфічним рецептором CX3CR1, сприяє адгезії моноцитів до адипоцитів. Фракталін рекрутує і Т-клітини [64]. У рекрутуванні Mj у жирову тканину бере участь і CCL5 (RANTES), який високо експресується адипоцитами при ожирінні і стимулює адгезію та трансміграцію моноцитів через ендотелій судин [44]. Пригнічення експресії Cxcl5 або його рецептора Cxcr2 запобігає розвитку індукованої ожирінням інсулінорезистентності в експериментальних тварин [16].
Необхідно підкреслити, що адипоцити продукують активні речовини, які блокують еміграцію Mj моноцитарного походження з жирової тканини. Зокрема, показано, що нейрональна спрямовуюча молекула, нетрин-1, зв’язуючись із макрофагальним рецептором UNC5B, утримує Mj біля адипоцитів. Відсутність нетрину-1 Mj ВЖТ супроводжується: 1) активацією генів, продукти яких беруть участь у поглинанні ВЖК та їх внутрішньоклітинному транспорті, утворенні ліпідних крапель та ліполізі; 2) пригніченням активності експресії генів, які беруть участь у метаболізмі арахідонової кислоти, що призводить до зниження вмісту прозапальних ейкозаноїдів (5-HETE, 6-транс-LTB4, TXB2, PGD2) у ВЖТ [78].
Поляризації Mj жирової тканини у фенотип М1 сприяють і ВЖК [48], глікопротеїн a2-Heremаns-Schmid фетуїн А, який продукується не тільки гепатоцитами, а й адипоцитами. Показано, що основним джерелом фетуїну А є не печінка, а ПЖТ. Фетуїн А, взаємодіючи з TLR4, активує фактор транскрипції NF-kB Mj жирової тканини, що викликає продукцію прозапальних цитокінів [11, 39].
Значна частина рекрутованих у жирову тканину Mj приймають «метаболічно активований» фенотип MMe й експресують маркери, що відсутні в типових M1 Mj або M2 Mj. Активність оксидази NOX2 визначає прозапальні й адипоцит-очищаючі властивості MMe Mj. Продемонстровано, що після 8 тижнів годування HFD у мишей з нокаутним геном Nox2–/– спостерігається значно менш виражене запалення жирової тканини, ніж у мишей дикого типу. Однак після 16 тижнів годування HFD у них розвиваються тяжка інсулінорезистентність, гепатостеатоз і вісцеральна ліпоатрофія, що характеризується накопиченням великої кількості загиблих адипоцитів [21].
Макрофаги MMe індукуються високим умістом ВЖК, глюкози й інсуліну. Макрофаги з фенотипом MMe, окрім активної продукції цитокінів TNF-a, –IL-1b, IL-6, відрізняються високим рівнем експресії гена NLRP3, продукт якого є основним структурним елементом інфламасоми. Також у MMe Mj спостерігається високий рівень експресії генів, асоційованих із ліпідним обміном: гена периліпіну 2 (perilipin 2 — PLIN2), що бере участь у накопиченні ліпідів, задіяного в поглинанні ліпідів гена CD36 та гена ABCA1, що бере учать в експорті ліпідів. Макрофаги MMe сприяють не тільки розвитку метазапалення, секретуючи прозапальні цитокіни і хемокіни, але й кліренсу загиблих адипоцитів, організовуючи структури лізосомального екзоцитозу [14, 52].
Макрофаги MMe відрізняються високим рівнем експресії прозапальних генів, включаючи IL1B, IL6, IL8/CXCL8, TNFA і CCL3, а також збагачені транскриптами, що кодують мітохондріальні, протеасомні та лізосомальні протеїни, ферменти метаболізму ВЖК і Т-клітинні хемоатрактанти [89]. Надлишкова продукція TNF-a, IL-6 MMe Mj призводить до пригнічення активності адипогенезу, зниження толерантності до глюкози й підвищення ектопічного накопичення ліпідів [15]. Показано, що TNF-a порушує взаємодію ендодомена інсулінового рецептора з IRS-1 [6, 79]. Пролонгована активація TNF-a Mj сигнальних шляхів p38, p44/42 і MAPK адипоцитів жирової тканини стимулює ліполіз [28].
Макрофаги MMe, продукуючи високі рівні прозапальних цитокінів (TNF-a, IL-1, IL-6, IL-12 і IL-23), стимулюють розвиток Th1-відповіді [57]. Макрофаги MMe не тільки синтезують прозапальні цитокіни, а й здійснюють лізосомальний екзоцитоз загиблих адипоцитів [21].
Відомо, що Mj беруть участь у загибелі і видаленні загиблих адипоцитів із жирової тканини. Проте видалення загиблих адипоцитів із жирової тканини пов’язане з двома фізіологічними проблемами. По-перше, оскільки відносно великий розмір жирової клітини не дозволяє Mj самостійно фагоцитувати адипоцити, видалення адипоцитів з жирової тканини залежить від якості утворення екстрацелюлярних лізосомальних компартментів безліччю макрофагів. Позаклітинні лізосомальні компартменти формуються макрофагальними короноподібними структурами. По-друге, руйнування адипоцитів супроводжується вивільненням великої кількості ВЖК, таких як пальмітат, які індукують прозапальну активацію Mj. З цієї причини кліренс загиблих адипоцитів, на відміну від кліренсу інших клітин, є протизапальним явищем [21].
Загиблі адипоцити в умовах ожиріння елімінуються за допомогою макрофагальних короноподібних структур. Макрофаги, що характеризуються змішаним фенотипом M1/M2, експресуючи маркер M1 Mj (CD11c) та маркер M2 Mj (CD206 або CD163), оточують загиблі гіпертрофовані адипоцити, будують короноподібні структури, всередині яких створюється екстрацелюлярний простір з високою лізосомальною активністю. Адипоцит у даному екстрацелюлярному лізосомальному компартменті піддається піроптозу та руйнуванню, а залишки жирової клітини елімінуються макрофагами. Короноподібні структури складаються приблизно з 15 клітин Mj, згрупованих навколо вже загиблих адипоцитів або тих, що гинуть. Установлено, що при ожирінні 90 % усіх Mj жирової тканини локалізуються в даних структурах [83]. У мишей Mj короноподібні структури містять надмірну кількість ліпідів і морфологічно нагадують пінисті клітини [25]. Гіпертрофія адипоцитів супроводжується посиленням їх здатності поглинати ліпопротеїди, асоційовані з LPS, що активує каспази-4/-5/-11, які викликають піроптоз клітини (рис. 3) [36].
При ожирінні практично в 30 разів збільшується швидкість загибелі адипоцитів як у мишей, так і в людини. Lars-Georg Hersoug і співавт. [36] припускають, що концентрація LPS, локально досягаючи критичної величини на поверхні ліпідних крапель, індукує сигнальний каскад, що призводить до піроптозу високоактивних великих адипоцитів.
Макрофаги є переважаючим типом імунних клітин, які накопичуються в жировій тканині при ожирінні та відіграють провідну роль у розвитку інсулінорезистентності [54].
Макрофаги жирової тканини є функціональними антиген-презентуючими клітинами, які сприяють клональній експансії антиген-специфічних Т-клітин і генерації IFNg-продукуючих Т1-клітин. Як резидентні CD11c–Mj, так і рекрутовані CD11c+Mj сприяють відповіді адаптивної імунної системи [74].
2.2. Роль гранулоцитів у розвитку метазапалення жирової тканини
Популяція гранулоцитів класифікована на нейтрофіли, еозинофіли, базофіли і MC, які розвиваються з одного попередника гранулоцито-моноцитарного ряду. Нейтрофіли диференціюються з GATA1– попередника, а еозинофіли, базофіли і MC — з GATA1+ попередника [27].
2.2.1. Роль GATA1– гранулоцитів у розвитку метазапалення жирової тканини
Нейтрофіли
Нейтрофіли становлять до 90 % усіх гранулоцитів у крові, але відносно рідко зустрічаються при фізіологічному стані жирової тканини [42].
Розрізняють три субпопуляції нейтрофілів: 1) нейтрофіли спокою з фенотипом CD49d–CD11b–, що не продукують цитокіни і хемокіни; 2) нейтрофіли 1-го типу (N1) з фенотипом CD49d+CD1b–, які продукують IL-12 і CCL3; 3) нейтрофіли 2-го типу (N2) з фенотипом CD49d–CD11b+, які продукують IL-10 та CCL2 (табл. 3) [92].
Нейтрофіли містять кілька підтипів гранул, які поділяються: на первинні, або азурофільні пероксидазопозитивні (містять МРО), і специфічні, або вторинні пероксидазонегативні, гранули [23].
Цитокіни, синтезовані гіпертрофованими адипоцитами й активованими Mj, IL-1b, IL-6, IL-8/CXCL8, TNF-a, LTB4, рекрутують нейтрофіли з кровоносного русла в жирову тканину. Так, установлено, що нейтрофіли є одними з перших респондерів, що залучаються у ВЖТ мишей, які отримують HFD [81]. Цікавим є те, що в експериментальних тварин вже на третій день отримання HFD відзначається збільшення у 20 разів числа Ly6g+CD11b+нейтрофілів у ВЖТ, водночас уміст Mj підвищується тільки на сьому добу експериментальної HFD [65].
Нейтрофіли стимулюють запалення жирової тканини, продукуючи TNF-a, CXCL8/IL-8 і CCL2 [26, 83]. Доказом участі нейтрофілів у розвитку ожиріння є висока експресія маркера активації CD66b, нейтрофільної мієлопероксидази й кальпротектину [46].
Також нейтрофіли жирової тканини продукують серинову еластазу, яка пригнічує поглинання глюкози і, розщеплюючи субстрат IRS-1, сприяє розвитку інсулінорезистентності [59]. Нейтрофільна еластаза також чинить прозапальну дію: вона активує TLR4 Mj, посилюючи експресію генів TNFa, IL1b і IL6, що –сприяє рекрутуванню нових нейтрофілів і M1 Mj в жирову тканину [83].
2.2.2. Роль GATA1+ гранулоцитів у розвитку метазапалення жирової тканини
2.2.2.1. Еозинофіли
Жирова тканина містить велику популяцію еозинофілів, які відіграють істотну роль у гомеостазі глюкози й регуляції акумуляції імунних клітин. Кількість еозинофілів у жировій тканині обернено корелює з рівнем ожиріння [62, 88]. У мишей із дефіцитом еозинофілів, які отримували HFD, спостерігається більш високий ступінь ожиріння та інсулінорезистентності [90].
Ключовими регуляторами рекрутингу та проліферації еозинофілів є еотаксини та IL-5 відповідно. У людини розрізняють три ізоформи еотаксину: еотаксин 1 (CCL11), еотаксин 2 (CCL24) й еотаксин 3 (CCL26), які забезпечують акумуляцію еозинофілів в ураженій тканині. IL-5 сприяє проліферації попередників еозинофілів у кістковому мозку і виживання зрілих еозинофілів на периферії [7, 51]. Основним первинним джерелом IL-5, що рекрутує еозинофіли в жирову тканину, є ILC2 клітини. Кількість ILC2 клітин корелює з кількістю еозинофілів [45]. Також у регуляції проліферації еозинофілів беруть участь IL-3, CSF-2, IL-33 [7].
Еозинофіли жирової тканини характеризуються сигнатурою CD45+DAPIlowSSChiCD11B+Siglec–F+ [61]. Еозинофіли, також як і Mj, представлені двома популяціями — E1 та E2. Еозинофіли E2 сприяють розвитку у Mj фенотипу M2, а праймовані окисненими ЛПНЩ еозинофіли E1 — розвитку у Mj фенотипу M1. Еозинофіли E2, будучи найважливішим джерелом IL-4, індукують поляризацію Mj білої жирової тканини в M2 [9, 50, 68].
Еозинофіли людини містять гранули, які багаті чотирма катіонними білками: основним базисним протеїном 1, еозинофільним катіонним протеїном, еозинофільним нейротоксином та еозинофільною пероксидазою [5].
У даний час установлено, що еозинофіли стимулюють M2 Mj жирової тканини, що, у свою чергу, покращує контроль над метаболізмом глюкози [56]. Вважають, що в жировій тканині еозинофіли підтримують дозрівання адипоцитів, сприяють акумуляції M2 Mj, які запобігають розвитку метазапалення та інсулінорезистентності, індукованих ожирінням [50].
2.2.2.2. Тучні клітини
Тучні клітини є клітинами вродженого імунітету, які переважно локалізуються в тканинах, у тому числі жировій тканині, і здатні продукувати прозапальні цитокіни. Це гранулярні довгоживучі клітини, які розвиваються з плюрипотентних гематопоетичних стовбурових CD34+/CD117+ клітин. Вважають, що жирова тканина є резервуаром попередників MC [94]. Ці попередники потрапляють у різні органи-мішені через хемокін та інтегрин-залежний трансфер. Попередники MC під впливом факторів зростання, головним чином, фактора SCF, диференціюються і дозрівають у функціональні MC, які експресують рецептор FceRI, що зв’язує IgE. Основним тригером, що активує MC, є IgE, його дія призводить до дегрануляції та вивільнення біологічно активних речовин: 1) попередньо сформованих медіаторів: гістаміну, гепарину, триптази і хімази; 2) синтезованих de novo медіаторів: PAF, PDG2, LTB4 і LTD4; 3) цитокінів: TNF-a, TGF-b, IL-1, IL-3, IL-5, CXCL8/IL-8, IL-10 (табл. 4).
У людей розрізняють два типи MC: MCTC клітини, що містять триптазу, хімазу, карбоксипептидазу і катепсини, які можуть переважно локалізуватись у сполучній тканині; та MCT клітини, які містять триптазу і переважно локалізовані в тканинах легень та кишечнику. Окрім алергічних реакцій, тучні клітини беруть участь в ангіогенезі, вивільняючи фактор VEGF і TGF-b, та в репарації тканин, продукуючи IL-4, VEGF, FGF-2 [29, 46].
В експериментальних тварин і людей з ожирінням відзначається підвищена кількість MC у жировій тканині, де вони розташовані переважно поблизу мікросудин і фіброзних ділянок [53]. Участь MC у розвитку ожиріння підтверджується їх акумуляцією в жировій тканині, а також більш високим рівнем триптази, у сироватці крові в осіб із надмірним відкладенням жиру [46, 53]. Рівень триптази в сироватці крові високо корелює з ІМТ, концентрацією глюкози натще і триацилгліцеридемією [34].
Дані про патофізіологічну участь MC при ожирінні в наш час досить суперечливі. З одного боку, продемонстровано, що в мишей із нокаутним геном рецептора фактора росту Kit (KitW-sh/W-sh), який зумовлює матурацію MC, не розвивається ожиріння у відповідь на HFD [53]. З іншого боку, показано, що в мишей із дефіцитом MC, який не пов’язаний із мутацією гена Kit, не відрізняється реакція на HFD щодо розвитку ожиріння та інсулінорезистентності від диких мишей [33].
Встановлено, що резидентні MC ВЖТ експресують рецептори як для лептину, так і для адипонектину. Лептин індукує секрецію гістаміну, цистеїн-лейкотрієнів (LTC4, LTD4 і LTE4), TNF-a і експресію CCL2, у той час як адипонектин індукує продукцію протизапального IL-10. У зв’язку з чим надлишок лептину та дефіцит адипонектину, характерні для ожиріння, викликають активацію MC із вираженою прозапальною спрямованістю [46, 60]. Цікавим є той факт, що активність MC регулюється IL-6 і IFN-g, але не TNF-a. Цитокіни IL-6 і IFN-g сприяють розвитку ожиріння. Різноманітні медіатори MC сприяють хемотаксису численних популяцій запальних клітин, включаючи лімфоцити, моноцити, нейтрофіли, еозинофіли, базофіли, до місця метазапалення. Інфільтрація жирової тканини імуноцитами сприяє деградації ECM, активними учасниками якої є протеази MC. Зокрема, триптаза викликає деградацію колагену VI типу та активує колагеназу, хімаза гідролізує молекули колагену IV, V типу, фібронектин та вітронектин, катепсини G — колаген IV, V типу, фібронектин; ММР-9 деградує тканинні протеоглікани, колаген IV і V типу й фібронектин [95].
Однак MC, що локалізовані у фіброзних ділянках жирової тканини, у ВЖТ високо експресують декілька колагенових генів, а в ПЖТ — тільки ген колагену COL6A1 [32].
Тучні клітини активують адипогенез у жировій тканині, індукуючи диференціювання преадипоцитів, а також проліферацію адипоцитів. Зокрема, MC, секретуючи простагландин и 15-дезокси-дельта-PGJ2, який є ендогенним лігандом рецепторів PPARg, сприяють посиленню адипогенезу [82].
Тучні клітини TIB64, вивільняючи гістамін і –IL-4, стимулюють експресію UCP1 адипоцитами 3T3-L1 [31].
Дефіцит представництва MC асоційований із високою чутливістю тканин до інсуліну [59]. Зрілі MC у жировій тканині сприяють прогресуванню як ожиріння, так й інсулінорезистентності. При ожирінні протеїн MCP-6 секретується зрілими MC, індукує експресію колагену V, сприяючи процесу фіброзування надлишкової жирової тканини. У свою чергу, MCP-6-індукований колаген V може посилити прояви інсулінорезистентності за рахунок пригнічення диференціювання преадипоцитів [37].
На думку Nir Goldstein і співавт. [32], акумуляція MC у ВЖТ супроводжує розвиток надлишкової жирової тканини, але перешкоджає виникненню метаболічних порушень, у тому числі інсулінорезистентності. Автори показали, що кількість MC корелює з представництвом Mj тільки у фіброзних ділянках жирової тканини, водночас в інших ділянках жирової тканини рівень експресії генів MC обернено пропорційний рівню експресії генів, специфічних для Mj, і кількості макрофагальних короноподібних структур. Таким чином, акумуляція MC у ВЖТ асоціюється з низьким ступенем макрофагальної інфільтрації жирової тканини і активності Mj.
Висновки
Жирова тканина, перебуваючи в умовах підвищеної концентрації ВЖК, які можуть індукувати TLR-опосередковану запальну реакцію, містить клітинні протизапальні механізми, основним компонентом якої є популяція Mj із фенотипом M2.
Однією з перших реакцій на розвиток ожиріння є зміна спектра продукції адипокінів і цитокінів адипоцитами жирової тканини. Підвищення продукції лептину, резистину і хемокінів сприяє залученню ефекторних клітин уродженої імунної системи в надлишкову жирову тканину.
При ожирінні в жировій тканині збільшується кількість адипоцитів і кількість гіпертрофованих адипоцитів. У ПЖТ переважно спостерігається гіпертрофія, а у ВЖТ — гіпертрофія і гіперплазія жирової тканини. Ожиріння супроводжується збільшенням продукції лептину, IL-6 і TNF-a і зниженням рівня секреції адипонектину. В ECM ПЖТ збільшується вміст колагену I типу, а в ECM ВЖТ — колагену IV типу.
При розвитку ожиріння першими клітинними рекрутами жирової тканини є нейтрофіли, які, продукуючи TNF-a, CXCL8/IL-8 і CCL2, сприяють залученню нових нейтрофілів і макрофагів. Цілком ймовірно, що дії нейтрофільної еластази і триптази «розпушують» екстрацелюлярний комплекс жирової тканини для збільшення ступеня доступу макрофагів до адипоцитів і здійснення подальшого ефективного макрофагального кліренсу прозапальних і гіпертрофованих адипоцитів. Гіпоксія та стрес ендоплазматичного ретикулуму адипоцитів жирової тканини обумовлюють збільшення швидкості загибелі адипоцитів, індукцію синтезу фактора HIF-1a і прозапальних цитокінів. Гіпертрофовані адипоцити й нейтрофіли, продукуючи хемокін CCL2, забезпечують рекрутинг Mj моноцитарного походження, які в надлишковій жировій тканині активуються ВЖК, фетуїном А і набувають фенотипу M1 і MMe. Рекрутовані Mj відрізняються від резидентних Mj розподілом у тканині, спектром транскриптому і функціональними можливостями. Дана поляризація Mj супроводжується посиленням експресії CD11c, продук–цією TNF-a, CCL2 та інших прозапальних цитокінів. Створення активованими Mj короноподібних структур викликає піроптоз адипоцитів і сприяє видаленню загиблих жирових клітин.
Залучені MC у жирову тканину не тільки сприяють розвитку інсулінорезистентності, метазапалення, але й фіброзу. Секретований MC протеїн MCP-6 активує продукцію колагену V, викликаючи фіброз надлишкової жирової тканини.
Таким чином, ожиріння супроводжується розвитком метазапалення, в якому ключову роль відіграють ефекторні клітини вродженої імунної системи — макрофаги, нейтрофіли, MC. Однак метазапалення підшкірної та вісцеральної жирової тканини характеризується особливостями як за рівнем рекрутованих імуноцитів, так і за механізмами кліренсу запальних та гіпертрофованих адипоцитів (рис. 4).
У даний час проводяться дослідження декількох терапевтичних підходів, метою дії яких є ефекторні клітини вродженої імунної системи. Розробляються лікувальні заходи, які сприяють виснаженню популяцій прозапальних ефекторних клітин, викликають пригнічення проліферації цих клітин, випробовується використання біологічної терапії для інактивації прозапальних цитокінів, медикаментозний сайленсинг прозапальних генів.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
- Абатуров А.Е. Метаболический синдром у детей (лекция). Таврический медико-биологический вестник. 2007. 10. 57-65.
- Абатуров А.Е. Особенности метаболического синдрома у детей. Дитячий лікар. 2011. 4. 11. 54-61.
- Бочарова О.В., Теплякова Е.Д. Ожирение у детей и подростков — проблема здравоохранения XXI века. Казанский медицинский журнал. 2020. 101. 3. 381-388.
- Васюкова О.В. Ожирение у детей и подростков: критерии диагноза. Ожирение и метаболизм. 2019. 16. 1. 70-73.
- Acharya K.R., Ackerman S.J. Eosinophil granule proteins: form and function. J. Biol. Chem. 2014. 289(25). 17406-17415. doi: 10.1074/jbc.R113.546218.
- Akash M.S.H., Rehman K., Liaqat A. Tumor Necrosis Factor-Alpha: Role in Development of Insulin Resistance and Pathogenesis of Type 2 Diabetes Mellitus. J. Cell Biochem. 2018. 119(1). 105-110. doi: 10.1002/jcb.26174.
- Angulo E.L., McKernan E.M., Fichtinger P.S., Mathur S.K. Comparison of IL-33 and IL-5 family mediated activation of human –eosinophils. PLoS One. 2019. 14(9). e0217807. Published 2019 Sep 6. doi: 10.1371/journal.pone.0217807.
- Bai Y., Sun Q. Macrophage recruitment in obese adipose tissue. Obes. Rev. 2015. 16(2). 127-136. doi: 10.1111/obr.12242.
- Bolus W.R. Diversity of Adipose Tissue Immune Cells: Are All Eosinophils Created Equal? Bioessays. 2018. 40(10). e1800150. doi: 10.1002/bies.201800150.
- Bora P., Majumdar A.S. Adipose tissue-derived stromal vascular fraction in regenerative medicine: a brief review on biology and translation. Stem. Cell Res. Ther. 2017. 8(1). 145. Published 2017 Jun 15. doi: 10.1186/s13287-017-0598-y.
- Bourebaba L., Marycz K. Pathophysiological Implication of Fetuin-A Glycoprotein in the Development of Metabolic Disorders: A Concise Review. J. Clin. Med. 2019. 8(12). 2033. Published 2019 Nov 21. doi: 10.3390/jcm8122033.
- Burhans M.S., Hagman D.K., Kuzma J.N., Schmidt K.A., Kratz M. Contribution of Adipose Tissue Inflammation to the Development of Type 2 Diabetes Mellitus. Compr. Physiol. 2018. 9(1). 1-58. Published 2018 Dec 13. doi: 10.1002/cphy.c170040.
- Cao H. Adipocytokines in obesity and metabolic disease. J. Endocrinol. 2014. 220(2). T47-T59. Published 2014 Jan 8. doi: 10.1530/JOE-13-0339.
- Caslin H.L., Bhanot M., Bolus W.R., Hasty A.H. Adipose tissue macrophages: Unique polarization and bioenergetics in obesity. Immunol. Rev. 2020. 295(1). 101-113. doi: 10.1111/imr.12853.
- Catrysse L., van Loo G. Adipose tissue macrophages and their polarization in health and obesity. Cell Immunol. 2018. 330. 114-119. doi: 10.1016/j.cellimm.2018.03.001.
- Chavey C., Lazennec G., Lagarrigue S. et al. CXC ligand 5 is an adipose-tissue derived factor that links obesity to insulin resistance. Cell Metab. 2009. 9(4). 339-349. doi: 10.1016/j.cmet.2009.03.002.
- Chen Y., Pan R., Pfeifer A. Fat tissues, the brite and the dark sides. Pflugers Arch. 2016. 468(11-12). 1803-1807. doi: 10.1007/s00424-016-1884-8.
- Chu D.T., Gawronska-Kozak B. Brown and brite adipocytes: Same function, but different origin and response. Biochimie. 2017. 138. 102-105. doi: 10.1016/j.biochi.2017.04.017.
- Chun S.Y., Lim J.O., Lee E.H. et al. Preparation and Characte–rization of Human Adipose Tissue-Derived Extracellular Matrix, Growth Factors, and Stem Cells: A Concise Review. Tissue Eng. Regen. Med. 2019. 16(4). 385-393. Published 2019 Jul 5. doi: 10.1007/s13770-019-00199-7.
- Chung K.J., Nati M., Chavakis T., Chatzigeorgiou A. Innate immune cells in the adipose tissue. Rev. Endocr. Metab. Disord. 2018. 19(4). 283-292. doi: 10.1007/s11154-018-9451-6.
- Coats B.R., Schoenfelt K.Q., Barbosa-Lorenzi V.C. et al. Metabolically Activated Adipose Tissue Macrophages Perform Detrimental and Beneficial Functions during Diet-Induced Obesity. Cell. Rep. 2017. 20(13). 3149-3161. doi: 10.1016/j.celrep.2017.08.096.
- Corrêa L.H., Heyn G.S., Magalhaes K.G. The Impact of the Adipose Organ Plasticity on Inflammation and Cancer Progression. Cells. 2019. 8(7). 662. Published 2019 Jun 30. doi: 10.3390/cells8070662.
- Cowland J.B., Borregaard N. Granulopoiesis and granules of human neutrophils. Immunol. Rev. 2016. 273(1). 11-28. doi: 10.1111/imr.12440.
- Cox A.R., Chernis N., Masschelin P.M., Hartig S.M. Immune Cells Gate White Adipose Tissue Expansion. Endocrinology. 2019. 160(7). 1645-1658. doi: 10.1210/en.2019-00266.
- Cox N., Geissmann F. Macrophage ontogeny in the control of adi–pose tissue biology. Curr. Opin. Immunol. 2020. 62. 1-8. doi: 10.1016/j.coi.2019.08.002.
- Dam V., Sikder T., Santosa S. From neutrophils to macrophages: differences in regional adipose tissue depots. Obes. Rev. 2016. 17(1). 1-17. doi: 10.1111/obr.12335.
- Drissen R., Buza-Vidas N., Woll P. et al. Distinct myeloid progenitor-differentiation pathways identified through single-cell RNA sequencing. Nat. Immunol. 2016. 17(6). 666-676. doi: 10.1038/ni.3412.
- Eda H., Shimada H., Beidler D.R., Monahan J.B. Proinflammatory cytokines, IL-1b and TNF-a, induce expression of interleukin-34 mRNA via JNK- and p44/42 MAPK-NF-kB pathway but not p38 pathway in osteoblasts. Rheumatol. Int. 2011. 31(11). 1525-1530. doi: 10.1007/s00296-010-1688-7.
- Elieh Ali Komi D., Bjermer L. Mast cell-mediated orchestration of the immune responses in human allergic asthma: current insights. Clin. Rev. Allergy Immunol. 2018. 56. 234-247. doi: 10.1007/s12016-018-8720-1.
- Engin A.B. Adipocyte-Macrophage Cross-Talk in Obesity. Adv. Exp. Med. Biol. 2017. 960. 327-343. doi: 10.1007/978-3-319-48382-5_14.
- Finlin B.S., Zhu B., Confides A.L. et al. Mast Cells Promote Seasonal White Adipose Beiging in Humans. Diabetes. 2017. 66(5). 1237-1246. doi: 10.2337/db16-1057.
- Goldstein N., Kezerle Y., Gepner Y. et al. Higher Mast Cell Accumulation in Human Adipose Tissues Defines Clinically Favorable Obesity Sub-Phenotypes. Cells. 2020. 9(6). E1508. Published 2020 Jun 20. doi: 10.3390/cells9061508.
- Gutierrez D.A., Muralidhar S., Feyerabend T.B., Herzig S., Rodewald H.R. Hematopoietic Kit Deficiency, rather than Lack of Mast Cells, Protects Mice from Obesity and Insulin Resistance. Cell Metab. 2015. 21(5). 678-691. doi: 10.1016/j.cmet.2015.04.013.
- Hammdy N., Salam R., El G.N.A., Mahmoud E. Mast cell a new player in Type 2 diabetes. Endocrine Abstracts. 2016. doi: 10.1530/endoabs.41.EP476.
- Harman-Boehm I., Blüher M., Redel H. et al. Macrophage infiltration into omental versus subcutaneous fat across different populations: effect of regional adiposity and the comorbidities of obesity. J. Clin. Endocrinol. Metab. 2007. 92(6). 2240-2247. doi: 10.1210/jc.2006-1811.
- Hersoug L.G., Møller P., Loft S. Role of microbiota-derived lipopolysaccharide in adipose tissue inflammation, adipocyte size and pyroptosis during obesity. Nutr. Res. Rev. 2018. 31(2). 153-163. doi: 10.1017/S0954422417000269.
- Hirai S., Ohyane C., Kim Y.I. et al. Involvement of mast cells in adipose tissue fibrosis. Am. J. Physiol. Endocrinol. Metab. 2014. 306(3). E247-E255. doi: 10.1152/ajpendo.00056.2013.
- Jablonski K.A., Amici S.A., Webb L.M. et al. Novel Mar–kers to Delineate Murine M1 and M2 Macrophages. PLoS One. 2015. 10(12). e0145342. Published 2015 Dec 23. doi: 10.1371/journal.pone.0145342.
- Jialal I., Pahwa R. Fetuin-A is also an adipokine. Lipids Health Dis. 2019. 18(1). 73. Published 2019 Mar 27. doi: 10.1186/s12944-019-1021-8.
- Kadl A., Meher A.K., Sharma P.R. et al. Identification of a novel macrophage phenotype that develops in response to atherogenic phospholipids via Nrf2. Circ. Res. 2010. 107(6). 737-746. doi: 10.1161/CIRCRESAHA.109.215715.
- Kanda H., Tateya S., Tamori Y. et al. MCP-1 contributes to macrophage infiltration into adipose tissue, insulin resistance, and hepatic steatosis in obesity. J. Clin. Invest. 2006. 116(6). 1494-1505. doi: 10.1172/JCI26498.
- Kane H., Lynch L. Innate Immune Control of Adipose Tissue Homeostasis. Trends Immunol. 2019. 40(9). 857-872. doi: 10.1016/j.it.2019.07.006.
- Keipert S., Jastroch M. Brite/beige fat and UCP1 — is it thermogenesis? Biochim. Biophys. Acta. 2014. 1837(7). 1075-1082. doi: 10.1016/j.bbabio.2014.02.008.
- Keophiphath M., Rouault C., Divoux A., Clément K., Lacasa D. CCL5 promotes macrophage recruitment and survival in human adipose tissue. Arterioscler. Thromb. Vasc. Biol. 2010. 30(1). 39-45. doi: 10.1161/ATVBAHA.109.197442.
- Klose C.S., Artis D. Innate lymphoid cells as regulators of immunity, inflammation and tissue homeostasis. Nat. Immunol. 2016. 17(7). 765-774. doi: 10.1038/ni.3489.
- Komi D.E.A., Khomtchouk K., Santa Maria P.L. A Review of the Contribution of Mast Cells in Wound Healing: Involved Molecular and Cellular Mechanisms. Clin. Rev. Allergy Immunol. 2020. 58(3). 298-312. doi: 10.1007/s12016-019-08729-w.
- Kratz M., Coats B.R., Hisert K.B. et al. Metabolic dysfunction drives a mechanistically distinct proinflammatory phenotype in adipose tissue macrophages. Cell Metab. 2014. 20(4). 614-625. doi: 10.1016/j.cmet.2014.08.010.
- Lackey D.E., Olefsky J.M. Regulation of metabolism by the innate immune system. Nat. Rev. Endocrinol. 2016. 12(1). 15-28. doi: 10.1038/nrendo.2015.189.
- Lee B.C., Lee J. Cellular and molecular players in adipose tissue inflammation in the development of obesity-induced insulin resistance. Biochim. Biophys. Acta. 2014. 1842(3). 446-462. doi: 10.1016/j.bbadis.2013.05.017.
- Lee E.H., Itan M., Jang J. et al. Eosinophils support adipocyte maturation and promote glucose tolerance in obesity. Sci Rep. 2018. 8(1). 9894. Published 2018 Jul 2. doi: 10.1038/s41598-018-28371-4.
- Lee J.J., Jacobsen E.A., Ochkur S.I. et al. Human versus mouse eosinophils: that which we call an eosinophil, by any other name would stain as red. J. Allergy Clin. Immunol. 2012. 130(3). 572-584. doi: 10.1016/j.jaci.2012.07.025.
- Li C., Menoret A., Farragher C. et al. Single cell transcriptomics based-MacSpectrum reveals novel macrophage activation signatures in diseases. JCI Insight. 2019. 5(10). e126453. Published 2019 Apr 16. doi: 10.1172/jci.insight.126453.
- Liu J., Divoux A., Sun J. et al. Genetic deficiency and pharmacological stabilization of mast cells reduce diet-induced obesity and diabetes in mice. Nat. Med. 2009. 15(8). 940-945. doi: 10.1038/nm.1994.
- Lumeng C.N., Bodzin J.L., Saltiel A.R. Obesity induces a phenotypic switch in adipose tissue macrophage polarization. J. Clin. Invest. 2007. 117(1). 175-184. doi: 10.1172/JCI29881.
- Luong Q., Huang J., Lee K.Y. Deciphering White Adipose Tissue Heterogeneity. Biology (Basel). 2019. 8(2). 23. Published 2019 Apr 11. doi: 10.3390/biology8020023.
- Maizels R.M., Allen J.E. Immunology. Eosinophils forestall obesity. Science. 2011. 332(6026). 186-187. doi: 10.1126/science.1205313.
- Martinez F.O., Gordon S. The M1 and M2 paradigm of macrophage activation: time for reassessment. F1000Prime Rep. 2014. 6. 13. Published 2014 Mar 3. doi: 10.12703/P6-13.
- Maurer S., Harms M., Boucher J. The colorful versatility of adipocytes: white-to-brown transdifferentiation and its therapeutic potential in man [published online ahead of print, 2020 Jul 3]. FEBS J. 2020. 10.1111/febs.15470. doi: 10.1111/febs.15470.
- McLaughlin T., Ackerman S.E., Shen L., Engleman E. Role of innate and adaptive immunity in obesity-associated metabolic disease. J. Clin. Invest. 2017. 127(1). 5-13. doi: 10.1172/JCI88876.
- Milling S. Adipokines and the control of mast cell functions: from obesity to inflammation? Immunology. 2019. 158(1). 1-2. doi: 10.1111/imm.13104.
- Molofsky A.B., Nussbaum J.C., Liang H.E. et al. Innate lymphoid type 2 cells sustain visceral adipose tissue eosinophils and alternatively activated macrophages. J. Exp. Med. 2013. 210(3). 535-549. doi: 10.1084/jem.20121964.
- Moussa K., Gurung P., Adams-Huet B., Devaraj S., Jialal I. Increased eosinophils in adipose tissue of metabolic syndrome. J. Diabetes Complications. 2019. 33(8). 535-538. doi: 10.1016/j.jdiacomp.2019.05.010.
- Nawaz A., Tobe K. M2-like macrophages serve as a niche for adipocyte progenitors in adipose tissue. J. Diabetes Investig. 2019. 10(6). 1394-1400. doi: 10.1111/jdi.13114.
- Nepali S., Park M., Lew H., Kim O. Comparative Analysis of Human Adipose-Derived Mesenchymal Stem Cells from Orbital and Abdominal Fat. Stem. Cells Int. 2018. 2018. 3932615. Published 2018 Aug 19. doi: 10.1155/2018/3932615.
- Nguyen K.D., Qiu Y., Cui X. et al. Alternatively activated macrophages produce catecholamines to sustain adaptive thermogenesis. Nature. 2011. 480(7375). 104-108. Published 2011 Nov 20. doi: 10.1038/nature10653.
- Oikonomou E.K., Antoniades C. The role of adipose tissue in cardiovascular health and disease. Nat. Rev. Cardiol. 2019. 16(2). 83-99. doi: 10.1038/s41569-018-0097-6.
- Orliaguet L., Dalmas E., Drareni K., Venteclef N., Alzaid F. Mechanisms of Macrophage Polarization in Insulin Signaling and Sensitivity. Front Endocrinol (Lausanne). 2020. 11. 62. Published 2020 Feb 19. doi: 10.3389/fendo.2020.00062.
- Qin M., Wang L., Li F. et al. Oxidized LDL activated eosinophil polarize macrophage phenotype from M2 to M1 through activation of CD36 scavenger receptor. Atherosclerosis. 2017. 263. 82-91. doi: 10.1016/j.atherosclerosis.2017.05.011.
- Rau C.S., Wu S.C., Lu T.H. et al. Effect of Low-Fat Diet in Obese Mice Lacking Toll-like Receptors. Nutrients. 2018. 10(10). 1464. Published 2018 Oct 9. doi: 10.3390/nu10101464.
- Remmerie A., Martens L., Scott C.L. Macrophage Subsets in Obesity, Aligning the Liver and Adipose Tissue. Front. Endocrinol. (Lausanne). 2020. 11. 259. Published 2020 Apr 29. doi: 10.3389/fendo.2020.00259.
- Roberts J., Fallon P.G., Hams E. The Pivotal Role of Macrophages in Metabolic Distress Reviewed: April 23rd 2019. Published: July 9th 2019. doi: 10.5772/intechopen.86474.
- Rosen E.D., Spiegelman B.M. What we talk about when we talk about fat. Cell. 2014. 156(1-2). 20-44. doi: 10.1016/j.cell.2013.12.012.
- Ross M., Wojciech P. Connective tissue. In: Histology: A Text and Atlas with Correlated Cell and Molecular Biology. Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins Health. 2015. 992 p.
- Russo L., Lumeng C.N. Properties and functions of adipose tissue macrophages in obesity. Immunology. 2018. 155(4). 407-417. doi: 10.1111/imm.13002.
- Sanchez-Gurmaches J., Guertin D.A. Adipocyte lineages: tracing back the origins of fat. Biochim. Biophys. Acta. 2014. 1842(3). 340-351. doi: 10.1016/j.bbadis.2013.05.027.
- Serbulea V., Upchurch C.M., Schappe M.S. et al. Macrophage phenotype and bioenergetics are controlled by oxidized phospholipids identified in lean and obese adipose tissue. Proc. Natl. Acad. Sci USA. 2018. 115(27). E6254-E6263. doi: 10.1073/pnas.1800544115.
- Shapouri-Moghaddam A., Mohammadian S., Vazini H. et al. Macrophage plasticity, polarization, and function in health and disease. J. Cell Physiol. 2018. 233(9). 6425-6440. doi: 10.1002/jcp.26429.
- Sharma M., Schlegel M., Brown E.J. et al. Netrin-1 Alters Adipose Tissue Macrophage Fate and Function in Obesity. Immunometabolism. 2019. 1(2). e190010. doi: 10.20900/immunometab20190010.
- Spite M., Hellmann J., Tang Y. et al. Deficiency of the leukotriene B4 receptor, BLT-1, protects against systemic insulin resistance in diet-induced obesity. J. Immunol. 2011. 187(4). 1942-1949. doi: 10.4049/jimmunol.1100196.
- Takaguri A. Yakugaku Zasshi. 2018. 138(11). 1329-1334. doi: 10.1248/yakushi.18-00116.
- Talukdar S., Oh D.Y., Bandyopadhyay G. et al. Neutrophils mediate insulin resistance in mice fed a high-fat diet through secreted elastase. Nat. Med. 2012. 18(9). 1407-1412. doi: 10.1038/nm.2885.
- Tanaka A., Nomura Y., Matsuda A., Ohmori K., Matsuda H. Mast cells function as an alternative modulator of adipogenesis through 15-deoxy-delta-12, 14-prostaglandin J2. Am. J. Physiol. Cell Physiol. 2011. 301(6). C1360-C1367. doi: 10.1152/ajpcell.00514.2010.
- Trim W., Turner J.E., Thompson D. Parallels in Immunometabolic Adipose Tissue Dysfunction with Ageing and Obesity. Front. Immunol. 2018. 9. 169. Published 2018 Feb 9. doi: 10.3389/fimmu.2018.00169.
- Vadde R., Gupta M.K., Nagaraju G.P. Is Adipose Tissue an Immunological Organ? Crit. Rev. Immunol. 2019. 39(6). 481-490. doi: 10.1615/CritRevImmunol.2020033457.
- Van Eijkeren R.J., Krabbe O., Boes M., Schipper H.S., Kalkhoven E. Endogenous lipid antigens for invariant natural killer T cells hold the reins in adipose tissue homeostasis. Immunology. 2018. 153(2). 179-189. doi: 10.1111/imm.12839.
- Viola A., Munari F., Sánchez-Rodríguez R., Scolaro T., Castegna A. The Metabolic Signature of Macrophage Responses. Front. Immunol. 2019. 10. 1462. Published 2019 Jul 3. doi: 10.3389/fimmu.2019.01462.
- Weisberg S.P., Hunter D., Huber R. et al. CCR2 modulates inflammatory and metabolic effects of high-fat feeding [published correction appears in J. Clin. Invest. 2006 May. 116(5). 1457]. J. Clin. Invest. 2006. 116(1). 115-124. doi: 10.1172/JCI24335.
- Weller P.F., Spencer L.A. Functions of tissue-resident eosinophils. Nat. Rev. Immunol. 2017. 17(12). 746-760. doi: 10.1038/nri.2017.95.
- Wentworth J.M., Naselli G., Brown W.A., et al. Pro-inflammatory CD11c+CD206+ adipose tissue macrophages are associated with insulin resistance in human obesity. Diabetes. 2010. 59(7). 1648-1656. doi: 10.2337/db09-0287.
- Wu D., Molofsky A.B., Liang H.E. et al. Eosinophils sustain adipose alternatively activated macrophages associated with glucose homeostasis. Science. 2011. 332(6026). 243-247. doi: 10.1126/science.1201475.
- Wu H., Ballantyne C.M. Metabolic Inflammation and Insulin Resistance in Obesity. Circ. Res. 2020. 126(11). 1549-1564. doi: 10.1161/CIRCRESAHA.119.315896.
- Yang F., Feng C., Zhang X., Lu J., Zhao Y. The Diverse Biological Functions of Neutrophils, Beyond the Defense Against Infections. Inflammation. 2017. 40(1). 311-323. doi: 10.1007/s10753-016-0458-4.
- Yang J., Zhang L., Yu C., Yang X.F., Wang H. Monocyte and macrophage differentiation: circulation inflammatory monocyte as biomarker for inflammatory diseases. Biomark. Res. 2014. 2(1). 1. Published 2014 Jan 7. doi: 10.1186/2050-7771-2-1.
- Zatterale F., Longo M., Naderi J. et al. Chronic Adipose Tissue Inflammation Linking Obesity to Insulin Resistance and Type 2 Diabetes. Front. Physiol. 2020. 10. 1607. Published 2020 Jan 29. doi: 10.3389/fphys.2019.01607.
- Żelechowska P., Agier J., Kozłowska E., Brzezińska-Błaszczyk E. Mast cells participate in chronic low-grade inflammation within adipose tissue. Obes. Rev. 2018. 19(5). 686-697. doi: 10.1111/obr.12670.
- Zorena K., Jachimowicz-Duda O., Ślęzak D., Robakowska M., Mrugacz M. Adipokines and Obesity. Potential Link to Metabolic Disorders and Chronic Complications. Int. J. Mol. Sci. 2020. 21(10). 3570. Published 2020 May 18. doi: 10.3390/ijms21103570.

/125-1.jpg)
/126-1.jpg)
/127-1.jpg)
/129-1.jpg)
/131-1.jpg)
/132-1.jpg)
/133-1.jpg)