Журнал «Почки» Том 9, №3, 2020
Вернуться к номеру
Рекомендації для клінічної практики IPNA щодо діагностики й лікування дітей із стероїд-резистентним нефротичним синдромом
Авторы: Agnes Trautmann, Marina Vivarelli, Susan Samuel, Debbie Gipson, Aditi Sinha, Franz Schaefer, Ng Kar Hui, Olivia Boyer, Moin A. Saleem, Luciana Feltran, Janina Müller-Deile, Jan Ulrich Becker, Francisco Cano, Hong Xu, Yam Ngo Lim, William Smoyer, Ifeoma Anochie, Koichi Nakanishi, Elisabeth Hodson, Dieter Haffner on behalf of the International Pediatric Nephrology Association
Рубрики: Нефрология
Разделы: Официальная информация
Версия для печати
Анотація
Ідіопатичний нефротичний синдром щорічно вражає 1–3 на 100 000 дітей. Приблизно у 85 % випадків спостерігається повна ремісія протеїнурії після лікування глюкокортикоїдами. Пацієнти, які не досягли повної ремісії протягом 4–6 тижнів лікування глюкокортикоїдами, мають стероїдрезистентний нефротичний синдром (СРНС). У 10–30 % резистентних до стероїдів пацієнтів можуть бути виявлені мутації в генах, пов’язаних із подоцитами, тоді як в інших випадках причиною вважається невизначений циркулюючий фактор імунного походження. Діагностика й лікування СРНС є великим викликом через його неоднорідну етіологію, часту відсутність ремісії при подальшому імуносупресивному лікуванні й тяжкі ускладнення, включно з розвитком термінальної хвороби нирок і рецидивами після трансплантації нирок. Команда експертів, включно з дитячими нефрологами й нирковими генетиками з Міжнародної асоціації педіатричної нефрології (IPNA), нирковими патологоанатомами й дорослими нефрологами, розробила на сьогодні комплексні рекомендації клінічної практики щодо діагностики й ведення СРНС у дітей. Команда виконала систематичний огляд літератури щодо 9 клінічно значущих PICO (Patient або Population, Intervention, Comparator, Outcome) питань, сформулювала рекомендації і дала їх формальну оцінку на основі консенсусу на засіданні за участю представників пацієнтів і дієтолога як зовнішніх консультантів і панелі голосування дитячих нефрологів. Надано також рекомендації щодо досліджень.
Резюме
Рекомендації для клінічної практики
Визначення й діагностика
Визначення
— Ми рекомендуємо кількісну оцінку протеїнурії за співвідношенням білка/креатиніну (СБК), або в першій ранковій сечі (РС), або у 24-годинній пробі сечі принаймні один раз до визначення в пацієнта СРНС і/або на початку альтернативної імуносупресії. Ми пропонуємо використовувати цю базову величину для оцінки подальшої відповіді (на лікування) (ступінь А, сильна рекомендація).
— Ми пропонуємо використовувати визначення, наведені в табл. 1, для діагностики й управління СРНС (ступінь В, помірна рекомендація).
— Ми пропонуємо використовувати «період підтвердження», який становить 4–6 тижнів від початку пероральної стероїдної терапії в стандартних дозах, щоб оцінити реакцію на перспективи подальшого лікування глюкокортикоїдами й розпочати лікування інгібіторами ренін-ангіотензин-альдостеронової системи (іРААС) (ступінь C, слабка рекомендація). Ми також рекомендуємо в цей час провести генетичне тестування і/або біопсію нирок (ступінь В, помірна рекомендація).
— Ми пропонуємо подати гістологічні, клінічні й генетичні дані всіх пацієнтів із СРНС до реєстрів пацієнтів і генетичних баз даних, щоб допомогти вдосконалити наше розуміння захворювання і його лікування (неградуйовано).
Початковий діагностичний аналіз дитини із СРНС
— Ми рекомендуємо збирати ретельний сімейний анамнез щодо ниркових і позаниркових проявів захворювання включно із запитаннями про спорідненість. Слід отримувати, де це можливо, дані про наявність ниркових захворювань у членів сім’ї, вік дебюту, клінічний перебіг, включно з відгуком на терапію, функцією нирок, результатами нефробіопсії і генетичного тестування (ступінь А, сильна рекомендація).
— Ми рекомендуємо ретельне фізикальне обстеження пацієнта включно з глибоким пошуком позаниркових проявів, таких як скелетні, неврологічні, очні, вушні й сечостатеві відхилення, а також отримання інформації щодо вторинних причин (переважно інфекційних) нефротичного синдрому (НС) (табл. 2) (ступінь А, сильна рекомендація).
— Ми пропонуємо провести аналізи крові, сироватки й сечі, наведені в табл. 2, для пошуку імунологічних чи інфекційних причин СРНС і оцінки ступеня протеїнурії, рШКФ і гістології нирок (ступінь В, помірна рекомендація).
— Ми пропонуємо порадити провести аналіз сечі рідним братам і сестрам пацієнтів з СРНС ще до того, як буде проведено генетичне тестування (ступінь С, помірна рекомендація).
Показання до генетичного тестування та біопсії нирок
— Ми рекомендуємо, якщо є можливість, проводити генетичне тестування в усіх дітей, у яких діагностовано первинний СРНС (ступінь В, помірна рекомендація).
— Ми пропонуємо віддавати перевагу генетичному тестуванню в сімейних випадках (сімейний анамнез протеїнурії/гематурії або хронічного захворювання нирок (ХЗН) невідомого походження), випадках із позанирковими ознаками й у тих, хто проходить підготовку до трансплантації нирок (ступінь С, слабка рекомендація).
— Ми рекомендуємо біопсію нирки всім дітям із діагнозом СРНС, за винятком відомих інфекцій або злоякісних захворювань, пов’язаних із вторинним захворюванням, або потенційно в пацієнтів із сімейними та/або синдромними випадками або генетичними причинами СРНС (ступінь А, сильна рекомендація).
— Ми пропонуємо генетичне тестування перед біопсією нирки дітям із СРНС, особливо в першочергових випадках (див. вище), за умови, що результати будуть доступними (протягом декількох тижнів) (ступінь D, слабка рекомендація). Ми не рекомендуємо проводити генетичне тестування пацієнтам із початковою стероїдною чутливістю, у яких згодом розвивається стероїдна резистентність під час хвороби (тобто вторинна стероїдна резистентність) (ступінь С, помірна рекомендація).
Генетичне тестування й консультування
— Ми рекомендуємо всебічний аналіз генетичної панелі (тобто панелі секвенування наступного покоління, яка включає всі відомі на даний час гени СРНС, що в даний час є найбільш затратно-ефективним підходом до генетичного тестування) (гени перераховані в табл. 3), якщо клінічний фенотип не підкаже конкретний стан, у такому випадку ми пропонуємо проводити аналіз лише одного гена (ступінь В, помірна рекомендація).
— Ми пропонуємо визначити патогенність ідентифікованих генетичних змін відповідно до настанов Американського коледжу медичної генетики. Аналіз сімейної сегрегації може бути проведений в окремих випадках (ступінь В, помірна рекомендація).
— Ми рекомендуємо генетичне консультування пацієнтів і їхніх сімей, щоб допомогти їм інтерпретувати як очікувані, так і непередбачені генетичні результати (ступінь В, помірна рекомендація).
Скринінг на інфекції
— Ми рекомендуємо обстежувати на субклінічний туберкульоз відповідно до настанов конкретних країн (наприклад, рентгенографія грудної клітки, туберкуліновий тест, аналіз квантиферону) при клінічній підозрі або у випадку проживання в ендемічних районах і/або подорожі з них (ступінь С, помірна рекомендація).
— Ми пропонуємо тестувати на гепатит В, С, сифіліс і ВІЛ: (i) для виключення вторинних причин НС і (ii) до імуносупресії, особливо ритуксимабом, враховуючи ендемічність цих інфекцій у різних країнах (ступінь С, слабка рекомендація).
Лікування
Неімуносупресивне лікування першого ряду в дітей із СРНС
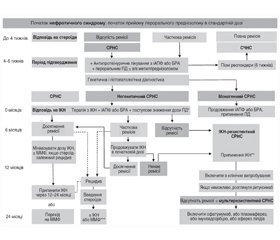
— Ми рекомендуємо починати з іРААС, а саме: інгібіторів ангіотензинперетворюючого ферменту (іАПФ) або блокаторів ангіотензинових рецепторів (БРА) після встановлення діагнозу СРНС (рис. 2) (ступінь B, помірна рекомендація). Ми пропонуємо кількісно визначити зміну першої ранкової протеїнурії після початку терапії іРААС (ступінь D, слабка рекомендація).
— Ми пропонуємо орієнтуватись на максимально допустимі дози, які наведені в табл. S8, що добре переносяться (ступінь C, слабка рекомендація).
— іАПФ або БРА слід застосовувати з обережністю в пацієнтів із ХЗН 4-ї стадії, їх не слід починати приймати або треба припиняти їх прийом у разі внутрішньосудинного зниження об’єму циркулюючої крові, гострого ураження нирок (ГУН), гіперкаліємії або частого блювання/діареї (ступінь A, сильна рекомендація).
— Ми пропонуємо використовувати іРААС із неренальним метаболізмом (тобто раміприл і БРА), оскільки вони не накопичуються при нирковій недостатності (ступінь D, слабка рекомендація).
— У підлітків жіночої статі слід забезпечити контрацепцію, щоб уникнути тератогенних ефектів іРААС (ступінь X, сильна рекомендація).
Імуносупресивне лікування першого ряду в дітей із СРНС
— Ми рекомендуємо, щоб інгібітор кальциневрину (ІКН) (циклоспорин або такролімус) був першою лінією імуносупресивної терапії в дітей з СРНС і стартував після підтвердження діагнозу (рис. 2) (ступінь B, помірна рекомендація).
— Ми пропонуємо зменшити дози преднізолону після встановлення діагнозу СРНС і припинити терапію преднізолоном через 6 місяців (ступінь D, слабка рекомендація).
— Ми рекомендуємо відміняти або відкладати лікування ІКН у пацієнтів із рШКФ < 30 мл/хв/1,73 м2, ГУН і/або неконтрольованою гіпертензією (ступінь X, сильна рекомендація).
— Ми рекомендуємо відмовитись від IКН і припинити лікування преднізолоном у пацієнтів, які мають підтверджену моногенну форму СРНС (ступінь B, помірна рекомендація).
— Коли ІКН недоступні за ціною або наявністю, ми пропонуємо використовувати циклофосфамід (ЦФ) [внутрішньовенно або перорально] з високими дозами стероїдів або без них (ступінь D, слабка рекомендація).
— Ми рекомендуємо ознайомити пацієнтів і сім’ї з можливими побічними ефектами імуносупресивних препаратів, як це наведено в табл. 4 (ступінь X, сильна рекомендація).
Призначення ІКН, моніторинг і взаємодії
— Ми пропонуємо початкову дозу циклоспорину (ЦсA) 3–5 мг/кг/добу (максимум з 250 мг/добу), що приймається перорально двічі на день (ступінь В, слабка рекомендація).
— Ми пропонуємо титрувати дозу ЦсA принаймні щоденними інтервалами, орієнтуючись на найнижчий рівень цільної крові ЦсA між 80 і 120 нг/мл, на основі сертифікованих тестів проти тандемної мас-спектрометрії (ступінь В, слабка рекомендація).
— Ми пропонуємо початкову дозу такролімусу (TAК) 0,1–0,2 мг/кг/добу (максимум від 5 мг/добу), що дається перорально двічі на день (ступінь В, слабка рекомендація).
— Ми пропонуємо титрувати дозу TAК, орієнтуючись на найнижчі рівні від 4 до 8 нг/мл. Ми також пропонуємо інтервали титрування принаймні раз на 3 дні (ступінь В, слабка рекомендація).
— Ми пропонуємо моніторинг рівнів ЦсA/TAК принаймні щотижня до досягнення цільових рівнів, а потім кожні 1–3 місяці разом із креатиніном у сироватці крові як параметром безпечності (ступінь D, слабка рекомендація) (табл. 2).
— Ми рекомендуємо зменшити дозу ІКН або його відміну, якщо рШКФ зменшиться нижче за 30 мл/хв/1,73 м2 (клас X, сильна рекомендація).
Тривалість лікування ІКН
— Ми пропонуємо мінімальний термін лікування до 6 місяців, щоб визначити відповідь на ІКН (ступінь B, слабка рекомендація). Ми рекомендуємо припинити ІКН, якщо часткова ремісія не буде досягнута через 6 місяців (ступінь В, помірна рекомендація). Якщо досягається повна ремісія, дозування ІКН слід зменшити до найнижчої дози, необхідної для підтримки ремісії. Ми також пропонуємо розглянути можливість припинення ІКН через 12–24 місяці в цих пацієнтів, щоб зменшити ризик нефротоксичності (ступінь С, слабка рекомендація). У цих пацієнтів перехід на мофетилу мікофенолат (ММФ) може розглядатися як мінімізація нефротоксичності й підтримка ремісії (див. infra). Якщо після припинення ІКН виникають рецидиви, ми пропонуємо знов призначити ІКН для випробування разом із 4-тижневим пероральним преднізолоном. Альтернативно може бути розглянута терапія ММФ (ступінь C, слабка рекомендація).
— Якщо досягається часткова ремісія, ми пропонуємо продовжувати ІКН у тій самий дозі мінімум 12 місяців (ступінь С, слабка рекомендація).
Мофетилу мікофенолат
— Якщо імуносупресія розглядається в дитини із СРНС і рШКФ < 30 мл/хв/1,73 м2, ми пропонуємо використовувати ММФ, а не ІКН, через ризик виникнення ІКН-нефротоксичності (ступінь С, слабка рекомендація).
— Ми пропонуємо розглянути можливість застосування ММФ для підтримки ремісії у дітей із СРНС у стадії ремісії після ІКН, якщо в них розвинувся рецидив зі збереженням чутливості до стероїдів (ступінь С, слабка рекомендація).
— У пацієнтів із СРНС, які досягли повної ремісії при терапії ІКН протягом принаймні 12 місяців, ми пропонуємо розглянути перехід на ММФ як альтернативний імуносупресивний засіб, щоб не продовжувати ІКН (ступінь С, слабка рекомендація).
Повторна біопсія нирок
— Якщо під час спостереження виявляється незрозуміле падіння рШКФ або збільшення протеїнурії, ми пропонуємо розглянути повторну біопсію нирки для оцінки нефротоксичності ІКН (ступінь С, слабка рекомендація).
— Ми пропонуємо розглянути питання про біопсію нирок у тих пацієнтів, які тривало приймали ІКН (> 2 роки), або перед повторним початком лікування ІКН другим курсом (ступінь С, слабка рекомендація).
Спільне призначення з глюкокортикоїдами
— Ми не рекомендуємо тривале (> 6 місяців) рутинне лікування преднізолоном у поєднанні з IКН та іРААС (ступінь C, помірні рекомендації)
— Ми пропонуємо зменшення дози преднізолону після початку лікування ІКН таким чином: 40 мг/м2/добу протягом 4 тижнів, 30 мг/м2/добу протягом 4 тижнів, 20 мг/м2/добу протягом 4 тижнів, 10 мг/м2/добу протягом 8 тижнів і відміна після цього (ступінь D, слабка рекомендація).
Друга лінія вибору
— Пацієнтам із СРНС, які не зможуть досягти хоча б часткової ремісії на ІКН (і які не мають генетичної чи синдромної хвороби), слід звернутися для участі в клінічному випробуванні, що оцінює нові потенційні методи терапії СРНС (неградуйовано).
— Якщо клінічне випробування відсутнє, можливе застосування ритуксимабу (ступінь С, слабка рекомендація).
— Ми пропонуємо вводити дві інфузії ритуксимабу в дозі 375 мг/м2 на інфузію, щоб зменшити кількість клітин CD19 нижче за 5 на мікролітр або до 1 % (як правило, 1–2 інфузії протягом 2 тижнів) (ступінь C, слабка рекомендація).
— Ритуксимаб не слід давати за наявності туберкульозу, гепатиту В або поліомавірусних інфекцій. У разі виникнення клінічної підозри й ендемічного підґрунтя пацієнту слід пройти рентгенографію грудної клітки, шкірний тест на туберкульоз або аналіз крові, серологію HBs-Ag у разі підвищення рівня печінкових ферментів та обстеження спинномозкової рідини в разі неврологічних симптомів, що вказують на вірусну інфекцію, перед початком прийому ритуксимабу (ступінь X, сильна рекомендація).
— У пацієнтів, резистентних до ритуксимабу або з непереносимістю ритуксимабу, може бути розглянуто використання офатумумабу й екстракорпоральної терапії очищення крові, такої як обмін плазми, імуноадсорбція або ліпідний аферез (ступінь С, слабка рекомендація).
Відміна імуносупресії в пацієнтів, які на неї не відповідають
— Ми рекомендуємо запропонувати скринінг для всіх відомих генів подоцитопатій, щоб прийняти рішення щодо подальшої імуносупресії (ступінь X, сильна рекомендація).
— Ми рекомендуємо консультувати пацієнтів і батьків щодо високого ризику прогресування термінальної ХНН у пацієнтів зі спадковими формами і/або СРНС, резистентними до багатьох ліків (категорія X, сильна рекомендація).
— Ми рекомендуємо припинити неефективну імуносупресивну терапію і продовжувати неімуносупресивне лікування, включно з іРААС та іншими підтримуючими заходами (ступінь X, сильна рекомендація).
— Пацієнтам з негенетичними захворюваннями ми пропонуємо вивчити наявні варіанти нових методів терапії, що оцінюються в клінічних випробуваннях (ступінь X, сильна рекомендація).
— Пацієнтам із спадковими дефектами, які досягли часткової або повної ремісії імуносупресією, ми пропонуємо наступне: генетичний варіант(-и) слід переглянути, щоб підтвердити, чи він є справді патогенним, чи ймовірно патогенним (ступінь А, сильна рекомендація).
— Рішення про продовження або припинення імуносупресії повинно прийматись через батьківські консультації щодо очікуваних переваг ремісії (симптоматичне полегшення; потенційно нижчий ризик прогресування захворювання) порівняно з потенційними ризиками (токсичність, пов’язана з терапією; інфекції) і витратами на терапію (ступінь А, сильна рекомендація).
Додаткові заходи щодо зменшення симптомів і контролю за набряками
Сіль
— Ми пропонуємо уникати надмірного споживання солі дітям із СРНС (табл. S11) (ступінь C, слабка рекомендація).
— Якщо це доступно, дієтолог повинен давати поради пацієнтам і сім’ям щодо придатних продуктів із низьким вмістом солі й продуктів із високим вмістом солі, яких слід уникати (ступінь D, слабка рекомендація).
Рідина
— Ми не рекомендуємо рутинне обмеження рідини в пацієнтів із СРНС (ступінь С, слабка рекомендація).
— Ми пропонуємо збалансоване споживання рідини з огляду на кількість сечі, волемічний стан і натрій у сироватці крові (ступінь С, слабка рекомендація).
Діуретики
— Ми пропонуємо розглянути можливість лікування петльовими діуретиками (наприклад, фуросемідом) у пацієнтів із сильними набряками. У пацієнтів із резистентними набряками також може розглядатися додавання метолазону, тіазидів або калійзберігаючих діуретиків (ступінь С, помірна рекомендація).
— Діуретики не слід давати пацієнтам з ознаками внутрішньосудинної гіповолемії, що включають тривалий час поповнення капілярів (периферична вазоконстрикція), тахікардію, гіпотензію та олігурію через ризик тромбозу та ГУН (ступінь X, сильна рекомендація).
Інфузії альбуміну
— Ми пропонуємо лікувати пацієнтів з рефрактерними набряками (перикардіальний/плевральний випіт, анасарка, набряк геніталій) і/або симптоматичною гіповолемією або преренальною кризою (олігурія з причини гіповолемії) інфузіями людського альбуміну (ступінь С, помірна рекомендація).
— Ми пропонуємо початкову дозу 20–25% альбуміну 0,5–1 г/кг маси тіла, що вводиться внутрішньовенно протягом 4–8 год, і додавання фуросеміду (1–2 мг/кг в/в) у середині та/або в кінці інфузії (ступінь С, слабка рекомендація).
— Дітям, які отримують інфузії альбуміну, на початку слід контролювати значення артеріального тиску й частоти серцевих скорочень кожні 30 хв, інфузію слід сповільнювати чи припиняти, якщо в них з’являються симптоми, що свідчать про гіперволемію (ступінь X, сильна рекомендація).
Білок
Немає достатніх доказів, щоб рекомендувати збільшення споживання білка в пацієнтів із СРНС (неградуйовано).
Рекомендації щодо способу життя
Ми рекомендуємо підтримувати фізичну активність і здорове харчування в дітей із СРНС та адаптуватися до можливостей пацієнта і стадії ХЗН. Рекомендуємо радити відмову від куріння (ступінь С, помірна рекомендація).
Моніторинг та управління ускладненнями НС і побічними ефектами ліків
Моніторинг ускладнень
Ми рекомендуємо проводити моніторинг на наявність ускладнень при персистуючому НС і побічних ефектів від ліків (див. табл. 4) (ступінь В, помірна рекомендація).
Втручання — профілактика та лікування
Гіпогаммаглобулінемія — відновлення імуноглобуліну
Ми пропонуємо враховувати відновлення імуноглобуліну у випадках низького рівня IgG у сироватці крові й при рецидивуючих і/або тяжких інфекціях (ступінь D, слабка рекомендація).
Антибіотикопрофілактика
— Ми не рекомендуємо рутинну антибіотикопрофілактику дітям із СРНС (ступінь С, слабка рекомендація).
— Ми пропонуємо антибіотикопрофілактику котримоксазолом у пацієнтів, які отримували ритуксимаб протягом 3–6 місяців, залежно від відновлення кількості В-клітин та імуносупресивного медикаментозного лікування (ступінь С, слабка рекомендація).
Вакцинація
— Ми рекомендуємо переглянути стан вакцинації дитини на початку захворювання й виконати всі вакцинації без зволікань, особливо для інкапсульованих бактерій (пневмококові, менінгококові, Haemophilus influenzae) і, якщо можливо, вірусу варицела-зостер (ступінь А, сильна рекомендація).
— Ми пропонуємо щорічно вводити інактивовану вакцину проти грипу (ступінь А, сильна рекомендація).
— Ми рекомендуємо дотримуватися національних рекомендацій щодо вакцинації для введення неактивних і живих ослаблених вакцин в імуноскомпрометованих пацієнтів (ступінь А, сильна рекомендація).
— Живі вакцини не слід вводити пацієнтам із СРНС, які щоденно отримують імуносупресивні препарати, включно з ІКН, ММФ і преднізолоном (ступінь X, сильна рекомендація).
Профілактика герпетичної інфекції
— Ми рекомендуємо лікувати сприйнятливих пацієнтів (тобто тих, які недостатньо або повністю неімунізовані до варицели й можуть мати контакти за вітрянкою) імуноглобуліном проти вірусу варицела-зостер (VZIG) (ступінь А, сильна рекомендація).
— Якщо VZIG недоступний, ми пропонуємо лікування пероральним ацикловіром (10 мг/кг /добу протягом 7 днів) протягом 7–10 днів після контакту (ступінь С, помірна рекомендація).
— Ми рекомендуємо приймати вакцину проти вітряної віспи неімунізованим пацієнтам у стані ремісії, а не під час лікування імуносупресивними препаратами (ступінь А, сильна рекомендація).
Профілактика тромбозу
— Ми рекомендуємо максимально мобілізувати пацієнтів і не розміщувати центральні венозні катетери, за винятком конкретної і минущої потреби (ступінь X, сильна рекомендація).
— Немає достатніх доказів, щоб рекомендувати рутинну профілактичну антикоагуляцію дітям із СРНС без попереднього анамнезу чи ризику тромбозу (неградуйовано).
— Ми пропонуємо профілактичну антикоагуляцію низькомолекулярним гепарином або пероральними антикоагулянтами в пацієнтів із попереднім венозним тромбоемболічним анамнезом, а також розглянути питання про лікування пацієнтів із додатковими факторами ризику (розміщення центральних венозних ліній, відома спадкова тромбофільна схильність, гострі захворювання при госпіталізації, інфекція або ризик зневоднення) (ступінь С, слабка рекомендація).
— Ми пропонуємо проведення тромбофільного скринінгу в пацієнтів із СРНС і додатковими факторами ризику, включаючи центральні венозні лінії, стійку протеїнурію нефротичного рівня й позитивний сімейний анамнез щодо тромбофільної схильності (табл. 2) (ступінь С, слабка рекомендація).
Лікування гіпер- або дисліпідемії
Ми пропонуємо розглянути вікзалежне ліпідознижувальне лікування в дітей із персистуючим мультирезистентним до ліків НС і стійким високим рівнем ЛПНЩ (> 130 мг/дл; > 3,4 ммоль л) (ступінь С, слабка рекомендація).
Добавки кальцію, магнію і вітаміну D
— Ми пропонуємо призначати кальцій перорально, якщо існує гіпокальціємія, на основі іонізованого та/або скорегованого за рівнем альбуміну кальцію (ступінь С, слабка рекомендація).
— Ми пропонуємо доповнення препаратами кальциферолу або ергокальциферолу, якщо рівень 25-ОН-вітаміну D низький (< 30 нг/мл) (ступінь С, помірна рекомендація).
— Ми пропонуємо призначати магній перорально в разі симптоматичної гіпомагніємії (ступінь D, слабка рекомендація).
Відновлення гормонів щитоподібної залози
Ми рекомендуємо призначати левотироксин (Т4) у разі гіпотиреозу (ступінь А, сильна рекомендація).
Лікування гіпертензії та ускладнень, пов’язаних із ХЗН
Ми рекомендуємо лікування гіпертензії та ускладнень, пов’язаних з ХЗН, таких як анемія, метаболічний ацидоз та гіперпаратиреоз, відповідно до чинних рекомендацій (ступінь А, сильна рекомендація).
Діагностика, профілактика та лікування рецидивуючого СРНС у власних нирках
Запобігання рецидиву
Немає клінічних або гістологічних параметрів при клінічному дебюті для прогнозування рецидивуючого перебігу СРНС (неградуйовано).
Лікування рецидиву
Рецидив при лікуванні ІКН
— Ми рекомендуємо відстежувати прихильність до ІКН за допомогою рівня в сироватці крові згідно з графіком моніторингу, показаним у табл. 2 (ступінь С, помірна рекомендація).
— Ми пропонуємо призначати перорально 60 мг/м2 щодня до досягнення ремісії або протягом максимального періоду 4 тижні з наступним зменшенням дози при досягненні ремісії (ступінь С, слабка рекомендація).
— У разі відсутності реакції, частих рецидивів або побічних ефектів від ліків ми рекомендуємо дотримуватися протоколу лікування рефрактерного СРНС (див. «Підходи другої лінії») (неградуйовано).
Рецидив після відміни імуносупресивного лікування
— Ми пропонуємо давати пероральний преднізолон (60 мг/м2 щодня) до досягнення ремісії або протягом максимального періоду 4 тижні з наступним зменшенням при досягненні ремісії.
— Як варіант ми пропонуємо знов призначити імуносупресивний агент, що зміг запобігти рецидиву (ступінь D, слабка рекомендація).
— У випадках неповного реагування протягом 4 тижнів, частих рецидивів або побічних ефектів ліків ми рекомендуємо дотримуватися протоколу рефрактерного СРНС (див. «Підходи другої лінії») (неградуйовано).
Ведення дітей із термінальним ХЗН
Діалізні пацієнти
— Ми рекомендуємо вимірювати екскрецію білка із сечею до трансплантації в пацієнтів із залишковою функцією нирки, щоб полегшити ретельний посттрансплантаційний нагляд щодо рецидиву (ступінь А, сильна рекомендація).
— Ми рекомендуємо, щоб передбачуваний ризик рецидиву після трансплантації нирок обговорювався з родиною при плануванні замісної терапії нирок (ступінь А, сильна рекомендація).
— Якщо трансплантація відбудеться до закінчення НС в умовах встановлення термінальної ХЗН, ми пропонуємо розглянути медичну або хірургічну нефректомію до трансплантації (ступінь D, слабка рекомендація).
Вибір реципієнтів для трансплантації
— Ми рекомендуємо проводити генетичне тестування перед трансплантацією, щоб повідомити про ризик рецидиву СРНС (ступінь В, помірна рекомендація).
— Ми рекомендуємо пропонувати трансплантацію нирок дітям із термінальним ХЗН із причини СРНС незалежно від генетичної або негенетичної причини СРНС (ступінь В, помірна рекомендація).
— Ми пропонуємо, щоб ризики й переваги повторної трансплантації в пацієнта з анамнезом рецидиву СРНС обговорювалися в межах групи з трансплантації і з пацієнтом і родиною при плануванні повторної трансплантації (ступінь А, сильна рекомендація).
Відбір донорів для трансплантації
— Ми рекомендуємо кандидатам на прижиттєве донорство алотрансплантата проходити генетичне тестування як частину оцінювання для встановлення генетичного СРНС, якщо це доступно (ступінь X, сильна рекомендація).
— Ми рекомендуємо кандидата-донора з патогенним або ймовірним патогенним варіантом у домінантному гені, із симптомами або без них, виключити як потенційного донора (ступінь X, сильна рекомендація).
— Гетерозиготний носій рецесивного генетичного варіанта СРНС може вважатися потенційним донором після генетичного консультування (крім носіїв патологічних варіацій COL4A5, COL4A3 та COL4A4) (ступінь C, слабка рекомендація).
— Безсимптомний носій варіанта невідомого значення може розглядатися як донор для трансплантації після всебічної оцінки й консультування, коли інших варіантів донорства органів немає (ступінь С, слабка рекомендація).
— Ми рекомендуємо включити очікуваний ризик рецидиву й передчасної недостатності алотрансплантата до розгляду кандидатури донора (ступінь А, сильна рекомендація).
Утримання від трансплантації пацієнтів, які раніше мали рецидив
— Ми рекомендуємо відмовляти від прижиттєвого донорства реципієнтів, у яких повторно виникли захворювання при першій трансплантації (ступінь В, помірна рекомендація).
— Пересадка від неживого донора може бути запропонована потенційним реципієнтам з історією попередньої втрати трансплантата до рецидиву НС, особливо якщо діаліз складно переносити або він пов’язаний з загрозами для життя, серйозними інфекціями, недостатнім ростом і/або низькою якістю життя (ступінь С, слабка рекомендація).
Профілактика рецидивів після трансплантації нирок
— Немає достатніх доказів, щоб рекомендувати стратегії втручання для запобігання рецидиву в дітей, які перенесли першу трансплантацію нирки (неградуйовано).
— Ми пропонуємо профілактичний плазмаферез або імуноадсорбцію, ліпідний аферез і періопераційний ритуксимаб для застосування в дітей з анамнезом втрати алотрансплантата внаслідок повторного рецидиву НС у попередній трансплантації (ступінь С, слабка рекомендація).
Рецидив у трансплантаті (як визначено в табл. 1)
— Ми рекомендуємо стежити за розвитком можливого рецидиву починаючи з дня трансплантації нирки шляхом моніторингу САК, продовжувати щодня протягом першої початкової госпіталізації пацієнта з трансплантатом, а потім продовжувати періодично (наприклад, щотижня протягом 4 тижнів, щомісяця протягом 1 року, а потім щоквартально) (ступінь C, помірна рекомендація).
— Ми вважаємо, що в пацієнта з ануричним періодом після трансплантації САК ≥ 100 мг/ммоль (1 мг/мг) може бути свідченням раннього рецидиву, інфекції або інших діагнозів і вимагає оцінки (ступінь С, слабка рекомендація).
— Ми вважаємо, що в пацієнта з вираженою протеїнурією під час трансплантації збільшення САК ≥ 100 мг/ммоль (1 мг/мг) може бути свідченням раннього рецидиву, інфекції або інших діагнозів і вимагає оцінки (ступінь С, слабка рекомендація).
— Ми вважаємо, що ранній розвиток гострого тубулярного некрозу (ГТН) або відсутність функції/дисфункцію трансплантата слід розглядати як перші ознаки рецидиву (ступінь C, слабка рекомендація).
— Ми пропонуємо, що біопсія алотрансплантата не потрібна для діагностики швидкого рецидиву НС, як визначено в табл. 1, але біопсія алотрансплантата рекомендується для проведення диференціальної діагностики при виникненні субнефротичної протеїнурії, рецидиву через 48 год або при встановленні затримки функції трансплантата (ступінь В, помірна рекомендація).
— Ми пропонуємо, щоб діагностична оцінка передувала корекції імуносупресивної терапії в умовах пізнього рецидиву НС (> 3 місяці після трансплантації), включаючи оцінку інфекції, специфічні для донора серологічнї антитіла й гістопатологію, включно з електронною мікроскопією (ступінь В, помірна рекомендація).
Лікування рецидиву
— Ми рекомендуємо застосовувати терапію, пов’язану з рецидивом НС, якомога швидше після встановлення діагнозу (ступінь X, сильна рекомендація).
— Ми пропонуємо застосовувати зростаючі дози ІКН, внутрішньовенні пульси метилпреднізолону і/або плазмаферез (або імуноадсорбцію) з ритуксимабом або без нього (ступінь С, слабка рекомендація).
— Ми пропонуємо розпочати прийом іРААС, коли не буде досягнуто повної ремісії після рецидивної цільової терапії (ступінь С, слабка рекомендація).
Переклад: проф. Д.Д. Іванов, к.м.н. М.Д. Іванова
Approved for publication by IPNA 01/09/2020/Дозволено для публікації IPNA 01/09/2020

/70.jpg)
/72.jpg)
/73.jpg)
/74.jpg)
/75.jpg)
/81.jpg)
/82.jpg)
/83_2.jpg)
/79.jpg)
/86.jpg)