Резюме
В оглядовій статті наведено системний аналіз рекомендацій з лікування мінерально-кісткових порушень у хворих із хронічними хворобами нирок (ХХН) з адаптацією до практики сімейних лікарів. Кількість хворих із ХХН становить 10 % від дорослого населення. Оскільки основними етіологічними причинами є цукровий діабет та артеріальна гіпертензія, такі хворі мають проходити регулярний скринінг на наявність у них ХХН. Дисбаланс фосфорно-кальцієвого обміну, що призводить до мінерально-кісткових порушень, починає розвиватися на 2-й стадії ХХН (при швидкості клубочкової фільтрації (ШКФ) від 60 до 89 мл/хв на 1,73 м2), коли знижується рівень 1,25-дигідроксивітаміну D. При пошкодженні нирок знижується кількість функціонуючих клубочків, нормальний рівень фосфатів підтримується за рахунок зменшення канальцевої реабсорбції під впливом фосфатоніну (гормон, що регулює екскрецію фосфатів) і паратиреоїдного гормону (ПТГ), і на стадії 3а ХХН виявляють збільшення рівня фосфатоніну. ПТГ стає головним механізмом підтримки гомеостазу фосфатів, його рівень у плазмі збільшується на стадії 3б ХХН. На 4–5-й стадії ХХН (ШКФ < 30 % від норми) цей механізм перестає адекватно справлятися з регуляцією обміну фосфатів і розвивається гіперфосфатемія, незважаючи на високий рівень ПТГ і фосфатоніну, також на цій стадії знижується рівень 25-гідроксивітаміну D — кальцидіолу. І нарешті, починає знижуватися рівень кальцію в плазмі, що призводить до резорбції кальцію з кісток і відкладання його в стінках судин. Основою діагностики мінерально-кісткових порушень є визначення лабораторних показників, що характеризують фосфорно-кальцієвий обмін. Рекомендується моніторинг сироваткових рівнів кальцію, фосфату, ПТГ та активності лужної фосфатази починаючи з 3-ї стадії ХХН. У дітей потрібно починати таке моніторування з 2-ї стадії ХХН.
В обзорной статье приведен системный анализ рекомендаций по лечению минерально-костных нарушений у больных с хроническими болезнями почек (ХБП) с адаптацией к практике семейных врачей. Количество больных с ХБП составляет 10 % от взрослого населения. Поскольку основными этиологическими причинами являются сахарный диабет и артериальная гипертензия, такие больные должны проходить регулярный скрининг на наличие у них ХБП. Дисбаланс фосфорно-кальциевого обмена, приводящий к минерально-костным нарушениям, начинает развиваться на 2-й стадии ХБП (при скорости клубочковой фильтрации (СКФ) от 60 до 89 мл/мин на 1,73 м2), когда снижается уровень 1,25-дигидроксивитамина D. При повреждении почек снижается количество функционирующих клубочков, нормальный уровень фосфатов поддерживается за счет уменьшения канальцевой реабсорбции под воздействием фосфатонина (гормона, регулирующего выведение фосфатов) и паратиреоидного гормона (ПТГ), и на стадии 3а ХБП выявляют увеличение уровня фосфатонина. ПТГ становится главным механизмом поддержания гомеостаза фосфатов, его уровень в плазме увеличивается на стадии 3б ХБП. На 4–5-й стадии ХБП (СКФ < 30 % от нормы) этот механизм перестает адекватно справляться с регуляцией обмена фосфатов и развивается гиперфосфатемия, несмотря на высокий уровень ПТГ и фосфатонина, также на этой стадии снижается уровень 25-гидроксивитамина D — кальцидиола. И наконец, начинает снижаться уровень кальция в плазме, что приводит к резорбции кальция из костей и откладыванию его в стенках сосудов. Основой диагностики минерально-костных нарушений является определение лабораторных показателей, характеризующих фосфорно-кальциевый обмен. Рекомендуется мониторинг сывороточных уровней кальция, фосфата, ПТГ и активности щелочной фосфатазы начиная с 3-й стадии ХБП. У детей нужно начинать такое мониторирование со 2-й стадии ХБП.
The review article presents a systematic analysis of recommendations for the treatment of bone and mineral disorders in patients with chronic kidney disease (CKD), with adaptation to the practice of family physicians. The number of patients with CKD is 10 % of the adult population. As the main etiological causes are diabetes and hypertension, such patients should be regularly screened for CKD. Imbalance of phosphorus-calcium metabolism, leading to mineral and bone disorders, begins to develop at stage 2 CKD (with glomerular filtration rate (GFR) from 60 to 89 ml/min per 1.73 m2) when the level of 1.25-dihydroxyvitamin D decreases. When the kidneys are damaged, the number of functioning glomeruli decreases, normal phosphate levels are maintained by reducing tubular reabsorption under the influence of fibroblast growth factor 23 (FGF23, a hormone that regulates phosphate excretion) and parathyroid hormone (PTH), and at stage 3a CKD, an increase in phosphate levels is detected. PTH becomes the main mechanism of maintenance of phosphate homeostasis, its plasma level increases at stage 3b CKD. At the 4th–5th stage of CKD (GFR < 30 % of normal), this mechanism ceases to adequately cope with the regulation of phosphate metabolism and hyperphosphatemia develops, despite the high levels of PTH and FGF23; also at this stage, the level of 25-hydroxyvitamin D — calcidiol decreases. Finally, the plasma level of calcium begins to decrease, which leads to the resorption of calcium from the bones and its deposition in the walls of blood vessels. The basis for the diagnosis of mineral and bone disorders is the determination of laboratory parameters that characterize phosphorus-calcium metabolism. Monitoring of serum calcium, phosphate, PTH, and alkaline phosphatase activity from stage 3 CKD is recommended. Children should start such monitoring from the 2nd stage of CKD.
Увага сімейного лікаря має бути сконцентрована в першу чергу на найбільш поширених захворюваннях, що є основною причиною смерті, інвалідності, зниження якості життя, таких як коронарна хвороба серця, артеріальна гіпертензія, цукровий діабет, онкологічні захворювання, хронічні обструктивні захворювання легень. До числа цих захворювань належать і хронічні хвороби нирок (ХХН).
Кількість хворих із ХХН становить 10 % від дорослого населення. Це означає, що якщо в сімейного лікаря в базі зареєстровано 2000 дорослих людей, то з них у 200 вже є хронічна хвороба нирок. У цих хворих, якщо їх не виявляти і не лікувати, дуже великий ризик серцево-судинних катастроф (інсультів і інфарктів міокарда), а зниження функції нирок швидко й неухильно прогресує аж до ниркової недостатності та уремії з необхідністю проведення діалізу або пересадки нирок [1].
Основними етіологічними чинниками розвитку ХХН є діабетична хвороба нирок (≈ 50 %) і гіпертензивна нефропатія (близько 30 %). Отже, скринінгове обстеження на наявність ХХН повинні проходити всі хворі із цукровим діабетом 2-го типу, як мінімум 1 раз на рік після встановлення діагнозу. Також повинні обстежитися всі хворі з артеріальною гіпертензією, як мінімум 1 раз на рік. Тобто таке скринінгове обстеження проходять усі хворі з ЦД 2-го типу і АГ у міру їх звернення до сімейного лікаря з приводу лікування цих захворювань.
Якщо будь-які клінічні прояви у хворого, або зміни в аналізах сечі, або зміни, виявлені за допомогою інструментальних методів дослідження, що оцінюються сімейним лікарем як патологічні, або швидкість клубочкової фільтрації (ШКФ) менше за 60 мл/хв на 1,73 м2 спостерігаються більше ніж 3 місяці, то встановлюється діагноз «хронічна хвороба нирок» [1].
Основними маркерами ХХН є альбумінурія (протеїнурія) і розрахункова ШКФ. За рівнем ШКФ встановлюється стадія ХХН. Хворих із ХХН при ШКФ менше ніж 30 мл/хв на 1,73 м2 повинен лікувати нефролог. При більш високій ШКФ хворі можуть перебувати під наглядом сімейного лікаря.
ХХН призводить до розвитку таких ускладнень, як артеріальна гіпертензія, анемія, дисліпідемія, порушення харчування й фосфорно-кальцієвого обміну (мінерально-кісткові порушення), нейропатія. Чим раніше починається адекватна терапія хворих із ХХН, тим ефективніша вона щодо запобігання ускладненням, перш за все серцево-судинним. Рано розпочате лікування також може сповільнити прогресування зниження функції нирок. Необхідно проводити специфічне лікування захворювання, що є причиною ХХН. Однак терапія власне ХХН має синдромний характер і неспецифічна щодо причини захворювання.
Порушення фосфорно-кальцієвого обміну, що призводять до мінерально-кісткових порушень, починають розвиватися на стадії 2 ХХН (при ШКФ від 60 до 89 мл/хв на 1,73 м2), коли знижується рівень 1,25-дигідроксивітаміну D (1,25(ОН)2D) (табл. 1).
При пошкодженні нирок знижується кількість функціонуючих клубочків, нормальний рівень фосфатів підтримується за рахунок зниження канальцевої реабсорбції під впливом фосфатоніну (гормон, що регулює екскрецію фосфатів) і паратиреоїдного гормону (ПТГ), і на стадії 3а ХХН виявляють збільшення рівня фосфатоніну [2]. Ефект фосфатоніну у хворих із діабетичною хворобою нирок обмежений дефіцитом білка Клото (трансмембранний білок, β-глюкуронідаза, що регулює чутливість організму до інсуліну), і ПТГ стає головним механізмом підтримки гомеостазу фосфатів, його рівень у плазмі збільшується на стадії 3б ХХН.
На 4–5-й стадії ХХН (ШКФ < 30 % від норми) цей механізм перестає адекватно справлятися з регуляцією обміну фосфатів і розвивається гіперфосфатемія, незважаючи на високий рівень ПТГ і фосфатоніну [3]. Також на цій стадії знижується рівень 25-гідроксивітаміну D (25(ОН)D) — кальцидіолу. І нарешті, починає знижуватися рівень кальцію в плазмі, що призводить до резорбції кальцію з кісток і відкладання його в стінках судин.
Порушення фосфорно-кальцієвого обміну проявляються клінічно у вигляді мінеральних і кісткових порушень при ХХН, які визначаються як системні порушення, що включають аномальні біохімічні показники, такі як гіперфосфатемія і гіперкальціємія, патологію кісток і судинний кальциноз. Судинний кальциноз розглядається як системний маркер мінеральних і кісткових порушень при ХХН.
Основою діагностики мінерально-кісткових порушень є визначення лабораторних показників, що характеризують фосфорно-кальцієвий обмін. Рекомендується моніторинг сироваткових рівнів кальцію, фосфату, ПТГ та активності лужної фосфатази починаючи з 3-ї стадії ХХН. У дітей потрібно починати таке моніторування з 2-ї стадії ХХН.
Частота обстеження хворого з ХХН для корекції терапії визначається загальними рекомендаціями й залежить у першу чергу від рівня ШКФ і альбумінурії (протеїнурії) [1] (табл. 2).
У пацієнтів із ХХН 3–5-ї стадії при визначенні частоти моніторування сироваткового рівня кальцію, фосфору й паратгормону доцільно орієнтуватися на наявність і вираженість порушень, а також на темпи прогресування ХХН. У пацієнтів із ХХН, які отримують лікування з приводу мінерально-кісткових порушень, або тих, у кого виявлені біохімічні порушення фосфорно-кальцієвого обміну, доцільно збільшити частоту вимірювань для моніторування їх динаміки, ефективності терапії і побічних ефектів. Також рекомендована різна частота визначення для різних біохімічних показників, що характеризують фосфорно-кальцієвий обмін (табл. 3).
/37_2.jpg)
Гіперфосфатемія призводить до активації на клітинах рецепторів PiT-1 і PiT-2, які беруть участь у патогенезі фосфат-індукованої судинної кальцифікації. Активація рецепторів PiT-1 сприяє кальцифікації судин, тоді як активація рецепторів PiT-2 захищає від кальцифікації судин за допомогою невідомих механізмів [4]. У результаті при прогресуванні ХХН розвивається медіальна кальцифікація аорти і дрібних артеріол у серці. Крім того, прогресує гіпертрофія міокарда лівого шлуночка. Кальцифікація судин, у свою чергу, катастрофічно збільшує ризик серцево-судинних катастроф (інсультів і інфарктів міокарда) [5].
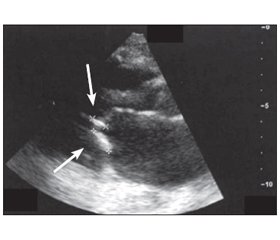
Для діагностики судинного кальцинозу в пацієнтів із ХХН 3–5D стадії рекомендується використання латеральної абдомінальної рентгенографії для виявлення наявності або відсутності судинної кальцифікації, а ехокардіографії — для визначення наявності або відсутності клапанної кальцифікації (рис. 1).
Також важливою є правильна інтерпретація отриманих даних. Перш за все на прийняття неправильного клінічного рішення може вплинути похибка в лабораторних тестах і наявні відмінності в референтних показниках при використанні різних методик визначення.
Крім того, рівень визначених в плазмі гормонів не завжди свідчить про їх достатній біологічний ефект. Так, наприклад, в умовах оксидативного стресу паратиреоїдний гормон піддається змінам, метіонін у позиціях 8 і 18 може окислюватися оборотно до метіонін-сульфоксиду й необоротно — до метіонін-сульфону. Оксидований ПТГ змінює тривимірну структуру, що блокує його зв’язок з рецепторами. «Біоактивний» інтактний ПТГ після оксидації присутній у сироватці, але не зв’язується з рецепторами й стає біологічно неактивним [6].
Рішення про лікування мінерально-кісткових порушень повинно базуватися на тенденціях біохімічних змін з огляду на всі показники, а не на одиничному лабораторному показнику. Слід віддавати перевагу використанню індивідуальних рівнів кальцію і фосфату сироватки, які оцінюються одночасно, а не математичному узагальненню у вигляді кальцій-фосфатного добутку (Са × Р).
Лікування мінерально-кісткових порушень повинно ґрунтуватися на серії визначень рівня фосфатів, кальцію і ПТГ у хворого, що оцінюються разом (рис. 2).
Рекомендується зниження підвищеного рівня фосфатів у бік нормальних значень, при цьому рекомендується уникати гіперкальціємії.
Дієта. Пацієнтам із ХХН 3–5D стадії при лікуванні гіперфосфатемії пропонується обмеження споживання фосфату з їжею, як правило, у поєднанні з іншими видами терапії [7]. З цією метою рекомендується зменшити споживання білка хворими із ХХН починаючи з 4-ї стадії.
Фармакотерапія. У пацієнтів із ХХН 3–5-ї стадії, які не перебувають на діалізі, оптимальний рівень ПТГ невідомий. У пацієнтів із підвищенням ПТГ за верхню межу норми рекомендується в першу чергу оцінювати наявність гіперфосфатемії, гіпокальціємії і дефіциту вітаміну D.
Для лікування гіперфосфатемії використовуються фосфатзв’язуючі препарати. У разі персистуючої або періодичної гіперкальціємії необхідне зменшення дози кальційвмісних фосфатзв’язуючих препаратів і/або дози кальцитріолу або аналогів вітаміну D. Рекомендується уникати тривалого застосування алюмінійвмісних фосфатзв’язуючих препаратів через токсичні побічні ефекти, пов’язані з накопиченням алюмінію. Лікування гіперфосфатемії кальцієм може викликати гіперкальціємію. Комбінована терапія севеламером і кальцієм, як правило, веде до зниження рівня сироваткового ПТГ.
Не слід рутинно використовувати кальцитріол і аналоги вітаміну D. Їх використання виправдане для хворих із ХХН 4–5-ї стадії з тяжким і прогресуючим гіперпаратиреоїдизмом [8].
Висновки
— У практиці сімейного лікаря необхідно виявляти хворих із ХХН, для чого слід проводити моніторування ШКФ з визначенням креатиніну плазми і альбумінурії (протеїнурії) у хворих з ЦД 2-го типу та АГ.
— Мінерально-кісткові порушення у хворих із хронічними хворобами нирок значно погіршують прогноз життя хворих й прогресування ХХН.
— Починаючи з 3-ї стадії ХХН необхідно моніторувати рівні фосфору, кальцію, ПТГ, 25(ОН)D (кальцидіолу), лужної фосфатази.
— Лікування мінерально-кісткових порушень, що включає дієту з обмеженням фосфору й фосфатзв’язуючих препаратів, повинно ґрунтуватися на динаміці комплексу лабораторних показників фосфорно-кальцієвого обміну.
Конфлікт інтересів. Не заявлений.
/37.jpg)

/36.jpg)
/37_2.jpg)
/38.jpg)