Международный эндокринологический журнал Том 16, №4, 2020
Вернуться к номеру
Нарушения репродуктивной функции и гормонального профиля у пациенток с АКТГ-секретирующими аденомами гипофиза
Авторы: Халимова З.Ю., Иргашева О.Б.
Республиканский специализированный научно-практический медицинский центр эндокринологии Министерства здравоохранения Республики Узбекистан имени акад. Ё.Х. Туракулова,
г. Ташкент, Республика Узбекистан
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
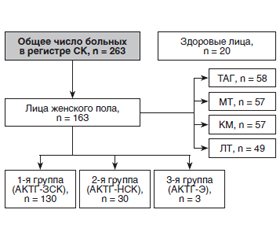
Актуальність. Синдром Кушинга (СК) — тяжка нейроендокринна патологія, що вже багато років знаходиться під пильною увагою різних фахівців внаслідок різноплановості її ускладнень. Гіперандрогенія та порушення менструального циклу, зокрема аменорея й олігоменорея, доповнюють клінічну картину СК. Мета дослідження: оцінити стан фертильної функції та гормонального профілю у пацієнток з синдромом Кушинга. Матеріали та методи. Під спостереженням щодо СК перебували в період з 2000 по 2019 р. 163 пацієнтки фертильного віку. Середній вік обстежених становив 27,58 ± 3,4 року (від 17 до 49 років), тривалість захворювання — 4,2 ± 0,2 року. 20 здорових жінок відповідного віку становили групу контролю. Результати. Пацієнтки з СК були розподілені наступним чином: перша група — з АКТГ-залежним СК — 130 (79,7 %), друга група — з АКТГ-незалежним СК — 30 (18,4 %) і третя група — з АКТГ-ектопованим СК — 3 (1,8 %). Серед різних репродуктивних порушень у пацієнток з СК переважали порушення менструального циклу і вторинна аменорея. Для пацієнток першої групи характерним на 14-й день менструального циклу було вірогідне зниження базальних рівнів лютеїнізуючого та фолікулостимулюючого гормонів, зниження рівня оваріальних гормонів (естрадіол, прогестерон) на тлі гіперандрогенемії та вірогідного підвищення рівня кортизолу крові при збільшенні вмісту АКТГ. Гіперплазія обох надниркових залоз діагностована у 110 (84,6 %) хворих з АКТГ-залежним СК, вузликова гіперплазія обох надниркових залоз — у 13 (10 %), інциденталома — у 3 (2,3 %), вузликова гіперплазія однієї надниркової залози — у 2 (1,5 %). Висновки. У пацієнток з синдромом Кушинга спостерігалися репродуктивні розлади: порушення менструального циклу — у 32,9 %, вторинна аменорея — у 20,4 %. Більшу частку порушень менструального циклу встановлено у групі хворих з АКТГ-залежним синдромом Кушинга. Порушення менструального циклу проявлялися у вигляді олігоменореї (30 % випадків), аменореї (35 %), поліменореї (7,5 %) і варіабельності циклу (7,5 %).
Актуальность. Синдром Кушинга (СК) — тяжелая нейроэндокринная патология, которая уже многие годы находится под пристальным вниманием различных специалистов вследствие разноплановости ее осложнений. Гиперандрогения и нарушения менструального цикла, такие как аменорея и олигоменорея, дополняют клиническую картину СК. Цель исследования: оценить состояние фертильной функции и гормонального профиля у пациенток с синдромом Кушинга. Материалы и методы. Под наблюдением по поводу СК находились в период с 2000 по 2019 г. 163 пациентки фертильного возраста. Средний возраст обследуемых составил 27,58 ± 3,40 года (от 17 до 49 лет), длительность заболевания — 4,2 ± 0,2 года. 20 здоровых женщин соответствующего возраста составили группу контроля. Результаты. Пациентки с СК были распределены следующим образом: первая группа — с АКТГ-зависимым СК — 130 (79,7 %), вторая группа — с АКТГ-независимым СК — 30 (18,4 %) и третья группа — с АКТГ-эктопированным СК — 3 (1,8 %). Среди различных репродуктивных нарушений у пациенток с СК преобладали нарушения менструального цикла и вторичная аменорея. Для пациенток первой группы на 14-й день менструального цикла характерным было достоверное снижение базальных уровней лютеинизирующего и фолликулостимулирующего гормонов, снижение уровня овариальных гормонов (эстрадиол, прогестерон) на фоне гиперандрогенемии и достоверное повышение уровня кортизола крови при увеличении показателя АКТГ. Гиперплазия обоих надпочечников диагностирована у 110 (84,6 %) больных с АКТГ-зависимым СК, узелковая гиперплазия обоих надпочечников — у 13 (10 %), инциденталома — у 3 (2,3 %), узелковая гиперплазия одного надпочечника — у 2 (1,5 %). Выводы. У пациенток с синдромом Кушинга наблюдались репродуктивные расстройства: нарушение менструального цикла — у 32,9 %, вторичная аменорея — у 20,4 %. Большая часть нарушений менструального цикла установлена в группе больных с АКТГ-зависимым синдромом Кушинга. Нарушения менструального цикла проявлялись в виде олигоменореи (30 % случаев), аменореи (35 %), полименореи (7,5 %) и вариабельности цикла (7,5 %).
Background. Cushing’s syndrome is a severe neuro-endocrine pathology, which for many years has been under the scrutiny of many different specialists due to the diversity of its complications. Hyperandrogenism and menstrual irregularities, such as amenorrhea and oligomenorrhea, complement the clinical picture of Cushing’s syndrome. The purpose of the study was to assess the state of fertile function and hormonal profile in female patients with Cushing’s syndrome. Materials and methods. Under supervision, there were 163 patients of reproductive age with Cushing’s syndrome during the period from 2000 to 2019. Their average age was 27.58 ± 3.40 years (from 17 to 49 years), the duration of the disease was 4.2 ± 0.2 years. Twenty healthy women of the corresponding age made up the control group. Results. Patients with Cushing’s syndrome were distributed as follows: the first group with ACTH-dependent Cushing’s syndrome — 130 (79.7 %), the second group with ACTH-independent Cushing’s syndrome — 30 (18.4 %), and the third group with ACTH-ectopic Cushing’s syndrome — 3 (1.8 %) people. Among various reproductive disorders in patients with Cushing’s syndrome, menstrual disorders and secondary amenorrhea dominated. A significant decrease in basal levels of luteinizing and follicle-stimulating hormones, a reduction in ovarian hormones (estradiol, progesterone) against the background of hyperandrogenemia and a significant increase in blood cortisol levels, as well as increase in ACTH were characteristic of patients from the first group on the 14th day of the menstrual cycle. Hyperplasia of both adrenal glands was diagnosed in 110 (84.6 %) people with ACTH-dependent Cushing’s syndrome, nodular hyperplasia of both adrenal glands — in 13 (10 %), incidentaloma — in 3 (2.3 %), and nodular hyperplasia of one adrenal gland — in 2 (1.5 %). Conclusions. Reproductive disorders were observed in patients with Cushing’s syndrome: menstrual irregularities — in 32.9 %, secondary amenorrhea — in 20.4 % individuals. Most of the menstrual irregularities were found in the group of patients with ACTH-dependent Cushing’s syndrome. Menstrual irregularities manifested in the form of oligomenorrhea (30 % of cases), amenorrhea (35 %), polymenorrhea (7.5 %) and cycle variability (7.5 %).
синдром Кушинга; жінки; діагностика; гормональний профіль; порушення репродуктивної сфери
синдром Кушинга; женщины; диагностика; гормональный профиль; нарушения репродуктивной сферы
Cushing’s syndrome; women; diagnosis; hormonal profile; reproductive disorder
Введение
Материалы и методы
/24.jpg)
Результаты
/25.jpg)
Обсуждение
Выводы
- Sharma S.T., Nieman L.K., Feelders R.A. Cushing’s syndrome: epidemiology and developments in disease management. Clin. Epidemiol. 2015. 7. 281-293. doi: 10.2147/CLEP.S44336.
- Feelders R.A., Pulgar S.J., Kempel A., Pereira A.M. The burden of Cushing’s disease: clinical and health-related quality of life aspects. Eur. J. Endocrinol. 2012. 167. 311-326. doi: 10.1530/EJE-11-1095.
- Ntali G., Asimakopoulou A., Siamatras T. et al. Mortality in Cushing’s syndrome: systematic analysis of a large series with prolonged follow-up. Eur. J. Endocrinol. 2013. 169. 715-723. doi: 10.1530/EJE-13-0569.
- Arnaldi G., Scandali V.M., Trementino L., Cardinaletti M., Appolloni G., Boscaro M. Pathophysiology of dyslipidemia in Cushing’s syndrome. Neuroendocrinology. 2010. 92(1). 86-90. doi: 10.1159/000314213.
- Geer E.B., Shen W., Strohmayer E., Post K.D., Freda P.U. Body composition and cardiovascular risk markers after remission of Cushing’s disease: a prospective study using whole-body MRI. J. Clin. Endocrinol. Metab. 2012. 97. 1702-1711. doi: 10.1210/jc.2011-3123.
- Macut D., Milutinović D.V., Rašić-Marković A., Nestorov J., Bjekić-Macut J., Stanojlović O. A decade in female reproduction: an endocrine view of the past and into the future. Hormones (Athens). 2018. 17(4). 497-505. doi: 10.1007/s42000-018-0073-x.
- Brue T., Amodru V., Castinetti F. Management of endocrine disease: Management of Cushing’s syndrome during pregnancy: solved and unsolved questions. Eur. J. Endocrinol. 2018. 178(6). R259-R266. doi: 10.1530/EJE-17-1058.
- Cyranska-Chyrek E., Filipowicz D., Szczepanek-Parulska E. et al. Primary pigmented nodular adrenocortical disease (PPNAD) as an underlying cause of symptoms in a patient presenting with hirsutism and secondary amenorrhea: case report and literature review. Gynecol. Endocrinol. 2018. 34(12). 1022-1026. doi: 10.1080/09513590.2018.1493101.
- Liao C.C., Lin S.Y., Lin H.W. et al. Menstrual Abnormalities in a Woman with ACTH-Dependent Pituitary Macroadenoma Mimicking Polycystic Ovary Syndrome. Taiwanese Journal of Obstetrics and Gynecology. 2006. 45(2). 176-179. https://doi.org/10.1016/S1028-4559(09)60221-7
- Szczepanek-Parulska E., Cyranska-Chyrek E., Nowaczyk M. et al. Diagnostic Difficulties in a Young Women with Symptoms of Cushing Syndrome. Endocr. Pract. 2018. 24(8). 766. doi: 10.4158/EP-2017-0257.
- Sathyakumar S., Paul T.V., Asha H.S. et al. Ectopic Cushing syndrome: a 10-year experience from a tertiary care center in Southern India. Endocr. Pract. 2017. 23(8). 907-914. doi: 10.4158/EP161677.
- Ackerman K.E., Misra M. Amenorrhoea in adolescent female athletes. Lancet Child Adolesc. Health. 2018. 2(9). 677-688. doi: 10.1016/S2352-4642(18)30145-7.
- Holgado-Galicia M.V., Magno J.D., Acelajado-Valdenor C. et al. Cushing’s syndrome in pregnancy. BMJ Case Rep. 2011. 2011. bcr0120113720. doi: 10.1136/bcr.01.2011.3720.
- Xu J.J., Wang Y.J., Shan L.Z. et al. Recurrent ACTH-independent Cushing’s syndrome in multiple pregnancies. Gynecol. Endocrinol. 2013. 29(4). 309-310. doi: 10.3109/09513590.2012.743014.
- Nassi R., Ladu C., Vezzosi Ch., Manelli M. Cushing’s syndrome in pregnancy. Gynecol. Endocrinol. 2015. 31. 102-4. doi: 10.3109/09513590.2014.984680.
- Tauchmanova L., Pivonello R., Di Somma C. et al. Bone demineralization and vertebral fractures in endogenous cortisol excess. J. Clin. Endocrinol. Metab. 2006. 91(15). 1779-84. doi: 10.1210/jc.2005-0582.
- Lindsay J.R., Jonklaas J., Oldfield E.H., Nieman L.K. Cushing’s syndrome during pregnancy: personal experience and review of the literature. J. Clin. Endocrinol. Metab. 2005. 90(5). 3077-83. doi: 10.1210/jc.2004-2361.

/25_2.jpg)
/26.jpg)