Резюме
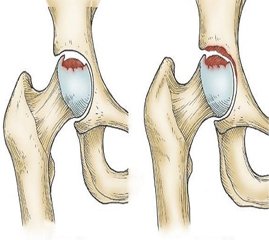
Асептичний некроз головки стегнової кістки (АНГСК) — це патологічний стан, що виникає в результаті клітинного порушення, викликаного зниженням активності остеобластів і місцевої популяції мезенхімальних стовбурових клітин (МСК). Клітинна терапія могла б допомогти в лікуванні такого стану за допомогою стовбурових та інших клітин-попередників, що потенційно можуть покращувати місцеве клітинне середовище в ураженому кульшовому суглобі. У рамках лікування АНГСК було науково обґрунтовано застосування клітинної терапії, а також описано методики імплантації автогенного кістково-мозкового концентрату. Хоча етіологія асептичного некрозу головки стегнової кістки до кінця не вивчена, була висунута гіпотеза про те, що захворювання має клітинне походження. Проблеми, які зменшують кількість або змінюють функцію кісткових клітин-попередників, можуть призвести до дисбалансу між утворенням остеобластів і некрозом, що може викликати розвиток АНГСК, якщо баланс не буде відновлено. З огляду на гіпотезу про те, що АНГСК має клітинне походження, вважають, що методи лікування на основі клітинної терапії (цитотерапії) мають значний потенціал. Також цитотерапія може допомогти уникнути тотального ендопротезування серед молодих пацієнтів. Для лікування АНГСК була запропонована трансплантація автогенної губчатої кісткової тканини (ГКТ), що давало позитивні результати. Ефективність мононуклеарних клітин ГКТ може бути пов’язана з локальною популяцією дорослих стовбурових клітин у ГКТ, наділених остеогенними властивостями. Імплантація ГКТ у вогнище асептичного некрозу головки призводить до локалізованого збільшення кількості цих клітин у некротичній головці стегнової кістки. Іншим можливим поясненням терапевтичного ефекту імплантації ГКТ є те, що при такій процедурі вводяться стромальні клітини, які секретують ангіогенні цитокіни, що призводить до посилення ангіогенезу й подальшого покращання остеогенезу. З урахуванням того, що середній кістковий матрикс складається на 33 % із ГКТ, кількість остеоцитів в 1 см3 губчастої кістки можна оцінити в межах 20 млн. З огляду на кількість попередників у межах 2500 на 1 мл підготовленої суміші МСК кожен попередник повинен був розділитися мінімум 12 або 14 разів для отримання 1 мл нової кістки, якщо припускати, що всі клітини-попередники зберігають при цьому здатність виробляти трабекулярну кістку (2500 × 214 = 20 млн остеобластів). Ці розрахунки припускають, що всі введені клітини залишаються на місці й жодних остеогенних клітин не вводили в зону патології. Тканинна інженерія може поєднувати мезенхімальні стовбурові клітини ГКТ, синтетичні скафолди й молекулярні сигнали (фактори росту) для формування гібридних конструкцій. У класичному підході інженерія кісткової тканини передбачає збір ГКТ у пацієнта, виділення МСК шляхом їх приєднання до пластинки тканинної культури, розширення й диференціювання цих клітин у культурі, а потім посів їх на відповідний синтетичний скафолд перед імплантацією тому самому пацієнту. Автогенний підхід до виділення й остеогенного диференціювання МСК є досить вимогливим щодо логістики, виробництва й безпеки умов культивування, що визначає високу вартість терапевтичної процедури. Поєднання біоматеріалів із клітинами остеопопередників пов’язане з технічними (джерело клітин, тип, дози, строки) і регуляторними проблемами (поєднання пристроїв і ліків).
Асептический некроз головки бедренной кости (АНГБК) — это патологическое состояние, возникающее в результате клеточного нарушения, вызванного снижением активности остеобластов и местной популяции мезенхимальных стволовых клеток (МСК). Клеточная терапия могла бы помочь в лечении такого состояния с помощью стволовых и других клеток-предшественников, которые могут улучшать местную клеточную среду в пораженном тазобедренном суставе. В рамках лечения АНГБК было научно обосновано применение клеточной терапии, а также описаны методики имплантации аутогенного костно-мозгового концентрата. Хотя этиология асептического некроза головки бедренной кости до конца не изучена, была выдвинута гипотеза о том, что заболевание имеет клеточное происхождение. Проблемы, которые уменьшают количество или изменяют функцию костных клеток-предшественников, могут привести к дисбалансу между образованием остеобластов и некрозом, что может вызвать развитие АНГБК, если баланс не будет восстановлен. Исходя из гипотезы о том, что АНГБК имеет клеточное происхождение, считается, что методы лечения на основе клеточной терапии (цитотерапии) имеют значительный потенциал. Также цитотерапия может помочь избежать тотального эндопротезирования среди молодых пациентов. Для лечения АНГБК была предложена трансплантация аутогенной губчатой костной ткани (ГКТ), что давало положительные результаты. Эффективность мононуклеарных клеток ГКТ может быть связана с локальной популяцией взрослых стволовых клеток в ГКТ, наделенных остеогенными свойствами. Имплантация ГКТ в очаг асептического некроза головки приводит к локализованному увеличению количества этих клеток в некротической головке бедренной кости. Другим возможным объяснением терапевтического эффекта имплантации ГКТ является то, что при такой процедуре вводятся стромальные клетки, которые секретируют ангиогенные цитокины, что приводит к усилению ангиогенеза и дальнейшему улучшению остеогенеза. С учетом того, что средний костный матрикс состоит на 33 % из ГКТ, количество остеоцитов в 1 см3 губчатой кости можно оценить в пределах 20 млн. Исходя из количества предшественников в пределах 2500 на 1 мл подготовленной смеси МСК, каждый предшественник должен был разделиться минимум 12 или 14 раз, чтобы получить 1 мл новой кости, предполагается, что все клетки-предшественники сохраняют при этом способность производить трабекулярную кость (2500 × 214 = 20 млн остеобластов). Эти расчеты предполагают, что все введенные клетки остаются на месте и никакие остеогенные клетки не вводились в зону патологии. Тканевая инженерия может сочетать мезенхимальные стволовые клетки ГКТ, синтетические скаффолды и молекулярные сигналы (факторы роста) для формирования гибридных конструкций. При классическом подходе инженерия костной ткани предполагает сбор ГКТ у пациента, выделение МСК путем их присоединения к пластинке тканевой культуры, расширение и дифференцировку этих клеток в культуре, а затем посев их на соответствующий синтетический скаффолд перед имплантацией тому же пациенту. Аутогенный подход к выделению и остеогенной дифференцировке МСК достаточно требователен с точки зрения логистики, производства и безопасности условий культивирования, что определяет высокую стоимость терапевтической процедуры. Сочетание биоматериалов с клетками остеопредшественников связано с техническими (источник клеток, тип, дозы, сроки) и регуляторными проблемами (сочетание устройств и лекарств).
The femoral head avascular necrosis (FHAN) is a pathological condition that occurs as a result of a cellular disorder caused by decreased activity of osteoblasts and the local population of mesenchymal stem cells (MSCs). Cell therapy could help treat this condition with stem and other progenitor cells that can potentially improve the local cell environment in the affected hip joint. As a part of the treatment for FHAN, the use of cell therapy was scientifically substantiated, as well as the methods for implantation of autogenous bone marrow concentrate were described. Although the etiology of FHAN has not been fully studied, it has been hypothesized that this disease is of cellular origin. Problems that can reduce the number or change the function of osteoprogenitor cells can lead to an imbalance between osteoblast formation and necrosis, which can cause the development of FHAN if the balance is not restored. Based on the hypothesis that FHAN has a cellular origin, it is believed that therapies based on cell therapy (cytotherapy) have significant potential. Cytotherapy can also help avoid total arthroplasty among young patients. For the treatment of FHAN, transplantation of autogenous cancellous bone tissue (ACBT) was proposed, which gave positive results. The efficacy of ACBT mononuclear cells may be related to the local population of adult stem cells in the ACBT, which have osteogenic properties. Implantation of the ACBT in the focus of avascular necrosis of the head leads to a localized increase in the number of these cells in the necrotic head of the femur. Another possible explanation for the therapeutic effect of ACBT implantation is that in this procedure, stromal cells are introduced that produce angiogenic cytokines, which leads to increased angiogenesis and further improvement of osteogenesis. Based on the average bone matrix, which consists of 33 % of the ACBT, the number of osteocytes in 1 cm3 of cancellous bone can be estimated in the range of 20 million. Given the number of precursors in the range of 2,500 per 1 ml of the prepared mixture of MSCs, each precursor had to divide at least 12 or 14 times to obtain 1 ml of new bone, assuming that all progenitor cells retain the ability to produce trabecular bone (2,500 • 214 = 20 million osteoblasts). These calculations assume that all introduced cells remain in place and that no osteogenic cells have been introduced into the pathology area. Tissue engineering can combine ACBT mesenchymal stem cells, synthetic scaffolds, and molecular signals (growth factors) to form hybrid constructs. In the classical approach, bone engineering consists of collecting the ACBT from a patient, isola-ting MSCs by attaching them to a tissue culture plate, expanding and differentiating these cells in culture, and then seeding them to a suitable synthetic scaffold before implantation in the same patient. The autogenic approach to the isolation and osteogenic differentiation of MSCs is quite demanding in terms of logistics, production and safety of cultivation conditions, which leads to the high cost of the therapeutic procedure. The combination of biomaterials with osteoprogenitor cells causes technical (i.e. cell sources, types, doses, timing) and regulatory problems (combination of devices and drugs).
Вступ
Ця стаття є продовженням наших попередніх публікацій у вигляді оглядів літератури в даному виданні, присвячених темі асептичного некрозу головки стегнової кістки (АНГСК), у яких ми розглянули сучасні погляди на етіологію і патогенез, а також сучасні класифікації і методи діагностики [1, 2]. У даній публікації ми хотіли б познайомити читача з біологічним підходом до лікування цієї ортопедичної патології, а саме із застосуванням клітинних технологій.
Хоча етіологія асептичного некрозу головки стегнової кістки до кінця не вивчена, була висунута гіпотеза про те, що захворювання має клітинне походження [3–5]. Проблеми, які зменшують кількість або змінюють функцію кісткових клітин-попередників, можуть призвести до дисбалансу між утворенням остеобластів і некрозом, що може викликати розвиток АНГСК, якщо баланс не буде відновлено [6–8]. З огляду на гіпотезу про те, що АНГСК має клітинне походження, вважають, що методи лікування на основі клітинної терапії (цитотерапії) мають значний потенціал [4, 5, 7, 9, 11]. Також цитотерапія може допомогти уникнути артропластики в молодих пацієнтів [12].
У цій роботі ми наведемо дані літератури щодо обґрунтування застосування трансплантації автогенного концентрату губчатої кісткової тканини (ГКТ) при АНГСК; опишемо існуючі методики лікування АНГСК мезенхімальними стовбуровими клітинами (МСК), отриманими з автогенної ГКТ; наведемо дані літератури щодо результатів і механізмів лікування АНГСК із використанням клітин-попередників; зупинимось на питанні достатності певної кількості клітин, необхідних для репарації головки стегнової кістки; покажемо, які проблеми й перспективи цитотерапії при лікуванні АНГСК розглядаються сьогодні в літературі.
1. Обґрунтування застосування трансплантації автогенного кісткового мозку при асептичному некрозі головки стегнової кістки
Взаємозв’язок між губчатою кістковою тканиною і АНГСК доволі складний [3, 5, 13–15]. Зміни сигналу кісткового мозку були помічені на магнітно-резонансній томографії (МРТ) пацієнтів з АНГСК. Спостерігається збільшення кількості жирової тканини в міжвертлюжній частині стегна при АНГСК [5]. Крім того, у деяких пацієнтів з АНГСК у ГКТ спостерігалися аномалії остеогенних стовбурових клітин [14].
Лікування кортикостероїдами в деяких пацієнтів призводить до остеонекрозу. У пацієнтів з АНГСК після кортикостероїдної терапії були відмічені аномалії в ГКТ гребеня клубової кістки, у тому числі зниження загальної кількості наявних стовбурових клітин [5]. Також було виявлено, що стероїди виробляють адипогенез і стимулюють жир-специфічні гени клонованих клітин кісткового мозку в культурі in vitro [12].
Розподіл кровотворних клітин у ГКТ проксимального відділу стегнової кістки залежить від багатьох факторів. МРТ-дослідження показали, що в деяких пацієнтів з аваскулярним некрозом у верхній частині стегнової кістки передчасно відбувається перетворення ГКТ на жирову тканину [5]. Як наслідок, змінюється інтрамедулярна васкулярність, що може спричиняти в пацієнта розвиток остеонекрозу, оскільки такі зміни в ГКТ можуть бути пов’язані з ремоделюванням кісткової тканини. Ще одним потенційним наслідком перетворення ГКТ на жирову тканину є зниження рівня остеогенних клітин. Втрата остеогенних клітин може викликати два різні явища в патогенезі остеонекрозу: виникнення самого остеонекрозу й відновлення кістки, яке відбувається після остеонекрозу.
Зниження рівня остеогенних стовбурових клітин у головці стегнової кістки спостерігалося під секвестром і в міжвертлюжній ділянці [5]. Це було підтверджено наявністю значної кількості омертвілих остеоцитів у проксимальному відділі стегнової кістки, що спостерігається в пацієнтів, яким проводилось тотальне ендопротезування кульшового суглоба при АНГСК. Реконструкція й відновлення спостерігалися після декомпресії головки стегнової кістки, але вони зазвичай були неповними.
Одним із пояснень неефективного заміщення й ремоделювання нової кістки при АНГСК може бути недостатня кількість клітин-попередників, наявних у некротизованій головці стегнової кістки. A.J. Fridenstein et al. [17] довели, що нова кістка формується проліферативними фібробластоподібними клітинами губчатої кісткової тканини, які зберігаються in vitro після загибелі кровотворних клітин. Кількість клітин, здатних швидко проліферувати, можна було б контролювати шляхом підрахунку кількості колонієутворюючих одиниць фібробластів (КУО-Ф) у зразках кісткового мозку.
Проведено оцінку активності клітин-попередників (КУО-Ф) губчатої кісткової тканини в проксимальному відділі стегнової кістки в пацієнтів із АНГСК, індукованим кортикостероїдами, і порівняння її з показниками контрольної групи пацієнтів без АНГСК [5]. Зниження кількості КУО-Ф було виявлено поза зоною АНГСК у пацієнтів з АНГСК, індукованим кортикостероїдами. В іншому дослідженні K.T. Suh et al. [15] проаналізували диференціювання мезенхімальних стовбурових клітин із проксимального відділу стегнової кістки в 33 пацієнтів з АНГСК, викликаним алкоголізмом. Вони відзначили, що МСК демонструють знижений потенціал диференціювання, і припустили, що зниження регуляції остеогенного потенціалу може призвести до виникнення АНГСК.
Чи є зниження остеогенного потенціалу або рівня остеогенних клітин причиною або наслідком некрозу, невідомо. Однак було б логічно припустити, що лікування, при якому автогенні клітини вводяться в некротичну ділянку, що безпосередньо збільшує рівень клітин-попередників, покращило б ремоделювання кістки шляхом поступового заміщення, тим самим зберігаючи цілісність головки стегнової кістки. Лікування з використанням клітин-поперед-ників може забезпечити відновлення остеогенного потенціалу в головці стегнової кістки. Отже, застосування клітинної аугментації при стандартному хірургічному лікуванні (декомпресія ядра) при АНГСК є доцільним.
Для лікування АНГСК була запропонована транс-плантація автогенної губчатої кісткової тканини, що давало добрі результати [7, 9]. Ефективність мононуклеарних клітин ГКТ може бути пов’язана з локальною популяцією дорослих стовбурових клітин у ГКТ, наділених остеогенними властивостями. Імплантація ГКТ у вогнище асептичного некрозу головки призводить до локалізованого збільшення кількості цих клітин у некротичній головці стегнової кістки. Іншим можливим поясненням терапевтичного ефекту імплантації ГКТ є те, що при такій процедурі вводяться стромальні клітини, які секретують ангіогенні цитокіни, що призводить до посилення ангіогенезу й подальшого покращання остеогенезу. Цікаво, що Y. Feng et al. [16] порівнювали кількість ендотеліальних прогеніторних клітин (ЕПК) у периферичному кровообігу в 54 пацієнтів із нетравматичним АНГСК та іншими подібними хворобами. Виявилось, що кількість ЕПК у пацієнтів з АНГСК була явно знижена. Це зниження може призвести до зниження ангіогенезу й у кінцевому підсумку спричинити розвиток АНГСК. Хоча роль клітин-попередників у механізмах АНГСК до кінця не з’ясована, було виявлено, що деякі фактори впливають на взаємозв’язок ангіогенезу й остеогенезу при остеонекрозі [18].
Нарешті, мононуклеарні клітини, отримані з кісткового мозку, здатні викликати утворення нових кровоносних судин завдяки наявності в концентраті ГКТ попередників ендотеліальних клітин або гемангіобластів [19]. Ангіогенезу може сприяти як підвищене надходження клітин-попередників, так і ангіогенні цитокіни, що продукуються клітинами ГКТ. Попередники ендотелію можуть брати активну участь в утворенні судин у тканинах, позбавлених судин, і в неоангіогенезі з уже існуючих капілярів [22–24]. На додаток до утворення нових капілярів зростаючий ендотелій посилює мобілізацію і зростання мезенхімальних попередників через шлях ангіопоетин-l/Tie2. Цей шлях генерує перицити й судинні муральні клітини, необхідні для росту й стабілізації нових судин [23]. Було продемонстровано, що периваскулярні мезенхімальні стовбурові клітини мають здатність до мультипотентного диференціювання, і було відзначено, що ці клітини беруть участь у репарації сусідніх тканин як у експериментальних моделях, так і в людини [21, 22]. Також можливо, що індукований гіпоксією 1-альфа (HIF-lα) фактор, що вивільняється клітинами-попередниками у відповідь на локалізовану ішемію, діє як сигнал і згодом мобілізує циркулюючі попередники через SDF1-залежний шлях, тим самим стимулюючи репарацію кровоносних судин і проліферацію нових клітин для регенерації кісткової тканини.
2. Спосіб лікування асептичного некрозу головки стегнової кістки з використанням мезенхімальних стовбурових клітин
2.1. Аспірація губчатої кісткової тканини і відбір клітин
Губчата кісткова тканина може бути відібрана як із передніх, так і із задніх відділів клубового гребеня. Для лежачого пацієнта місцем відбору є передній клубовий гребінь. Для пацієнта в бічному положенні таким місцем може бути передній або задній гребінь клубової кістки. Якщо пацієнт перебуває в положенні лежачи на животі, то відбір проводиться із заднього відділу гребеня клубової кістки. Для пацієнтів з нормальною вагою доречна пряма пункція. Якщо пацієнт страждає від ожиріння, то в місці збору необхідно зробити двоміліметровий розріз.
Відбір кісткового мозку з гребеня клубової кістки здійснюється за допомогою конусної аспіраційної голки. Для отримання пунктату ГКТ слід використовувати стандартний 10-кубовий шприц. Безпосередньо перед введенням голку й аспіраційний шприц промивають розчином гепарину. Голку вставляють між внутрішньою і зовнішньою стінками клубового гребеня на глибину до 5 см. Аспірація починається зі швидкого витягування плунжера. Шприци змінюють, коли вони заповнюються приблизно наполовину, не змінюючи при цьому глибини проникнення голки. Під час послідовних відсмоктувань голка повертається на 45°, щоб змінити кут, тим самим забезпечуючи збір із максимально можливої зони в клубовому гребні. Після одного повного повороту на 360° голку переміщують на 2 см до поверхні через одне і те ж місце введення й виконують послідовні відсмоктування. Голка завжди повертається на 45° після кожного відсмоктування. Пунктат кісткового мозку містить більше стовбурових клітин, коли він відсмоктується в невеликих обсягах. Цей метод зменшує розбавлення зібраних матеріалів периферичною кров’ю. Пунктати збирають у пластикові пакети, що містять середовище для культивування клітин і розчин антикоагулянту. Упаковані пунктати фільтрують для поділу клітинних накопичень і жиру, а мононуклеарну фракцію відокремлюють стандартними методами для концентрації клітинного препарату перед ін’єкцією. Концентрат ГКТ може бути отриманий кількома комерційними системами, спеціально розробленими для концентрування пунктату ГКТ.
2.2. Внутрішньокісткова ін’єкція мезенхімальних стовбурових клітин
Пацієнти можуть бути поміщені на стіл із двома підсилювачами зображення на С-подібному важелі. Декомпресія проводиться через шкіру з використанням трепана діаметром 3 мм. ГКТ вводиться в головку стегнової кістки за допомогою невеликого троакара. Інструмент вводиться через великий трохантер, як при звичайній декомпресії ядра. Положення інструменту в голівці стегнової кістки й некротичному сегменті контролюється за допомогою двопроєкційної флюороскопії. Якщо прості радіограми майже не показують ознак некрозу, то передопераційні МРТ-знімки можуть бути використані разом із підсилювачами зображення для визначення місця ураження. Перед ін’єкцією ГКТ можна ввести кілька мілілітрів контрастної речовини. Це дозволить визначити ділянку в головці стегнової кістки, де буде поширюватися введений кістковий мозок. Встановлено, що контрастна речовина не пошкоджує клітини-попередники кісткової тканини.
Хоча отвір троакара невеликий порівняно з трепанами, які зазвичай використовуються для декомпресії ядра, вимірювання тиску в головці стегнової кістки й вертлюжної ділянки показали, що навіть невеликий отвір знижує внутрішньокістковий тиск. Під час ін’єкції кісткового мозку було виявлено, що тиск у головці стегнової кістки підвищується, але нормальний тиск відновлюється після завершення ін’єкції. Саме це й спостерігається при вимірюванні внутрішньокісткового тиску. У наших пацієнтів під час анестезії не спостерігалося жодних ускладнень, зокрема не спостерігалося зниження насичення киснем і зміни частоти пульсу або рівня артеріального тиску.
3. Результати та механізм репарації асептичного некрозу головки стегнової кістки клітинами-попередниками
Р. Hernigou et al. [9] займалися лікуванням 189 кульшових суглобів у 116 пацієнтів з аутогенним концентратом ГКТ із подальшим спостереженням протягом 5–10 років. Задовільні результати були досягнуті в більшості пацієнтів, що проявилося в покращанні оцінки кульшового суглоба за шкалою Харріса, рентгенологічної оцінки й відсутності необхідності тотального ендопротезування кульшового суглоба. Прогноз був значною мірою пов’язаний зі стадією захворювання й кількістю введених клітин-попередників. Кращі результати спостерігалися, коли пацієнти були прооперовані до колапсу й отримали більшу кількість ін’єкцій концентрату ГКТ [11]. У 2008 році Р. Hernigou et al. [10] провели ретроспективний аналіз 534 кульшових суглобів у 342 пацієнтів з АНГСК, які отримували лікування у вигляді трансплантації автогенного концентрату ГКТ. Результати були позитивними — зі зменшенням обсягу некрозу з 26 до 12 см3 у 371 пацієнта при середньому терміні спостереження 12 років. Були лише 94 пацієнти, яким було проведено повне ендопротезування кульшового суглоба. Найкращим показанням для цитотерапії АНГСК була передколапсна стадія, коли захворювання кульшового суглоба було симптоматичним. У деяких пацієнтів із хворобою Штейнберга III стадії успішний результат лікування АНГСК може бути отриманий через 5–10 років.
В іншому звіті від V. Gangji et al. [7] двом пацієнтам з АНГСК була проведена ін’єкція стромальних клітин ГКТ. Остеопопередники й остеобласти з ГКТ відокремлювали, культивували in vitro і вводили в зону некрозу після диференціювання. Повідомлялося про зниження болю, зменшення некротичного ураження й функціональне покращання, при цьому спостерігалися лише незначні побічні ефекти.
Інші дослідники повідомляли про ефективність комбінації цитотерапії і традиційної терапії, включно з декомпресією головки стегнової кістки й автогенною кістковою пластикою як методом лікування АНГСК. Наприклад, B.L. Wang et al. [23] лікували АНГСК методом декомпресії ядра й імплантації автогенного концентрату ГКТ. ГКТ, відібрана з гребеня клубової кістки, концентрувалася, і концентрат ГКТ було імплантовано в 59 головок стегнових кісток у 45 пацієнтів з АНГСК I–IIA стадії за класифікацією ARCO [2]. Середній бал за шкалою Харріса при оцінці кульшового суглоба покращився з 71 до 83, і тільки 11,9 % пролікованих пацієнтів знадобилося тотальне ендопротезування кульшового суглоба після спостереження в середньому протягом 27,6 міс.
J.S. Kang et al. [24] повідомили про результати автогенного лікування клубово-губчастої кістки в поєднанні з імплантацією аутогенних клітин ГКТ при АНГСК і продемонстрували добрі клінічні результати при короткостроковому спостереженні в середньому за 32 міс. Хоча ці попередні звіти є обнадійливими, їх складно перевірити, і вони потребують подальшого підтвердження. Залишається ще багато питань. Наприклад, незважаючи на значні успіхи, досягнуті у фундаментальних і клінічних дослідженнях нетравматичного АНГСК клітинного походження, передчасно робити висновок про те, що є первинним тригером: чи зміна числа й природи попередників призводить до АНГСК, чи ідіопатичний АНГСК індукує біологічні зміни попередників. За результатами досліджень на моделях тварин видається, що лікування за допомогою транс-плантації ГКТ і введення стовбурових клітин може покращити можливості лікування АНГСК.
4. Яка кількість клітин необхідна для відновлення тканин
Вивчено вплив кількості клітин-попередників при лікуванні АНГСК у пацієнтів, яким було проведено автогенну трансплантацію кісткового мозку. Попереднє дослідження показало, що загальна кількість клітин-попередників у автотрансплантаті головки стегнової кістки становить у середньому 1500 одиниць (1000–3000). Кількість клітин-попередників у ГКТ визначали шляхом оцінки кількості ядровмісних клітин і методом аналізу КУО-Ф. Кількість клітин-попередників, розміщених у трансплантаті, визначали за кількістю КУО-Ф у концентраті ГКТ після центрифугування.
Кількість клітин-попередників у ГКТ клубових гребенів хворих на АНГСК становила приблизно
1 КУО-Ф на 30 000 ядровмісних клітин. Було виявлено, що середня кількість ядровмісних клітин в 1 мл становить 18 × 106 клітин. Було виявлено, що аспірат ГКТ, взятий із гребеня клубової кістки, містить у середньому близько 600 клітин-попередників на 1 мл. Після обробки концентрація клітин-попередників була збільшена приблизно до 2500 попередників на 1 мл. МРТ при лікуванні АНГСК показала, що відновлена ділянка в середньому становила 15 см3, при цьому ін’єкція концентрату ГКТ становила 20 мл. З урахуванням середньої концентрації в кількості 2500 клітин-попередників на 1 мл це призводить до того, що в середньому на місце відновлення доставляється загалом 50 000 клітин-попередників.
При ремоделюванні кісток дорослої людини процеси кісткоутворення перебігають у контексті базисної багатоклітинної одиниці, описаної A.M. Parfit et al. [25] і H.M. Frost [26]. Остеобласт починає створювати матрикс протягом доби, і синтез матриці збільшується протягом декількох днів до максимальної швидкості приблизно 1,5 мкм на день на площі приблизно 150 мкм2 на один остеобласт, що призводить до синтезу приблизно 225 мкм3 на день на один остеобласт. Підраховано, що обсяг кісткового матриксу, утвореного одним остеобластом, становить приблизно 5000 мкм3. Повідомляється [27], що щільність остеоцитів становить 0,000047/мкм3 у губчастій кістковій тканині. Було відмічено, що значна кількість МСК у трансплантаті кісткового мозку збільшує швидкість відновлення [25]. З урахуванням того, що середній кістковий матрикс складається на 33 % із ГКТ, кількість остеоцитів в 1 см3 губчастої кістки можна оцінити в межах 20 млн. З огляду на кількість попередників у межах 2500 на 1 мл підготовленої суміші МСК кожен попередник повинен був розділитися мінімум 12 або 14 разів для отримання 1 мл нової кістки, якщо припускати, що всі клітини-попередники зберігають при цьому здатність виробляти трабекулярну кістку (2500 × 214 = 20 млн остеобластів). Ці розрахунки припускають, що всі введені клітини залишаються на місці і жодних остеогенних клітин не вводили в зону патології.
Гістологічні спостереження показали, що обсяг трабекулярної кісткової тканини в головці стегнової кістки становить 1 : 3, а решту становлять жирові й гематологічні клітини. Це означає, що під час відновлення 15 см3 головки стегнової кістки третину відновленої тканини становить кістка, у результаті чого під час лікування відновлюється 5 см3 кістки.
5. Клітинна терапія асептичного некрозу головки стегнової кістки: проблеми й перспективи
5.1. Варіації кількості МСК, що спостерігаються в пацієнтів, можуть накладати деякі обмеження на використання цієї методики
Зниження КУО-Ф було описано в пацієнтів з АНГСК, викликаним прийомом кортикостероїдів, та АНГСК, викликаним алкоголізмом [6, 28]. Було показано, що кількість КУО-Ф є ненормальною при деяких гематологічних розладах [10] і знижується за інших несприятливих умов, таких як вживання тютюну [31]. Кількість клітин-попередників також варіювала залежно від віку пацієнта. У результаті цих супутніх захворювань можуть виникнути обмеження в терапевтичному потенціалі автогенного концентрату МСК із ГКТ пацієнта. Проте в цих випадках стандартна практика полягає в тому, щоб відбирати великі обсяги кісткового мозку перед концентрацією.
5.2. Тканинна інженерія може ефективно вирішувати проблему забезпечення відбору ефективної кількості клітин для пацієнта
Тканинна інженерія [30–32] може поєднувати мезенхімальні стовбурові клітини ГКТ, синтетичні скафолди й молекулярні сигнали (фактори росту) для формування гібридних конструкцій. У класичному підході інженерія кісткової тканини передбачає збір ГКТ у пацієнта, виділення МСК шляхом їх приєднання до пластинки тканинної культури, розширення й диференціювання цих клітин у культурі, а потім посів їх на відповідний синтетичний скафолд перед імплантацією тому самому пацієнту [33–35]. Автогенний підхід до виділення й остеогенного диференціювання МСК є досить вимогливим щодо логістики, виробництва й безпеки умов культивування, що призводить до високої вартості терапевтичної процедури. Поєднання біоматеріалів із клітинами остеопопередників пов’язане з технічними (джерела клітин, типи, дози, терміни) і регуляторними проблемами (поєднання пристроїв і ліків).
Z.M. Xiao et al. повідомили про декілька методів збільшення кількості й ефективності культивованих МСК: 1) попереднє культивування аспірату ГКТ для збільшення кількості клітин МСК; 2) попереднє культивування аспірату ГКТ для збільшення кількості клітин МСК і індукції остеогенного диференціювання шляхом додавання факторів росту; 3) генетична модифікація введених МСК для збільшення секреції факторів росту, таких як кістковий морфогенетичний протеїн і фактор зростання судинного ендотелію [34].
5.3. Моделі на тваринах
Побудувати модель на основі двоногої тварини для імітації АНГСК доволі складно. Не можна нехтувати похибкою в процесі руйнування й відновлення, і метод, який використовується для індукування АНГСК у тваринних моделях, далекий від патогенезу в людини, тому значна частина даних залишається невідомою.
Т. Asada еt al. [3] провели оцінку ін’єкції МСК губчатої кісткової тканини для профілактики АНГСК, індукованого прийомом кортикостероїдів. Частота АНГСК у кролів, які отримували тільки метилпреднізолон у дозі 20 мг/кг (контрольна група), становила близько 70 %, а в групі, яка отримувала ін’єкції МСК із ГКТ у поєднанні з метилпреднізолоном, така частота становила 0 %. Автори дійшли висновку, що пряме введення автогенних мезенхімальних стовбурових клітин ГКТ у головки стегнових кісток може запобігти виникненню АНГСК, індукованого прийомом високих доз кортикостероїдів у коротких проміжках. Z. Yan et al. [35] використовували МСК для лікування АНГСК і досліджували стан виживання й диференціювання. Їх дослідження показали, що пересаджені МСК можуть виживати, проліферувати й диференціюватися безпосередньо в остеобласти, що може прискорити процес відновлення. Тваринна модель була індукована в експерименті травматично, тому частка МСК, пересаджених на головку стегнової кістки, повинна бути аналогічною їх частці при нетравматичному АНГСК. Z.M. Xiao et al. [34] оцінювали вплив автогенних МСК, посіяних на біологічно похідні субстрати в поєднанні з рекомбінантним морфологічним білком 2 кісткової тканини людини для репарації дефектів АНГСК на моделі кролика. Вони спостерігали утворення нової кісткової тканини. Ці нові протоколи лікування відповідають концепції in vivo тканинної інженерії, що ґрунтується на посівах клітин, скафолдах і цитокінах.
Висновки
Стандартне лікування АНГСК (декомпресія головки) часто виявляється недостатнім для стабілізації патології, що призводить до руйнування головки й вимагає тотального ендопротезування кульшового суглоба. У роботі оцінено застосування автогенної клітинної терапії у вигляді МСК. Істотна репарація і стабілізація некротичної головки стегнової кістки були досягнуті шляхом введення пацієнту власних МСК у поєднанні з декомпресією головки. Вважається, що кількість і активність введених клітин відіграють важливу роль у досягненні доброго терапевтичного результату. З огляду на притаманну кожному пацієнту варіабельність МСК у ГКТ використання методів тканинної інженерії може розширити застосування цитотерапії в лікуванні навіть найважчих випадків АНГСК. Оскільки хворі на АНГСК, відібрані для цитотерапії, в основному перебували в стадії передколапсу, а етичні обмеження обумовлюють дефіцит високоякісних контрольованих досліджень для порівняння, необхідні подальші дослідження, щоб диференціювати задовільний результат цитотерапії від природного перебігу нетравматичного АНГСК. Для підтвердження цих даних важливі дослідження на тваринних моделях.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів і власної фінансової зацікавленості при підготовці даної статті.
Список литературы
1. Зазірний І.М., Климовицький В.Г., Семенів I.П., Сім’ячко Є.А. Деякі питання асептичного некрозу головки стегнової кістки. Травма. 2018. Т. 19. № 6. С. 107-113.
2. Зазірний І.М., Климовицький В.Г., Семенів І.П., Михальченко О.М., Рижков Б.С. Діагностичні методи і класифікації асептичного некрозу головки стегнової кістки. Травма. 2019. Т. 20. № 5. С. 95-104.
3. Asada T., Kushida T., Umeda M. et al. Prevention of corticosteroid-induced osteonecrosis i n rabbits by intra-bone marrow injection of autologous bone marrow cells. Rheunatology. (Oxford). 2008. 47. 591-596.
4. Gangji V., Hauzeur J. P., Schoutens A. et al. Abnormalities in the replicative capacity of osteoblastic cells in the proximal femur of patients with osteonecrosis of the femoral head. J. Rheumatol. 2003. 30. 348-351.
5. Hernigou P., Beaujean F., Lambotte J.C. Decrease in the mesenchymal stem cell pool in proximal femur in corticosteroid induced osteonecrosis. J. Bone Joint Surg. 1999. 81(B). 349-355.
6. Chang J.K., Ho M.L., Yeh C.H. et al. Osteogenic gene expression decreases in stromal cells of patients with osteonecrosis. Clin. Orthop. Relat. Res. 2006. 453. 286-292.
7. Gangji V., Hauzeur J.P. Cellular-based therapy for osteonecrosis. Orthop. Clin. N. Am. 2009. 40. 213-221.
8. Jones L.C., Hungerford D.S. The pathogenesis of osteonecrosis. Instr. Course Leet. 2007. 56. 179-196.
9. Hernigou P., Beaujean F. Treatment of osteonecrosis with autologous bone marrow grafting. Clin. Orthop. Relat. Res. 2002. 405. 14-23.
10. Hernigou P., Poignard A., Zilber S. et al. Cell therapy of hip osteonecrosis with autologous bone marrow grafting. Indian J. Orthop. 2008. 43. 40-45.
11. Hernigou P., Zilber S., Filippini P. et al. Bone marrow injection in hip osteonecrosis. Tech. Orthop. 2008. 23. 18-25.
12. Johannson H.R., Zywiel M.G., Marker D.R. et al. Osteonecrosis is not a predictor of poor outcomes in primary total hip arthroplasty: a systemic literature review. Int. Orthop. 2011. 35. 465-473.
13. Lee H.S., Huang G.T., Chiang H. et al. Multipotential mesenchymal stem cells from femoral bone marrow near the site of osteonecrosis. Stem Cells. 2003. 21. 190-199.
14. Lee J.S., Lee J.S., Roh H.L. et al. Alterations in the differentiation ability of mesenchymal stem cells in patients with nontraumatic osteonecrosis of the femoral head: comparative analysis according to the risk factor. J. Orthop. Res. 2006. 24. 604-609.
15. Suh K.T., Kim S.W., Roh H.L. et al. Decreased osteogenic differentiation of mesenchymal stem cells in alcohol induced osteonecrosis. Clin. Orthop. Relat Res. 2005. 431. 220-225.
16. Feng Y., Yang S.H., Xiao B.J. et al. Decreased in the number and function of circulation endothelial progerutor cells in patients with avascular necrosis of the femoral head. Bone. 2010. 46. 32-40.
17. Friedenstein A.J., Shapiro-Piatetzky I.I., Petrakova K.V. Osteogenesis intransplants of bone marrow cells. J. Embryol. Exper. Morph. 1966. 16. 381-390.
18. Sun Y., Feng Y., Zhang C. The effect of bone marrow mononuclear cells on vascularization and bone regeneration in steroid-induced osteonecrosis of the femoral head. Joint Bone Spine. 2009. 76. 685-690.
19. Roberts N., Jahangiri M., Xu Q. Progenitor cells in vascular disease. J. Cell Mol. Med. 2005. 9. 583-591.
20. Conway E.M., Collen D., Carmeliet P. Molecular mechanisms of blood vessel growth. Cardiovasc. Res. 2001. 49. 507-521.
21. Jain R.K. Molecular regulation of vessel maturation. Nature Medicine. 2003. 9. 685-693.
22. Nehls V., Drenckhahn D. The versatility of microvascular pericytes: from mesenchyme to smooth muscle? Histochemistry. 1993. 99. 1-12.
23. Wang B.L., Sun W., Shi Z.C. et al. Treatment of nontraumatic osteonecrosis of the femoral head with the implantation of core decompression and concentrated autologous bone marrow containing mononuclear cells. Arch. Orthop. Trauma Surg. 2010. 130. 859-865.
24. Kang J.S., Moon K.H., Park S.R. et al. Clinical results of autoiliac cancellous bone graft combined with implantation of autologous bone marrow cells for osteonecrosis of the femoral head. J. Korean Orthop. Assoc. 2008. 43. 1-8.
25. Parfitt A.M., Drezner M.K., Glorieux F.H. et al. Bone histomorphometry: standardization of nomenclature, symbols, and units. Report of the ASBMR histomorphometry nomenclature committee. J. Bone Miner. Res. 1987. 2. 595-610.
26. Frost H.M., ed. Intermediary Organization of the Ske-leton. Boca Raton: CRC press, 1986.
27. Muschler G.F., Midura R.J., Nakamoto C. Practical modeling concepts for connective tissue stem cell and progenitor compartment kinetics. J. Biomed. Biotec. 2003. 3. 170-193.
28. Chakkalakal D.A. Alcohol-induced bone loss and deficient bone repair. Alcohol. Clin. Exp. Res. 2005. 29. 2077-2090.
29. Daftari T.K., Whitesides T.E., Goudrich A.C. et al. Nicotine on the revascularization of bone graft. An experimental study in rabbits. Spine. 1994. 19. 904-911.
30. Bianco P., Riminucci M., Gronthos S. et al. Bone marrow stem cells: nature, biology and potential applications. Stem Cells. 2001. 19. 180-192.
31. Derubeis A.R., Cancedda R. Bone marrow stromal cells (BMSCs) in bone engineering: limitations and recentadvances. Ann. Biomed. En. 2004. 32. 60-165.
32. Langer R., Vacanti J. P. Tissue engineering. Science. 1993. 260. 920-926.
33. Tiedeman J.J., Connolly J.F., Strates B.S. et al. Treatment of hip osteonecrosis by percutaneous injection of bone marrow and demineralized bone matrix. An experi-mental study in dogs. Clin. 0rthop. Rel. Res. 1991. 268. 294-302.
34. Xiao Z.M., Jiang H., Zhan X.L. et al. Treatment of osteonecrosis of femoral head with BMSCs-seeded bio derived bone materials combined with rhBMP-2 in rabbits. Chin. J. Traumatоl. 2008. 11. 165-170.
35. Yan Z., Hang D., Guo C. et al. Fate of mesenchymal stern cells transplanted to osteonecrosis of femoral head. J. Orthop. Res. 2009. 27. 442-446.