Международный эндокринологический журнал Том 16, №3, 2020
Вернуться к номеру
Фенотипи діабетичної хвороби нирок (огляд літератури та власні дані)
Авторы: Царик І.О., Пашковська Н.В.
Вищий державний навчальний заклад України «Буковинський державний медичний університет», м. Чернівці, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
У статті надані сучасні відомості про діабетичну хворобу нирок (ДХН) з огляду на її фенотипи. Наведені дані літератури щодо епідеміології, чинників і механізмів розвитку фенотипів цього ускладнення при цукровому діабеті (ЦД), а також можливостей його діагностики та лікування. Описано варіанти перебігу ДХН залежно від типу ЦД, що ґрунтуються на власних дослідженнях. Наведені дані аналізу 1576 пацієнтів з ЦД 1-го, 2-го типів і латентним автоімунним діабетом дорослих (LADA), описано розподіл хворих за стадіями хронічної хвороби нирок і фенотипами ДХН. За даними лабораторних та інструментальних досліджень встановлено, що неальбумінурійне порушення функції нирок є домінуючим фенотипом серед пацієнтів з ЦД (60 % — з ЦД 1-го типу, 43 % — з ЦД 2-го типу, 53 % — з LADA). Виявлені відмінності залежно від типу ЦД, ймовірно пов’язані з різницею у механізмах ураження нирок при різних типах ЦД. Оскільки ЦД 2-го типу зазвичай діагностується через тривалий час після маніфестації, всі патогенетичні ланки виникнення ДХН, включаючи феномен глюкозотоксичності, ендотеліальної дисфункції, оксидативного стресу тощо, призводять до більш масштабних змін, ніж у пацієнтів з ЦД 1-го типу, що діагностується одразу після початку захворювання. Також частота альбумінурійної форми ДХН при ЦД 2-го типу вочевидь пов’язана з обтяжувальним впливом артеріальної гіпертензії, дисліпідемії й інсулінорезистентності, що сприяють прогресуванню ДХН. Зниження поширеності альбумінурійного фенотипу пов’язане як із удосконаленням нефропротекторної дії цукрознижувальних препаратів, що не тільки дає змогу зупинити розвиток протеїнурії, але й сприяє регресії вже наявного ураження нирок, так і зі зростанням кількості пацієнтів зі зниженням швидкості клубочкової фільтрації без протеїнурії, що, на думку авторів, може бути наслідком більш ранньої діагностики основного захворювання та його ускладнень.
В статье приведены современные сведения о диабетической болезни почек (ДБП) с учетом ее фенотипов. Представлены данные литературы об эпидемиологии, факторах и механизмах развития фенотипов этого осложнения при сахарном диабете (СД), а также возможностях его диагностики и лечения. Описаны варианты течения ДБП в зависимости от типа СД, основанные на собственных исследованиях. Представлены данные анализа 1576 пациентов с СД 1-го, 2-го типов и латентным аутоиммунным диабетом взрослых (LADA), описано распределение больных по стадиям ХБП и фенотипам ДБП. По данным лабораторных и инструментальных исследований установлено, что неальбуминурическое нарушение функции почек является доминирующим фенотипом среди пациентов с СД (60 % — с СД 1-го типа, 43 % — с СД 2-го типа, 53 % — с LADA). Выявленные различия в зависимости от типа СД, вероятно связаны с особенностями механизмов поражения почек при разных типах СД. Поскольку СД 2-го типа обычно диагностируется спустя длительное время после манифестации, все патогенетические звенья возникновения ДБП, включая феномен глюкозотоксичности, эндотелиальной дисфункции, оксидативного стресса и т.д., приводят к более масштабным изменениям, чем у пациентов с СД 1-го типа, который диагностируется сразу же после начала заболевания. Также частота альбуминурической формы ДБН при СД 2-го типа может быть связана с отягчающим влиянием артериальной гипертензии, дислипидемии и инсулинорезистентности, которые способствуют прогрессированию ДБП. Снижение распространенности альбуминурического фенотипа связано как с совершенствованием нефропротекторного действия сахароснижающих препаратов, что не только позволяет остановить развитие протеинурии, но и способствует регрессированию уже имеющихся поражений почек, так и с ростом количества пациентов со снижением скорости клубочковой фильтрации без протеинурии, что, по мнению авторов, может быть следствием более ранней диагностики основного заболевания и его осложнений.
This article provides up-to-date information about diabetic kidney disease (DKD), given its phenotypes. The literature data on the epidemiology, factors and mechanisms for the development of phenotypes of this complication in diabetes mellitus (DM), as well as the possibility of its diagnosis and treatment are presented. Variants of DKD course depending on the type of diabetes are described, based on our own researches. The analysis data are presented for 1,576 patients with type 1 and type 2 diabetes mellitus and latent autoimmune diabetes in adults, the distribution of patients according to the stages of CKD and phenotypes of DKD is described. According to laboratory and instrumental studies, non-albuminuric renal dysfunction is the dominant phenotype among patients with diabetes (60 % — with type 1 diabetes mellitus, 43 % — with type 2 diabetes mellitus, 53 % — with latent autoimmune diabetes in adults). The differences found depending on the type of DM are probably related to the difference in the mechanisms of kidney damage in various types of DM. Since type 2 DM is usually diagnosed long after manifestation, all pathogenetic links in the occurrence of DKD, including the phenomenon of glucose toxicity, endothelial dysfunction, oxidative stress, etc., lead to greater changes than in patients with type 1 DM, which is diagnosed immediately after the onset of the disease. Also, the frequency of the albuminuric form of DKD in type 2 DM is apparently related to the aggravating effects of hypertension, dyslipidemia, and insulin resistance, which cause the progression of DKD. A decrease in the prevalence of albuminuria phenotype is associated with both the improvement of the nephroprotective effect of hypoglycemic drugs, which allows us to stop the development of proteinuria and contributes to the regression of existing kidney damage, and with an increase in the number of patients having a decline in glomerular filtration rate without proteinuria. These data may be the result of earlier diagnosis of the underlying disease and its complications.
цукровий діабет; діабетична хвороба нирок; хронічна хвороба нирок; фенотипи
сахарный диабет; диабетическая болезнь почек; хроническая болезнь почек; фенотипы
diabetes mellitus; diabetic kidney disease; chronic kidney disease; phenotypes
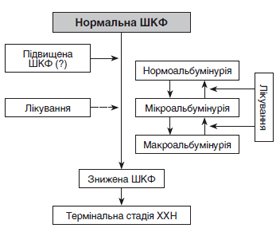
Неальбумінурійне порушення функції нирок
Прогресуюче зниження функції нирок
/101.jpg)
Результати власних досліджень та обговорення
Висновки
- Alicic R.Z., Rooney M.T., Tuttle K.R. Diabetic kidney disease: challenges, progress, and possibilities. Clin. J. Am. Soc. Nephrol. 2017. 12. 2032-2045. doi: 10.2215/CJN.11491116.
- Collins A.J., Foley R.N., Herzog C. et al. US renal data system 2010 annual data report. Am. J. Kidney Dis. 2011. 57(1 suppl. 1). A8. e1-526. doi: 10.1053/j.ajkd.2010.10.007.
- Doshi S.M., Friedman A.N. Diagnosis and management of type 2 diabetic kidney disease. Clin. J. Am. Soc. Nephrol. 2017. 12. 1366-1373. doi: 10.2215/CJN.11111016.
- Pugliese G. Updating the natural history of diabetic nephropathy. Acta Diabetol. 2014. 51. 905-915. doi: 10.1007/s00592-014-0650-7.
- American Diabetes Association Standards of medical care in diabetes — 2020. Diabetes Care. 2020. 43(suppl. 1). doi: 10.2337/dc20-S015.
- Mogensen C.E., Christensen C.K., Vittinghus E. The stages in diabetic renal disease: with emphasis on the stage of incipient diabetic nephropathy. Diabetes. 1983. 32(suppl. 2). 64-78. doi: 10.2337/diab.32.2.s64.
- Ruggenenti P., Cravedi P., Remuzzi G. The RAAS in the pathogenesis and treatment of diabetic nephropathy. Nat. Rev. Nephrol. 2010. 6. 319-330. doi: 10.1038/nrneph.2010.58.
- Afkarian M., Zelnick L.R., Hall Y.N., Heagerty P.J., Tuttle K., Weiss N.S. et al. Clinical manifestations of kidney disease among US Adults with diabetes, 1988–2014. JAMA. 2016. 316. 602-610. doi: 10.1001/jama.2016.10924.
- Lane P.H., Steffes M.W., Mauer S.M. Glomerular structure in IDDM women with low glomerular filtration rate and normal urinary albumin excretion. Diabetes. 1992. 41. 581-586. doi: 10.2337/diab.41.5.581.
- Tsalamandris C., Allen T.J., Gilbert R.E., Sinha A., Panagiotopoulos S., Cooper M.E. et al. Progressive decline in renal function in diabetic patients with and without albuminuria. Diabetes. 1994. 43. 649-655. doi: 10.2337/diab.43.5.649.
- Kramer H.J., Nguyen Q.D., Curhan G., Hsu C.Y. Renal insufficiency in the absence of albuminuria and retinopathy among adults with type 2 diabetes mellitus. JAMA. 2003. 289. 3273-3277. doi: 10.1001/jama.289.24.3273.
- Kume S., Araki S.I., Ugi S., Morino K., Koya D., Nishio Y. et al. Secular changes in clinical manifestations of kidney disease among Japanese adults with type 2 diabetes from 1996 to 2014. J. Diabetes Investig. 2019. 10(4). 1032-1040. doi: 10.1111/jdi.12977.
- MacIsaac R.J., Tsalamandris C., Panagiotopoulos S., Smith T.J., McNeil K.J., Jerums G. Nonalbuminuric renal insufficiency in type 2 diabetes. Diabetes Care. 2004. 27. 195-20. doi: 10.2337/diacare.27.1.195.
- Dwyer J.P., Parving H.H., Hunsicker L.G., Ravid M., Remuzzi G., Lewis J.B. Renal dysfunction in the presence of normoalbuminuria in type 2 diabetes: results from the DEMAND Study. Cardiorenal. Med. 2012. 2. 1-10. doi: 10.1159/000333249.
- Yokoyama H., Sone H., Oishi M., Kawai K., Fukumoto Y., Kobayashi M. et al. Prevalence of albuminuria and renal insufficiency and associated clinical factors in type 2 diabetes: the Japan Diabetes Clinical Data Management study (JDDM15). Nephrol. Dial. Transplant. 2009. 24. 1212-1219. doi: 10.1093/ndt/gfn603.
- Thomas M.C., Macisaac R.J., Jerums G., Weekes A., Moran J., Shaw J.E. et al. Nonalbuminuric renal impairment in type 2 diabetic patients and in the general population (National Evaluation of the Frequency of Renal Impairment cO-existing with NIDDM [NEFRON] 11). Diabetes Care. 2009. 32. 1497-1502. doi: 10.2337/dc08-2186.
- Penno G., Solini A., Bonora E., Fondelli C., Orsi E., Zerbini G. et al. Clinical significance of nonalbuminuric renal impairment in type 2 diabetes. J. Hypertens. 2011. 29. 1802-1809. doi: 10.1097/HJH.0b013e3283495cd6.
- Afghahi H., Miftaraj M., Svensson A.M., Hadimeri H., Gudbjörnsdottir S., Eliasson B. et al. Ongoing treatment with renin-angiotensin-aldosterone-blocking agents does not predict normoalbuminuric renal impairment in a general type 2 diabetes population. J. Diabetes Complications. 2013. 27. 229-234. doi: 10.1016/j.jdiacomp.2012.10.010.
- Hill C.J., Cardwell C.R., Patterson C.C., Maxwell A.P., Magee G.M., Young R.J. et al. Chronic kidney disease and diabetes in the National Health Service: a cross-sectional survey of the U.K. national diabetes audit. Diabet. Med. 2014. 31. 448-454. doi: 10.1111/dme.12312.
- Gao B., Wu S., Wang J., Yang C., Chen S., Hou J. et al. Clinical features and long-term outcomes of diabetic kidney disease — a prospective cohort study from China. J. Diabetes Complications. 2019. 33. 39. doi: 10.1016/j.jdiacomp.2018.09.019.
- Bramlage P., Lanzinger S., van Mark G., Hess E., Fahrner S., Heyer C.H.J. et al. Patient and disease characteristics of type-2 diabetes patients with or without chronic kidney disease: an analysis of the German DPV and DIVE databases. Cardiovasc. Diabetol. 2019. 18. 33. doi: 10.1186/s12933-019-0837-x.
- Lee H.W., Jo A.R., Yi D.W., Kang Y.H., Son S.M. Prevalent rate of nonalbuminuric renal insufficiency and its association with cardiovascular disease event in Korean type 2 diabetes. Endocrinol. Metab. (Seoul). 2016. 31. 577-585. doi: 10.3803/EnM.2016.31.4.577.
- Koye D.N., Magliano D.J., Reid C.M., Jepson C., Feldman H.I., Herman W.H. et al. Risk of progression of nonalbuminuric CKD to end-stage kidney disease in people with diabetes: the CRIC (Chronic Renal Insufficiency Cohort) Study. Am. J. Kidney Dis. 2018. 72. 653-661. doi: 10.1053/j.ajkd.2018.02.364.
- Thorn L.M., Gordin D., Harjutsalo V., Hägg S., Masar R., Saraheimo M. et al. The presence and consequence of nonalbuminuric chronic kidney disease in patients with type 1 diabetes. Diabetes Care. 2015. 38. 2128-2133. doi: 10.2337/dc15-0641.
- Penno G., Russo E., Garofolo M., Daniele G., Lucchesi D., Giusti L. et al. Evidence for two distinct phenotypes of chronic kidney disease in individuals with type 1 diabetes mellitus. Diabetologia. 2017. 60. 1102-1113. doi: 10.1007/s00125-017-4251-1.
- Pacilli A., Viazzi F., Fioretto P., Giorda C., Ceriello A., Genovese S. et al. Epidemiology of diabetic kidney disease in adult patients with type 1 diabetes in Italy: the AMD-Annals initiative. Diabetes Metab. Res. Rev. 2017. 33(4). e2873. doi: 10.1002/dmrr.2873.
- Retnakaran R., Cull C.A., Thorne K.I., Adler A.I., Holman R.R.; UKPDS Study Group. Risk factors for renal dysfunction in type 2 diabetes: U.K. Prospective Diabetes Study 74. Diabetes. 2006. 55. 1832-1839. doi: 10.2337/db05-1620.
- Molitch M.E., Steffes M., Sun W., Rutledge B., Cleary P., de Boer I.H. et al. Development and progression of renal insufficiency with and without albuminuria in adults with type 1 diabetes in the diabetes control and complications trial and the epidemiology of diabetes interventions and complications study. Diabetes Care. 2010. 33. 1536-1543. doi: 10.2337/dc09-1098.
- Krolewski A.S. Progressive renal decline: the new paradigm of diabetic nephropathy in type 1 diabetes. Diabetes Care. 2015. 38. 954-962. doi: 10.2337/dc15-0184.
- Krolewski A.S., Skupien J., Rossing P., Warram J.H. Fast renal decline to end-stage renal disease: an unrecognized feature of nephropathy in diabetes. Kidney Int. 2017. 91. 1300-1311. doi: 10.1016/j.kint.2016.10.046.
- Skupien J., Warram J., Smiles A., Stanton R.C., Krolewski A.S. Patterns of estimated glomerular filtration rate decline leading to end-stage renal disease in type 1 diabetes. Diabetes Care. 2016. 39. 2262-2269. doi: 10.2337/dc16-0950.
- Pugliese G., Penno G., Andrea N., Barutta F., Salvatore D.P., Reboldi G., Gesualdo L., Luca D.N. on behalf of the Italian Diabetes Society and the Italian Society of Nephrology Diabetic kidney disease: New clinical and therapeutic issues. Joint position statement of the Italian Diabetes Society and the Italian Society of Nephrology on “The natural history of diabetic kidney disease and treatment of hyperglycemia in patients with type 2 diabetes and impaired renal function”. Nutrition, Metabolism & Cardiovascular Diseases. 2019. 29. 1127-1150. doi: 10.1016/j.numecd.2019.07.017.
- Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group KDIGO clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney Int. Suppl. 2013. 3. 1-150. doi: 10.1038/kisup.2012.73.
- Krolewski A.S., Warram J.H., Forsblom C., Smiles A.M., Thorn L., Skupien J. et al. Serum concentration of cystatin C and risk of end-stage renal disease in diabetes. Diabetes Care. 2012. 35. 2311-2316. doi: 10.2337/dc11-2220.
- Pan Y., Jiang S., Qiu D., Shi J., Zhou M., An Y. et al. Comparing the GFR estimation equations using both creatinine and cystatinc to predict the long-term renal outcome in type 2 diabetic nephropathy patients. J. Diabetes Complications. 2016. 30. 1478-1487. doi: 10.1016/j.jdiacomp.2016.07.013.
- Fioretto P., Caramori M.L., Mauer M. The kidney in diabetes: dynamic pathways of injury and repair. The Camillo Golgi Lecture 2007. Diabetologia. 2008. 51(8). 1347-1355. doi: 10.1007/s00125-008-1051-7.
- Корбут А.И., Климонтов В.В. Терапия, основанная на инкретинах: почечные эффекты. Сахарный диабет. 2016. 19(1). 53-63. doi: 10.14341/DM7727.
- Корбут А.И., Климонтов В.В. Эмпаглифлозин: новая стратегия нефропротекции при сахарном диабете. Сахарный диабет. 2017. 20(1). 75-84. doi: 10.14341/DM8005.
- Wookey P.J., Cooper M.E. Amylin: physiological roles in the kidney and a hypothesis for its role in hypertension. Clin. Exp. Pharmacol. Physiol. 1998. 25(9). 653-60. doi: 10.1111/j.1440-1681.1998.tb02272.x.
- Пашковська Н.В. Латентний автоімунний діабет у дорослих (LADA): сучасний погляд на проблему. Міжнародний ендокринологічний журнал. 2019. 15(3). 272-280. doi: 10.22141/2224-0721.15.3.2019.172116.