Введение
Гигантоклеточный артериит (ГКА) является разновидностью системного васкулита с поражением крупных сосудов. Это заболевание с большей частотой регистрируется у пациентов старше 50 лет и примерно в три раза чаще встречается у женщин. Симптомы ГКА включают головную боль (обычно новых локализаций или новой симптоматики), слабость жевательных мышц (перемежающаяся хромота челюсти), болезненность кожи головы, лихорадку, потерю веса и симптомы ревматической полимиалгии. Кроме того, могут наблюдаться глазные симптомы, среди которых самыми грозными являются временная или необратимая потеря зрения и инсульт. Диагностического лабораторного теста для этого заболевания, к сожалению, не существует. Биопсия височной артерии традиционно считается золотым стандартом, хотя чувствительность этого метода исследования составляет всего до 50 %. В последнее время все чаще используются методы визуализации для постановки диагноза при отсутствии диагностических признаков при гистопатологическом исследовании биопсии височной артерии или невозможности проведения патоморфологического исследования. Как только диагноз ГКА установлен, важно немедленно инициировать проведение лечения, так как пролонгация может привести к неблагоприятным клиническим исходам, таким как слепота.
Хотя глюкокортикоиды (ГК) эффективны для контроля проявлений ГКА и предотвращения потери зрения, переносимость такой терапии часто неудовлетворительна; кроме того, при длительном использовании ГК наблюдаются необратимые поражения внутренних органов в рамках традиционных побочных эффектов стероидной терапии. В течение многих лет предпринимались многочисленные попытки идентифицировать эффективные глюкокортикоидсберегающие агенты; совсем недавно тоцилизумаб — ингибитор альфа-рецептора интерлейкина-6 — был идентифицирован как эффективный терапевтический агент для лечения ГКА. В этом обзоре литературы будут рассмотрены последние достижения в диагностике и менеджменте пациентов с ГКА.
Диагностика: ультразвуковое исследование височной и других артерий
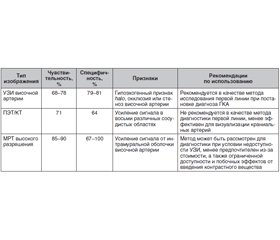
Рекомендации Европейской противоревматической лиги (EULAR) 2018 года по визуализационным методам исследования для васкулитов сосудов крупного калибра (ВСКК) рассматривают ультразвуковой метод исследования (УЗИ) височной артерии как визуализационное исследование первой линии для пациентов, у которых подозревают ГКА [7]. В Рекомендациях по диагностике и лечению ВСКК Британского общества ревматологов (BSR/BHPR) 2020 г. также подчеркивается, что при подозрении на ГКА пациенту следует выполнить подтверждающий диагностический тест [15]. Им может быть либо биопсия участка височной артерии длиной не менее 1 см, либо УЗИ височных и подмышечных артерий, либо сочетание этих методов. В рекомендательных принципах EULAR и BSR/BHPR подчеркивается, что характерных изменений на УЗИ достаточно для постановки диагноза ГКА при отсутствии биопсии височной артерии и высоком подозрении на наличие васкулита.
Наиболее значимым симптомом на УЗИ, отражающим воспаление стенок сосудов при ГКА, является гипоэхогенный ореол, или нимб, — признак halo. Это воспалительный отек стенки пораженной артерии. Специфичность признака halo составляет 79 %, а чувствительность — 68 %. Эти оценки возрастают до 81 и 78 % соответственно при наличии дополнительных ультразвуковых признаков, таких как окклюзия или стеноз (табл. 1) [21]. Следует отметить, что большинство исследований, в которых оценивались значимость и информативность УЗИ височной артерии при диагностике ГКА, проводилось в академических медицинских центрах с большим опытом ультразвуковой визуализации височных артерий.
/26.jpg)
Остается неясным, следует ли использовать УЗИ для определения места биопсии височной артерии. Было высказано предположение, что направленная биопсия (т.е. биопсия в месте присутствия симптома нимба — halo) может повысить чувствительность исследования у тех пациентов, у которых обнаруживают его одностороннюю локализацию [13]. В исследовании G. Germano и соавт. (2015) [10] пациенты с подозрением на ГКА были рандомизированы на 2 группы: тех, кому биопсия височной артерии проводилась под контролем УЗИ, и тех, кому выполнялась стандартная биопсия височной артерии (наиболее уплотненной и болезненной части, которую определяет врач). Как итог, не было установлено увеличения чувствительности биопсии височной артерии в группе, где биопсия проводилась под УЗИ-контролем [10]. Следует отметить, что чувствительность признаков на УЗИ снижается после применения ГК с 92 % после 0–1-го дня лечения до 80 % после 2–4 дней и до 50 % после более 4 дней приема ГК [12], что намного быстрее, чем изменение чувствительности гистопатологических изменений, выявляемых на биопсии височной артерии на фоне лечения ГК. Было показано, что биопсия височной артерии была диагностически значимой у 78 % пациентов, получавших ГК менее 2 недель до биопсии, по сравнению с 65 % получавших ГК 2–4 недели и 40 % получавших ГК более 4 недель [19]. В другом исследовании пациентам с ГКА была назначена повторная биопсия височной артерии в различные моменты времени, и было обнаружено, что через 3 месяца положительные признаки все еще имели 70 % пациентов, через 6 месяцев — 75 % пациентов, через 9 месяцев — 44 % и через 12 месяцев — 44 % [16].
Следует отметить, что УЗИ имеет очень ограниченную диагностическую значимость при оценке грудной аорты и не должно использоваться в качестве надежного метода выявления аортита или другого поражения крупных сосудов. Полезно ли УЗИ для подтверждения или исключения рецидива/обострения ГКА у пациента с установленным диагнозом? Этот вопрос остается открытым, хотя активно исследуется [7]. В целом необходимо заключить, что УЗИ — отличный диагностический инструмент при ГКА, хотя он зависит от квалификации и опыта специалиста, поэтому важно, чтобы этот метод исследования проводился в центрах, где диагносты, выполняющие и интерпретирующие исследования, имели достаточный опыт его использования для диагностики ГКА и оценки изменений височной артерии.
Диагностика. Визуализационные возможности ПЭТ/КТ и МРТ
EULAR разработала ряд рекомендательных принципов по выбору методов визуализации при ВСКК [7]. Позитронно-эмиссионная томография/компьютерная томография (ПЭТ/КТ) не рекомендуется в качестве метода диагностики первой линии. Однако этот метод исследования особенно полезен для оценки аортита с наиболее частой локализацией в восходящей аорте при ГКА. Появляется все больше данных о том, что ПЭТ/КТ обладает достаточной чувствительностью для выявления васкулита не только в экстракраниальных крупных кровеносных сосудах, но и в краниальных. Недавно разработанная более усовершенствованная методика с использованием томографических срезов толщиной 1 мм улучшает способность ПЭТ/КТ-оценки височных артерий [22].
В исследование A.M. Sammel и соавт. (2019) [22] было включено 64 пациента с ГКА, которым была проведена ПЭТ/КТ. По сравнению с биопсией височной артерии чувствительность ПЭТ/КТ составила 92 %, а специфичность — 85 % для диагностики височного артериита, а в сравнении с клиническими признаками чувствительность этого метода составила 71 %, а специфичность — 91 %. ПЭТ/КТ также имеет отрицательную прогностическую ценность, которая составляет 98 %, что свидетельствует о ее большой пользе для исключения ГКА у пациентов с низким риском. Аортит при ПЭТ/КТ выявляется почти у половины пациентов с положительной биопсией височной артерии, а среди пациентов с ВСКК, обнаруженными на ПЭТ/КТ, в среднем было вовлечено четыре сосудистых участка [6, 22].
Недостатки использования ПЭТ/КТ включают высокую стоимость, радиационное облучение и отсутствие широкой доступности изображений нового поколения [22]. Кроме того, как и в случае других методов визуализации, поглощение фтордезоксиглюкозы (ФДГ) и, следовательно, чувствительность теста значительно снижаются после воздействия ГК. Поэтому для наиболее точного диагноза рекомендуется проводить ПЭТ/КТ в диапазоне 72 часов от начала терапии ГК [2]. Дополнительным потенциальным недостатком является то, что у многих пациентов сохраняется некоторая степень поглощения ФДГ крупными сосудами даже после лечения; таким образом, роль этого метода исследования в мониторинге активности заболевания остается неопределенной [2].
Магнитно-резонансная томография (МРТ) также используется для оценки краниальных артерий с общей чувствительностью около 73 % и специфичностью 88 %. Однако из-за высокой стоимости и ограниченной доступности МРТ, а также из-за возможных побочных эффектов контрастных реагентов МРТ не рекомендуется для использования в качестве визуализационного метода исследования первой линии при ГКА [7, 15].
Глюкокортикоиды и их токсичность
ГК были терапией первой линии и монотерапией для ГКА в течение последних 70 лет. Общепринятые рекомендации диктуют важность высоких стартовых доз преднизолона, обычно 1 мг/кг/сут, или пульс-терапии метилпреднизолоном по 1 г внутривенно ежедневно в течение 3 дней при преходящих нарушениях зрения или полной потере зрения. Длительность лечения ГК составляет как минимум 1 год приема преднизолона или другого ГК в сопоставимой дозе со снижением от высоких до низких доз в течение многих месяцев без определенной конечной точки. Теперь, согласно рекомендациям EULAR, предлагается снижение дозы ГК до 15–20 мг/сут через 2–3 месяца и до 5 мг/сут через год; продолжительность такого приема составляет приблизительно 2 года [7]. Снижение дозы преднизолона согласно рекомендациям BSR представлено в табл. 2.
/28.jpg)
Однако отмечается, что большинство пациентов, получавших только преднизолон, в конечном итоге нуждались в дополнительном повышении дозы из-за рецидивирующих обострений или рефрактерных симптомов, особенно если предпринимались попытки полностью отменить ГК в течение 1 года [23].
Несмотря на неоспоримую эффективность применения высоких доз преднизолона для подавления активного ГКА и предотвращения потери зрения, токсичность обычных дозировок ГК для лечения ГКА является значимой. До 90 % пациентов имеют по крайней мере одно неблагоприятное событие при приеме ГК, при этом чаще всего встречаются катаракта и вторичный остеопороз [3]. При каждом увеличении воздействия ГК на 1000 мг отношение рисков для нежелательных явлений увеличивается на 3 % [3]. Серия анализов «случай — контроль» оценивала многочисленные осложнения, а также дозозависимый характер риска приема ГК. Среди пациентов с ГКА, принимающих преднизолон в дозе 30 мг в день или более, по сравнению с пациентами, принимавшими более низкие дозы (5 мг в день или менее), соотношение рисков осложнений было следующим: диабет (4,7), остеопороз (1,9), переломы (2,6), глаукома (3,5), серьезная инфекция (3,3) и смерть (2,1), со многими осложнениями, возникающими спустя годы [29]. Другое исследование продемонстрировало аналогичные показатели риска развития остеопороза и переломов среди мужчин и женщин [30]. Кроме того, увеличение веса вызывает особую обеспокоенность у многих пациентов и способствует плохой приверженности к терапии. Предыдущие исследования лечения васкулитов показали смешанные результаты относительно влияния ГК на увеличение веса. Уменьшение активности заболевания было связано с увеличением веса независимо от кумулятивной дозы преднизолона, а у пациентов, у которых не удавалось добиться контроля над заболеванием, увеличения веса, несмотря на прием больших доз ГК, не происходило [28, 31].
Тоцилизумаб как новая терапевтическая опция в лечении ГКА
Первое рандомизированное плацебо-контролируемое исследование по оценке эффективности внутривенного тоцилизумаба 8 мг/кг в месяц в дополнение к терапии ГК у 20 пациентов с ГКА показало более высокую выживаемость с отсутствием рецидивов в группе тоцилизумаба (85 против 20 %, P < 0,001) на 52-й неделе [26]. В исследование Giant Cell Arteritis Actemra (GiACTA) были включены пациенты (251), рандомизированные в четыре группы: 1) тоцилизумаб по 162 мг еженедельно; 2) тоцилизумаб в этой же дозе раз в 2 недели (в сочетании со снижением преднизолона в течение 26 недель); изолированный прием преднизолона со снижением в течение 26 (3) и 52 (4) недель. Первичная конечная точка — устойчивая ремиссия без ГК на 52-й неделе — достигнута у 56 % пациентов первой группы с еженедельным приемом тоцилизумаба и у 53 % — у пациентов второй группы, получавших тоцилизу-маб 1 раз в 2 недели, по сравнению с 14 и 18 % в 3-й и 4-й группе соответственно изолированного приема ГК. Суммарная доза преднизолона была значительно ниже в обеих группах тоцилизумаба по сравнению с обеими группами изолированного приема преднизолона. Серьезные побочные эффекты также чаще наблюдались в 3-й и 4-й группе [23]. Эффекты тоцилизумаба как стероидсберегающего агента отмечались как при рецидивирующем, так и при недавно диагностированном ГКА.
Применение устекинумаба при ГКА
Устекинумаб был также исследован в качестве потенциального стероидсберегающего агента при ГКА, но с менее стабильным положительным результатом. Вследствие этого он не одобрен Управлением по контролю за продуктами и лекарствами (FDA) для лечения ГКА. В открытом исследовании 25 пациентов с рефрактерным ГКА, которым был назначен устекинумаб в дополнение к ГК, было продемонстрировано отсутствие рецидива у всех пациентов. Через 52 недели средняя суточная доза преднизолона была снижена с 20 до 5 мг. Кроме того, КТ-ангиография продемонстрировала уменьшение интенсивности проявлений васкулита крупных сосудов у всех пациентов [5]. Тем не менее последующее открытое исследование по оценке использования устекинумаба при ГКА в сочетании со снижением дозы преднизолона в течение 6 месяцев было прекращено на ранней стадии из-за наблюдения обострений заболевания у 7 из первых 11 (63,6 %) пациентов, включенных в исследование. Только два пациента (18 %) достигли первичной конечной точки — ремиссии без приема ГК с нормальными маркерами воспаления на 52-й неделе [17]. Фундаментальное различие этих двух открытых исследований с устекинумабом, по-видимому, заключается в поддержании ремиссии при помощи ГК в первом исследовании и прекращении лечения ГК во втором.
Другие виды терапии при ГКА
Абатацепт, иммуноглобулин CTLA-4, который действует как негативный регулятор костимуляции Т-клеток, был изучен в рандомизированном исследовании с пробой отмены препарата. Безрецидивная выживаемость в группе, получавшей абатацепт, составила 48 % по сравнению с 31 % в группе, получавшей плацебо (Р = 0,049) [14]. Также была отмечена более длительная средняя продолжительность ремиссии в группе, получавшей абатацепт (9,9 по сравнению с 3,9 месяца). Увеличения побочных эффектов на фоне приема абатацепта не отмечалось, однако этот препарат также не одобрен FDA для лечения ГКА [14].
Длительность терапии тоцилизумабом
Хотя тоцилизумаб продемонстрировал обнадеживающие результаты в исследованиях как глюкокортикоидсберегающий агент для лечения ГКА, оптимальная продолжительность лечения остается неизвестной. Проспективное исследование 17 пациентов, которые получали тоцилизумаб в течение 1 года и находились в стадии ремиссии без лечения во время прекращения приема тоцилизумаба, показало, что у 8 пациентов (47 %) произошел рецидив в среднем через 6,3 месяца [1]. Пациенты, включенные в это исследование, у которых наблюдался рецидив после прекращения применения тоцилизумаба, были моложе и имели более выраженную степень усиления сигнала стенки сосуда на МРТ в начале исследования по сравнению с теми, у которых рецидив не наблюдался. Однако у всех пациентов, включенных в исследование, отмечались постоянные изменения на МРТ во время исследования [1]. Как интерпретировать признаки улучшения по данным МРТ при ГКА, остается неопределенным.
В долгосрочном, 2-летнем продленном исследовании GiACTA было продолжено наблюдение за пациентами, которые получали тоцилизумаб с ГК или только ГК [24]. 49 % пациентов в еженедельной группе тоцилизумаба и 39 % пациентов, получавших тоцилизумаб 1 раз в 2 недели, удерживали полную ремиссию в течение всего периода наблюдения. Самая высокая доля пациентов, которые сохраняли полную ремиссию, не получая никакого лечения, составляла 68 % в еженедельной группе тоцилизумаба. 49 % пациентов, достигших устойчивой ремиссии заболевания на еженедельной дозе тоцилизумаба и на 26-недельном снижении преднизолона, сохраняли ремиссию в течение 2 лет после прекращения применения тоцилизумаба, подчеркивая тот факт, что, хотя бдительность в отношении вероятности возникновения рецидивов заболевания при ГКА остается критической, не всем пациентам требуется постоянное лечение иммуносупрессивными препаратами [24].
Факторы риска неэффективности лечения или рецидивов при ГКА
Несмотря на лечение ГК и даже тоцилизумабом, у значительной части пациентов наблюдается рецидив заболевания во время прекращения приема этих препаратов или после него. Исследование 149 пациентов, получавших тоцилизумаб, продемонстрировало, что у 24 % исследуемых был отмечен рецидив, и 64 % из них все еще получали преднизолон во время рецидива [25]. Приблизительно 25 % обострений заболевания возникало, когда пациенты принимали более 10 мг преднизолона в день. Маркеры воспаления не являются надежными индикаторами рецидива, особенно у пациентов, получающих лечение блокаторами интерлейкина (ИЛ)-6. У 92 % пациентов, получавших тоцилизумаб, отмечались нормальные уровни С-реактивного белка (СРБ) во время обострения. Более того, 34 % пациентов, получавших только преднизолон, имели нормальные уровни СРБ при обострении заболевания [25]. Этот факт указывает на необходимость поиска новых, более чувствительных биомаркеров, способных прогнозировать и предсказывать развитие рецидива заболевания.
Вышеописанное исследование, в котором сообщалось о более высокой степени усиления сигнала на МРТ у пациентов с рецидивом после прекращения лечения тоцилизумабом, не обнаружило различий по полу, наличию или отсутствию краниальных симптомов, наличию или отсутствию положительной биопсии височной артерии или других факторов, которые могли бы прогнозировать рецидив после лечения [1]. Однако последующий анализ исследования GiACTA показал, что женский пол, более тяжелые поражения органов на момент манифестации заболевания и лечение преднизолоном в монорежиме (в отличие от тоцилизумаба) были независимыми предикторами неудачи лечения [27]. В мультивариантном анализе женщины с ГКА более чем в пять раз чаще, чем мужчины, не отвечали на изолированное лечение преднизолоном. Двумя наиболее сильными факторами риска возникновения рецидивов ГКА были отсутствие лечения тоцилизумабом и женский пол. Хотя было выдвинуто предположение, что пациенты с ГКА, у которых отмечается поражение аорты и ее первичных ветвей в отличие от краниального поражения, имеют более тяжелый для лечения фенотип заболевания, до настоящего времени исходы пациентов с ГКА и поражением крупных сосудов не отличаются от исходов лечения когорты пациентов только с краниальными симптомами [6].
Поиск и возможности биомаркеров для идентификации рецидивов
Предпринималось множество попыток определить биомаркеры, которые могут быть информативны для мониторинга заболевания и выявления его рецидивов. Это особенно важно, поскольку тоцилизумаб замедляет скорость оседания эритроцитов и снижает СРБ, что делает их ненадежными в качестве маркеров активности заболевания. Несмотря на роль ИЛ-6 в патогенезе ГКА, оказалось, что сывороточные уровни ИЛ-6 не коррелируют с активностью заболевания [25]. Исследование, проведенное A.D. Gloor и соавт. (2018) [11], продемонстрировало, что матриксная металлопротеиназа-3 (ММР-3), пентраксин-3 и рецептор растворимого фактора некроза опухоли 2 (sTNFR2) были значительно повышены у пациентов с ГКА по сравнению с контрольной группой лиц того же возраста и пола, а тоцилизумаб привел к нормализация этих показателей. Уровни MMP-3 также слабо коррелировали с интенсивностью сигнала стенки аорты на МРТ-ангиографии [11]. Целью еще двух недавних исследований была оценка роли сывороточного амилоида А в характеристике активности болезни. В исследовании А. Dartevel и соавт. (2019) [8] уровни амилоида А (AA) в сыворотке были значительно выше у пациентов с ГКА с активным заболеванием по сравнению с лицами с неактивным заболеванием. В другом исследовании были проанализированы профили здоровых доноров крови и пациентов с ГКА; обнаружено, что уровни сывороточного АА, а также ИЛ-23 и ИЛ-6 были значительно выше у пациентов с ГКА по сравнению со здоровыми лицами группы контроля. Изменения уровней AA в сыворотке также коррелировало с рецидивами заболевания, а также с нарушениями зрения [4]. Хотя эти сывороточные маркеры в настоящее время не используются в клинической практике, данные испытания могут проложить путь к перспективным исследованиям возможности терапии, направленной на сывороточный АА.
Мониторинг заболевания с динамическим использованием визуализационных методов исследования
Серии МРТ, ПЭТ/КТ и УЗИ были изучены у пациентов с ГКА со смешанными результатами. Одно исследование показало, что у всех пациентов в длительной ремиссии все еще наблюдалось усиление сигнала от сосудистой стенки низкой интенсивности на МРТ во время наблюдения [1]. Другое исследование также продемонстрировало, что выраженность сигнала сосудистой стенки на МРТ не коррелировала с клинической активностью заболевания [20]. Аналогично на ПЭТ/КТ у большинства пациентов все еще наблюдается некоторая степень усиления захвата сосудами контрастного вещества через 1 год, хотя уровень максимального поглощения потенциально может помочь отличить пациентов с ремиссией от пациентов с активным заболеванием [2, 18]. Что касается УЗИ височной артерии, то в исследовании G. Evangelatos и соавт. (2019) [9] были представлены два пациента, у которых при применении тоцилизумаба значительно уменьшился симптом halo. Использование изображений для подтверждения или исключения рецидивов в настоящий момент изучено недостаточно, но рекомендуется для долгосрочного мониторинга пациентов с вовлечением сосудов крупного калибра [7].
Выводы
Таким образом, диагностика и лечение ГКА в последние годы претерпели существенные изменения. И если биопсия височной артерии ранее считалась единственным высокоинформативным методом диагностики ГКА, то теперь появилась возможность использовать неинвазивные визуализационные методы исследования. Кроме того, некоторые неинвазивные методы исследования также полезны для выявления поражения крупных сосудов или аорты. Их роль в длительном мониторинге активности заболевания требует дальнейшей оценки. Точно так же если ранее длительное лечение ГК считалось единственным надежным терапевтическим вариантом для пациентов с ГКА на протяжении десятилетий, то в настоящее время тоцилизумаб позиционируется в качестве терапевтического агента, который значительно увеличивает скорость ремиссии без ГК и уменьшает кумулятивные дозы ГК, необходимые для поддержания контроля над заболеванием. Необходимы дальнейшие исследования для поиска и определения новых вариантов лечения, а также разработка биомаркеров, способных идентифицировать рецидивы заболевания.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
Список литературы
1. Adler S., Reichenbach S., Gloor A. et al. Risk of relapse after discontinuation of tocilizumab therapy in giant cell arteritis. Rheumatology (Oxford). 2019. 58(9). 1639-1643. doi: 10.1093/ rheumatology/kez091.
2. Braun J., Baraliakos X., Fruth M. The role of 18F-FDG positron emission tomography for the diagnosis of vasculitides. Clin. Exp. Rheumatol. 2018. 36(suppl. 114). S108-S114.
3. Broder M.S., Sarsour K., Chang E. et al. Corticosteroid-related adverse events in patients with giant cell arteritis: a claims-based analysis. Semin. Arthritis Rheum. 2016. 46(2). 246-252. doi: 10.1016/j.semarthrit. 2016.05.009.
4. Burja B., Feichtinger J., Lakota K. et al. Utility of serological biomarkers for giant cell arteritis in a large cohort of treatment-naïve patients. Clin. Rheumatol. 2019. 38(2). 317-329. doi: 10.1007/s10067-018-4240-x.
5. Conway R., O’Neill L., Gallagher P. et al. Ustekinumab for refractory giant cell arteritis: a prospective 52-week trial. Semin. Arthritis Rheum. 2018. 48(3). 523-528. doi: 10.1016/j.semarthrit.
6. De Boysson H., Liozon E., Lambert M. et al. Giant-cell arteritis: do we treat patients with large-vessel involvement differently? Am. J. Med. 2017. 130(8). 992-995. doi: 10.1016/j.amjmed.2017.03.054.
7. Dejaco C., Ramiro S., Duftner C. et al. EULAR recommendations for the use of imaging in large vessel vasculitis in clinical practice. Ann. Rheum. Dis. 2018. 77(5). 636-643. doi: 10.1136/annrheumdis-2017-212649.
8. Dartevel A., Toussaint B., Trocme C. et al. Serum amyloid A as a marker of disease activity in Giant cell arteritis. Autoimmun. Rev. 2019. 19(1). 102428. doi: 10.1016/j.autrev.2019.102428.
9. Evangelatos G., Fragoulis G.E., Iliopoulos A. Temporal ultrasound for monitoring tocilizumab treatment in giant cell arteritis: seeing beyond serum markers? Ann. Rheum. Dis. 2019. doi: 10.1136/annrheumdis-2019-216527. [Epub ahead of print].
10. Germano G., Muratore F., Cimino L. et al. Is colour duplex sonography-guided temporal artery biopsy useful in the diagnosis of giant cell arteritis? A randomized study. Rheumatol. (United Kingdom). 2015. 54(3). 400-4. doi: 10.1093/rheumato-logy/keu241.
11. Gloor A.D., Yerly D., Adler S. et al. Immuno-monitoring reveals an extended subclinical disease activity in tocilizumab-treated giant cell arteritis. Rheumatology (Oxford). 2018. 57(10). 1795-1801. doi: 10.1093/rheumatology/key158.
12. Hauenstein C., Reinhard M., Geiger J. et al. Effects of early corticosteroid treatment on magnetic resonance imaging and ultrasonography findings in giant cell arteritis. Rheumatol. (United Kingdom). 2012. 51(11). 1999-2003. doi: 10.1093/rheumatology/kes153.
13. Karahaliou M., Vaiopoulos G., Papaspyrou S. et al. Colour duplex sonography of temporal arteries before decision for biopsy: a prospective study in 55 patients with suspected giant cell arteritis. Arthritis Res. Ther. 2006. 8. R116. DOI: 10.1186/ar2003.
14. Langford C., Cuthbertson D., Ytterberg S. et al., Vasculitis Clinical Research Consortium. A randomized, double-blind trial of abatacept (CTLA-4Ig) for the treatment of giant cell arteritis. Arthritis Rheumatol. 2017. 69(4). 837-845. doi: 10.1002/art.40044.
15. Mackie S.L., Dejaco C., Appenzeller S. et al. British Society for Rheumatology guidelines on diagnosis and treatment of giant cell arteritis. Rheumatology. 2020. 0. 1-23. doi: 10.1093/rheumatology/kez672.
16. Maleszewski J.J., Younge B.R., Fritzlen J.T. et al. Clinical and pathological evolution of giant cell arteritis: a prospective study of follow-up temporal artery biopsies in 40 treated patients. Mod. Pathol. 2017. 30(6). 788-796. doi: 10.1038/modpathol.2017.10.
17. Matza M., Stone J., Fernandes A., Unizony S. Ustekinumab for the treatment of giant cell arteritis (abstract 1837). American College of Rheumatology’s Annual Meeting. 2019. doi: 10.1002/acr.24200. [Epub ahead of print].
18. Nannini C., Niccoli L., Sestini S. et al. Remission maintenance after tocilizumab dose- tapering and interruption in patients with giant prospective, pilot study. Ann. Rheum. Dis. 2019. 78(10). 1444-1446. doi: 10.1136/annrheumdis-2019-215585.
19. Narvaez J., Bernad B., Roig-Vilaseca D. et al. Influence of previous corticosteroid therapy on temporal artery biopsy yield in giant cell arteritis. Semin. Arthritis Rheum. 2007. 37(1). 13-19. doi: 10.1016/j.semarthrit.2006.12.005.
20. Reichenbach S., Adler S., Bonel H. et al. Magnetic resonance angiography in giant cell arteritis: results of a randomized controlled trial of tocilizumab in giant cell arteritis. Rheumato-logy (Oxford). 2018. 57(6). 982-986. doi: 10.1093/rheumatology/ key015.
21. Rinagel M., Chatelus E., Jousse-Joulin S. et al. Diagnostic performance of temporal artery ultrasound for the diagnosis of giant cell arteritis: a systematic review and meta-analysis of the literature. Autoimmun. Rev. 2019. 18(1). 56-61. doi: 10.1016/j.autrev.2018.07.012.
22. Sammel A.M., Hsiao E., Schembri G. et al. Diagnostic accuracy of positron emission tomography/computed tomography of the head, neck, and chest for giant cell arteritis: a prospective, double-blind, cross-sectional study. Arthritis Rheumatol. 2019. 71(8). 1319-1328. doi: 10.1002/art.40864.
23. Stone J., Tuckwell K., Dimonaco S. et al. Trial of tocilizumab in giant-cell arteritis. NEJM. 2017. 377. 317-328. DOI: 10.1056/NEJMoa1613849.
24. Stone J., Bao M., Han J. et al. Long-term outcome of tocilizumab for patients with giant cell arteritis: results from part 2 of a randomized controlled phase 3 trial (abstract 808). American College of Rheumatology’s Annual Meeting. 2019.
25. Stone J.H., Tuckwell K., Dimonaco S. et al. Glucocorticoid dosages and acutephase reactant levels at giant cell arteritis flare in a randomized trial of tocilizumab. Arthritis Rheumatol. 2019. 71(8). 1329-1338. doi: 10.1002/art.40876.
26. Villiger P.M., Adler S., Kuchen S. et al. Tocilizumab for induction and maintenance of remission in giant cell arteritis: a phase 2, randomised, doubleblind, placebo-controlled trial. Lancet. 2016. 387(10031). 1921-7. doi: 10.1016/S0140-6736(16)00560-2.
27. Unizony S., Bao M., Han J. et al. Risk factors for treatment failure in patients with giant cell arteritis treated with tocilizumab plus prednisone versus prednisone alone. Ann. Rheum. Dis. 2019. 78(suppl. 2). 810. (Abstract 0261).
28. Wallace Z.S., Miloslavsky E.M., Cascino M. et al. Effect of disease activity, glucocorticoid exposure, and rituximab on body composition during induction treatment of antineutrophil cytoplasmic antibody-associated vasculitis. Arthritis Care Res. 2017. 69(7). 1004-1010. doi: 10.1002/acr.23099.
29. Wilson J.C., Sarsour K., Collinson N. et al. Serious adverse effects associated with glucocorticoid therapy in patients with giant cell arteritis (GCA): a nested case-control analysis. Semin. Arthritis Rheum. 2017. 46(6). 819-827. doi: 10.1016/j.semarthrit.
30. Wilson J.C., Sarsour K., Collinson N. et al. Incidence of outcomes potentially associated with corticosteroid therapy in patients with giant cell arteritis. Semin. Arthritis Rheum. 2017. 46(5). 650-656. doi: 10.1016/j.semarthrit.2016.10.001.
31. Wung P.K., Anderson T., Fontaine K.R. et al. Wegener’s granulomatosis etanercept trial research group. Effects of glucocorticoids on weight change during the treatment of Wegener’s granulomatosis. Arthritis Care Res. 2008. 59(5).746-753. doi: 10.1002/art.23561.

/26.jpg)
/28.jpg)