Резюме
Мета: оцінити ефективність і безпеку фармакологічної корекції нейрогенної дисфункції нижніх сечових шляхів у дітей препаратом ноофен (фенібут) в поєднанні з профілактичною дозою препарату фурамаг. Матеріали та методи. Під наглядом перебували 24 дитини віком від 5 до 8 років зі скаргами на часте сечовипускання в денний час. Всім хворим проводилося уронефрологічне та неврологічне обстеження. Оцінювалися дані анамнезу захворювання, соматичного статусу, загальний аналіз сечі, бактеріологічний посів сечі на флору. Для оцінки уродинаміки нижніх сечових шляхів вивчалися щоденник сечовипускань, ультразвукове дослідження нирок і сечового міхура, урофлоуметрія. Проводилась оцінка психоневрологічного статусу, а саме: симптомів порушення уваги, гіперактивності й імпульсивності. Дітям протягом 28 днів призначались стандартна уротерапія і препарат ноофен, профілактична доза препарату фурамаг, вітаміни групи В. Результати. Після обстеження гіперактивний сечовий міхур діагностовано у 15 (62,5 %), дисфункціональне сечовипускання — у 9 (37,5 %) дітей. Після закінчення лікування позитивна динаміка клінічної картини відзначена у 21 (87 %) пацієнта, із них повне одужання спостерігалося у 9 (38 %), часткове поліпшення — у 12 (49 %) дітей. Відсутність ефекту від проведеної терапії відзначено у 3 (13 %) дітей. Зміна частоти сечовипускань на тлі терапії характеризувалася значним зниженням в перші два тижні лікування з 16,00 ± 1,35 до 11,1 ± 0,57 (р < 0,001). Після закінчення терапії частота сечовипускань становила 8,90 ± 0,35 (р < 0,001). Ургентні позиви до сечовипускання практично ліквідувалися, нетримання сечі не відзначалося. Після курсу лікування ефективний обсяг сечового міхура збільшився на 38,9 % (р < 0,001). Показаний позитивний вплив на уродинамічні показники: збільшення об’єму сечовипускання (на 35,1 %, р < 0,001), максимальної (на 28,8 %, р < 0,002) і середньої об’ємної швидкості потоку сечі (на 53,3 %, р < 0,001). За час спостереження в обстежених дітей не відзначено жодного випадку інфекції сечових шляхів. Доведено коригуючий вплив препарату ноофен на симптоми неуважності і більшою мірою гіперактивності/імпульсивності, а також значущість зв’язку ефективності лікування дисфункції нижніх сечових шляхів і психоневрологічної позитивної динаміки (р < 0,004). Показаний сприятливий профіль безпеки препаратів ноофен і фурамаг. Висновки. Встановлена терапевтична ефективність і безпека препарату ноофен у поєднанні з профілактичною дозою препарату фурамаг у дітей з нейрогенною дисфункцією нижніх сечових шляхів, що підтверджено позитивною клінічною динамікою, покращенням уродинамічних показників, зниженням симптомів неуважності, гіперактивності та імпульсивності.
Цель: оценить эффективность и безопасность фармакологической коррекции нейрогенной дисфункции нижних мочевых путей у детей препаратом ноофен (фенибут) в сочетании с профилактической дозой препарата фурамаг. Материалы и методы. Под наблюдением находились 24 ребенка в возрасте от 5 до 8 лет с жалобами на учащенное мочеиспускание в дневное время. Всем больным проводилось уронефрологическое и неврологическое обследование. Оценивались данные анамнеза заболевания, соматического статуса, общий анализ мочи, бактериологический посев мочи на флору. Для оценки уродинамики нижних мочевых путей изучались дневник мочеиспусканий, ультразвуковое исследование почек и мочевого пузыря, урофлоуметрия. Проводилась оценка психоневрологического статуса, а именно: симптомов нарушения внимания, гиперактивности и импульсивности. Детям в течение 28 дней назначались стандартная уротерапия и препарат ноофен, профилактическая доза препарата фурамаг, витамины группы В. Результаты. После обследования были диагностированы гиперактивный мочевой пузырь у 15 (62,5 %), дисфункциональное мочеиспускание у 9 (37,5 %) детей. По окончании лечения положительная динамика клинической картины отмечена у 21 (87 %) пациента, из них полное выздоровление наблюдалось у 9 (38 %), частичное улучшение — у 12 (49 %) детей. Отсутствие эффекта от проводимой терапии отмечено у 3 (13 %) детей. Изменение частоты мочеиспусканий на фоне терапии характеризовалось значительным снижением в первые две недели лечения с 16,00 ± 1,35 до 11,10 ± 0,57 (р < 0,001). По окончании терапии частота мочеиспусканий составила 8,90 ± 0,35 (р < 0,001). Ургентные позывы к мочеиспусканию практически ликвидировались, недержание мочи не отмечалось к завершению наблюдения. После курса лечения эффективный объем мочевого пузыря увеличился на 38,9 % (р < 0,001). Показано положительное влияние на уродинамические показатели: увеличение объема мочеиспускания (на 35,1 %, р < 0,001), максимальной (на 28,8 %, р < 0,002) и средней объемной скорости потока мочи (на 53,3 %, р < 0,001). За время наблюдения у обследованных детей не отмечено ни одного случая инфекции мочевых путей. Доказаны корригирующее влияние препарата ноофен на симптомы невнимательности и в большей степени гиперактивности/импульсивности, а также значимость связи эффективности лечения дисфункции нижних мочевых путей и психоневрологической положительной динамики (р < 0,004). Показан благоприятный профиль безопасности препаратов ноофен и фурамаг. Выводы. Установлена терапевтическая эффективность и безопасность препарата ноофен в сочетании с профилактической дозой препарата фурамаг при нейрогенной дисфункции нижних мочевых путей у детей, что подтверждалось положительной клинической динамикой, улучшением уродинамических показателей, снижением симптомов невнимательности, гиперактивности и импульсивности.
Background. The purpose was to evaluate the effectiveness and safety of pharmacological correction of neurogenic lower urinary tract dysfunction in children using noophen (phenibut) in combination with a prophylactic dose of furamag. Materials and methods. Twenty-four children aged 5 to 8 years with complaints of frequent urination in the daytime were under observation. All patients underwent neurological and uronephrological examination. The history of the disease, somatic status, general urine analysis and bacteriological culture of urine were evaluated. To assess the urodynamics of the lower urinary tract, a diary of urination, ultrasound examination of the kidneys and bladder, and uroflowmetry were studied. An assessment of the neuropsychiatric status was carried out, namely: symptoms of impaired attention, hyperactivity and impulsivity. For 28 days, children were prescribed standard urotherapy and noophen, a prophylactic dose of furamag, and group B vitamins. Results. After examination, a hyperactive bladder was diagnosed in 15 (62.5 %) and dysfunctional urination — in 9 (37.5 %) children. At the end of treatment, a positive dynamics in the clinical picture was observed in 21 (87 %) patients, of which 9 (38 %) fully recovered, and partial improvement was observed in 12 (49 %) children. The lack of effect from the therapy was observed in 3 (13 %) children. The change in the frequency of urination during therapy was characterized by a significant decrease in the first two weeks of treatment from 16.00 ± 1.35 to 11.10 ± 0.57 (p < 0.001). At the end of therapy, the frequency of urination was 8.90 ± 0.35 (p < 0.001). Urges to urinate were practically eliminated; urinary incontinence was not observed by the end of treatment course. After a course of treatment, the effective bladder volume increased by 38.9 % (p < 0.001). The positive impact on urodynamic indicators was shown: an increase in urination volume (by 35.1 %, p < 0.001), maximal (by 28.8 %, p < 0.002) and average urine flow rate (by 53.3 %, p < 0.001). During the observation, the examined children did not have a single case of urinary tract infection. We succeeded to prove the corrective effect of noophen drug on the symptoms of inattention and, to a greater extent, on hyperactivity-impulsivity; as well as the significance of the connection between the effectiveness of treatment for lower urinary tract dysfunction and neuropsychiatric positive dynamics (p < 0.004). A favorable safety profile of noophen and furamag preparations is shown. Conclusions. The therapeutic efficacy and safety of noophen in combination with the prophylactic dose of furamag for neurogenic lower urinary tract dysfunction in children was established, which was confirmed by a positive dynamics of clinical disease symptoms, urodynamic indicators, a decrease in the symptoms of inattention, hyperactivity and impulsivity.
Введение
Актуальность проблемы функциональных нарушений нижних мочевых путей определяется распространенностью данной патологии, нарушением качества жизни детей и их семей, рецидивированием инфекции мочевой системы, развитием пузырно-мочеточникового рефлюкса.
Распространенность функциональных расстройств мочеиспускания у детей колеблется от 3 до 20 % [1], а по данным зарубежных авторов — от 10 до 30 % [2, 3].
На протяжении длительного времени в отношении этой патологии использовались термины «нейрогенный мочевой пузырь», «нейрогенная дисфункция мочеиспускания» и т.д. Нейрогенная дисфункция мочевого пузыря рассматривалась как расстройство его резервуарной и эвакуаторной функций в результате нарушения нервной регуляции мочеиспускания на различных уровнях — от коры головного мозга до интрамурального аппарата мочевого пузыря [4]. Данной междисциплинарной патологией занимаются детские урологи, неврологи и нефрологи.
Эксперты Международного общества по проблемам недержания мочи у детей (International Children’s Continence Society — ICCS) в 2014 году представили обновленные рекомендации, касающиеся стандартизации терминологии дисфункции нижних мочевых путей у детей и подростков [5]. Был определен возраст ребенка для диагностики данного заболевания, а именно старше 5 лет. Симптомы разделены по отношению к фазе наполнения мочевого пузыря и фазе мочеиспускания. К симптомам, связанным с нарушением фазы наполнения мочевого пузыря, относятся увеличение (8 и более раз в день) или уменьшение (3 раза в день) частоты мочеиспусканий, недержание мочи, ургентность мочеиспускания, никтурия. Недержание мочи может быть постоянным или интермиттирующим и включает такие симптомы, как дневное недержание и энурез. Термин «энурез» не следует использовать для обозначения дневного недержания мочи. Ургентность означает внезапный и неожиданный позыв к мочеиспусканию. Никтурия — это жалоба на то, что ребенок просыпается ночью для опорожнения мочевого пузыря. Следует обратить внимание, что никтурия распространена среди школьников и не обязательно свидетельствует о патологическом состоянии.
Симптомы, связанные с нарушением фазы мочеиспускания, — это нерешительность и напряжение при мочеиспускании, слабый поток мочи, прерывистая струя мочи, дизурия. Нерешительность при мочеиспускании означает трудность в начале мочеиспускания, когда ребенок готов от него отказаться. Напряжение при мочеиспускании — необходимость ребенку приложить интенсивные усилия для повышения внутрибрюшного давления, чтобы инициировать и поддерживать опорожнение мочевого пузыря. Дизурия — это жалоба на боль или дискомфорт во время мочеиспускания. Дизурия в начале мочеиспускания указывает на патологию уретры, в конце мочеиспускания — патологию мочевого пузыря.
В соответствии с обновленными рекомендациями ICCS, в детском возрасте выделяют следующие виды нарушений мочеиспускания, проявляющиеся в дневное время: дисфункция мочевого пузыря и кишечника, гиперактивный мочевой пузырь, задержка мочеиспускания, гипоактивный мочевой пузырь, дисфункциональное мочеиспускание, инфравезикальная обструкция, стрессовое недержание мочи, вагинальный рефлюкс, недержание при смехе, чрезвычайно частое мочеиспускание только в дневное время, дисфункция шейки мочевого пузыря [5].
Наиболее распространенными нарушениями мочеиспускания в дневное время у детей, заставляющими родителей обратиться за медицинской помощью, являются гиперактивный мочевой пузырь и дисфункциональное мочеиспускание.
Гиперактивный мочевой пузырь — это синдром, включающий ургентность мочеиспускания в сочетании с поллакиурией (частое мочеиспускание) и никтурией, с недержанием мочи или без такового. При этом отсутствуют признаки инфекции мочевых путей или другой очевидной патологии. Перечисленные признаки до уточнения диагноза рассматривают как проявление синдрома императивного мочеиспускания [6, 7]. Термин «гиперактивный мочевой пузырь» заменил такие применяемые прежде термины, как «гиперрефлекторный мочевой пузырь», «нестабильный мочевой пузырь» и др.
Дисфункциональное мочеиспускание вызвано дискоординацией между детрузором и наружным уретральным сфинктером/мышцами тазового дна у неврологически нормального ребенка [5]. Ребенок с дисфункциональным мочеиспусканием обычно сжимает наружный уретральный сфинктер или мышцы тазового дна во время мочеиспускания (удерживающие позы) с наличием или без прерывистого мочеиспускания, и демонстрирует паттерн «стаккато» на урофлоуметрической кривой [8, 9]. Термин «дисфункциональное мочеиспускание» применяется вместо ранее используемого термина «детрузорно-сфинктерная диссинергия».
В соответствии с рекомендациями Европейской ассоциации детских урологов и ICCS, при первичном обследовании детей с нейрогенной дисфункцией нижних мочевых путей используются неинвазивные методы, а именно: ведение дневника мочеиспусканий, проведение ультразвукового исследования (УЗИ) почек и мочевого пузыря с определением остаточной мочи, урофлоуметрии [5, 10]. Проведение инвазивного уродинамического исследования рекомендуется в случае неэффективности традиционной эмпирической терапии в течение 3–6 мес. [11, 12].
Терапевтическая тактика при нейрогенной дисфункции нижних мочевых путей определяется патогенетическими механизмами развития заболевания. Известно, что более 60 % расстройств мочеиспускания имеют функциональный характер [8]. Основная роль в патогенезе принадлежит расстройству регуляции гипоталамо-гипофизарной системы, вегетативной нервной системы на любом из ее уровней, несинхронному развитию и задержке созревания систем регуляции акта мочеиспускания, а именно высших центров и проводящих путей [4, 8, 13–15].
Лечение дневной дисфункции нижних мочевых путей, согласно рекомендациям ICCS и Европейской ассоциации детских урологов, начинают с наименее инвазивных методов. Прежде всего это касается стандартной уротерапии, к которой относится система когнитивных методов, направленных на помощь семье в соблюдении индивидуально подобранного графика потребления жидкости и мочеиспусканий, режима дня, правильности ведения дневника регистрации частоты мочеиспусканий и стула. Первым шагом в достижении полного опорожнения мочевого пузыря при дисфункциональном мочеиспускании является обучение детей правильному положению на унитазе и позе во время мочеиспускания. Вне зависимости от пола ребенку предлагается мочиться сидя на унитазе, который должен иметь детский стульчак и скамеечку для опоры ног. Спина ребенка должна быть прямой с небольшим наклоном кпереди, ноги — разведены для обеспечения большей релаксации мышц тазового дна. Ребенка следует приучать считать во время и после мочеиспускания или петь, так как эти действия предотвращают напряжение мышц тазового дна при мочеиспускании [5, 10].
Дополнительно к уротерапии назначают нейромодуляцию. Это лечение, которое уменьшает симптомы дисфункции нижних мочевых путей или восстанавливает их функцию посредством центральной и/или периферической стимуляции нервной деятельности [5]. В мочевом пузыре, шейке мочевого пузыря, уретре обнаружено много рецепторов для различных трансмиттеров и нейромодуляторов: АТФ, субстанция P, ГАМК-рецепторы, нейропептид Y и др., которые оказывают стимулирующее действие на гладкую мускулатуру мочевого пузыря [4]. Имеется несколько исследований, показавших эффективность назначения при нейрогенной дисфункции нижних мочевых путей у детей ноотропных препаратов (пикамилон, пантогам), улучшающих деятельность центральной нервной системы и снижающих активность детрузора путем воздействия на ГАМК-рецепторы мочевого пузыря [16–18].
У 30–40 % детей с дисфункцией нижних мочевых путей имеют место различные коморбидные состояния, в том числе поведенческие расстройства (психоневрологические состояния): синдром дефицита внимания с гиперактивностью (СДВГ), депрессивные и тревожные расстройства [5, 19]. Лечение сопутствующих поведенческих и эмоциональных расстройств у детей с нейрогенной дисфункцией нижних мочевых путей может повысить приверженность к терапии дисфункции нижних мочевых путей и улучшить ее результаты [19].
В связи с вышеизложенным обращает на себя внимание препарат ноофен (фенибут), который является производным ГАМК (γ-аминомасляная кислота) и фенилэтиламина. Особенностью ноофена является комбинация свойств ноотропного и транквилизирующего препарата. Активация ГАМКергических процессов в коре головного мозга обусловливает ноотропный и антигипоксический эффекты. Воздействием на нейроны гипоталамуса, координирующего деятельность вегетативной нервной системы, объясняется вегетостабилизирующее действие. Транквилизирующий эффект обусловлен влиянием на лимбико-ретикулярный комплекс. Бета-фенилэтиламин способствует высвобождению и торможению обратного захвата дофамина, что определяет антиастеническое и психостимулирующее действие препарата [20].
Ряд исследователей доказали высокую клиническую эффективность препарата ноофен при СДВГ у детей [21, 22], что объяснялось транквилизирующим действием препарата, связанным с его способностью усиливать контролирующую функцию корковых структур над подкорковыми за счет улучшения ГАМКергической нейромедиаторной передачи. Другие исследователи показали эффективность препарата ноофен у детей с психовегетативным синдромом и вегетативной дисфункцией [23–25], первичным энурезом [26]. Можно предположить, что стимуляция препаратом ноофен ГАМК-рецепторов в коре головного мозга, гипоталамусе, а также в мочевом пузыре, шейке мочевого пузыря, уретре приведет к положительному влиянию при нейрогенной дисфункции нижних мочевых путей у детей. Принимая во внимание высокий риск развития инфекции мочевой системы в связи с нарушением уродинамики при нейрогенной дисфункции нижних мочевых путей, обоснована низкодозовая профилактическая терапия антимикробным препаратом фурамаг, который имеет широкий спектр действия в отношении многих уропатогенных микроорганизмов.
Цель исследования — оценить эффективность и безопасность фармакологической коррекции нейрогенной дисфункции нижних мочевых путей у детей препаратом ноофен в сочетании с профилактической дозой препарата фурамаг.
Задачи исследования:
1. Изучить клинические и уродинамические особенности проявлений нейрогенной дисфункции нижних мочевых путей у детей на фоне лечения препаратом ноофен в сочетании с профилактической дозой препарата фурамаг.
2. Установить состояние психоневрологического статуса у детей с нейрогенной дисфункцией нижних мочевых путей и динамику на фоне лечения препаратом ноофен.
3. Оценить эффективность и безопасность лечения детей с нейрогенной дисфункцией нижних мочевых путей препаратом ноофен в сочетании с профилактической дозой препарата фурамаг.
Материалы и методы
Под наблюдением находились 24 ребенка (18 девочек и 6 мальчиков) в возрасте от 5 до 8 лет с жалобами на учащенное мочеиспускание в дневное время. Средний возраст составил 6,33 ± 0,21 года. Наличие подписанной родителями пациента формы информированного согласия до проведения процедур исследования и назначения терапии было обязательным. Критерии исключения: наличие инфекции мочевых путей, врожденной патологии мочевой системы, органического поражения центральной нервной системы.
Всем больным проводилось уронефрологическое и психоневрологическое обследование, которое выполняли детский нефролог, детский уролог, детский невролог. Оценивались данные анамнеза заболевания, соматического статуса, лабораторные методы (общий анализ мочи, бактериологический посев мочи на флору). Для оценки уродинамики нижних мочевых путей изучались дневник мочеиспусканий (регистрация ритма спонтанных мочеиспусканий — время и количество выделенной мочи, эпизоды недержания мочи, императивных позывов, энуреза), ультразвуковое исследование почек и мочевого пузыря, урофлоуметрия (УФМ).
Оценку дневника мочеиспусканий проводили по квалиметрической таблице Е.Л. Вишневского, отражающей в баллах частоту мочеиспусканий, императивных позывов, императивного недержания мочи, энуреза [27]. Балльная оценка предусматривала три степени тяжести расстройств мочеиспускания — легкую (2–7 баллов), среднюю (8–19 баллов) и тяжелую (20–32 балла) [27]. Нормальный объем мочевого пузыря рассчитывали по формуле V = 30 + 30n, где V — функциональная емкость пузыря, n — возраст в годах.
При проведении УЗИ мочевого пузыря оценивались толщина и эхогенность стенки мочевого пузыря, объем остаточной мочи после микции.
Уродинамическое исследование выполнялось на урофлоуметре «Поток К» (Украина) с программным обеспечением, позволяющим проводить автоматическое вычисление урофлоуметрических параметров и построение урофлоуметрических номограмм. В связи с наличием небольших объемов мочевого пузыря у обследованных детей оценивались только объем мочеиспускания, максимальная и средняя скорость потока мочи (Qmax — максимальной, Qmid — средней), тип урофлоуметрической кривой. Тип урофлоурограммы определялся в соответствии с рекомендациями ICCS [5].
С учетом значимости психоневрологических расстройств у обследованных пациентов изучался неврологический статус, проводилась оценка симптомов СДВГ в соответствии с критериями классификации DSM-IV-TR, а именно — нарушение внимания, гиперактивность и импульсивность [28].
Исследования проводили до лечения, спустя 2 недели и по окончании курса лечения, длительность которого составила 4 недели.
После всех исследований и установления диагноза детям назначалось лечение, которое включало стандартную уротерапию и фармакотерапию: препараты ноофен и фурамаг, витамины группы В. Доза препарата ноофен детям в возрасте 5–7 лет составила 1 порошок (100 мг) или 1/2 табл. (250 мг) 3 раза в день, 8 лет — 1 табл. (250 мг) 3 раза в день (с последним приемом не позднее 17—18 ч). Профилактическая доза препарата фурамаг (капс. 0,25) 1–2 мг/кг принималась 1 раз на ночь. При наличии запоров назначали препарат лактулозы, при необходимости — глицериновые суппозитории.
Эффективность лечения оценивали по динамике клинических симптомов заболевания согласно рекомендациям ICCS [5]. Чувствительность к терапии рассматривалась как уменьшение выраженности признаков дисфункции нижних мочевых путей более чем на 50 %: полный ответ — на 90–100 %, частичный ответ — на 50–89 %. Отсутствие ответа определялось как уменьшение выраженности симптомов болезни на 0–49 %. Кроме того, оценивалась динамика уродинамических параметров и психоневрологического статуса. Проведена также оценка переносимости и безопасности препаратов ноофен и фурамаг.
Обработка полученных данных осуществлялась на базе статистического пакета программ IBM SPSS Statistics v. 23. Методы описательной статистики количественных переменных включали арифметическое среднее (М), медиану (Me), стандартную ошибку среднего значения (m) и интерквартильный размах (Q1–Q3). Проверка нормальности распределения количественных выборок проводилась с использованием критерия Колмогорова — Смирнова. Наличие зависимости между порядковыми показателями определялась при помощи таблиц сопряженности (χ2-критерия). Для оценки значимости динамики показателей в процессе лечения использовался критерий знаковых рангов Вилкоксона (в случае количественной шкалы) и критерий Мак-Немара (в случае номинальной шкалы).
Результаты и обсуждение
Основным клиническим проявлением у всех обследованных детей было учащенное мочеиспускание в дневное время. Частота мочеиспусканий достигала в среднем 16,2 раза в сутки. Кроме того, императивные позывы наблюдались у 18 (75,0 %) из 24 обследуемых, императивное недержание мочи — у 6 (25,0 %), энурез — у 10 (41,6 %) больных. Дисфункция нижних мочевых путей отмечалась у большинства детей (18 — 75,0 %) в среднем 4,6 мес., у остальных (6 — 25,0 %) — давностью от 6 мес. и более.
На основании клинических данных 15 (62,5 %) детям поставлен диагноз «гиперактивный мочевой пузырь» [29], хотя у них по результатам УФМ не выявлено характерных изменений для гипертонуса детрузора, а именно увеличения максимальной и средней скоростей потока мочи, что, скорее всего, связано с небольшим объемом мочеиспускания. Это подтверждают и другие исследователи [12]. У остальных 9 (37,5 %) детей получена урофлоуметрическая кривая в виде стаккато.
В результате клинического и уродинамического обследования до лечения были диагностированы следующие виды дисфункций нижних мочевых путей: гиперактивный мочевой пузырь — у 15 (62,5 %), дисфункциональное мочеиспускание — у 9 (37,5 %) детей.
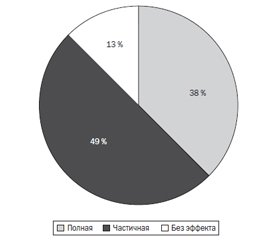
По окончании лечения нейрогенной дисфункции нижних мочевых путей положительная динамика клинической картины отмечена у 21 (87 %) пациента, из них полное выздоровление наблюдалось у 9 (38 %), частичное улучшение — у 12 (49 %) детей (рис. 1).
/27.jpg)
Отсутствие эффекта от проводимой терапии отмечено у 3 (13 %) детей. Анализ анамнестических данных этих пациентов показал, что они родились недоношенными в сроке 28–30 недель гестации с низкой массой тела, в асфиксии тяжелой степени. В течение первого года жизни наблюдались по поводу перинатальной энцефалопатии, что позволяет предположить задержку созревания систем регуляции акта мочеиспускания. Возраст детей в период обследования составлял 5 лет. Они имели снижение нутритивного статуса и запоры. Степень расстройств мочеиспускания по шкале Вишневского соответствовала тяжелой степени у 2 детей, средней степени — у 1 ребенка. При УЗИ выявлено неполное опорожнение мочевого пузыря с большим остаточным объемом мочи (90–120 мл). По данным урофлоуметрии диагностировано дисфункциональное мочеиспускание. Таким образом, учитывая особенности клинической и уродинамической картины, а также отсутствие эффекта от стартовой терапии, этим детям показано специальное инвазивное урологическое обследование для уточнения вида дисфункции нижних мочевых путей [30].
Нами проведена оценка динамики клинических и уродинамических признаков дисфункции нижних мочевых путей на фоне терапии у 21 ребенка с полной или частичной эффективностью (табл. 1). Изменение частоты мочеиспусканий характеризовалось значительным снижением уже в первые две недели лечения: количество дневных мочеиспусканий уменьшилось с 16,00 ± 1,35 до 11,10 ± 0,57 (р < 0,001). По окончании терапии частота мочеиспусканий составляла 8,90 ± 0,35 (р < 0,001). Значительная положительная динамика наблюдалась в частоте ургентных позывов к мочеиспусканию, которые практически ликвидировались к завершению курса лечения. Частота ургентного недержания мочи уменьшалась на фоне терапии и к 28-му дню лечения не зафиксирована ни у одного пациента. Отмечена положительная динамика изменения частоты эпизодов энуреза: до начала лечения он отмечался у 7 (33,3 %) детей, через 14–28 дней терапии — у 3 (57 %) больных (табл. 2). Интегральный показатель клинических признаков нейрогенной дисфункции нижних мочевых путей, оцененный квалиметрической шкалой Вишневского, показал уменьшение тяжести расстройств мочеиспускания на 9,6 балла (р < 0,001) к окончанию терапии (табл. 1).
/28.jpg)
Отмечена положительная динамика изменения эффективного объема мочевого пузыря (это объем утренней порции мочи в дневнике мочеиспусканий). Как видно из табл. 1, прирост эффективного объема отмечался в течение всего срока наблюдения. После курса терапии эффективный объем мочевого пузыря увеличился на 38,9 % (р < 0,001), по отношению к возрастным нормативам — с 48,30 ± 3,46 % до 67,20 ± 3,79 % (р < 0,001). Подобная положительная динамика отмечена также касательно среднего эффективного объема мочевого пузыря (табл. 1).
Анализ данных УФМ показал положительную динамику на фоне терапии уродинамических показателей у обследованных пациентов (табл. 3). Отмечено существенное увеличение объема мочеиспускания (на 35,1 %, р < 0,001), максимальной объемной скорости потока (на 28,8 %, р < 0,002) и средней объемной скорости потока мочи (на 53,3 %, р < 0,001).
На фоне терапии положительным образом изменилась урофлоуметрическая кривая. У 9 детей, имевших кривую потока в виде стаккато с количеством пиков до лечения в среднем 2,00 ± 0,79, после лечения ликвидировалась прерывистость мочеиспускания и не регистрировались пики (р < 0,03). Еще у 9 из 15 детей с платообразной или прерывистой урофлоуметрической кривой через 28 дней терапии последняя приобрела вид колокола.
При УЗИ внутренний контур мочевого пузыря у всех обследованных был ровным и четким. Толщина стенки мочевого пузыря была не изменена и не превышала 4 мм. Количество остаточной мочи у детей до лечения в среднем составило 27,40 ± 6,74 (25; 0–40), после лечения стало существенно меньше — 9,30 ± 2,47 (0; 0–20) (р < 0,003) и соответствовало нормальным значениям.
Общий анализ мочи у обследованных детей был в норме. Бактериологический посев мочи оказался положительным у 3 пациентов, выделен Enterococcus faecalis 105, что было расценено как асимптоматическая бактериурия. После завершения терапии бактериологический посев мочи у всех пациентов был отрицательным. За время наблюдения не отмечено ни одного случая инфекции мочевых путей.
Следующим этапом исследования была оценка динамики психоневрологического статуса у обследованных детей с полной и частичной эффективностью терапии нейрогенной дисфункции нижних мочевых путей. Проведенная индивидуальная оценка симптомов нарушения внимания и гиперактивности/импульсивности не выявила 6 из 9 симптомов невнимательности
и/или импульсивности/гиперактивности, необходимых для диагностики СДВГ [28]. При этом отдельные признаки СДВГ выявлялись у большинства детей.
Динамика частоты симптомов нарушения внимания у обследованных детей на фоне терапии представлена в табл. 4.
Как видно из табл. 4, до лечения преобладающими являлись такие симптомы, как «часто теряет различные предметы», «отвлекается от начатого занятия». Через 2 недели терапии препаратом ноофен число детей с симптомом «часто теряет различные предметы» достоверно уменьшилось (р < 0,03), а к окончанию терапии такой признак наблюдался лишь у трети пациентов (р < 0,004). Такая же положительная динамика, однако более выраженная после 4 недель терапии, отмечена и у показателя «отвлекается от начатого занятия». Более чем у половины детей до лечения наблюдался симптом «ребенок не слушает обращенную к нему речь». После лечения данный симптом наблюдался значительно реже, отмечаясь лишь у 3 пациентов (р < 0,004). Таким образом, после терапии препаратом ноофен в течение 4 недель три из девяти признаков нарушения внимания стали отмечаться достоверно реже.
Согласно полученным результатам, значительное улучшение по сравнению с исходным состоянием на фоне терапии препаратом ноофен наблюдалось в отношении синдрома гиперактивности и импульсивности (табл. 5). У пяти из девяти признаков данного синдрома отмечена положительная динамика к завершению терапии, наиболее выраженная в проявлениях гиперактивности. Так, если до начала терапии у 2/3 детей наблюдался такой признак, как «не может сидеть спокойно», то к 28-му дню лечения таких детей было лишь 28,6 %. По завершении наблюдения практически в 2 раза уменьшилась частота следующих симптомов: «ребенок все время в движении, как заведенный», «избыточно общителен, болтлив», в 3 раза — «слишком много бегает». В синдроме импульсивности существенная положительная динамика отмечена у одного показателя — «мешает другим».
/29.jpg)
Таким образом, полученные результаты свидетельствуют о корригирующем влиянии препарата ноофен на симптомы невнимательности и в большей степени гиперактивности/импульсивности у детей с нейрогенной дисфункцией нижних мочевых путей. Очевидно, для более значимого регресса симптомов СДВГ необходим более продолжительный курс терапии, включая психокоррекцию.
Детский невролог отметил эффективность терапии препаратом ноофен у 15 (62,5 %) из 24 больных. Проведено сравнение эффективности терапии дисфункции нижних мочевых путей и коррекции психоневрологического статуса (табл. 6). Выяснилось, что у детей с положительной динамикой симптомов невнимательности и гиперактивности/импульсивности наблюдалась частичная или полная эффективность терапии дисфункции нижних мочевых путей. Значимость связи эффективности лечения дисфункции нижних мочевых путей и психоневрологической положительной динамики по χ2-критерию составила р < 0,004. Таким образом, учитывая определенную роль психогенного фактора в этиологии нейрогенной дисфункцией нижних мочевых путей, клиническое улучшение на фоне терапии препаратом ноофен можно объяснить не только коррекцией психоневрологического статуса, но и стимуляцией структур мозга, вегетативной нервной системы, отвечающих за регуляцию акта мочеиспускания.
/30.jpg)
В данном исследовании не зарегистрировано ни одного серьезного нежелательного явления при приеме препаратов ноофен и фурамаг, что свидетельствует о благоприятном профиле безопасности данных лекарственных средств. Все пациенты и родители отметили хорошую переносимость лечения.
Выводы
1. Лечение нейрогенной дисфункции нижних мочевых путей у детей препаратом ноофен в сочетании с профилактической дозой препарата фурамаг является достаточно эффективным методом. Положительная динамика клинических и уродинамических показателей отмечена у 21 (87 %) пациента, из них полное выздоровление наблюдалось у 9 (38 %), частичное улучшение — у 12 (49 %) детей.
2. Частота мочеиспусканий на фоне терапии уменьшилась в первые две недели лечения с 16,00 ± 1,35 до 11,10 ± 0,57 (р < 0,001), через 28 дней — до 8,90 ± 0,35 (р < 0,001). К завершению курса лечения ургентные позывы к мочеиспусканию практически ликвидировались, недержание мочи не отмечалось, частота энуреза уменьшилась, а эффективный объем мочевого пузыря увеличился на 38,9 % (р < 0,001). Показана положительная динамика уродинамических показателей: увеличение объема мочеиспускания (на 35,1 %, р < 0,001), максимальной (на 28,8 %, р < 0,002) и средней объемной скорости потока мочи (на 53,3 %, р < 0,001).
3. Показано корригирующее влияние препарата ноофен на сочетанные симптомы невнимательности и в большей степени гиперактивности/импульсивности у 15 (62,5 %) детей с нейрогенной дисфункцией нижних мочевых путей. При этом установлена значимость связи эффективности лечения дисфункции нижних мочевых путей и психоневрологической положительной динамики (р < 0,004).
4. Отмечена высокая безопасность препаратов ноофен и фурамаг в виде хорошей переносимости и отсутствия побочных эффектов.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
/27.jpg)

/28.jpg)
/29.jpg)
/30.jpg)