Долгое время амилоидоз рассматривали как одно заболевание, характеризующееся метаболическим дефектом. На сегодняшний день под амилоидозом понимают группу заболеваний, для которых типично отложение в тканях и органах фибриллярного гликопротеида амилоида, который отличается от других фибриллярных протеидов тканей способностью к двойному лучепреломлению в поляризованном свете из-за кросс-b-складчатой конформации.
Современная классификация амилоидоза выделяет около 30 его клинических форм, наиболее распространенные из которых — системные и локальные. Белки — предшественники амилоида — существенно различаются по своим физиологическим функциям, их синтез регулируется разными факторами. Так, формирование AL-типа амилоидоза является результатом плазмоклеточной дискразии с продукцией амилоидогенных легких цепей иммуноглобулинов патологическим клоном плазмоцитов в костном мозге. При АА-типе депозиция амилоида обусловлена высокой продукцией амилоидогенных белков острой фазы воспаления SAA, что имеет место при ревматоидном артрите, остеомиелите, туберкулезе, опухолях, периодической болезни [1].
В зависимости от этиологии и особенностей течения выделяют генетически обусловленный и приобретенный амилоидоз. Наиболее распространенными типами системного заболевания являются амилоидоз с легкими цепями (AL), за счет воспаления (AA), диализный амилоидоз (Aβ2M), наследственный и амилоидоз пожилого возраста (ATTR), а также при миеломной болезни и APUD-амилоидоз.
Поражение почек при амилоидозе — один из наиболее неблагоприятных факторов течения заболевания. Установлено, что амилоид откладывается в клубочках почек вначале в мезангии, затем вдоль базальной мембраны. При вовлечении почек не наблюдается полного параллелизма между клиническими проявлениями и массивностью отложения амилоида в клубочках. Уровень потери белка с мочой зависит не столько от величины отложений амилоида, сколько от деструкции ножек и самих клеток подоцитов. Если отложение амилоида в клубочках является причиной протеинурии, то вовлечение интерстиция приводит к раннему снижению функции почек.
Суточная потеря белка при АА-амилоидозе более выражена, чем при других типах амилоидоза. По данным B.P. Hazenberg и M.H. Rijswijk, наличие белка в моче наблюдается в 70 % случаев АА-амилоидоза, в то время как снижение функции почек встречается с частотой 18 %. Клинической особенностью амилоидной нефропатии является сохраняющийся нефротический синдром (НС) при развитии почечной недостаточности, а также последовательный переход стадии умеренной протеинурии в НС и почечную недостаточность. НС при амилоидозе протекает со всеми классическими проявлениями: массивная протеинурия, гипоальбуминемия, гиперхолестеринемия, отеки. Отеки развиваются довольно рано и приобретают стойкий характер.
Разработка иммунобиологических лекарственных препаратов произвела революцию в терапевтическом подходе при хронических ревматических заболеваниях, особенно у пациентов, устойчивых к стандартному лечению (табл. 1). Использование этих препаратов действительно позволило улучшить прогноз при таких ревматических заболеваниях, как ревматоидный артрит, псориатический артрит, анкилозирующий спондилит (АС), системная красная волчанка, и получить клиническую ремиссию.
Приводим клиническое наблюдение, иллюстрирующее течение заболевания и эффективность лечения антагонистом фактора некроза опухоли альфа адалимумабом [2] у пациента с вторичным амилоидозом АА на фоне активного анкилозирующего спондилита.
Пациент Ф., 40 лет, обратился в медицинскую практику профессора Д. Иванова 20.03.2017 г. с жалобами на боли в спине, прогрессирующую общую слабость и утомляемость, трудности при ходьбе, выраженные отеки нижних конечностей, ноющие боли в спине.
Анамнез болезни. Считает себя больным с 2000 года, когда появились боли и ограничения движений суставов нижних конечностей, скованность в поясничной области. Лечился по месту жительства у ревматолога и ортопеда. Пациенту были рекомендованы рентгенография коленных и тазобедренных суставов, магнитно-резонансная томография грудного и поясничного отделов позвоночника. В общем анализе крови (ОАК) — анемия, скорость оседания эритроцитов (СОЭ) — 40 мм/ч. Общий анализ мочи (ОАМ) — без особенностей. Биохимический анализ крови: С-реактивный белок (СРБ) — ++, ревматоидный фактор (РФ) — отрицательный, HBs-Ag — отрицательный; иммуноглобулины класса G к неденатурированной ДНК отрицательные; иммунофенотипирование лимфоцитов периферической крови выявило абсолютное и относительное снижение В-лимфоцитов, относительное повышение натуральных киллеров. Рентгенография грудного и поясничного отделов позвоночника патологии не выявила, рентгенография костей таза — крестцово-подвздошное сочленение справа четко не прослеживается, слева крестцово-подвздошное сочленение видно прерывисто, представляется суженным. Ультразвуковое исследование внутренних органов — гепатомегалия. Консультирован ревматологом, был поставлен диагноз «анкилозирующий спондилоартрит (болезнь Бехтерева), хроническое течение, активность II ст., ФН II–III, односторонний сакроилеит I–II ст.». Согласно рекомендациям ревматолога, получал базисную терапию в виде метотрексата 7,5 мг в неделю с фолиевой кислотой 2 мг/сут, небольшую дозу глюкокортикоидов. В 2003 году после консультации в ревматологическом отделении г. Киева в связи с прогрессированием жалоб и рентгенологической картины был назначен колхицин в дозе 1 мг 2 раза в сутки в течение 6 месяцев с положительной динамикой. Последующие 14 лет несистемно получал лечение у ревматолога.
Состояние пациента резко ухудшилось в феврале 2017 года, когда появились отеки нижних конечностей и белок в моче. Консультирован в НИИ нефрологии, где заподозрено развитие вторичной нефропатии (АА-амилоидоз?) на фоне болезни Бехтерева. Биопсия десны не подтвердила диагноз амилоидоза. Однако состояние пациента продолжало ухудшаться. Обращало на себя внимание значительное похудение, гипотензия 80/50 мм рт.ст., диарея, нередко с прожилками крови. Помимо периферических отеков, асцита обнаружена жидкость в перикарде, плевральной полости с обеих сторон. Лабораторные данные: в ОАК — анемия 2-й степени, СОЭ — 76 мм/ч. ОАМ: протеинурия — 3,3 г/л. Биохимический анализ крови: гипопротеинемия — общий белок — 40 г/л, СРБ — ++, РФ — отрицательный, креатинин — 125 ммоль/л, мочевина — 9 ммоль/л. Была проведена биопсия почки, гистологическое исследование подтвердило диагноз вторичного амилоидоза.
Учитывая мнения ревматологов и данные нефробиопсии, заключительный диагноз сформулирован следующим образом.
Основной: анкилозирующий спондилоартрит (болезнь Бехтерева), хроническое течение, активность III ст., ФН III, двусторонний сакроилеит (Rg III–IV ст.).
Осложнение: вторичный системный амилоидоз — поражение почек (нефротический синдром, анасарка: периферические отеки, асцит, гидроторакс). Кахексия. Вторичная анемия.
Пациенту была назначена посиндромная терапия.
Обратился в «Медицинскую практику проф. Д. Иванова» в связи с поиском активного лечения по установленному диагнозу.
Повторный анализ нефробиоптата был проведен проф. Дядык Е.А.
Заключение нефробиопсии
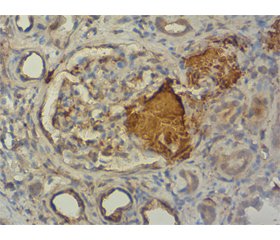
Описание биопсии: в препарате в биоптатах до 16 клубочков, 5 склерозированы полностью, в 4 клубочках очаговое отложение бесструктурного розового (окраска гематоксилином и эозином) материала в клубочках в зонах мезангиума, распространяется на часть капиллярных петель, в клубочках очаговая слабо выраженная пролиферация мезангиальных клеток, фокально-сегментарное неравномерно выраженное утолщение части периферических капиллярных петель (рис. 1), в 3 клубочках фиброзно-клеточные полулуния, занимающие до 1/3 периметра, очаговые точечные сращения периферических капиллярных петель с капсулой Боумена, очаговое неравномерно выраженное, в части клубочков резко выраженное утолщение и расщепление базальной мембраны капсулы Боумена.
В канальцах дегенеративные изменения (зернистая, очагово гиалиново-капельная и вакуольная дистрофии), некроз групп клеток, крупные очаги атрофии с утолщением и расщеплением тубулярной базальной мембраны. Честь канальцев резко кистозно расширена, в них уплощенный атрофированный эпителий. В просвете части канальцев белковые массы, гиалиновые цилиндры. В строме очаги интерстициального фиброза, очаговые разного размера лимфогистиоцитарные инфильтраты (рис. 2). В сосудах мелкого калибра резко выраженное утолщение стенки за счет отложения бесструктурных розовых масс, в сосудах среднего калибра — неравномерно выраженное утолщение стенки и сужение просвета за счет эластофиброза и склероза, очагово отмечается дисмукоидоз (рис. 2).
/83.jpg)
Окраска конго красным — частично в склерозированных клубочках, в зонах очагового склероза клубочков, в части утолщенных капиллярных петель, очагово в утолщенной базальной мембране капсулы Боумена, в строме, в стенках сосудов разного калибра определяется отложение амилоида (кирпично-красные массы) (рис. 3).
Иммуноморфологическое исследование
IgA: в клубочках фокально-сегментарные гранулярные депозиты вдоль части капиллярных петель от + до ++, в мезангиуме до +, в зонах отложения амилоида депозитов нет, очаговые депозиты в строме, в перитубулярных капиллярах, в клеточных инфильтратах до ++.
IgG: в клубочках фокально-сегментарные гранулярные депозиты вдоль части капиллярных петель до +, в зонах отложения амилоида депозитов нет, очаговые депозиты в строме между канальцами, в перитубулярных капиллярах, в зонах клеточных инфильтратов до ++, в эпителии части канальцев депозиты в виде зернистости до +.
IgM: в клубочках фокально-сегментарные гранулярные депозиты вдоль части капиллярных петель от + до ++, в мезангиуме до +, в зонах отложения амилоида депозитов нет, очаговые депозиты в строме между канальцами, в перитубулярных капиллярах, в клеточных инфильтратах до +++.
С3: в клубочках фокально-сегментарные гранулярные депозиты вдоль части капиллярных петель от + до ++, в мезангиуме до +, в зонах отложения амилоида депозитов нет, очаговые депозиты в строме между канальцами, в перитубулярных капиллярах, в клеточных инфильтратах до ++, в эпителии части канальцев в виде зернистости депозитов от + до ++, у части сосудов среднего калибра очаговый депозит в стенке.
CD20: от умеренного до большого количества В-лимфоцитов в клеточных инфильтратах разной локализации.
CD68: в клубочках — единичные макрофаги, много макрофагов в клеточных инфильтратах разной локализации.
АА-амилоид: выраженная позитивная окраска во всех клубочках в зонах отложения амилоида, в утолщенных капиллярных петлях, в мезангиальной зоне, в базальной мембране части канальцев, очагово в строме, в стенках сосудов (рис. 4).
κ-легкие цепи иммуноглобулина — в клубочках в очагах отложения амилоида окраски нет или следовая, в эпителии части канальцев депозитов в виде зернистости до ++, в клеточных инфильтратах очаговые депозиты до ++, в сосудах нет окраски.
λ-легкие цепи иммуноглобулинов — в клубочках в зонах отложения амилоида окраски нет, в эпителии канальцев депозитов в виде зернистости до ++, в эпителии части канальцев депозитов в виде зернистости до ++, в клеточных инфильтратах очаговые депозиты до ++ (рис. 5).
Заключение: данные патоморфологического, гистохимического, иммуногистохимического исследований свидетельствуют в пользу АА-амилоидоза (вторичного) с выраженными тубулоинтерстициальными изменениями.
Диагноз пациента на момент обращения в клинику: «анкилозирующий спондилоартрит (болезнь Бехтерева), хроническое течение, активность III ст., ФН III, двусторонний сакроилеит (Rg III–IV ст.). Нефротический синдром, хроническая болезнь почек (ХБП) 4-й стадии (рСКФ — 19,8 мл/мин), вторичный АА-амилоидоз почек, железодефицитная анемия 3-й ст. АГ 0–1-й ст.».
После получения информированного согласия пациенту была предложена иммунобиологическая терапия: адалимумаб 40 мг 1 раз в неделю первые 2 месяца, затем 40 мг 1 раз в 2 недели, кардосал 10 мг в сутки на ночь, плавикс 75 мг в сутки, либера 1 таблетка 3 раза в сутки, кетостерил 3 таблетки 3 раза в сутки, аденурик 40 мг 1 раз в сутки, альфа Д3-Тева 0,5 мкг на ночь, мальтофер фол 1 таблетка 1 раз в сутки, аранесп 50 мкг 2 раза в месяц. После назначенного лечения в течение 6 месяцев показатели креатинина и мочевины у пациента стали постепенно улучшаться, рCКФ достигла 25,6 мл/мин, после чего были отменены кетостерил и либера. Было принято решение о продолжении терапии, которая к настоящему времени не прекращена. К концу третьего года лечения адалимумабом рСКФ достигла значения 60 мл/мин, полностью прошли болевые ощущения в спине, анемия сохраняется в пределах 110–120 г/л. Выполняет вышепредставленные назначения без изменений.
Адалимумаб не повлиял на генеративную функцию пациента, через 2 года после начала лечения у него родилась двойня.
Данный клинический случай с описанием длительного периода (трех лет) непрерывного лечения адалимумабом подтверждает стойкое улучшение показателей СОЭ, СРБ со снижением протеинурии и восстановлением функции почек. В целом отмечено улучшение, что сопровождалось нормализацией белка SAA, исчезновением нефротического синдрома и увеличением клиренса креатинина. Нормализация уровней SAA в сыворотке путем адекватного подавления основного заболевания определяет прогноз амилоидоза АА [1]. Использование адалимумаба при болезни Бехтерева является известной опцией. Однако восстановление функции почек при ХБП 4-й стадии на фоне лечения анкилозирующего спондилоартрита адалимумабом в литературе нами не обнаружено и представляется полезным.
/85.jpg)
Стабилизаторы образования фибрилл, ингибиторы протеасом и иммунотерапия показали многообещающие результаты в улучшении результатов у пациентов с системным амилоидозом, и эти новые алгоритмы будут эффективно объединены с современными методами лечения, основанными на химиотерапевтических схемах [3].
В данном случае пациент страдает более 20 лет, в диагностическом поиске ревматологов звучали диагнозы ревматоидного артрита, псориатического артрита, исключали неспецифический язвенный колит. Возможности ранее назначаемых препаратов были ограничены, и результат его состояния к 2017 году был обусловлен как личной дисциплиной в выполнении назначений ревматологов, так и ограниченными возможностями терапии. Использование адалимумаба было скорее опцией отчаяния, хотя и имело под собой патогенетическую основу [3]. Фактически адалимумаб погасил активность основного заболевания, дав возможность компенсации почечной функции.
Таким образом, развитие АА-амилоидоза может быть приостановлено, а отложение амилоида, возможно, является контролируемым процессом за счет подавления активности основного ревматологического заболевания и компенсации со стороны почек при наличии у них такой возможности, спрогнозировать которую достаточно сложно.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
Коментар спеціаліста до статті Іванова Д.Д., Федоренко О.Г., Дядик О.О.
«Случай вторичного AA-амилоидоза при болезни Бехтерева: успешная 3-летняя терапия адалимумабом»
Значне поширення імунозапальних ревматичних захворювань залишається актуальною медико-соціальною проблемою як в світі, так і в Україні. Ревматичні захворювання з вісцеральними проявами/ускладненнями, зокрема з ураженням нирок або формуванням ниркових ускладнень, становлять потенційну загрозу як ускладнення перебігу хвороби, так і її прогнозу, від якого значною мірою залежить тривалість життя хворого. На сьогодні кількість таких хворих збільшується, що робить цю проблему ще більш актуальною.
При анкілозуючому спондиліті (АС) третина пацієнтів ніколи не досягає ремісії, а частота ремісії без ліків не перевищує 10–15 %.
Часто при АС розвивається АА-амілоїдоз нирок, клініко-лабораторні характеристики якого не мають особливостей, притаманних цій хворобі. Вторинний амілоїдоз нирок типу АА відноситься до загрозливих для життя ускладнень перебігу АС.
АА-амілоїдоз як ускладнення АС розвивається у випадках тривалого активного суглобового процесу. Ураження нирок у рамках АС найчастіше проявляється клінічними ознаками нефротичного синдрому із швидким розвитком ниркової недостатності. Це слід враховувати при проведенні диференційної діагностики вторинних нефропатій — гломерулонефриту, тубулоінтерстиціального нефриту. Без адекватного лікування АС ураження нирок прогресує до термінальної ниркової недостатності.
Слід зазначити, що за життя пацієнтів із запальними захворюваннями суглобів амілоїдоз нирок діагностують тільки у 37 % спостережень, асимптоматичний перебіг амілоїдозу нирок — у 7–8 % хворих на АС, тоді як морфологічне дослідження нефробіоптатів у 77 % випадках підтверджує клінічно підозрілий амілоїдоз нирок.
Сучасний рівень терапії АС, ускладненого амілоїдозом, дозволяє гальмувати патологічний процес у нирках.
Наведений клінічний випадок демонструє не тільки складність діагностики, але й недостатню увагу лікарів/пацієнта до проведення патогенетичної терапії АС для попередження виникнення ускладнення — амілоїдозу нирок. Привертає до себе увагу швидкопрогресуюче ураження нирок. Безумовно, що фоном для такого характеру перебігу нефропатії була латентна передіснуюча ниркова патологія, що зумовлена персистуючим загостренням АС.
Лікування вторинного АА-амілоїдозу залишається складним завданням. У зв’язку з цим ведеться пошук нових лікувальних підходів у лікуванні імунозапальних ревматичних захворювань, до яких відноситься використання біологічно активних агентів.
У наведеному клінічному спостереженні продемонстровано суттєве покращення клініко-лабораторних показників (функції нирок) у хворого, який раніше отримував імуносупресивну терапію.
Клінічний випадок підтверджує необхідність переходу на альтернативний лікувальний режим хворих на АС, резистентних до традиційної терапії.
Доцент кафедри нефрології та НЗТ НМАПО
імені П.Л. Шупика, к.м.н. Ротова С.О.

/82.jpg)
/83.jpg)
/84.jpg)
/85.jpg)