Вступ
Хронічний біль є серйозною проблемою для багатьох країн світу. Згідно з даними останніх епідеміологічних досліджень, представленість хронічного болю в різних країнах коливається від 20 до 40 % [1–3]. Поряд з високою поширеністю хронічного болю в популяції має місце низька ефективність терапії в таких пацієнтів [4]. Частково це викликано складними патофізіологічними механізмами, які спочатку зумовлюють процес хронізації болю, а потім — розвитку й підтримання хронічного больового стану. Багато з механізмів цих процесів до кінця ще не вивчені, але переконливим є факт розвитку порушень у периферичній і центральній соматосенсорній нервовій системі, які призводять до появи нейропатії [5].
Терапія хронічного болю являє собою складне завдання. На сьогодні в лікуванні застосовуються різні групи препаратів: нестероїдні протизапальні засоби (НПЗЗ), антиконвульсанти, антидепресанти, прості анальгетики, місцеві анестетики, опіоїди. Незважаючи на досить широкий арсенал фармакологічних препаратів, наявних сьогодні в розпорядженні лікарів, рідко вдається досягти повного усунення болю в пацієнта. У той же час нерідко терапію доводиться коригувати або переривати через розвиток побічних ефектів. Пошук і розробка схем лікування, які б відзначалися підвищеною ефективністю і безпекою, є одним з актуальних питань для обговорення на міжнародних конгресах з проблеми болю останніх років.
Останнім часом зі збільшенням кількості досліджень і зростанням доказової бази почала розгортатися дискусія про застосування препаратів, що містять нуклеотиди, найбільш часто піримідинового ряду, як ад’ювантної терапії в пацієнтів з хронічними больовими станами, що супроводжуються нейропатією. Перед обговоренням клінічних ефектів доцільно зупинитися на основних фізіологічних механізмах дії нуклеотидів.
Фізіологічний базис
Пуринергічна система відіграє важливу роль у перебігу великої кількості як фізіологічних, так і патологічних процесів. Пуринові рецептори поділяються на 2 основні категорії: Р1- (аденозинові) і Р2-рецептори [6]. Агоністом для перших служить аденозин, для других — аденозинтрифосфорна кислота (АТФ). Аденозинові рецептори мають різну селективність і афінність до аденозину й поділяються на чотири підтипи: А1, А2a, А2b і А3. Усі аденозинові рецептори пов’язані з G-білками. При активації А1a-рецепторів відзначається седативний, протисудомний і антиноцицептивний ефект [7]. При активації А2a-рецепторів спостерігається протизапальний ефект [8]. У низці досліджень було встановлено власний аналгетичний ефект аденозину, який спочатку пов’язували з активацією А1a-рецепторів, а пізніше була встановлена роль А3-рецепторів у досягненні протибольового ефекту при нейропатичному болі [9].
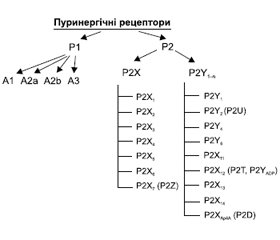
Група P2-рецепторів складається з двох класів: P2X-рецепторів, що беруть участь у процесах регуляції входу в клітину іонів Ca2+, K+ і Na+, і P2Y-рецепторів, пов’язаних з G-білками, на зразок аденозинових рецепторів. Кожен клас поділяється на підтипи: клас P2X-рецепторів — на 7 підтипів (P2X1-P2X7), а клас P2Y-рецепторів — на 8 підтипів (P2Y1, P2Y2, P2Y4, P2Y6, P2Y11, P2Y12, P2Y13, P2Y14). У даний час відповідно до рекомендацій Номенклатурного комітету Міжнародного товариства фармакологів класифікація пуринорецепторів виглядає таким чином (рис. 1) [24].
P2-рецептори можуть активуватися під дією АТФ, аденозиндифосфату (АДФ), уридиндифосфату (УДФ), уридинтрифосфату (УТФ) [10].
Підтипи P2X3- і P2X2/3-рецепторів переважно спостерігаються на немієлінізованих С-волокнах і тонких мієлінізованих А-дельта-волокнах, пов’язаних з передачею больових імпульсів [11].
Було показано, що підтип P2Y1-рецепторів чутливий до АДФ, P2Y2,4-рецептори чутливі до УТФ і АТФ, P2Y6-рецептор чутливий до УДФ, а P2Y14-рецептор взаємодіє з уридиновими цукрами. Дослідження встановили важливу роль P2Y-рецепторів у патогенезі болю і знеболювання [12].
Уридин, як представник піримідинових нуклеотидів, входить до складу ДНК і відіграє кілька фундаментальних ролей у клітинному метаболізмі [21]. Також у нормі він міститься в різних органах і тканинах людського організму. Уридин бере участь в біосинтезі різних нуклеїнових кислот і відіграє важливу роль у цілому каскаді біохімічних реакцій. З уридину синтезується АТФ, цитидиндифосфат (ЦДФ), який у подальшому призводить до утворення холіну й фосфоліпідів у центральній нервовій системі. Уридин, по суті, може виступати в ролі нейротрансмітера, активуючи описані вище типи рецепторів і справляючи таким чином різні ефекти, включно з власне аналгетичним [13].
Уридин є одним з чотирьох основних компонентів рибонуклеїнової кислоти; інші три — це аденозин, гуанозин і цитидин. Є дані, що уридин міститься в грудному молоці, субпродуктах (печінці й підшлунковій залозі), ячмені, пекарських дріжджах, екстракті цукрової тростини й овочах. Однак уридин в формі РНК практично не є біодоступним, оскільки він руйнується в печінці й шлунково-кишковому тракті, і, швидше за все, саме тому споживання їжі достовірно не підвищує рівень уридину в крові. У немовлят, які вживають материнське молоко або комерційні суміші для дитячого харчування, уридин присутній у вигляді монофосфату (УМФ), і це джерело уридину є біодоступним і потрапляє в кров. Монофосфатна частина уридину є транспортером, що допомагає уридину переміщатися по шлунково-кишковому тракту, потрапляти в плазму й долати гематоенцефалічний бар’єр. Кількість уридину в крові людини багато в чому залежить від її віку: в дитинстві, як описано вище, материнське молоко або суміші для дитячого харчування можуть забезпечити значну кількість уридину в формі УМФ, проте в зрілому віці майже весь уридин у необхідній формі синтезується печінкою.
Цікавим є той факт, що у немовлят УМФ (біодоступний уридин), що накопичується при вживанні материнського молока, є необхідною речовиною для виробництва достатньої кількості синапсів і будівництва їх мембран, що, у свою чергу, необхідно для швидко зростаючого мозку. А у хворих з полінейропатією, у яких виснажуються синапси, у зв’язку з чим виникає необхідність прискорити синтез синаптичної мембрани, УМФ стає «умовно необхідною поживною речовиною» [22].
При пероральному прийомі УМФ досить швидко всмоктується з кишечника методом простої дифузії або за допомогою спеціальних транспортерів, завдяки яким він здатний проникати через гематоенцефалічний бар’єр [14, 15]. За рахунок взаємодії з P2Y2-рецепторами і активації фактора росту нервових волокон уридин сприяє зростанню аксонів, їх мієлінізації і збільшенню швидкості проведення нервового імпульсу [16]. Одним з механізмів, що забезпечують посилення мієлінізації, є активація шваннівських клітин і стимуляція їх міграції до ушкодженого нервового закінчення [17].
Уридин-5-монофосфат синтезується de novo або з гліцерину, або шляхом фосфорилювання уридину уридинкіназою. Анаболізм уридину призводить до утворення уридин-5-дифосфату, що може з’єднуватися з різними цукрами, утворюючи, наприклад, уридиндифосфат-глюкозу або уридиндифосфат-галактозу, які є важливими елементами процесу гліколізації білків. Приєднання третьої фосфатної групи призводить до утворення уридин-5-трифосфату. Останній може бути використаний для синтезу РНК або, у разі його перетворення в деоксипіримідини, може інкорпоруватися в ДНК. УТФ може також перетворюватися в цитидин-5-трифосфат (ЦТФ), який при поєднанні з деякими ліпідами може утворювати цитидин-5-дифосфат ліпідні комплекси, такі як ЦДФ-етаноламін, який бере участь у формуванні клітинних мембран. Катаболізм уридину приводить до утворення урацилу і бета-аланіну, які надалі вступають у цикл трикарбонової кислоти (ТКК). Схематично описані вище процеси подані на рис. 2 [18].
Отже, прийом УМФ може підвищувати внутрішньоклітинний рівень цитидину, УДФ і УТФ [25].
Клінічна ефективність
На сьогодні існує низка досліджень, які демонструють ефективність препаратів, що містять нуклеотиди, у лікуванні больового синдрому, пов’язаного з нейропатіями.
Один з перших висновків про позитивний вплив нуклеотиду уридину на регуляцію нейрональної пластичності був зроблений після реалізації експериментальної моделі, у якій щурам із феохромоцитомою вводили уридин у різних концентраціях. Дослідження показало, що ефект уридину залежав від дози (чим вища доза, тим кращий результат) і тривалості курсу (більш тривалий курс показав вищу ефективність на відміну від короткого, який був зовсім неефективним). У результаті дослідження спостерігалося збільшення кількості аксонів, їх розгалуження й посилення росту [25].
У наступних експериментах за участю піщанок, які отримували УМФ як джерело уридину протягом 4 тижнів, спостерігалося значне збільшення кількості пресинаптичного білка синапсину-1, постсинаптичного білка PSD-95 і деяких нейритних нейрофібрилярних білків [23].
V. Gallai та співавт. (Італія) провели подвійне сліпе контрольоване нейрофізіологічне дослідження застосування уридину в 40 пацієнтів із цукровим діабетом і проявами периферичної нейропатії. Середній вік пацієнтів становив 48,5 ± 3,4 року, а тривалість захворювання — мінімум 5 років. Усі пацієнти мали знижену швидкість моторної і сенсорної відповіді мінімум на одному з периферичних нервів, а також постійний біль у нижніх кінцівках і порушення вібраційної чутливості. Двадцять пацієнтів приймали уридин у дозі 300 мг 3 рази на день, а 20 пацієнтів — плацебо за такою ж схемою. Кожні 2 тижні пацієнти отримували новий блістер з препаратом в обмін на використаний. Електроміографічне дослідження проводилося на домінантній стороні. Досліджували показники серединного, загального малогомілкового, заднього великогомілкового, променевого, серединного й литкового нервів. Фіксувалися швидкості й амплітуди моторних і сенсорних відповідей. Оцінка проводилася на початку дослідження, а також на 60, 120 і 180-й день терапії з повторним контрольним дослідженням на 90-й день після закінчення терапії. У групі плацебо не було відзначено жодних статистично достовірних змін, тоді як в основній групі відзначалося статистично достовірне покращання нейрофізіологічних показників починаючи з 120-го дня терапії (табл. 1, рис. 3), яке зберігалося аж до 90-го контрольного дня після закінчення терапії.
/117_2.jpg)
Дані цього дослідження свідчать про те, що застосування уридину у високих дозах призводить до статистично достовірного покращення функції периферичних нервів. Швидкість проведення нервового імпульсу збільшилася на 11 % (уридин vs плацебо) на 180-й день дослідження. Показово, що в жодного пацієнта не відзначалося будь-яких побічних ефектів.
У відкритому проспективному мультицентровому дослідженні Negrao зі співавт. проводилося вивчення ефективності комбінації УМФ, фолієвої кислоти і вітамінів групи В щодо больового синдрому в пацієнтів із периферичною нейропатією різного генезу [19]. У дослідження увійшли 212 пацієнтів, з яких 131 (62,4 %) — жінки. Середній вік становив 59,0 ± 14,4 (19–92) року. Інтенсивність і характеристики болю оцінювалися за допомогою опитувальника painDETECT. Під час дослідження разом з даною комбінацією використовувалися базові препарати (НПЗЗ, антиконвульсанти, антидепресанти тощо) з метою визначення зміни їх застосування під час дослідження. Загальний бал за опитувальником painDETECT на початку дослідження становив 17,5 ± 5,7 бала. На 60-й день дослідження ця цифра достовірно знизилася до 8,8 ± 5,2 бала (p < 0,001). Статистично достовірне покращання спостерігалося в усіх трьох найбільш частих випадках болю — при поперековому болі, ішіасі й шийній радикулопатії. Важливо відзначити, що на початку дослідження пацієнти приймали переважно НПЗЗ (77,8 %), парацетамол (51,4 %) і трамадол (25,5 %). На 60-й день дослідження було відзначено зменшення прийому супутніх препаратів у більшості (75,6 %) пацієнтів. Під час дослідження було відзначено достовірне зниження таких відчуттів, як: пекучий біль, поколювання, простріл, оніміння (рис. 4). Побічних ефектів відзначено не було.
Під стандартним лікуванням слід розуміти застосування НПЗЗ, парацетомолу, метамізолу натрію, габапентину, прегабаліну, антидепресантів тощо.
/118.jpg)
Схоже дослідження було проведене Negrao у 48 пацієнтів із синдромом зап’ястного каналу [20]. Відкрите проспективне мультицентрове дослідження відбувалося в 34 клінічних центрах Португалії. Пацієнти приймали комбінацію УМФ, фолієвої кислоти і вітаміну В12 в одній капсулі 1 раз на день протягом 60 днів. Інтенсивність, кількісні та якісні характеристики болю оцінювалися за допомогою опитувальника painDETECT. Під час дослідження відзначався також прийом базових препаратів (НПЗЗ, парацетамол, прегабалін, габапентин, трамадол та інші) з метою визначення змін у їх прийомі. Загальний бал за опитувальником painDETECT на початку дослідження становив 17,3 ± 5,9 бала. На 60-й день дослідження ця цифра статистично достовірно знизилася до 10,3 ± 6,1 бала (p < 0,001). Також був зменшений або повністю скасований прийом супутніх анальгетиків у 37 (77,4%) пацієнтів, тоді як на початку дослідження 39 пацієнтів (81,3%) приймали НПЗЗ, 9 пацієнтів (18,8%) — трамадол і ще 9 (18,8%) — прегабалін. Під час дослідження також було відзначено достовірне зниження таких відчуттів, як: пекучий біль, біль за типом прострілів електричним струмом, оніміння, поколювання й алодинія. Побічних явищ під час дослідження відзначено не було.
Уридин, будучи ендогенною сполукою, яка присутня в організмі людини, стає привабливим для терапевтичного застосування. Завдяки тому, що уридин є природною речовиною, яка бере участь у багатьох процесах організму, в дослідженнях з його використанням не зустрічаються серйозні побічні явища.
Спільне використання уридину (як УМФ) і ще одного нуклеотиду холіну також збільшує кількість білків (синапсин-1, PSD-95), що локалізуються в пресинаптичній і постсинаптичній мембранах. Холін також бере участь у формуванні мембрани синапса. Вітаміни В6 і В12 сприяють синтезу ендогенного холіну в печінці, але його необхідний рівень у пацієнтів з нейропатією можливо підтримувати тільки пероральним прийомом [22].
Одним з представлених в Україні комплексних продуктів є препарат Юнігамма® («Юніфарм Лабораторіз Лімітед», Ірландія), що містить 150 мг уридину, 82,5 мг холіну, 2,5 мг вітаміну В1, 4 мг вітаміну В6, 3 мкг вітаміну В12 і 400 мкг фолієвої кислоти. З огляду на підтверджений у низці досліджень дозозалежний ефект уридину препарат Юнігамма® викликає інтерес у першу чергу завдяки високій дозі уридину в його складі (на відміну від інших препаратів, у яких доза уридину в рази менша) і вмістом біодоступного уридину — уридину монофосфату. Завдяки високому вмісту уридину (150 мг/капсулу) і синергічному ефекту додаткових компонентів можна стверджувати, що включення препарату Юнігамма® в схему лікування хронічного болю з проявами нейропатії сприяє нейрорегенерації, опосередкованому протибольовому ефекту і посиленню клітинного метаболізму.
Висновки
Покращення підходів до терапії пацієнтів із хронічним болем із проявами нейропатії є актуальною проблемою. Комплексне лікування з включенням природних нуклеотидів, що покращують нервову провідність, демонструє більш високу ефективність. Важливою перевагою комплексного підходу є високий профіль безпеки, тому що нуклеотиди є ендогенними речовинами. При цьому важливо пам’ятати, що ефективність нуклеотиду уридину безпосередньо залежить від дози й тривалості лікування. Застосування уридину сприяє відновленню мієлінової оболонки нервів і покращанню нейрофізіологічних показників провідності. Завдяки додаванню комбінації уридину, вітамінів групи В і фолієвої кислоти до основної терапії хронічного болю з проявами нейропатії можна досягти зменшення кратності та/або доз супутніх препаратів або повної їх відміни.
Конфлікт інтересів. Автор отримав гонорар від представництва «Юніфарм Лабораторіз Лімітед» за підготовку матеріалів, які були використані для написання статті.
Список литературы
1. Breivik H. et al. Survey of chronic pain in Europe: Prevalence, impact on daily life, and treatment. European Journal of Pain. 2006. Vol. 10. № 4. P. 287-287.
2. Bouhassira D. et al. Prevalence of chronic pain with neuropathic characteristics in the general population. Pain. 2008. Vol. 136. № 3. P. 380-387.
3. Todd A. et al. The Europain Epidemic: pain prevalence and socioeconomic inequalities in pain across 19 European countries. Eur. J. Pain. 2019. P. ejp.1409.
4. Dworkin R.H. et al. Recommendations for the Pharmacological Management of Neuropathic Pain: An Overview and Literature Update. Mayo Clinic Proceedings. 2010. Vol. 85. № 3. P. S3-S14.
5. Dimitroulas T. et al. Neuropathic pain in osteoarthritis: A review of pathophysiological mechanisms and implications for treatment. Seminars in Arthritis and Rheumatism. 2014. Vol. 44, № 2. P. 145-154.
6. Magni G., Riccio D., Ceruti S. Tackling Chronic Pain and Inflammation through the Purinergic System. CMC. 2018. Vol. 25, № 32. P. 3830-3865.
7. Peleli M. et al. Pharmacological targeting of adenosine receptor signaling. Molecular Aspects of Medicine. 2017. Vol. 55. P. 4-8.
8. Gomes C. et al. Activation of microglial cells triggers a release of brain-derived neurotrophic factor (BDNF) inducing their proliferation in an adenosine A2A receptor-dependent manner: A2A receptor blockade prevents BDNF release and proliferation of microglia. J. Neuroinflammation. 2013. Vol. 10. № 1. P. 780.
9. Sawynok J. Adenosine receptor targets for pain. Neuroscience. 2016. Vol. 338. P. 1-18.
10. Burnstock G. Purinergic Mechanisms and Pain. Advances in Pharmacology. Elsevier, 2016. Vol. 75. P. 91-137.
11. Giniatullin R., Nistri A. Desensitization properties of P2X3 receptors shaping pain signaling. Front. Cell. Neurosci. 2013. Vol. 7.
12. Abbracchio M.P. et al. International Union of Pharmacology LVIII: Update on the P2Y G Protein-Coupled Nucleotide Receptors: From Molecular Mechanisms and Pathophysiology to Therapy. Pharmacol. Rev. 2006. Vol. 58. № 3. P. 281-341.
13. Harden T.K. et al. Signalling and pharmacological properties of the P2Y receptor. Acta Physiol (Oxf). 2010. Vol. 199, № 2. P. 149-160.
14. Pizzorno G. et al. Homeostatic control of uridine and the role of uridine phosphorylase: a biological and clinical update. Biochi-mica et Biophysica Acta (BBA) — Molecular Basis of Disease. 2002. Vol. 1587, № 2–3. P. 133–144.
15. Beal P.R. et al. The equilibrative nucleoside transporter fa-mily, SLC29. Pflgers Archiv European Journal of Physiology. 2004. Vol. 447. № 5. P. 735–743.
16. Neary J.T. et al. Trophic actions of extracellular nucleotides and nucleosides on glial and neuronal cells. Trends in Neurosciences. 1996. Vol. 19. № 1. P. 13-18.
17. Martiáñez T. et al. UTP affects the Schwannoma cell line proteome through P2Y receptors leading to cytoskeletal reorganisation. Proteomics. 2012. Vol. 12. № 1. P. 145-156.
18. Connolly G.P., Duley J.A. Uridine and its nucleotides: biological actions, therapeutic potentials. Trends in Pharmacological Sciences. 1999. Vol. 20. № 5. P. 218-225.
19. Negrão L. et al. Effect of the combination of uridine nucleotides, folic acid and vitamin B12 on the clinical expression of peri-pheral neuropathies. Pain Management. 2014. Vol. 4, № 3. P. 191-196.
20. Negrão L., Nunes P., on behalf of the Portuguese Group for the Study of Peripheral Neuropathy. Uridine monophosphate, folic acid and vitamin B12 in patients with symptomatic peripheral entrapment neuropathies. Pain Management. 2016. Vol. 6. № 1. P. 25-29.
21. Voet D., Voet Judith G., Pratt C.W. Fundamentals of bioche-mistry: Life at the molecular level. Hoboken, NJ: Wiley, 2008.
22. Wurtman R.J.A., Department of Brain and Cognitive Sciences, Massachusetts Institute of Technology. Nutrient Combination that Can. Affect. Synapse Formation. 2014.
23. Dobolyi А., Juhász G., Kovács Z., Kardos J. Uridine Function in the Central Nervous System. Current Topics in Medicinal Chemistry. 2011. 11. 1058-1067.
24. Bulanаva K.Ya., Bakunovich A.V., Burko D.V. et al. The purine nucleotides system 1: the membrane mechanisms of the physiological effects of adenine derivatives. Военная медицина. 2012. № 4. С. 102-108.
25. Pooler A.M., Guez D.H., Benedictus R., Wurtman R.J. Uridine enhances neurite outgrowth in nerve growth factor-differentiated PC12. Neuroscience. 2005. 134. 207-214.
26. Gallai V., Mazzotta G., Montesi S., Sarchielli P. et al. Effects of uridine in the treatment of diabetic neuropathy: an electrophysiological study. Acta Neurologica Scandinavica. 1992. 86. 3-7.
/116.jpg)
/117.jpg)

/117_2.jpg)
/118.jpg)