Вступ
Біль у нижній частині спини — одна з найбільш поширених скарг та причин звернення за медичною допомогою [1–4]. У 2015 році більше мільярда людей у світі страждали від люмбалгії тривалістю понад 3 місяці [5, 6]. Цей біль, як найчастіша причина обмеження побутової та професійної діяльності, не лише є тягарем для окремої людини чи її сім’ї, але й викликає значні економічні втрати для держави загалом [7–10].
Значна робота та велика кількість публікацій присвячується створенню практично-орієнтованої класифікації дорсалгій. Розподіл пацієнтів на підгрупи з більш гомогенними клінічними ознаками та схожими характеристиками болю має на меті більш точне прогнозування перебігу та якісне надання медичної допомоги. Найчастішим варіантом болю в нижній частині спини, близько двох третин випадків, є його поєднання з болем у нозі (low back-related leg pain) [11–13]. Біль ноги, пов’язаний із люмбалгією, може як провокуватися ураженням спинномозкового корінця, так і бути проявом ураження інших структур, наприклад зв’язок і суглобів хребта, або дископатії за відсутності безпосереднього залучення корінців [14]. Існує певна неоднозначність визначення болю в нозі, пов’язаного з болем у спині: часто терміни «ішіалгія», «корінцевий біль», «радикулопатія» чи «грижа диска з радикулярними симптомами» використовуються як взаємозамінні або без чітко визначених критеріїв [15–20].
У будь-якому разі більшість дослідників погоджується, що наявність ішіалгії чи радикулярного болю погіршує функціонування більшою мірою, ніж неспецифічна люмбалгія, а також є несприятливим прогностичним чинником та своєрідною «перешкодою» для одужання [21–24].
Тим парадоксальнішим здається той факт, що більшість клінічних настанов надають чіткі та узгоджені рекомендації щодо лікування неспецифічного болю в нижній ділянці спини, однак мало стосуються ішіалгії. Багато досліджень показують, що звичні консервативні методи лікування значно різняться в ефективності у цих двох груп пацієнтів [25–27].
Роль більшості фармакологічних середників, що рутинно використовуються при лікуванні люмбоішіалгії, зокрема нестероїдних протизапальних препаратів, міорелаксантів, системних кортикостероїдів, антидепресантів та антиконвульсантів, чітко не встановлена. Ефективність використання більшості знеболюючих та ад’ювантних засобів значно варіює в різних дослідженнях [28–30]. Систематичні огляди та метааналізи щодо лікування люмбоішіалгії та радикулярного болю показують, що наявні в даний час дослідження мають середній рівень доказовості та є недостатніми для рекомендації того чи іншого засобу [25, 28].
З огляду на актуальність та практичну цінність вищевказаних питань ми провели паралельно-групове клінічне випробування курсу дексаметазону проти L-лізину есцинату в пацієнтів із гострою люмбоішіалгією та поперековою радикулопатією.
Мета дослідження — оцінити ефективність використання дексаметазону та L-лізину есцинату в пацієнтів із гострою люмбоішіалгією та радикулопатією. Установити потенційні предиктори, прогностичні чинники та маркери перебігу ішіалгії з радикулопатією.
Матеріали та методи
Схематично дизайн дослідження поданий на рис. 1.
Учасники. У дослідження включалися пацієнти віком від 18 до 75 років із первинним чи повторним епізодом ішіалгії, тривалістю від 1 до 4 тижнів. Ішіалгія визначалася як біль ноги (з болем поперекової ділянки або без такого), що поширювався нижче від коліна за радикулярним патерном, з ознаками подразнення корінця (позитивний симптом Ласега) та/або корінцевим неврологічним дефіцитом (чутливі чи рефлекторні прояви). Також критерієм включення була нейровізуалізація — МРТ із наявністю вип’ячування міжхребцевого диска та дегенеративно-дистрофічних змін, що відповідають за рівнем клінічним проявам.
Критерії виключення: протипоказання до використання кортикостероїдів чи L-лізину есцинату, наявний чи прогресуючий моторний дефіцит та синдром кінського хвоста, біль тривалістю понад 4 тижні, цукровий діабет та тяжка супутня соматична патологія (зокрема, неконтрольована артеріальна гіпертензія, ниркова, печінкова або серцева недостатність), хірургічне втручання з приводу люмбоішіалгії в анамнезі, системне чи епідуральне використання кортикостероїдів протягом останніх 6 тижнів, вагітність.
Інтервенції та контрольні точки. 94 пацієнти, які відповідали вищевказаним критеріям, були рандомізовані в три групи, порівнянні за кількістю учасників. Протягом першої доби дослідження не використовували жодні медикаменти.
У першу добу виконували магнітно-резонансне обстеження попереково-крижового відділу хребта, а також визначали інтенсивність болю за візуальною аналоговою шкалою (Visual Analogue Scale for pain; 0–10), встановлювали рівень та функціональну значимість болю за коротким опитувальником болю (Brief Pain Inventory, КОБ). Також визначали інтенсивність симптому Ласега (тест підйому випрямленої ноги) із фіксацією показників від 30 до 70º (при показнику понад 70º тест вважався позитивним). У пацієнтів із клінічними чи візуалізаційними ознаками ураження корінця S1 додатково проводилося електронейроміографічне обстеження з визначенням амплітуди H-рефлексу.
Починаючи з другої доби всі пацієнти отримували рівнозначну консервативну терапію у вигляді анальгетиків чи нестероїдних протизапальних засобів за потребою та фізичну терапію. В одній групі пацієнти додатково отримували розчин дексаметазону (внутрішньовенний болюс 8 мг/добу) протягом 5 діб. Пацієнти з інших двох груп, окрім звичних заходів, отримували розчин L-лізину есцинату в дозуваннях 5 та 10 мл на добу (1 мг/мл) відповідно у вигляді внутрішньовенної інфузії з розведенням ізотонічним розчином натрію хлориду до 50 мл сумарного об’єму (також протягом 5 діб).
Результати оцінювалися на 15-й та 30-й дні дослідження повторним виконанням МРТ, оцінкою симптому Ласега та інтенсивності болю за ВАШ. Показники короткого опитувальника болю та амплітуди Н-рефлексу було протестовано як предиктори перебігу ішіалгії та потенційні прогностичні маркери.
Терміни контрольних точок були визначені з метою встановлення ймовірності покращення функціонального стану пацієнтів в ранньому періоді, коли симптоматика є найбільш інтенсивною, а також у часовому проміжку, що визначається настановами як відносне показання до хірургічного втручання в разі неефективності консервативних заходів (тривалість болю протягом 6–8 тижнів).
Результати. 94 пацієнти взяли участь в дослідженні згідно з вищевказаними критеріями. Перед початком лікування групи були підібрані та порівнянні за віком та вихідними показниками (табл. 1).
Усі пацієнти були на контрольному дослідженні через 2 та 4 тижні від початку дослідження. Жоден пацієнт не вибув із приводу побічних ефектів чи потреби в іншому методі лікування.
Статистичний аналіз та обробка даних. Динаміку оцінки пацієнтів за ВАШ та симптомом Ласега, відмінності між групами, а також можливий вплив оцінки болю за КОБ та інтенсивності Н-рефлексу на динаміку аналізували статистично у програмному середовищі R версії 3.4.3. Оскільки дизайн дослідження є ієрархічним (у кожній із трьох груп згруповано повторювані вимірювання, отримані від одного й того ж пацієнта), а також присутні фактори із фіксованим впливом (fixed effect — препарат, що приймав пацієнт, оцінка за коротким опитувальником болю, інтенсивність Н-рефлексу) та випадковим впливом (random effect — індивідуальні відмінності між пацієнтами), для аналізу використано метод лінійних змішаних регресійних моделей (mixed models). Цей метод у даний час є методом вибору для дослідження повторюваних вимірювань у медицині загалом, а також рекомендується до застосування в галузі неврології як такий, що має значні переваги над традиційними методами. Нормальний розподіл залишків регресійної моделі та відсутність статистичних викидів перевіряли шляхом інспекції квантиль-квантильного нормального графіку. Статистичну значимість впливу факторів (оцінка за КОБ та Н-рефлекс) на динаміку болю у пацієнтів визначали шляхом дисперсійного аналізу вкладених (nested) регресійних моделей (одна містила можливий фактор впливу, інша — ні). Як базову групу для порівняння використовували групу пацієнтів, які отримували препарат дексаметазону. Варто відмітити, що повторювані вимірювання в пацієнтів очікувано не є незалежними одне від одного. Стан пацієнта на п’ятнадцятий та тридцятий день певною мірою залежить від початкового стану. Тому для врахування часового зв’язку між послідовними вимірюваннями в одного й того ж пацієнта ми вивчали доцільність корекції часової автокореляції у змішаній регресійній моделі. Статистично значимими вважали результати із р < 0,05. Середні значення та стандартне відхилення округлювали до кількості значущих цифр при вимірюванні плюс один, р-величини — до двох значущих цифр, інші статистичні параметри — до трьох.
Результати
1. Динаміка больового компонента за ВАШ на фоні терапії дексаметазоном або L-лізину есцинатом
Під час проведення дослідження у всіх групах відмічалося покращення показників ВАШ (рис. 2).
На п’ятнадцятий день від початку лікування покращення стану та виражене зниження больових відчуттів фіксували у всіх групах. Лише поодинокі пацієнти не відреагували на терапію, зазначивши такий же рівень болю, як і до лікування. При першому контролі відмічалася різниця між середніми показниками: 4,6 бала в групі дексаметазону; 3,8 та 3,2 бала — в групах L-лізину есцинату 5 та 10 мл відповідно. Середній бал різниці між групою 1 та групою 3 становив 1,4 (p = 0,0159, f-ratio value = 4,33574).
На тридцятий день після ініційованого лікування середня інтенсивність болю продовжила знижуватись у всіх групах. Найменших рівнів болю на тридцятий день досягнуто в пацієнтів, які отримали препарат
L-лізину есцинат 10 мл, однак зниження болю мало більшу амплітуду саме у групі, якій вводили дексаметазон (рис. 3, табл. 2).
2. Динаміка симптому Ласега на фоні терапії дексаметазоном або L-лізину есцинатом
У всіх пацієнтів визначали симптом Ласега перед початком введення препаратів, а також на п’ятнадцяту та тридцяту добу від початку лікування. На початку експериментального дослідження середні значення симптому Ласега у першій групі становили 42,8 ± 14,2º, що було дещо менше, ніж у другій (52,8 ± 15,6º) та третій групі (50,6 ± 17,7º). При цьому вже на п’ятнадцятий день середні значення симптому Ласега у першій групі (65,2 ± 20,2º) слабко перевищили аналогічні показники у другій (64,4 ± 19,4º) та третій (60,8 ± 17,1º) групах (рис. 4, табл. 3).
/31.jpg)
Регресійна модель підтверджує зростання градусної міри симптому Ласега в першій групі в середньому на 22,4º на п’ятнадцяту добу та 39,8º — на тридцяту добу. Пацієнти в другій та третій групах мали кращі початкові значення за симптомом Ласега (в середньому на 10,0 та 7,8º відповідно), але слабшу позитивну динаміку. На тридцятий день загальна позитивна динаміка пацієнтів, що отримали L-лізину есцинат, виявилася слабшою в середньому на 18,3º у випадку дозування 5 мл (р = 0,0015) та на 13,9º (р = 0,014) — у випадку дозування 10 мл, ніж у пацієнтів, які отримали дексаметазон. Це може бути наслідком досить низької точності та стабільності при вимірюванні симптому Ласега, а також існування верхнього порогу — негативного симптому Ласега, що досить часто присутній в отриманих нами даних. У сукупності це дещо применшує надійність та, відповідно, цінність наведеної тут моделі.
3. Динаміка морфологічних змін міжхребцевих дисків за даними МРТ
У всіх групах фіксували зміни розмірів та конфігурації вип’ячувань міжхребцевих дисків. На 15-й день відмічені лише поодинокі випадки вірогідних змін, що, імовірно, пояснюється коротким періодом спостереження. У підсумку природний перебіг дископатії при курсовому лікуванні дексаметазоном чи L-лізину есцинатом наведено в табл. 4.
Указані зміни не корелювали з ВАШ у динаміці та КОБ при первинному огляді. Також не виявлений вірогідний зв’язок між розміром вип’ячування, його морфологічною динамікою та градусною оцінкою симптому Ласега (r = 0,16).
Оскільки волюметричної оцінки не проводилося, то дані МРТ було проаналізовано за рангами: зменшення, без змін чи збільшення розмірів без врахування відносних показників (рис. 5). Якщо оцінити кінцеву частку пацієнтів із покращенням морфометричних даних, то є статистично значима різниця між групою L-лізину есцинату в дозуванні 5 мл проти 10 мл та групи дексаметазону (p = 0,02). Тобто в першій та третій групах зменшення розмірів зустрічалося частіше, ніж в групі L-лізину есцинату 5 мл. На точність та статистичну значимість результатів в даному випадку значно впливає мала вибірка спостережень.
Найбільша динаміка середнього значення розмірів міжхребцевих дисків спостерігалася в групі дексаметазону (рис. 6). Хоча в групі L-лізину есцинату 10 мл не зафіксовано випадків збільшення розмірів чи каудальної міграції грижі, різниця з іншими групами є статистично незначущою, зокрема проти групи дексаметазону, в якій 3 випадки погіршення морфологічних характеристик (р = 0,23).
Значущої різниці між впливом курсу лікування дексаметазоном чи L-лізину есцинатом 10,0 мл на перебіг дископатії не виявлено. Також не доведено зв’язку чи модифікуючого впливу морфометричних показників міжхребцевого диска на больові характеристики за ВАШ та КОБ, градусною оцінкою симптому Ласега чи амплітуди Н-рефлексу.
Варто зазначити, що певні особливості перебігу та МР-характеристик дископатії, а також їх потенційне клінічне значення обговорені в розділі «Клінічні випадки».
4. Модифікуючі фактори та предиктори перебігу за КОБ та Н-рефлексом
До змішаної регресійної моделі як можливий фактор — модифікатор динаміки пацієнтів було внесено оцінку інтенсивності болю за КОБ, отриману до початку лікування (один із пацієнтів не був оцінений за даним опитувальником — його дані вилучили з аналізу). Відношення правдоподібностей цих моделей становило LR = 20,8, а р = 0,00090. Таким чином, початкова оцінка інтенсивності болю за КОБ впливає або корелює із інтенсивністю болю за ВАШ із статистичною значущістю. Так, значення коефіцієнта при КОБ у першу добу βКОБ-1 = 0,077 означає, що на початку лікування кожні 10 балів за шкалою КОБ асоціюються із підвищенням ВАШ на 0,77 бала. Зрозуміло, що обидві шкали вимірюють проблеми, пов’язані з болем, і кореляція між ними є очікуваною. Якби роль КОБ у регресійній моделі обмежилась би кореляцією із показником ВАШ у перший день, то внесення у модель фактора КОБ слід було б вважати зайвим, незважаючи на будь-які покращення в моделі. Однак регресійний коефіцієнт βКОБ-15, що характеризує вплив КОБ на оцінку ВАШ, виміряну через 15 діб після початку лікування, помітно відрізняється від нуля і становить –0,021 ± 0,014. Коефіцієнт βКОБ-15 — від’ємна величина. З цього випливає, що пацієнти з високими початковими рівнями за шкалою КОБ матимуть кращу додаткову позитивну динаміку на п’ятнадцятий день: у них спостерігатимуть показники ВАШ на п’ятнадцятий день нижчі в середньому на 0,21 бала за кожні 10 балів початкового значення КОБ (після врахування ефекту від препарату). За допомогою фактора КОБ модель пояснює сильнішу позитивну динаміку окремих пацієнтів тим, що в них були високі початкові значення за шкалою КОБ. При цьому після врахування впливу початкового рівня КОБ на динаміку змодельований ефект від препаратів (і дексаметазону, і L-лізину есцинату) зменшився в розмірі (βдекс-15 досяг значення –1,15 ± 0,81 порівняно з коефіцієнтом –2,30 ± 0,29, що був отриманий без врахування впливу оцінки за КОБ). Це означає, що пацієнти із високим початковим показником КОБ демонструють подальше, навіть більш швидке зниження інтенсивності болю в проміжку між п’ятнадцятою і тридцятою добою.
Оцінку інтенсивності болю за КОБ, отриману до початку лікування, також було внесено до змішаної регресійної моделі із градусною мірою симптому Ласега як можливий фактор — модифікатор динаміки пацієнтів. В отриманій моделі коефіцієнт βКОБ-1, що, по суті, відповідає за ступінь кореляції із симптомом Ласега, дорівнює –0,55 ± 0,30 і свідчить про те, що кожні 10 балів за шкалою КОБ асоціюються із зниженим у середньому на 5,5º значенням симптому Ласега. Цей ефект у розробленій моделі дещо не досяг статистичної значимості із р = 0,069. Це свідчить, що якщо фактору КОБ і відводиться певна роль у змішаній регресійній моделі, то ця роль обмежена виключно кореляцією інтенсивності болю за шкалою КОБ та градусною мірою симптому Ласега (симптом Ласега більш виражений у пацієнтів із вищими балами за шкалою КОБ). Можливий вплив оцінки за шкалою КОБ на динаміку градусної міри симптому Ласега в даному дослідженні не спостерігається.
Як можливий фактор — модифікатор перебігу болю у спині після призначеного курсу лікування досліджували також Н-рефлекс. Для цього фактор Н-рефлексу вносили в змішану регресійну модель. В одного з пацієнтів Н-рефлекс не був оцінений — його дані вилучили з аналізу. Статистична значимість при порівнянні двох моделей дисперсійним аналізом становить р = 0,59, тому врахування оцінки Н-рефлексу при дослідженні та описі динаміки больового симптому в досліджуваних пацієнтів не є доцільним.
Подібні результати отримані і при вивченні Н-рефлексу як потенційного предиктору перебігу в змішаній моделі з градусною мірою симптому Ласега. Співвідношення правдоподібностей між двома моделями становило LR = 5,2, а відповідна статистична значимість р = 0,39. Тому можливий вплив ступеня H-рефлексу на майбутню динаміку градусної міри симптому Ласега в умовах проведеного експерименту не знайшов свого підтвердження.
Обговорення та клінічні випадки
Ефективність дексаметазону та L-лізину есцинату при люмбоішіалгії та поперековій радикулопатії
За останні 40 років опубліковано не більше десяти порівнюваних досліджень щодо ефективності системних кортикостероїдів при ішіалгії та радикулярному болі [31–38]. Деякі дослідження показали тенденцію до покращення показників болю та значного покращення функціонування через 1 місяць після одноразового введення метилпреднізолону [36]. Одноразове внутрішньовенне ведення дексаметазону теж показало певний ефект в покращенні болю та збільшенні обсягу рухів у пацієнтів із радикулопатією, хоча автори й відмітили, що ефект був нетривалим та сам патогенетичний механізм знеболювання не є цілком зрозумілим [38]. Курсове використання преднізолону в гострому періоді показало статистично значуще покращення функції, однак без значного полегшення болю [37].
Вищевказані дослідження мають певні недоліки, зокрема, деякі з них не були статистично потужними, наприклад, у зв’язку з малою кількістю пацієнтів [32, 33, 35]. Одноразове введення препаратів заслуговує на увагу, але навряд чи може призвести до стійкого ефекту [38], у той час як пульс-терапія викликає багато запитань щодо безпечності та виправданості відносно тяжкості стану [36]. У більшості курсових випробувань застосовувався преднізолон або метилпреднізолон, відомі своїм дозозалежним та дещо відстроченим ефектом, на що часто вказують і самі автори [37].
У нашому дослідженні використовувався короткий курс дексаметазону, що більш виправдане з точки зору патофізіології процесу та клінічних потреб (швидкий ефект та сприятливий профіль побічних ефектів).
У пошуках нових шляхів та ефективних засобів лікування пацієнтів із радикулопатіями було вирішено дослідити також препарат L-лізину есцинат. Патогенетичне обґрунтування базується на полімодальній дії препарату. L-лізину есцинат зменшує активність лізосомальних гідролаз, тим самим пригнічуючи розщеплення мукополісахаридів, що в клінічній практиці проявляється мембраностабілізуючим та протиексудативним ефектами, а інгібування фосфоліпази А2 — помірною протизапальною дією [39–43]. Використання препарату L-лізину есцинат при радикулопатіях та дорсалгіях є рутинним в практиці багатьох лікарів як первинної ланки, так і спеціалізованої допомоги, хоча в даний час не є рекомендованим у клінічних настановах.
Дослідження щодо ефективності цього засобу при радикулопатіях та люмбоішіалгії показали перевагу над плацебо чи базовою терапією [44–47]. Разом з тим слід зазначити, що дослідження оцінювали лише гострий період та мали помірне клінічне значення, хоча й досягли статистичної значимості. У нашому дослідженні вперше порівнюється ефективність L-лізину есцинату в різних дозуваннях проти дексаметазону. Таке завдання виправдане подібністю впливу на основні патогенетичні ланки: саме протизапальний та протинабряковий вплив кортикостероїдів розглядається як потенційний механізм позитивної дії при радикулопатіях.
Н-рефлекс як маркер та предиктор перебігу радикулопатій
У проспективному дослідженні, що включало 206 пацієнтів, Dillingham із співавторами оцінили дані електрофізіологічного обстеження та хірургічного підтвердження грижі міжхребцевого диска [48]. Автори виявили, що електроміографічне дослідження дозволяє визначити 97 % радикулопатій та 89 % хірургічно підтверджених гриж. Marin із співавторами провели дослідження з метою виявити більш специфічні ознаки радикулопатій та діагностичне значення для окремих з них [49]. Результати показали, що чутливість Н-рефлексу для виявлення радикулопатії L5 становить всього 6 %, S1 — 50 % із специфічністю 91 %. Н-рефлекс розглядається настановами Північноамериканського товариства спінальної хірургії як додаткове обстеження, що підтверджує радикулопатію S1 з грижею міжхребцевого диска [27] та має найбільшу прогностичну цінність [50].
Ураховуючи дані літератури, зокрема вищевказаних публікацій, ми вирішили оцінити показники амплітуди Н-рефлексу як потенційний предиктор чи модифікуючий фактор перебігу радикулопатій у поєднанні з визначенням інтенсивності симптому Ласега, оцінкою за КОБ та даними МРТ.
Клінічні випадки та перебіг радикулопатій, асоційованих із дископатіями
Хоча патомеханізми природного перебігу радикулопатії, пов’язаної з грижею міжхребцевого диска, не цілком зрозумілі, вважається, що стан більшості пацієнтів покращиться незалежно від методу лікування [27].
Teplick та Haskin понад 30 років тому вперше описали спонтанну регресію грижі диска в 11 пацієнтів [50]. Відтоді задокументовані багато випадків з підтвердженням повторюваними КТ- та МР-скануваннями [51–54]. У літературі запропоновані три можливі механізми цього феномену. Перший — повторна ретракція екструдованого матеріалу в міжхребцевий простір. Другий базується на явищах дегідратації та «зморщення» грижі диска. Найбільш сучасна теорія вважає, що ферментативна деградація, запалення за рахунок цитокінів та металопротеїназ із наступним фагоцитозом призводять до реабсорбції [55–58]. Цікаво, що, незважаючи на опис багатьох клінічних випадків мимовільного зменшення розмірів грижі диска, практично немає клінічних досліджень щодо впливу певних препаратів на ці показники.
У нашому дослідженні спостерігалися випадки зменшення розмірів грижі міжхребцевого диска, а також збільшення чи деконфігурації. У групі дексаметазону більш вираженими виявилися зміни замикальних пластин тіл хребців, що може відображати пригнічення запалення чи неоваскуляризації [58]. Випадки майже повної резорбції, а також масивної екструзії з секвестрацією задокументовані лише в групі L-лізину. Оскільки МР-волюметрія міжхребцевих дисків у нашій роботі не виконувалася, то незначні зміни в розмірах не досягли необхідної статистичної значимості. Нижче наводимо кілька клінічних випадків із нашого дослідження, що чітко вирізнялися при повторюваних МРТ-контролях.
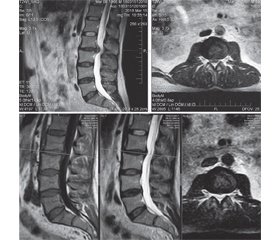
Клінінчний випадок 1 (група дексаметазону, зміни замикальних пластин). Пацієнтка І., 71 рік, скаржиться на біль поперекової ділянки протягом 4 днів, що поширюється в ліву ногу, різко посилюється при рухах. Анамнестично відмічає кілька подібних епізодів протягом останніх 5 років. У неврологічному огляді на момент звернення — позитивний симптом Ласега (60º) та зниження ахіллового рефлексу лівобічно. Інтенсиність болю за ВАШ 8 балів. На МРТ: множинні протрузії на рівнях від L2 до S1 із частковим стенозом форамінальних каналів на рівні L4–L5 правобічно та L5–S1 лівобічно, що відповідало клінічним проявам (зокрема, амплітуда Н-рефлеку лівобічно 10 %) (рис. 7). Звертає на себе увагу наявність змін замикальних пластин L5–S1, що чітко проявляються на 15-й день дослідження і практично зникають на тридцятий, при незначимих змінах у розмірі вип’ячувань міжхребцевих дисків. На момент завершення дослідження пацієнтка відмічала покращення та зменшення болю до рівня 4 балів за ВАШ.
/34.jpg)
У випадку 1 у пацієнтки утримувався помірний біль протягом усього дослідження при вираженому покращенні стану замикальних пластин. Наступний випадок цікавий значною розбіжністю між клінічним перебігом та радіологічними ознаками.
Клінічний випадок 2 (група дексаметазону, розбіжність між клінічним перебігом та нейровізуалізацією)
Пацієнт М., 64 роки, скаржиться на інтенсивний біль у спині та лівій нозі, відчуття затерпання та поколювання в стопі. Клінічно: ВАШ — 8 балів. Симптом Ласега лівобічно до 30º, хода різко утруднена, щадна. Ахіллів рефлекс лівобічно не викликається, гіпестезія в дерматомі S1.
Ініціальна МРТ: грижа міжхребцевого диска L5–S1 до 8 мм із стенозом форамінального каналу лівобічно та компресією відповідних структур. На тлі лікування дексаметазоном вже на 15-й день (перша контрольна точка) оцінка за ВАШ 1–2 бали, хода неутруднена, повний обсяг рухів. Однак нейровізуалізація на 15-й та 30-й день не відмічає зміни інтенсивності замикальних пластин (тип Modic II) чи розміру вип’ячування (рис. 8).
Клінічний випадок 3 (група L-лізину есцинату 5,0 мл, збільшення та екструзія грижі)
Цей випадок, на нашу думку, потребує окремого коментаря. У клінінчній практиці, як правило, вважається, що збільшення розмірів грижі міжхребцевого диска є негативною прогностичною ознакою, однак дані численних публікацій та спостережень вказують на протилежне. Масивна грижа, що супроводжується секвестрацією чи екструзією, але не викликає моторного дефіциту, більше схильна до реабсорбції та «зморщення». Попри великі розміри, саме такі грижі дисків легше ферментуються, дегідратуються та деконфігуруються так, що не створюють компресії нейрональних структур [59, 60].
Пацієнт М., 41 рік, скарги на помірний біль у спині та прострілюючий біль у правій нозі. На первинному огляді: надлишкова маса тіла, неврологічний статус без сенсорного, рефлекторного чи моторного дефіциту. ВАШ — 5 балів. Симтом Ласега правобічно до 35º.
МРТ: на тлі поширених дегенеративно-дистрофічних змін та протрузій наявна грижа L4–L5 рівня. При першому контролі — екструдування вип’ячування, каудальна міграція — при наступному.
Цікаво, що показники ВАШ при першому ж конт-ролі — 0 балів. Тобто в такому випадку збільшення розмірів та зміна форми виявилися елементом саногенезу — каудально зміщена грижа не компремує нейрональні структури (рис. 9).
Клінічний випадок 4 (група L-лізину есцинату 10,0 мл, «зникнення» грижі)
Показовий випадок, що підтверджує твердження, що великі грижі диска найбільш схильні до регресування [54].
Пацієнт В., 52 роки, із болем у спині тривалістю 3 дні. ВАШ — 7 балів. Біль поширюється в ноги, більше праву, зокрема в передньомедіальні відділи стегна та гомілки. Гіпестезія в дерматомі L3, симптом Ласега 60º. Рухи та хода посилюють біль.
На МР-томограмах: екструзія міжхребцевого диска L2–L3 з компресією форамінальних каналів білатерально. На 30-й день — чітке зменшення розмірів екструзії, що супроводжувалося клінічним одужанням — повним регресом больової симптоматики (рис. 10).
Обговорення клінічних випадків та підсумки. Значущої різниці між впливом курсу лікування дексаметазоном чи L-лізину есцинатом 10,0 мл на перебіг дископатії не виявлено (р = 0,23). Хоча в групі L-лізину есцинату 10 мл не зафіксовано випадків збільшення розмірів чи каудальної міграції грижі, різниця з іншими групами є статистично незначущою, зокрема проти групи дексаметазону, у якій 3 випадки погіршення морфологічних характеристик. Також не доведено зв’язку чи модифікуючого впливу морфометричних показників міжхребцевого диска на больові характеристики за ВАШ та КОБ, градусною оцінкою симптому Ласега чи амплітуди Н-рефлексу (r = 0,16).
Згідно з отриманими нами даними, показники КОБ корелювали з оцінкою болю за ВАШ та симптомом Ласега, що логічно пояснюється спільним описом больових характеристик. На початку лікування кожні 10 балів за шкалою КОБ асоціюються із підвищенням ВАШ на 0,77 бала. Пацієнти із високими початковими рівнями за шкалою КОБ матимуть кращу додаткову позитивну динаміку на п’ятнадцятий день: у них спостерігатимуть показники ВАШ на п’ятнадцятий день, що нижчі в середньому на 0,21 бала за кожні 10 балів початкового значення КОБ (після врахування ефекту від препарату). Пацієнти із високим початковим КОБ демонструють подальше, навіть більш швидке зниження інтенсивності болю в проміжку між п’ятнадцятою і тридцятою добою. Якщо фактору КОБ і відводиться певна роль у моделі динаміки симптому Ласега, то ця роль обмежена виключно кореляцією інтенсивності болю за шкалою КОБ та градусною мірою (симптом Ласега більш виражений у пацієнтів із вищими балами за шкалою КОБ). Можливий вплив оцінки за шкалою КОБ на динаміку градусної міри симптому Ласега в даному дослідженні не спостерігається.
Ступінь Н-рефлексу, виміряний перед початком лікування, не впливав на подальшу динаміку пацієнтів. Показник Н-рефлексу як фактора-модифікатора при дослідженні та описі динаміки больового симптому в досліджуваних пацієнтів не є показовим, оскільки статистична значущість при порівнянні двох моделей дисперсійним аналізом становить р = 0,59. Подібні результати отримані і при вивченні Н-рефлексу як потенційного предиктора перебігу в змішаній моделі з градусною мірою симптому Ласега. Тому можливий вплив ступеня H-рефлексу на майбутню динаміку градусної міри симптому Ласега в умовах проведеного експерименту не знайшов свого підтвердження (LR = 5,2, р = 0,59).
Аналіз динаміки градусної міри симптому Ласега вказав на переважаючу ефективність дексаметазону як на 15-ту, так і на 30-ту добу, що, однак, може бути наслідком досить низької точності та стабільності при вимірюванні, а також існування верхнього порога — негативного симптому Ласега.
Обмеження, присутні у дослідженні
Дане дослідження є порівняльним клінічним дослідженням ефективності дексаметазону та L-лізину есцинату при фармакотерапії болю в спині. Кінцевими точками дослідження виступали інтенсивність болю, виміряна за ВАШ, та градусна міра симптому Ласега. Обидві кінцеві точки можуть зазнавати коливань внаслідок як нестабільного підходу пацієнта до оцінки власного болю, так і неточностей у встановленні градусної міри симптому Ласега, допущених із боку лікаря та пацієнта. Дослідження не містило плацебо-контролю, тому не дозволяє судити про ефективність застосовуваних препаратів порівняно з плацебо. Використаний дизайн дослідження дозволяє говорити лише про подібність чи відмінність динаміки стану пацієнтів, які отримували різні препарати.
У даній статті також вивчено можливість впливу оцінки за КОБ та ступеня Н-рефлексу на зміни стану пацієнтів. Обидва фактори тісно пов’язані з інтенсивністю болю чи з симптомом Ласега, тому коректно відокремити їх вплив від доведеної у даній статті часової автокореляції кінцевих точок не є можливим.
Висновки
1. Потенційні предиктори, прогностичні чинники та маркери перебігу ішіалгії з радикулопатією
Морфометричні характеристики міжхребцевого диска за даними МРТ не корелюють з інтенсивністю больових відчуттів та не є валідними предикторами клінчного стану. Вплив оцінки за коротким опитувальником болю на зменшення больових відчуттів та ліквідацію симптому Ласега при отримуваному лікуванні потребує подальших досліджень.
Згідно з отриманими нами результатами, жоден вищевказаний параметр (розмір грижі міжхребцевого диска, градусна міра симптому Ласега, КОБ та Н-рефлекс) не має вірогідної прогностичної цінності та не дозволяє передбачити перебіг люмбоішіалгії з радикулопатією, зокрема регрес больової симптоматики чи майбутню потребу в хірургічному лікуванні.
Отже, лише ретельна повторювана оцінка клінічних проявів та наявність «червоних прапорців» є надійним показником негативного перебігу люмбоішіалгії з радикулопатією та може слугувати підставою до зміни методу лікування, зокрема, хірургічного.
2. Ефективність використання дексаметазону та L-лізину есцинату у пацієнтів з гострою люмбоішіалгією та радикулопатією
Ступінь зменшення в пацієнтів з болем у спині больових відчуттів на 15-ту добу після розпочатого курсу терапії 0,4% рочином дексаметазону 2 мл чи 0,1% розчином L-лізину есцинату у дозах 5 чи 10 мл суттєво не відрізнявся. Відмінність у динаміці на 30-ту добу становила 1,47 ± 0,50 бала за ВАШ при порівнянні дексаметазону з 0,1% розчином L-лізину есцинату у дозі 5 мл (р = 0,0038) та 1,07 ± 0,52 бала — при порівнянні дексаметазону з 0,1% розчином L-лізину есцинату в дозі 10 мл (р = 0,040).
Найменших рівнів болю на тридцятий день досягнуто в пацієнтів, які отримали препарат L-лізину есцинат 10 мл, однак зниження болю мало більшу амплітуду у групі, якій вводили дексаметазон.
При потребі більш тривалого протибольового ефекту перевага може надаватись дексаметазону. Враховуючи небажані ефекти, які супроводжують прийом дексаметазону, розчин L-лізину есцинату у дозі 10 мл може бути застосований із метою зняття больових симптомів.
Застосування розчину L-лізину есцинату в пацієнтів із люмбоішіалгією та радикулопатією потребує подальшого дослідження з метою більш точного визначення довготривалих ефектів.
Список литературы
1. Andersson G.B. Epidemiology of low back pain. Acta Orthop. Scand. Suppl. 1998. 281. 28-31.
2. Dionne C.E., Dunn K.M., Croft P.R. Does back pain prevalence really decrease with increasing age? A systematic review. Age Ageing. 2006. 35. 229-34.
3. Rapoport J., Jacobs P., Bell N.R. et al. Refining the measurement of the economic burden of chronic diseases in Canada. Chronic. Dis. Can. 2004. 25. 13-21.
4. Deyo R.A., Cherkin D., Conrad D. et al. Cost, controversy, crisis: low back pain and the health of the public. Annu. Rev. Public Health. 1991. 12. 141-56.
5. Hurwitz E.L., Randhawa K., Yu H., Côté P., Haldeman S. The Global Spine Care Initiative: a summary of the global burden of low back and neck pain studies. Eur. Spine J. 2018 Sep. 27(Suppl. 6). 796-801. doi: 10.1007/s00586-017-5432-9. Epub 2018 Feb.
6. Lidgren L. The bone and joint decade 2000–2010. Bull. World Health Organ. 2003. 81. 629.
7. Steenstra I.A., Verbeek J.H., Heymans M.W. et al. Prognostic factors for duration of sick leave in patients sick listed with acute low back pain: a systematic review of the literature. Occup. Environ. Med. 2005. 62. 851-60.
8. Kent P.M., Keating J.L. The epidemiology of low back pain in primary care. Chiropr. Osteopat. 2005. 13. 13.
9. Thelin A., Holmberg S., Thelin N. Functioning in neck and low back pain from a 12-year perspective: a prospective population-based study. J. Rehabil. Med. 2008. 40. 555-61.
10. Waddell G. The back pain revolution. 2nd ed. Edinburgh: Churchill Livingstone, 2004.
11. Hill J.C., Konstantinou K., Egbewale B.E., Dunn K.M., Lewis M., van der Windt D. Clinical outcomes among low back pain consulters with referred leg pain in primary care. Spine. 2011. 36(25). 2168-75.
12. Kongsted A., Kent P., Albert H., Jensen T.S., Manniche C. Patients with low back pain differ from those who also have leg pain or signs of nerve root involvement - a cross-sectional study. BMC Musculoskel. Disord. 2012. 13(1). 1-9.
13. Bogduk N. On the definitions and physiology of back pain, referred pain, and radicular pain. Pain. 2009. 147(1–3). 17-9
14. Merskey H., Bogduk N. Classification of chronic pain. 2nd ed. Seattle: IASP Press, 1994.
15. Vroomen P.C., de Krom M.C., Knottnerus J.A. Consistency of history taking and physical examination in patients with suspected lumbar nerve root involvement. Spine. 2000. 25(1). 91-6.
16. Fairbank J. Sciatica: an archaic term. BMJ. 2007. 335(7611). 112.
17. Lin C., Verwoerd A., Maher C., Verhagen A., Pinto R., Luijsterburg P. et al. How is radiating leg pain defined in randomized controlled trials of conservative treatments in primary care? A syste-matic review. Eur. J. Pain. 2014. 18. 455-64.
18. Genevay S., Atlas S.J., Katz J.N. Variation in eligibility criteria from studies of radiculopathy due to a herniated disc and of neurogenic claudication due to lumbar spinal stenosis: A structured literature review. Spine. 2010. 35(7). 803-11.
19. Konstantinou K., Dunn K.M. Sciatica: review of epidemiological studies and prevalence estimates. Spine. 2008. 33(22). 2464-72.
20. Haswell K. Clinical Decision Rules for Identification of Low Back Pain Patients With Neurologic Involvement in Primary Care. Spine. 2008. 33(0362–2436). 68-73.
21. Fransen M., Woodward M., Norton R., Coggan C., Dawe M., Sheridan N. Leg pain is considered an obstacle to recovery. Risk factors associated with the transition from acute to chronic occupational back pain. Spine. 2002. 27(1). 92-8.
22. Shaw W.S., Pransky G., Fitzgerald T.E. Early prognosis for low back disability: intervention strategies for health care providers. Disabil. Rehabil. 2001. 23(18). 815-28.
23. Konstantinou K., Hider S.L., Jordan J.L., Lewis M., Dunn K.M., Hay E.M. The Impact of Low Back-related Leg Pain on Outcomes as Compared With Low Back Pain Alone: A Systematic Review of the Literature. Clin. J. Pain. 2013. 29(7). 644-54.
24. Pinto R.Z., Maher C.G., Ferreira M.L., Ferreira P.H., Hancock M., Oliveira V.C., McLachlan A.J., Koes B. Drugs for relief of pain in patients with sciatica: systematic review and meta-analysis. BMJ. 2012. 344. e497.
25. Valat J., Genevay S., Marty M., Rozenberg S., Koes B. Sciatica. Best Practice & Research Clinical Rheumatology. 2010. 24(2). 241-52.
26. Bogduk N., McGuirk B. Medical management of acute and chronic low back pain: an evidence-based approach. Oxford: Elsevier, 2002.
27. Kreiner D.S., Hwang S.W., Easa J.E. et al. An evidence-based clinical guideline for the diagnosis and treatment of lumbar disc herniation with radiculopathy. Spine J. 2014. 14. 180-91.
28. Vogt M.T., Kwoh C.K., Cope D.K., Osial T.A., Culyba M., Starz T.W. Analgesic usage for low back pain: impact on health care costs and service use. Spine. 2005. 30. 1075-81.
29. Cherkin D.C., Wheeler K.J., Barlow W., Deyo R.A. Medication use for low back pain in primary care. Spine. 1998. 23. 607-14.
30. Di Iorio D., Henley E., Doughty A. A survey of primary care physician practice patterns and adherence to acute low back problem guidelines. Arch. Fam. Med. 2000. 9. 1015-21.
31. Porsman O., Friis H. Prolapsed lumbar disctreated with intramuscularly administered dexamethasone phosphate: a prospectively planned, double-blind, controlled clinical trial in 52 patients. Scand. J. Rheumatol. 1979. 8(3). 142-144.
32. Hedeboe J., Buhl M., Ramsing P. Effects of using dexamethasone and placebo in the treatment of prolapsed lumbar disc. Acta Neurol. Scand. 1982. 65(1). 6-10.
33. Haimovic I.C., Beresford H.R. Dexamethasone isnot superior to placebo for treating lumbosacral radicular pain. Neurology. 1986. 36(12). 1593-1594.
34. Finckh A., Zufferey P., Schurch M.-A., Balagué F., Waldburger M., So A.K.L. Short-term efficacy of intravenous pulse glucocorticoids in acute discogenic sciatica: a randomized controlled trial. Spine (Phila Pa 1976). 2006. 31(4). 377-381.
35. Holve R.L., Barkan H. Oral steroids in initial treatment of acute sciatica. J. Am. Board. Fam. Med. 2008. 21(5). 469-474.
36. Friedman B.W., Esses D., Solorzano C. et al. A randomized placebo-controlled trial of single-dose IM corticosteroid for radicular low backpain. Spine (Phila Pa 1976). 2008. 33(18). E624-E629.
37. Goldberg H., Firtch W., Tyburski M. et al. Oral steroids for acute radiculopathy due to a herniated lumbar disk: a randomized clinical trial. JAMA. 2015. 313. 1915.
38. Balakrishnamoorthy R. et al. Does a single dose of intravenous dexamethasone reduce Symptoms in Emergency department patients with low Back pain and RAdiculopathy (SEBRA)? A double-blind randomised controlled trial. Emerg. Med. J. 2015 Jul. 32. 525.
39. Спасіченко П.В. Лiкувальнi можливостi препарату L-лiзину есцинат у комплекснiй терапiї хворих з черепно-мозковою травмою. Практика i досвiд. 2003. 4. 60-63.
40. Черний Т.В., Андронова И.А., Черний В.И., Городник Г.А. Исследование эффективности препарата L-лизина эсцинат в комплексном лечении тяжелой черепно-мозговой травмы и ишемического инсульта. International neurological journal. 2010. 1(31).
41. Черній В.І., Кардаш A.M., Страфун C.C. та ін. Застосування препарату L-лізину есцинат в нейрохірургії, травматології і ортопедії: Методичні рекомендації. K.: Інститут нейрохірургії ім. акад. А.П. Ромоданова, 2004.
42. Хабиров Ф.А., Кочергина О.С., Гранатов Е.В. и др. Клинико-нейрофизиологическая оценка эффективности L-лизина эсцината в сочетанной терапии острых компрессионно-ишемических радикулопатий. Неврологический вестник. 2012. XLIV. 4. 3-8.
43. Sirtori C.R. Aescin: pharmacology, pharmacokinetics and therapeutic profile. Chem. Pharm. Bull (Tokyo). 2001 May. 49(5). 628-8.
44. Лихачев С.А., Войтов В.В., Ващилин В.В. Опыт применения L-лизина эсцината в терапии неврологических проявлений поясничного остеохондроза. Медицинские новости (бюллетень). 2012. 10. 54-57.
45. Бойко А.Н., Лебедева А.В., Щукин И.А., Болотов А.В., Зейналова С.Р., Исмаилов А.М., Петров С.В., Шихкеримов Р.К. Боль в нижней части спины — новые патогенетические подходы к терапии. РМЖ. 2014. 22. 1633-1638.
46. Скоромец А.А., Бубнова Е.В., Ендальцева С.М. и др. L-лизина эсцинат при дискогенно-венозной люмбосакральной радикуломиелоишемии. Неврология. Психиатрия. 2014. 4(9). 2-11.
47. Балязина Е.В., Гончарова З.А., Балязин В.А. L-лизина эсцинат в сочетанной терапии вертеброгенных дорсалгий. Российский журнал боли. 2015. 1. 60-61.
48. Dillingham T.R., Dasher K.J. Te lumbosacral electromyographic screen: revisiting a classic paper. Clin. Neurophysiol. Dec. 2000. 111(12). 2219-2222.
49. Marin R., Dillingham T.R., Chang A., Belandres P.V. Extensor digitorum brevis reflex in normals and patients with radiculopathies. Muscle Nerve. Jan 1995. 18(1). 52-59.
50. Albeck M.J., Taher G., Lauritzen M., Trojaborg W. Diagnostic value of lectrophysiological tests in patients with sciatica. Acta Neurol. Scand. Apr 2000. 101(4). 249-254
51. Sabuncuŏglu H., Özdŏgan, S., Timurkaynak E. Spontaneous Regression of Extruded Lumbar Disc Herniation: Report of Two Illustrative Case and Reviewof the Literature. Turkish Neurosurgery. 2008. 18. 4. 392-396.
52. Da Silva C.E. Extruded Lumbar Disc Herniation with Spontaneous Reabsorption: Case Report and Review. Arq. Bras. Neurocir. 2016. 35. 70-73.
53. Benson R. Conservatively treated massive prolapsed discs: a 7-year follow-up. Ann. R. Coll. Surg. Engl. 2010. 92. 147-153.
54. Slavin K.V., Raja A., Thornton J., Wagner F.C. Jr. Spontaneous regression of a large lumbar disc herniation: Report of an illustrative case. Surg. Neurol. 2001. 56(5). 333-336.
55. ItoT., Yamada M., Ikuta F. et al. Histologic evidence of absorption of sequestration-type herniated disc. Spine. 1996. 21(2). 230-234.
56. Haro H., Crawford H.C., Fingleton B. et al. Matrix metalloproteinase-3-dependent generation of a macrophage chemoattractant in a model of herniated disc resorption. J. Clin. Invest. 2000. 105(2). 133-141.
57. Doita M., Kanatani T., Ozaki T., Matsui N., Kurosaka M., Yoshiya S. Influence of macrophage infiltration of herniated disc tissue on the production of matrix metalloproteinases leading to disc resorption. Spine. 2001. 26(14). 1522-1527.
58. Henmi T., Sairyo K., Nakano S. et al. Natural history of extruded lumbar intervertebral disc herniation. J. Med. Invest. 2002. 49(1–2). 40-43.
59. Boisson M., Lefèvre-Colau M., Rannou F. et al. Active discopathy: a clinical reality/RMD Open 2018. 4. e000660.
60. Buttermann G.R. Lumbar disc herniation regression after successful epidural steroid injection. J. Spinal. Disord. Tech. 2002. 15(6). 469-476.
Вперше надруковано
в журналі Medicina. 2019. 55. 736.
doi: 10.3390/medicina55110736
/30.jpg)
/32.jpg)
/32_2.jpg)

/28.jpg)
/29.jpg)
/29_2.jpg)
/30_2.jpg)
/31.jpg)
/31_2.jpg)
/34.jpg)
/35.jpg)
/36.jpg)
/37.jpg)