Журнал "Гастроэнтерология" Том 54, №1, 2020
Вернуться к номеру
Порушення мікробіоценозу товстого кишечника й частота синдрому надлишкового бактеріального росту у хворих на хронічні запальні захворювання кишечника
Авторы: Степанов Ю.М., Тітова М.В., Татарчук О.М.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
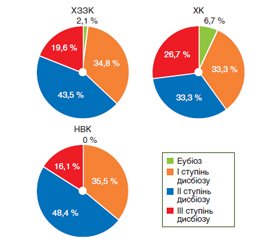
Актуальність. На даний час хронічні запальні захворювання кишечника (ХЗЗК), яскравими представниками яких є хвороба Крона (ХК) та неспецифічний виразковий коліт (НВК), у зв’язку з високою поширеністю та захворюваністю, тяжкістю перебігу захворювання та труднощами діагностики залишаються однією з найбільш складних і невирішених проблем сучасної гастроентерології. На жаль, і на сьогодні етіологія ХЗЗК достеменно невідома, однак найбільш вірогідною вважають гіпотезу імунної «гіпервідповіді», викликаної чинниками навколишнього середовища до зміненої мікробіоти кишечника або патогенних мікроорганізмів у генетично схильного хазяїна. Зміни мікробіоти при ХЗЗК загальновизнані, а їх дослідження має велике значення для глибшого розуміння етіології та патогенезу цих захворювань та пошуку нових альтернативних методів лікування. Саме тому дослідження дисбіозу кишечника при ХЗЗК привертають дедалі більшу увагу науковців усього світу. Мета дослідження: дослідити особливості дисбіозу кишечника та частоту синдрому надлишкового бактеріального росту (СНБР) у пацієнтів із ХЗЗК залежно від нозології та статі. Матеріали та методи. Проведене обстеження 46 хворих на ХЗЗК віком від 20 до 79 років, у середньому (47,4 ± 2,4) року. Залежно від нозології всі пацієнти були розподілені на 2 групи. Першу становили 15 пацієнтів iз XK, другу — 31 хворий на НВК. Серед пацієнтів було 19 жінок і 27 чоловіків. Усім хворим було проведено водневий дихальний тест (ВДТ) для виявлення синдрому надлишкового бактеріального росту та бактеріологічне дослідження калу. Результати. Мікробіологічні дослідження виявили наявність глибоких змін якісного та кількісного складу мікрофлори товстої кишки у 97,8 % хворих на ХЗЗК, з переважанням дисбіозу ІІ ступеня у 48,4 % хворих на НВК та дисбіозу ІІ і ІІІ ступеня у 33,3 % хворих на ХК. Ці зміни були обумовлені зменшенням кількості біфідо- та лактофлори, підвищенням концентрації умовно-патогенних мікроорганізмів і дріжджоподібних грибів. Результати, отримані при проведенні ВДТ, свідчать про високу частоту СНБР у пацієнтів із ХЗЗК (50 %). При аналізі даних виявлено, що СНБР переважно визначався у хворих на НВК (51,6 %). За гендерною ознакою в обох нозологічних групах хворих із виявленим СНБР переважали чоловіки. Висновки. Отримані результати свідчать про те, що практично всім хворим на ХЗЗК притаманні зміни мікробіоти кишечника, головним чином за рахунок різкого зниження чисельності основних симбіонтів товстокишкового мікробіоценозу та зростання концентрації умовно-патогенної мікрофлори. Мікробіологічне дослідження калу та ВДТ є найдоступнішими неінвазійними методами, що дозволяють швидко виявити порушення мікрофлори кишечника.
Актуальность. В настоящее время хронические воспалительные заболевания кишечника (ХВЗК), яркими представителями которых являются болезнь Крона (БК) и неспецифический язвенный колит (НЯК), в связи с высокой распространенностью и заболеваемостью, тяжестью течения заболевания и трудностями диагностики остаются одной из наиболее сложных и нерешенных проблем современной гастроэнтерологии. К сожалению, и сегодня этиология ХВЗК точно неизвестна, однако наиболее вероятной считают гипотезу иммунного «гиперответа», вызванного факторами окружающей среды к измененной микробиоте кишечника или патогенным микроорганизмам у генетически склонного хозяина. Изменения микробиоты при ХВЗК общепризнанны, а их исследование имеет большое значение для более глубокого понимания этиологии и патогенеза этих заболеваний и поиска новых альтернативных методов лечения. Именно поэтому исследования дисбиоза кишечника при ХВЗК привлекают все большее внимание ученых всего мира. Цель исследования: исследовать особенности дисбиоза кишечника и частоту синдрома избыточного бактериального роста (СИБР) у пациентов с ХВЗК в зависимости от нозологии и пола. Материалы и методы. Проведено обследование 46 больных ХВЗК в возрасте от 20 до 79 лет, в среднем (47,4 ± 2,4) года. В зависимости от нозологии все пациенты были разделены на 2 группы. Первую составляли 15 пациентов с БK, вторую — 31 больной НЯК. Среди пациентов было 19 женщин и 27 мужчин. Всем больным был проведен водородный дыхательный тест (ВДТ) для выявления СИБР и бактериологическое исследование кала. Результаты. Микробиологические исследования выявили наличие глубоких изменений качественного и количественного состава микрофлоры толстой кишки у 97,8 % больных ХВЗК, с преобладанием дисбиоза II степени у 48,4 % больных НЯК и дисбиоза II и III степени у 33,3 % больных БК. Эти изменения были обусловлены уменьшением количества бифидо- и лактофлоры, повышением концентрации условно-патогенных микроорганизмов и дрожжеподобных грибов. Результаты, полученные при проведении ВДТ, свидетельствуют о высокой частоте СИБР у пациентов с ХВЗК (50 %). При анализе данных выявлено, что СИБР преимущественно определялся у больных НЯК (51,6 %). По гендерному признаку в обеих нозологических группах больных с выявленным СИБР преобладали мужчины. Выводы. Полученные результаты свидетельствуют о том, что практически всем больным с ХВЗК присущи изменения микробиоты кишечника, главным образом за счет резкого снижения численности основных симбионтов толстокишечного микробиоценоза и роста концентрации условно-патогенной микрофлоры. Микробиологическое исследование кала и ВДТ являются самыми доступными неинвазивными методами, позволяющими быстро выявить нарушения микрофлоры кишечника.
Background. Inflammatory bowel diseases (IBD) typically presented by Crohn’s disease (CD) and ulcerative colitis (UC) are still regarded as one of the most difficult and unsolved challenges in contemporary gastroenterology due to its wide spread, high incidence, severe disease progression and complications in diagnosis. Unfortunately, the etiology of IBD is still unknown, but the hypothesis of an immune “hyper-response” caused by environmental factors in relation to the altered gut microbiota or pathogenic microorganisms in a genetically susceptible host is considered the most plausible. The changes of microbiota in IBD are widely recognized and their studies are of great significance for deeper understanding of etiology and pathogenesis of these diseases, as well as for the search of new alternative methods of their treatment. Therefore, the studies of the intestinal dysbiosis in IBD attract more and more attention of the scientists worldwide. Purpose: the current paper aims at studying the features of intestinal dysbiosis and the incidence of small intestine bacterial overgrowth (SIBO) in patients with IBD depending on the disease area and gender. Materials and methods. Forty-six patients with IBD aged 20 to 79 years have been examined, their average age was (47.4 ± 2.4) years. The patients have been distributed into two groups according to the disease area. The first group consisted of 15 individuals with CD, the second group included 31 patients with UC. There were 19 females and 27 males in these groups. All patients underwent hydrogen breath test for SIBO detection and the bacteriologic fecal culture. Results. The microbiological study has revealed the presence of deep qualitative and quantitative changes in the colonic microflora in 97.8 % of patients with IBD, with predominance of dysbiosis II in 48.4 % of people with UC and dysbiosis II and III in 33.3 % of individuals with CD. These changes were caused by a decrease in the quantity of bifidobacteria and lactobacillus flora, an increase in the concentration of opportunistic microorganisms and yeast-like fungi. The results obtained after performing hydrogen breath tests evidence the high incidence of SIBO in patients with IBD (50 %). The analysis of the received data allows revealing the fact that SIBO prevailed in patients with UC (51.6 %). The certain difference has been noted between males and females: in both groups of patients with detected SIBO, the males prevailed. Conclusions. The results obtained indicate that virtually all patients with IBD are characterized by changes in the gut microbiota, mainly due to a sharp decrease in the number of major symbionts of colonic microbiocenosis and an increase in the concentration of opportunistic microflora. Fecal microbiological examination and hydrogen breath test are the most available non-invasive methods that allow rapid detection of intestinal microflora disturbances.
хронічні запальні захворювання кишечника; мікрофлора кишечника; синдром надлишкового бактеріального росту; водневий дихальний тест
хронические воспалительные заболевания кишечника; микрофлора кишечника; синдром избыточного бактериального роста; водородный дыхательный тест
inflammatory bowel diseases; intestinal microflora; small intestinal bacterial overgrowth syndrome; hydrogen breath test
Вступ
Матеріали та методи
Результати та обговорення
/58_2.jpg)
Висновки
1. Khan I. et al. Alteration of Gut Microbiota in Inflammatory Bowel Disease (IBD): Cause or Consequence? IBD Treatment Targeting the Gut Microbiome. Pathogens. 2019. Vol. 8 (3). Р. E126. doi: 10.3390/pathogens8030126.
2. Lo Presti А., Zorzi F., Del Chierico F. et al. Fecal and Mucosal Microbiota Profiling in Irritable Bowel Syndrome and Inflammatory Bowel Disease. Front. Microbiol. 2019. Vol. 10. P. 1655. doi:10.3389/fmicb.2019.01655.
3. Haque S.Z., Haque M. The ecological community of commensal, symbiotic, and pathogenic gastrointestinal microorganisms — an appraisal. Clin. Exp. Gastroenterol. 2017. Vol. 10. P. 91-103. doi: 10.2147/CEG.S126243.
4. Babickova J., Gardlik R. Pathological and therapeutic interactions between bacteriophages, microbes and the host in inflammatory bowel disease. World J. Gastroenterol. 2015. Vol. 21(40). P. 11321-30. doi: 10.3748/wjg.v21.i40.11321.
5. Бурковская В.А., Белобородова Э.И., Акимова Л.А. и др. Нарушение микробиоценоза кишечника при хронических воспалительных заболеваниях кишечника и абсорбционная функция тонкой кишки. Сибирский медицинский журнал (Томск). 2009. № 24 (4–2). С. 40-45.
6. Данилова Н.А., Абдулхаков Р.А., Абдулхаков С.Р. и др. Синдром избыточного бактериального роста у пациентов с воспалительными заболеваниями кишечника. Практическая медицина. 2015. № 6(91). С. 122-126.
7. Naser S.A et al. Mycobacterium avium subspecies paratuberculosis causes Crohn’s disease in some inflammatory bowel disease patients. World J. Gastroenterol. 2014. № 20(23). P. 7403-15. doi: 10.3748/wjg.v20.i23.7403.
8. Wills E.S., Jonkers D.M., Savelkoul P.H. et al. Fecal microbial composition of ulcerative colitis and Crohn’s disease patients in remission and subsequent exacerbation. PLoS One. 2014. № 9(3). doi: 10.1371/journal.pone.0090981.
9. Igarashi Н., Maeda S., Ohno K. et al. Effect of oral administration of metronidazole or prednisolone on fecal microbiota in dogs. PLoS One. 2014. № 9(9). doi: 10.1371/journal.pone.0107909.
10. Nishida A., Inoue R., Inatomi O. Gut microbiota in the pathogenesis of inflammatory bowel disease. Clin. J. Gastroenterol. 2018. № 11(1). P. 1-10. doi: 10.1007/s12328-017-0813-5.
11. Мартынов В.Л., Хайрдинов А.Х. Синдром избыточного бактериального роста в тонкой кишке у пациентов с недостаточностью баугиниевой заслонки и после ее хирургической коррекции. Бюллетень сибирской медицины. 2015. № 14(2). C. 12-19.
12. Степанов Ю.М., Будзак И.Я., Коненко И.С. Дыхательный водородный тест в диагностике патологии желудочно-кишечного тракта. Гастроэнтерология. 2015. № 55(1). С. 81-85.
13. Rezaie A., Buresi M., Lembo A. et al. Hydrogen and Methane-Based Breath Testing in Gastrointestinal Disorders: The North American Consensus. Am. J. Gastroenterol. 2017. Vol. 112(5). P. 775-784. doi: 10.1038/ajg.2017.46.
14. Rezaie A., Buresi M., Lembo A. et al. How to Test and Treat Small Intestinal Bacterial Overgrowth: an Evidence-Based Approach. Curr. Gastroenterol. Rep. 2016. Vol. 18(2). Р. 8. doi: 10.1007/s11894-015-0482-9.
15. Erdogan A., Rao S.S., Gulley D. et al. Small intestinal bacterial overgrowth: duodenal aspiration vs glucose breath test. Neurogastroenterol. Motil. 2015. Vol. 27(4). P. 481-9. doi: 10.1111/nmo.12516. Epub 2015 Jan 19.

/57.jpg)
/58.jpg)
/58_3.jpg)
/59.jpg)